«Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
| Вид материала | Автореферат |
- «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению, 423.77kb.
- «Челябинская государственная медицинская академия федерального агентства по здравоохранению, 333.68kb.
- Фомин Михаил Владимирович ТоксиколОго-гигиеническая характеристика компонентов производства, 338.79kb.
- Диабетической стопы, 428.28kb.
- «Уральская государственная медицинская академия Федерального агентства по здравоохранению, 743.14kb.
- «Санкт-Петербургская государственная педиатрическая медицинская академия Федерального, 682.04kb.
- «Оренбургская государственная медицинская академия федерального агентства по здравоохранению, 584.36kb.
- «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению, 431.13kb.
- «Астраханская государственная медицинская академия Федерального агентства по здравоохранению, 341.75kb.
- Основных профессий газоперерабатывающего завода, 427.41kb.
1 2
На правах рукописи
КОЧКИНА
Наталья Николаевна
СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ИЗМЕНЕНИЯ
МЯГКИХ ТКАНЕЙ В АСПЕКТЕ НЕЙРОЭНДОКРИННОЙ РЕГУЛЯЦИИ ПРИ ПРОНИКАЮЩИХ РАНЕНИЯХ ЩЕЧНОЙ ОБЛАСТИ
(ЭКСПЕРИМЕНТАЛЬНО-ГИСТОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ)
03.03.04. –клеточная биология, цитология, гистология
14.01.14. – стоматология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Оренбург – 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию».
| Научные руководители: | з.д.н. РФ, доктор биологических наук, профессор, Стадников Александр Абрамович заслуженный врач РФ, доктор медицинских наук, профессор Матчин Александр Артемьевич |
| Официальные оппоненты: | Доктор медицинских наук, профессор Брюхин Геннадий Васильевич З.д.н. РФ, доктор медицинских наук, профессор Соловьев Михаил Михайлович |
| Ведущая организация: | ГОУ ВПО «Московский государственный медико-стоматологический университет Федерального агентства по здравоохранению и социальному развитию» |
Защита состоится «_____» марта 2010 г. в 1000 часов на заседании диссертационного совета Д 208. 066. 04 при Государственном образовательном учреждении высшего профессионального образования «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» по адресу: 460000, Оренбург, ул. Советская, 6, зал заседаний Учёного совета
С диссертацией можно ознакомится в библиотеке Оренбургской государственной медицинской академии (460000, г. Оренбург, Парковый проспект д. 7.
Автореферат разослан «______»_________2010г.
Ученый секретарь
диссертационного совета,
доктор биологических наук, профессор Шевлюк Н. Н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования
Проблема лечения и реабилитации больных с повреждениями мягких тканей и костей лицевого скелета остается одной из самых актуальных в челюстно-лицевой хирургии.
Изменения в общественно-политической и социально-экономической жизни России в конце прошлого столетия и начале XXI века сопровождаются неуклонным повышением частоты ранений и повреждений челюстно-лицевой области (Алимова З.А., Ямуркова Н.Ф., 2007; Богатов В.В с соавт., 2007; Прохватилов Г.И., Панченко В.Н., 2007; Holt G.R.,2007).
Анализ литературы, посвященной структуре травматизма мирного времени свидетельствуют не только об увеличении абсолютного числа пострадавших, но и об утяжелении повреждений челюстно-лицевой зоны, увеличении количества сочетанных травм, главным образом за счет дорожно-транспортных происшествий (Александров Н.М., Козлов В.А., 1981; Лимберг Ал.А. с соавт., 1987; Subhashraj K. et аl., 2007; Месхиа Шота, 2008).
Многолетние наблюдения по лечению больных в клинике челюстно-лицевой хирургии Оренбургской государственной медицинской академии свидетельствуют о том, что значимое количество травм лица регистрируется у лиц трудоспособного возраста (Лебедянцев В.В., с соавт., 2007; Ямуркова Н.Ф., 2007). Это, в свою очередь, обуславливает существенный экономический ущерб в связи с временной и/или стойкой утратой трудоспособности травмированных и случаями преждевременной смерти (Матчин А.А., 1983; Матчин А.А. с соавт., 1988).
В сложной проблеме лечения пострадавших с ранами мягких тканей и костей лица значительное место занимает вопрос предупреждения общих и особенно местных послеоперационных инфекционных осложнений. Число последних все еще достаточно велико особенно при тяжелых огнестрельных ранениях челюстно-лицевой области с обширными повреждениями мягких тканей, языка, неба, а также при всех ранениях, проникающих в полость рта (Лукьяненко А.В., 1996).
Среди местных факторов, препятствующих заживлению раны, большое значение исследователи отводят инфекции, химиотерапевтическим препаратом, глюкокортикоидам, радиационному воздействию, ишемии (Гусев Е.Ю., Юрченко Л.Н., 2004; Матчин А.А., Стадников А.А., 2006; Беляев А.Н. с соавт., 2007; Fisher E et Frodel Jr., 2007; Артамов О.Г. с соавт., 2009).
На протяжении сотен лет предпринимались попытки ускорить процесс заживления ран, но не было найдено ни одного средства или условия, позволяющих достичь этой цели.
В этом отношении структурно-функциональная реорганизация клеточных и тканевых структур в ране и окружающих ее тканей в аспекте нейроэндокринной регуляции этих процессов остаются до настоящего времени не изученными.
С полным основанием можно утверждать, что изучение патогенеза и лечение ран с позиции реактивности и рапаративности свойств тканей и является одной из основных проблем хирургии (Кузин М. И., Костюченок Б. М. 1990). Несмотря на множество разнообразных методов и способов лечения раневых процессов, ни один из них полностью не удовлетворяет хирургов.
В последние годы опубликованы работы об оптимизирующем влиянии гипоталамических нейропептидов (в частности окситоцина, вазопрессина) на репаративные процессы тканей различного генеза (Поленов А. П. 1994; Стадников А. А., 1999, 2001; Барков В.Н. 2004; Гречихина С.В. с соавт, 2007). В этой связи формируется новое перспективное направление, открывающее целесообразность местного применения одного из гипоталамических нанопептидов окситоцина, при лечении ряда заболеваний, в том числе воспалительного характера (Курлаев П. П. 1986, 2001, Сивожелезов К. Г. 2005). Однако роль гипоталамической нейросекреции и антибактериальной терапии в стимуляции и оптимизации репаративных гистогенезов мягких тканей челюстно-лицевой области не выявлена.
Все вышеизложенное определило цель и задачи настоящего исследования.
Цель исследования
Экспериментально-гистологическое обоснование способа лечения проникающих ран мягких тканей челюстно-лицевой области (ЧЛО) с применением окситоцина и антибиотиков.
Задачи исследования.
- Выявить морфофункциональные изменения в мягких
тканях челюстно-лицевой области (ЧЛО) и гипоталамо-гипофизарной нейросекреторной системе (ГГНС) при заживлении экспериментальных проникающих ран челюстно-лицевой области.
- Изучить влияние окситоцина на течение раневого процесса в эксперименте, в том числе и в условиях инфицирования S. aureus.
- Оценить роль и значение и возможности использования комбинации антибиотика и окситоцина при заживлении экспериментальных проникающих ран, в том числе и в условиях инфицирования S. aureus.
Научная новизна работы.
Впервые с использованием световой и электронной микроскопии, иммуноцитохимии на основании экспериментально-гистологических исследований и выявленных закономерностей в течение раневого процесса обоснована целесообразность использования антибиотика в комбинации с окситоцином при лечении проникающих ранений мягких тканей челюстно-лицевой области с учетом закономерностей клеточного и тканевого гомеостаза, диапазона гисто- и органоспецифических потенций и эпителиальной, соединительной и мышечной тканей, а также особенностей микроциркулиции. Доказана высокая эффективность предложенного способа лечения проникающих экспериментальных ран челюстно-лицевой области.
Теоретическая и практическая значимость.
Экспериментально обоснован новый способ лечения проникающих ранений мягких тканей челюстно-лицевой области с использованием окситоцина и антибиотика.
Выявленные морфологические и ультраструктурные изменения в ране и окружающих проникающую рану мягких тканей челюстно-лицевой области и ГГНС в различные периоды течения раневого процесса существенно расширили существующее представление о фазах и закономерностях течения раневого процесса и механизмах заживления раны.
Обоснованный и разработанный в эксперименте способ лечения проникающих ранений мягких тканей может быть представлен к апробации в клинике после получения разрешения Росздравнадзора.
Реализация результатов исследования.
Результаты исследований используются в учебном процессе Оренбургской медицинской академии при чтении лекций и проведении практических занятий по гистологии, цитологии, эмбриологии и по хирургической стоматологии,а также используются в учебном процессе в Воронежской государственной медицинской академии им. Н.Н. Бурденко, Ижевской государственной медицинской академии, Оренбургской государственной медицинской академии.
Апробация материала.
Основные положения диссертационного исследования были доложены и обсуждены на II Всероссийском симпозиуме с международным участием «Клинические и фундаментальные аспекты тканевой терапии. Теория и практика клеточных биотехнологий» (Самара, 2004); на конференции хирургов, посвящённой 100-летию со дня рождения профессора С.П. Вилесова. «Актуальные вопросы экстренной и восстановительной хирургии» (Оренбург, 2005); на VII Всероссийской научно- практической конференции врачей Приволжско – Уральского военного округа «Актуальные вопросы военной и практической медицины» (Оренбург, 2006); на Всероссийской научной конференции. «Актуальные вопросы челюстно-лицевой хирургии и стоматологии» (С-Петербург, 2007); на Всероссийской научной конференции «Современные аспекты гистогенеза и вопросы преподавания гистологии в ВУЗе, посвященная 100-летию со дня рождения Л.И. Фалина» (Москва, 2007); на IX Всероссийской научно-практической конференции врачей Приволжско-Уральского военного округа (Оренбург, 2008); на Всероссийской научной конференции «Нейробиологические аспекты морфогенеза и регенерации» (Оренбург, 2008); на XIII Международной конференции челюстно – лицевых хирургов и стоматологов «Новые технологии в стоматологии» (С-Петербург, 2008).
Основные положения, выносимые на защиту.
- Репаративные процессы в окружающих проникающую рану щеки крыс тканях связаны с изменениями нейросекреции крупноклеточных ядер гипоталамуса, что свидетельствует о генерализованном адаптивном влиянии гипоталамических нонапептидов и доказывает существенную роль парааденогипофизарного пути в регуляции клеточного и тканевого гомеостаза структур челюстно-лицевой области.
- Применение окситоцина в моделируемых условиях (включая дополнительное инфицирование проникающих экспериментальных ран) способствует ускорению реэпителизации раневых дефектов, закрытию их каналов за счет инициации пролиферации камбиальных элементов, сокращении сроков основных стадий раневого процесса, реализации органотипических программ гистогенезов.
- Оптимизация репаративных гистогенезов обусловлена стимулирующим воздействием окситоцина на пролиферативную активность эндотелиоцитов, фибробластов, эпителиоциов слизистой и кожной частей щеки, миосимпластов, на функциональную деятельность макрофагов, что в конечном итоге способствует оптимальному развитию грануляционной ткани и эпителизации раневого дефекта. Это в свою очередь, ускоряет заживление раны в целом, а также восстановление специфической морфофункциональной организации мягких тканей щеки.
Публикации.
По теме диссертации опубликовано 15 работ, из них 5 в изданиях, рекомендованных ВАК РФ.
Объем и структура диссертации.
Диссертация изложена на 142 страницах машинописного текста и состоит из введения, обзора литературы, описания материалов и методов исследования, главы с описанием собственных исследований с четырьмя подглавами, главы обсуждения их результатов, выводов, и списка литературы. Работа содержит 14 таблиц, 46 рисунков.
СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
МАТЕРИАЛ И МЕТОДЫ
Работа выполнена на 96 белых беспородных половозрелых крысах – самцах массой 220-250 г с созданием модели полнослойной сквозной раны челюстно-лицевой области (щеки). В экспериментальных условиях изучены тканевые реакции в области раны, в том числе при местном введении нейропептидов и (или) антибиотика.
Под наркозом (эфирным рауш-наркозом) у животных формировали модель полнослойной сквозной раны челюстно-лицевой области в области щеки с формированием дефекта 2×2 мм путем травматических повреждения. В области щеки наносилась сквозное ранение, проникающее в полость рта 2×2 мм, с помощью троакара. На раны швы не накладывались.
Для решения поставленных задач диссертационного исследования проведены 8 серий опытов, каждая на 12 животных.
В I серии создана экспериментальная модель полнослойной сквозной раны (ЭСР).
Во II серии опытов при создании ЭСР в область раны вводилась капельно взвесь Staphylococcus aureus (штамм 209Р) в дозе 3×109 микробных тел в 1 мл изотонического раствора хлорида натрия с помощью шпица с тупой иглой (Левенец А.А., Шувалов С.М., Поляков А.В., 1989).
В III серии опытов при создании ЭСР в рану вводился окситоцин в ткани тонкой иглой с помощью инъекционного шприца в разовой дозе 1ЕД (ГЕДЕОН РИХТЕР А. О. Будапешт-Венгрия). В дальнейшем окситоцин таким же образом подводился в зону дефекта в той же дозе 1 раз через сутки (на 1, 3, 5, 7 сутки после операции).
В IV серии опытов при создании ЭСР рана инфицировалась стафилококком (St. Aureus штамм 209Р, 3×108 микробных клеток) и вводился окситоцин в разовой дозе 1 ЕД. В дальнейшем окситоцин подводился в зону дефекта в той же дозе 1 раз через сутки (на 1, 3, 5, 7 сутки после операции).
В V серии опытов при создании ЭСР в область раны вводился антибиотик (30% линкомицин) [ОАО «Дальхимфарм»] разовой дозе 0,2 мл. После операции к ЭСР экзогенно подводился 30% линкомицин по 0,2 мл 1 раз через сутки (на 1, 3, 5 и 7 сутки).
В VI серии опытов при создании ЭСР в область раны вводился стафилококк (St. Aureus штамм 209Р, 3×108 микробных клеток) и антибиотик линкомицин 30% по 0,2мл. В дальнейшем к ЭСР экзогенно подводится антибиотик линкомицин (30% по 0,2мл) 1 раз через сутки (на 1, 3, 5 и 7 сутки).
В VII серии опытов при создании ЭСР в область раны вводился окситоцин и антибиотик в вышеперечисленных дозах. В дальнейшем к ЭСР экзогенно подводится линкомицин (30% по 0,2мл) в сочетании с окситоцином (1МЕ) 1 раз через сутки (на 1, 3, 5 и 7 сутки).
В VIII серии опытов при создании ЭСР в область раны вводился стафилококк (St.аureus штамм 209Р, 3×108 микробных клеток), окситоцин и антибиотик в вышеперечисленных дозах. В дальнейшем к ЭСР экзогенно подводится линкомицин (30% по 0,2мл) в сочетании с окситоцином (1МЕ) 1 раз через сутки (на 1, 3, 5 и 7 сутки).
Во всех сериях опытов область ЭСР и окружающие ее ткани иссекались на 3, 5, 10, 30 сутки (по 3 животных на каждую серию) и они подвергались однотипной гистологической обработке с использованием с использованием методов световой и электронной микроскопии, иммуноцитохимии и морфометрии с последующим статистическим анализом количественных данных. Все животные выводились из эксперимента путем их эвтаназии передозировкой эфирного наркоза.
Светооптическое исследование
Материал фиксировали в 10% водном растворе нейтрального формалина, спирт-формоле, жидкости Буэна, обезвоживали в спиртах возрастающей концентрации и заливали в целлоидин-парафин. Приготовление серийных срезов толщиной 5-6 мкм осуществляли на ротационном мокротоме МПС-2. Депарафинированные срезы окрашивали гематоксилином Майера и эозином. Гликоген и нейтральные мукополисахариды (гликопротеиды) определяли с помощью перйодат-Шифф реакции по Мак-Манусу, гликозаминогликаны – толуидиновым синим при значении рН 2,7-3,0, рибонуклеопротеиды – метиленовым зеленым и пиронином «Ж» по Браше. Гистохимические реакции сопровождались ферментативными контролями (Э. Пирс, 1962).
Электронномикроскопическое исследование
Материал фиксировали при +4˚С в 2,5%-м растворе глютарового альдегида на S-коллединовом буфере (рН 7,2-7,4). Постфиксацию проводили в четырехокиси осмия по прописи G. Millonig (1961). Материал обезвоживали при комнатной температуре в ацетоне возрастающей концентрации и заливали в смолу ЭПОН-812. Полимеризацию объектов проводили при +60ºС в течении 2 суток. С каждого блока на ультратоме LKB-5 (Sweden-Bromma) получали полутонкие (1мкм) и ультратонкие (40-60 нм) срезы. Полутонкие срезы окрашивали метиленовым синим и основным фуксином по прописи Sato et Shamoto (1973). Полутонкие срезы использовали при подготовке блоков к заточке перед изготовлением ультратонких срезов, а также для анализа тканей и клеточной организации на световом уровне.
Ультратонкие срезы, полученные подвергали двойному контрастированию насыщенным спиртовом растворе уранилацетата при температуре +37˚С в течении 20 минут и цитрате свинца по Reynolds (1963). Срезы изучали на электронном микроскопе ЭМВ 100АК, фотографирование структур проводили при увеличении от ×5400 до ×40000.
Морфометрические исследование выполняли на препаратах с использованием стандартной окулярной сетки Автандилова Г. Г. (1990), а также винтового окуляр-микрометра МОВ-1-15xY4,2.
Иммуноцитохимическое исследование
Для идентификации клеток с признаками апоптоза применяли следующие реакции с моноклональными антителами: на определение экспрессии проапоптотического белка р 53, антиапоптотического белка bcl2 и на выявление интрануклеосомной фрагментации ДНК. Исследование проводили на серийных парафиновых срезах, используя наборы реактивов фирмы “Dако” (Дания) и “Intergen” (Канада). Доокрашивание ядер производили 0,5% раствором метиленового зеленого на 0,1 М ацетоновом буфере.
Полученные количественные результаты исследования статистически оценивали по t-критерию Стьюдента, используя коммерческую программу Microsoft Excel 5.0а. Данные представлены в виде среднего арифметического по результатам каждого раздела работы, ± - стандартные отклонения. Достоверными считались отличия при р≤0,05 (95%).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Характер морфологических изменений тканей щеки крысы при нанесении экспериментальных полнослойных сквозных ран.
Начальной реакцией на травматическое повреждение тканей слизистой оболочки, подслизистой основы щеки, мышц и структур кожи челюстно-лицевой области являются расширение сосудов микроциркуляции, эмиграции лейкоцитов и их хемотаксис в формирующийся очаг воспаления. Диаметр функционирующих микрососудов (артериол, венул, гемокапилляров) вокруг зоны альтерации на 3-е сутки после нанесения травмы превышает соответствующие показатели у интактных крыс на 50% (в зоне слизистой оболочки) и на 30% в (области дермы и гиподермы) (табл.1).
Таблица 1
Изменение диаметра кровеносных сосудов (капилляров) в мкм.
| | | 3 сутки | 5 сутки | 10 сутки | 30 сутки |
| Интактная крыса | кожа | 4,54±0,06 | 4,54±0,06 | 4,54±0,06 | 4,54±0,06 |
| слизистая | 5,26±0,01 | 5,26±0,01 | 5,26±0,01 | 5,26±0,01 | |
| Рана | кожа | 9,31±0,51 | 6,11±0,22 | 5,62±0,22 | 4,88±0,14 |
| слизистая | 10,55±0,71 | 8,31±0,14 | 5,78±0,11 | 4,61±0,10 |
Все это приводит к выраженной диффузной полиморфноклеточной инфильтрации с преобладанием нейтрофилов.
К 5-м суткам плотность инфильтрата нарастает, распространяясь на зоны гиперемии, раздвигая и сдавливая мышечные волокна, которые подвергаются некротическим изменениям. В эти же сроки формируется демаркационный вал (сосредоточие нейтрофилов, макрофагов, лимфоцитов), не четко разделяющий зону некроза и окружающие жизнеспособные ткани.
Этому процессу предшествует плазматическая экссудация за счет усиления сосудистой проницаемости. Нередко, особенно в гемокапиллярах собственной пластинки слизистой оболочки щеки, наблюдалась альтерация эндотелия. Воспалительный отек и набухание гистологических структур кожной и слизистой частей щеки, а также миосимпластов наиболее выражены к 5 суткам эксперимента. При этом продолжались некротические изменения тканей (как правило в зонах спазмированных и тромбированных кровеносных сосудов микроциркуляции).
Развитие пролиферативной фазы воспаления, начинается уже в период осуществления экссудативной реакции (3-5 сутки опыта). Так в краевой зоне сквозной раны, а затем среди полиморфноклеточного инфильтрата мы наблюдали пролиферацию фибробластов, скопления которых с гемокапиллярами направлялись в отечную область раны.
К 5-м суткам площадь вновь образованной малодифференцированной соединительной (грануляционной) ткани увеличивалось. В зоне некроза и рядом с ней отмечались макрофаги, лимфоциты, малодифференцированные фибробласты. Формирующаяся грануляционная ткань характеризовалась значительным количеством клеточных элементов и низким содержанием тонких светлоокрашенных коллагеновых волокон. При это в кожной части раневого дефекта преобладали фибробласты, претерпевающие более быструю цитодифференцировку, приобретая фенотипические признаки фиброцитов. При этом явления экссудации в сосочковом слое дермы сохранились.
В нашем исследовании наибольшая плотность новообразованных сосудов наблюдалась к 10-м суткам после нанесения травмы (особенно в области слизистой оболочки и подслизистой основы щеки).
В более поздние сроки наблюдения (30 сутки) значительно снижалось количество сосудов микроциркуляторного русла и происходило уменьшение их диаметра в раневой области, что совпадало со структурно-функциональной реорганизацией соединительной ткани.
Развитие молодой соединительной ткани и ее васкуляризация осуществлялась одновременно с репаративной регенерацией многослойного плоского эпителия слизистой оболочки, эпидермиса и его дериватов (волосяные фолликулы, сальные и половые железы).
Через 3 сутки эксперимента митотический индекс эпителия слизистой оболочки составил 9,12% (у интактных крыс этот показатель был 5,31%). Наползающий эпителиальный регенерат состоял из крупных недифференцированных клеток и отличался слабой выраженностью базального слоя (рис.1).
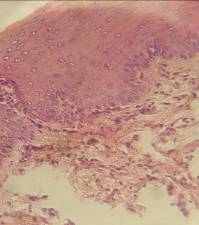
Рис.1 Эпителиальной регенерат травмированной слизистой оболочки щеки крысы. Стадия: 3 суток. Фиксация: 10% раствор нейтрального формалина. Окраска: гематоксилин Майера и эозин. Увеличение: об. 40, ок. 10.
Митотических фигур в регенерате не отмечено. Максимальное количество митозов регистрировалось в прилегающем к раневому участку эпителиальном пласте (на уровне базального и шиповатого слоев). Эпителиальный покров слизистой щеки околораневой зоны утолщен и был инфильтрирован полиморфноядерными лейкоцитами.
Высокая митотическая активности эпителиальных клеток слизистой оболочки регистрировалась нами у животных и через 5 суток после травматического повреждения ЧЛО. Однако впоследствии происходило ее снижение (табл. 2).
Таблица 2
Митотический индекс эпителиоцитов в краевой области раны слизистой оболочки щеки ‰
| | 3 сутки | 5 сутки | 10 сутки | 15 сутки |
| Интактная крыса (4,31±0,07) | | | | |
| рана | 9,12±0,63 | 11,3±0,37 | 8,9±0,51 | 6,2±1,22 |
Спустя 10 суток эпителизация раны в области слизистой оболочки щеки завершалась. Однако, восстановленный эпителиальный пласт характеризовался сглаженной границей между эпителием и подлежащей соединительной тканью (отсутствие сосочкового слоя собственной пластинки, характерного для обычного состояния слизистой оболочки). Более рыхлое расположение клеток и коллагеновых волокон подэпителиальной соединительной ткани свидетельствовало о продолжающейся ее дифференцировке, которая завершается лишь к 30 суткам эксперимента.
На данном этапе происходит функциональная дифференцировка эпителиального регенерата. Можно четко идентифицировать клетки базального, шиповатого, покровного слоев. Однако эпителиоциты не демонстрировали способность синтеза кератогиалина, что свидетельствовало все таки о незавершенности органотипической цитодифференцировки.
Эти данные в своей совокупности свидетельствуют о дисрегенераторном характере репарации сквозной раны щеки.
Ультраструктурный анализ реактивных изменений мышечных волокон, оказавшихся в раневом канале, показал следующее. После травмы в некротизирующихся участков миосимпластов наблюдается пикноз ядер (3-5 сутки эксперимента). У большинства мышечных волокон отмечается значительный отек саркоплазмы с расслоением и дезорганизацией миофибрилл, набухание митохондрий с разрушением их крист. У сарколеммы сохраненных фрагментов волокон определяются немногочисленные, окруженные узким ободком цитоплазмы вытянутые ядра с крупным ядрышком (миосателлитоциты).
В поврежденных мышечных волокон с 5 до 10 суток наблюдений обнаруживаются реактивно измененные, увеличенные в размерах собственно мышечные и подсаркалеммальные ядра миосателлитоцитов. В это же время на культях миосимпластов формируются слабобазофильные мышечные почки (рис.2). Последние, в ряде случаев, увеличиваясь в размерах, превращаются в примитивные миосимпласты, мигрирующие в саркоколеммный футляр.
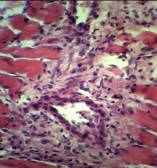
Рис.2 Формирование базофильных «почек» роста миосимпластов в зоне сквозного дефекта ЧЛО крысы. Стадия: 10 суток. Фиксация: 10% раствор нейтральный формалин. Окраска: гематоксилин Майера и эозин. Увеличение: об. 40, ок. 10.
Однако процесс образования подобных миобластов и миосимпластов не наблюдается в неповрежденных околораневых зонах щеки.
Гистологические особенности заживления ран в эксперименте в условиях инфицирования.
В серии наших экспериментов с инфицированными животными были в основном отмечены те же основные этапы развития воспалительного процесса в области раневого дефекта щеки, что и в случаях без введения микробных патогенов. Однако выраженность и морфологические проявления фаз этого процесса имели существенные отличия.
Так некротические явления и выраженность экссудативных реакций были более значительными. Повышение проницаемости стенки сосудов сопровождалось усиленными диапедезом форменных элементов крови (не только лейкоцитов, но и эритроцитов). Выраженная функциональная активация клеток эндотелия (скопления цитоплазматических везикул и гранул различной электронной плотности, набухание митохондрий, расширение полостей эндоплазматического ретикулума, возрастание количества пиноцитозных пузырьков) происходит на фоне ультраструктурных повреждений компартментов эндотелиоцитов и дискомплексация их цитомембран. При этом в цитоплазме данных клеток появляются крупные липосомы и ламеллярные тельца.
Нейтрофильные лейкоциты фагоцитируют микробов, а также некротизированные массы, лизируют нежизнеспособные эпителиальные, соединительнотканные и мышечные структуры. В отличие от предыдущей серии опытов установлено, что при инфицировании раны, в цитоплазме нейтрофильных лейкоцитов обнаруживаются крупные фагосомы с тканевым детритом. При этом клетки подвергаются деструктивным изменениям и распаду (возрастает число клеток с признаками дегенерации).
Нами установлено, что при загрязнении раны микроорганизмами четкий лейкоцитарной вал (демаркационная зона) не образуется, что не обеспечивает отграничение жизнеспособных тканей щеки от омертвевших гистологических структур. При этом скопления полиморфноядерных лейкоцитов всегда тесно связано с зоной расположения микробов в слизистой оболочке, подслизистой основе, в интермизии, дерме, гиподерме.
Развитие малодифференцированной (грануляционной) соединительной ткани в раневом канале носит очаговый характер. Она умеренно инфильтрирована лейкоцитами. Существенным моментом является быстрое созревание фибробластов, ускоренное формирование коллагеновых волокон, что наблюдается уже к 10 суткам эксперимента.
Ускоренная дифференцировка соединительной ткани в области раневого канала лимитирует регенерационные потенции эпителиальных и мышечных структур щеки. В итоге заживления раны осуществляется по принципу вторичного натяжения с образованием глубокого рубца. То есть в данном случае речь идет о заживлении раны через нагноение и гранулирование, что как известно обосновано патологами и хирургами (И. В. Давыдовский, 1952; М. И. Кузин, Б. М. Костюченок 1990).
При инфицировании нами обнаружено снижение фагоцитарной активности нейтрофилов.
Таким образом, по результатам цитологического анализа раневого процесса в условиях инфицирования мы сделали заключение о его дегенеративно-воспалительном характере. Это обосновывается тем, что в раневой области (по срокам наблюдений 3, 5, 10 суток) содержится большое количество нейтрофилов и макрофагов (рис. 3) в состоянии дегенерации и деструкции в виде кариопикноза и кариорексиса, цитолиза. У сохраненных же нейтрофилов, при внутриклеточном расположении микробов, фагоцитоз носит преимущественно незавершенный характер.
Рис.3 Лейкоциты с признаками деструкции в области инфицированной раны щеки крысы. Стадия: 10 суток. Увеличение: 22500
Полученные нами данные по течению инфицированных ран щеки позволили сделать заключение о существенных нарушениях гомеостатических механизмов, приводящих к разобщению процессов воспаления и регенерации тканей и в последнем к неадекватному фиброзу. Эти события позволили нам их интерпретировать как проявления дисрегенерации, как результат нарушения (уклонения) кинетики воспалительно-репаративной реакции (В. В. Серов, В. С. Пауков, 1995).
Склерозирующие процессы негативно сказываются не только для посттравматического восстановления структур слизистой оболочки щеки, структур кожи но и особенно для репаративного гистогенеза миосимпластов. Последнее обстоятельство на наш взгляд является особенно усугубляющим фактором для репарации и функционального состояния сократительного (жевательного) аппарата ЧЛО.
По данным ультраструктурного анализа в макрофагах уменьшено количество лизосом и фагосом, регистрируются признаки деструкции данных клеток. Отсутствуют макрофаго-фибробластические и макрофаго-лейкоцитарные контакты.
В фибробластах часто отмечаются ультраструктурные повреждения мембранных компартментов. Вследствие весьма незначительного числа миофибробластов тормозится контракция раневого дефекта. Регенерация эпителиев слизистой оболочки и кожи, мышечных структур щеки замедлена из-за выраженной воспалительной инфильтрации, некротических изменений грануляционной ткани, нарушения стромально-паренхиматозных взаимоотношений.
Резкое набухание, деструкция и десквамация эндотелия капилляров, утолщение и расслоение базальных мембран ведут к существенным нарушениям транскапиллярного обмена. С другой стороны плазматическое пропитывание и нейтрофильная инфильтрация стенок кровеносных сосудов и периваскулярных пространств создают условия для развития эндо- , пери- и панваскулита, часто заканчивающегося облитерацией их просвета.
В своей совокупности описанные ранее процессы приводят к структурной перестройке поврежденных участков ЧЛО, прогрессированию склероза, сочетающегося с отсутствием не только гистотипической регенерации, но и органотипической дифференцировки элементов, формирующихся в регенерате слизистой оболочки, подслизистой основы, мышц, дермы и ее дериватов. Подобная ситуация по определению патологов (А. И. Струков, В. С. Пауков, О. Я. Кауфман, 1990, А. Б. Шехтер, 1990) «является извращением морфологической функции соединительной ткани, которая как бы отмежевывается от паренхиматозных структур, действует в интересах сохранения формы органа, «жертвуя» его функцией».
При инфицировании отмечено значительное лимитированное развитие грануляционной (малодифференцированной) соединительной ткани в раневой области, что приводило к задержке эпителизации как гистоструктур кожи, так и слизистой оболочки щек (что было подтверждено нашими иммуноцитохимическими исследованиями по оценке антиапоптотического гена bcl 2).
Как известно белок bcl 2 способен контролировать процессы регенерации, ограничивает вступление клеток в апоптоз, обеспечивая межклеточные коммуникации и энергетические метаболические процессы (Selinfreund R. H., 2001; Корепанова О. А., 2007).
Наши исследования показали, что экспрессия синтеза данного белка в моделируемых условиях составила (подсчет позитивных клеток в условных полях зрения микроскопа МБИ – 15) в зависимости от сроков (5-10 суток) эксперимента (в %):
- эпителиоциты слизистой оболочки щеки 8,2±0,6 – 11,3±0,9 (интактные крысы 3±0,01);
- фибробласты в зоне сквозной раны щеки 16,2±1,1 – 22,2±0,9 (интактные крысы 4±0,01);
- эндотелиоциты раневой области 1±0,01 – 6,2±0,33 (интактные крысы 0).
Структурно-функциональная реорганизация крупноклеточных ядер гипоталамуса при сквозных ранениях челюстно-лицевой области крыс.
Исходя из целевой установки нашей работы, мы на светооптическом и ультраструктурном уровне проанализировали морфофункциональное состояние нонпептидергической нейросекреторной системы (супраоптические и паравентрикулярные ядра подбугорья головного мозга) у экспериментальных животных.
Наши исследования показали, что через трое суток от начала эксперимента (полнослойные сквозные раны щеки крыс) происходит достоверное увеличение размеров ядер, ядрышек и цитоплазмы «светлых» (то есть изначально функционально активных) нейросекреторных клеток (НСК) супраоптических (СО) и паравентрикулярных (ПВ) ядер гипоталамуса. Данные морфометрические показатели сохранялись повышенными (относительно интактных животных) через 5 и 10 суток.
В перикариотах НСК определяется расширенная эндоплазматическая сеть и большое количество свободные рибосом. Аппарат Гольджи представлен в виде нескольких компонентов (диктиосомы), локализованных перпендикулярно, развит хорошо. Митохондрии имеют обычное строение и рассредоточены по всей цитоплазме.
Нейросекреторные включения представлены двумя разновидностями: гранулами и каплями, имеющими позитивную окраску по Гомори-Габу (паральдегидфуксином). Элементарные секреторные гранулы при ультраструктурном исследовании имеют электронноплотную сердцевину, оптически прозрачное тело и пограничную мембрану. Размеры гранул в значительном состоянии варьируют.
В составе исследованных гипоталамических ядер экспериментальных животных в наблюдаемые сроки преобладает «светлые» функционально активные НСК. В подобных клетках синтез нейросекрета уравновешен с его выведением в аксоны и их терминали на уровне нейрогипофиза. Они имеют крупные размеры тела, ядра и ядрышка. Ядра светлые, содержат деконденсированный хроматин. Количество пикноморфных НСК не велико.
Одновременно в эти сроки мы установили усиленное высвобождение нейросекрета по аксонам НСК на уровне тубероинфундибудярного тракта и аксовазальных контактов. При этом в терминалях аксонов НСК определялись в большом количестве «пустые пузырьки», то есть те ультраструктуры, которые прежде содержали нейросекреторный материал. Однако степень высвобождения нейросекрета по стадиям опытов отличалась и существенно понижалась к 15 суткам.
Так через 5 суток в нейрогипофизе травмированных крыс у 32,6±2,9% терминалей аксонов нейросекреторных клеток, в том числе контактирующих с гемокапиллярами, отмечалось скопление элементарных секреторных гранул в виде электронноплотных конгломератов, напоминающих гипертрофированные тельца Герринга.
Через 15 суток эксперимента доля подобных терминалей составила 47,8±2,3%. Все это свидетельствует о депонировании нейросекрета и задержке (блокировки) его высвобождения в общий кровоток. Об этом же свидетельствует распад секреторных гранул в аксоплазме без явления экзоцитоза.
Кроме того происходила дегенерация части терминалей аксонов по «темному» типу. Такие терминали, вероятно, принадлежали пикноморфным, а также дегенерирующим функционально активным нейросекреторным клеткам супраоптическим и паравентрикулярным ядрам гипоталамуса. В них происходит деградация органелл (особенно микротрубочек и микрофиламентов), набухание и разрушение митохондрий. Часть фрагментирующихся аксонов фагоцитируется питуицитами.
Подобные изменения терминалей аксонов НСК были в 2,2-2,7 раза больше у инфицированных крыс. При этом в перикарионах подобных клеток появляются крупные (до 1 мкм) вторичные лизосомы. Они представлены аутофагическими вакуолями, мультивезикулярными, липофусциноподобными и остаточными тельцами. Во многих из них определяются следы лизируемых ими органелл и секреторных включений.
Мы особенно подчеркиваем, что у данных экспериментальных животных (в условиях инфицированных ран) в ядре гипоталамуса возрастает число пикноморфных НСК [по А. Л. Поленову (1993) клетки в состоянии «физиологической» дегенерации]. Они имеют угловатую, различной степени сжатости форму тела и пикнотические ядра, темную цитоплазму (рис. 4). У подобных клеток происходит массовая деградация органелл, потеря секреторных гранул.
Рис. 4 Пикноморфные нейросекреторные клетки паравентрикулярного ядра гипоталамуса крысы через 15 суток после травматического повреждения ЧЛО (в условиях инфицирования раны). Фиксация: жидкость Буэна. Окраска: паральдегидфуксин по Гомари-Габу в модификации А. Л. Поленова. Увеличение: об. 8, ок. 10.
Описанные явления можно трактовать с позиций особенностей секреторного цикла пептидергических нейронов переднего гипоталамуса, который как известно (А. Л. Поленов 1993), возможен в двух вариантах: спокойное функционирование и интенсивная гиперсекреция. Мы лишь делаем акцент на том, что активация гипоталамо-гипофизарной нейросекреции (ГГНС) в условиях инфицирования ран ЧЛО происходит на фоне блокирования высвобождения нейросекрета в гемоциркуляцию животных, что, безусловно, приведет к дефициту данных адаптивных нейрогормонов в общий кровоток (особенно на стадии 15 суток эксперимента и особенно в условиях инфицирования). Заметим, что именно в эти сроки эксперимента в раневом канале щеки крыс наблюдались явления дисрегенераторного характера в ране.
Ультраструктурный анализ СО и ПВ ядер гипоталамуса у данных экспериментальных животных позволили получить дополнительную информацию о серьезных повреждениях секреторного процесса, что вероятно еще более усугубляет недостаточность поступления наннопептидных гормонов в гемоциркуляцию, тем самым создавая ограничения в регуляторном их влиянии на репаративные процессы.
Имеет также место дискомплексация канальцев гранулярного ретикулума, редукция комплекса Гольджи, увеличение числа лизосом, ауфагосом, ламеллярных телец и липосом. Секреторные гранулы локализуются в околоядерной зоне, а также по периферии клеток. Четко наблюдаются явления кринофагии.
Возрастает численность пикноморфных нейросекреторных клеток (дегенерирующих), с признаками кариопикноза, секвестрацией цитоплазмы.
Наши результаты не позволяют в полной мере ответить на вопрос в какой степени изменения гипоталамо-гипофизарной нейросекреции в условиях инфицированной раны ЧЛО однонаправлено реализуются в общей гемоциркуляции по критериям содержания гормонов и их связей с лигард-рецепторами. Тем не менее мы можем сделать определенное заключение о том, что процессы, происходящие в раневом канале ведут к «запуску» различных звеньев репарации тканей, в том числе и гипоталамо-гипофизарного. Безусловно, нарушение репаративного тканевого гомеостаза в инфицированной ране, рассинхронизация фаз воспаления, переход регенеративного процесса в дисрегенерацию протекает на фоне разбалансированных процессов продукции и высвобождения гуморальных факторов центрального звена нейроэндокринной регуляции, что может в свою очередь ограничить реализацию адаптогенного их влияния на паренхиматозные и стромальные элементы ЧЛО.
Влияние гипоталомических нейропептидов (окситоцина) на заживление ран в эксперименте, в том числе в условиях инфицирования.
Как было описано выше морфологические процессы в раневом дефекте щеки экспериментальных крыс коррелировали с соответствующем реорганизацией нонапептидергической ГГНС (СО и ПВЯ гипоталамума, нейрогипофиза).
Исходя из этого мы приводим в данной главе диссертации морфологические сведения об эффектах воздействия окситоцина на течение раневого процесса. Прежде всего местное применение окситоцина приводит к 2,5-3-х кратному возрастанию митотического индекса эпителиоцитов слизистой оболочки щеки по срокам наблюдений (табл. 3). При этом усиление пролиферации отмечено и при совместном использовании данного нейропептида и антибиотика. Следует подчеркнуть, что антибиотикотерапия раневого процесса без введения окситоцина подобного эффекта не оказывала.
Таблица 3
Митотическая активность (митотический индекс – МИ) эпителиоцитов слизистой оболочки ротовой полости экспериментальных крыс.
| МИ (в промиллях) | 3 сутки | 5 сутки | 10 сутки | 30 сутки |
| Контроль 3,34±0,03 | | | | |
| Опыт (без лечения) | 6,77±0,07 | 8,32±0,04 | 9,62±0,11 | 6,78±0,03 |
| Опыт (окситоцин) | 9,53±0,06 | 12,22±0,06 | 10,84±0,23 | 6,89±0,04 |
| Опыт (антибиотик) | 5,41±0,03 | 7,11±0,05 | 8,12±0,12 | 4,11±0,02 |
| Опыт (антибиотик + окситоцин) | 10,22±0,04 | 13,12±0,03 | 12,41±0,06 | 7,01±0,01 |
Кроме того, можно сделать заключение о том, что инициация клеточной репродукции под воздействием гипоталамического нонапептида (окситоцина), имеющаяся у эпителиоцитов на ранних этапах регенераторного процесса, не приводит в последующие сроки к чрезмерному разрастанию эпителиальной ткани. При этом пролиферация эпителиоцитов всегда происходит в ходе органотипической миграции клеток в область краев раны (рис. 5).
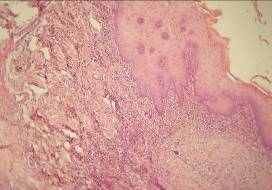
Рис. 5 Эпителиальный пролиферат в слизистой части сквозной раны щеки крысы через 5 суток после травматического повреждения (введения оксотоцина). Фиксация: спирт – формалин. Окраска: метиловый-зеленый и пиранин по Браше. Увеличение: об. 20, ок. 10.
Коэффициент регенерации (соотношение эпителизированной поверхности к общей поверхности раны) был следующим (табл. 4):
Таблица 4
| | 3 сутки | 5 сутки | 10 сутки |
| Опыт (без лечения) | 0,24 | 0,54 | 0,83 |
| Опыт (окситоцин) | 0,43 | 0,67 | 0,97 |
| Опыт (антибиотик) | 0,22 | 0,49 | 0,78 |
| Опыт (антибиотик+окситоцин) | 0,45 | 0,81 | 1,00 |
* соотношение определилось с помощью окуляр-вставка (256 квадратов) в полях зрения микроскопа МБИ-15, ув. об. 8, ок. 7.
Таким образом выявлено опережение появления краевой эпителизации и эпителизации раневого дефекта в целом у животных, которым вводили окситоцин, в том числе и совместно с антибиотиками, который сам по себе подобный процесс не вызывал.
Существенно корригировалось соотношение функционально специализированных клеток на «поле воспаления». Это касалось как кожной, так и слизистой части щеки животных (табл.5, табл.6)
Таблица 5
Содержание нейтрофильных лейкоцитов в тканях щеки (слизистая оболочка) %
| | 3 сутки | 5 сутки | 10 сутки |
| Интактная крыса 0,61±0,03 | | | |
| Без окситоцина | 37,21±2,13 | 19,14±1,13 | 10,71±1,22 |
| Окситоцин | 51,4±3,21 | 22,11±1,45 | 5,11±0,52 |
| Антибиотик | 28,6±1,14 | 17,8±1,02 | 9,14±0,77 |
| Окситоцин+антибиотик | 56,8±1,33 | 31,4±1,09 | 6,82±0,78 |
Таблица 6
Содержание нейтрофильных лейкоцитов в тканях кожной части щеки (%)
| | 3 сутки | 5 сутки | 10 сутки |
| Интактная крыса 0,31±0,01 | | | |
| Без окситоцина, асептические условия | 41,12±1,82 | 31,81±2,08 | 27,31±3,14 |
| Окситоцин, асептические условия | 59,11±1,42 | 29,8±2,11 | 11,4±0,88 |
| Антибиотик | 39,82±2,14 | 28,8±2,31 | 26,31±0,97 |
| Антибиотик +окситоцин | 48,61±1,81 | 25,61±0,16 | 9,18±0,14 |
Наряду с нейтрофильными лейкоцитами из сосудистого русла эмигрируют на «поле воспаления» и макрофаги моноцитарного генеза. Исследование их количества на условную единицу гистологического препарата, показало различный характер их экстравазации по сериям опыта (табл. 7).
Таблица 7
Содержание мононуклеаров (макрофагов) в тканях щеки (слизистая оболочка)%
| | 3 сутки | 5 сутки | 10 сутки |
| Интактная крыса 0,51±0,01 | | | |
| Без окситоцина, асептические условия | 61,81±4,31 | 40,04±1,22 | 12,31±1,22 |
| Окситоцин, асептические условия | 71,21±2,41 | 51,12±2,44 | 18,21±2,13 |
| Антибиотик | 58,41±3,21 | 33,46±1,48 | 13,22±2,61 |
| Антибиотик+окситоцин | 69,11±1,22 | 52,11±2,61 | 17,81±1,66 |
Под влиянием окситоцина в том числе и в сочетании с антибиотиком содержания макрофагов, дифференцирующихся из моноцитов, достоверно увеличивается. Данная тенденция прослеживается и через 3-5 сутки эксперимента. Аналогичные результаты получены и в тканевых структурах кожи.
Следует полагать, что более быстрая дифференцировка мононуклеаров и их трансформация в макрофаги (в условиях местного воздействия на раневой дефект тканей щеки экспериментальных животных окситоцина) и последующая утилизация продуктов распада обеспечивают эффективное очищение очага воспаления и последующие развитие репаративных процессов эпителиальных и соединительнотканных структур.
Толщина эпителия слизистой оболочки щеки (в краевой зоне раневого дефекта) постепенно увеличивалась по срокам наблюдений в условиях введения окситоцина во всех сериях опытов. Так через 5 суток опыта толщина эпителия у неинфицированных животных под воздействием окситоцина возрастает в 1,8 раза, а у инфицированных – в 1,4 раза.
Увеличение толщины эпителиального пласта происходило за счет активизации митотического деления клеток базального и шиповатого слоев (табл. 8).
Таблица 8
Митотическая активность эпителия слизистой оболочки щеки крыс (в краевой зоне раны) в %
| | 3 сутки | 5сутки | 10 сутки | 30 сутки |
| Животные без инфицирования | 3,8±0,21 | 4,9±0,11 | 4,1±0,22 | 2,9±0,14 |
| Инфицированные животные | 2,7±0,11 | 2,2±0,12 | 1,7±0,05 | 1,4±0,03 |
| Введение окситоцина (без инфициров) | 5,5±0,26 | 9,1±0,31 | 7,3±0,21 | 4,0±0,24 |
| Введение окситоцина (инфициров) | 4,1±0,22 | 5,9±0,11 | 5,1±0,33 | 3,9±0,17 |
| Инфицир. животные+антибиотик | 2,6±0,08 | 1,4±0,01 | 1,8±0,22 | 1,2±0,02 |
| Инфицр. живот.+антибиот+окситоцин | 5,0±0,02 | 10,4±0,09 | 8,2±0,06 | 5,1±0,07 |
Нарастание толщины эпителия слизистой ротовой полости экспериментальных животных может рассматриваться как приспособительный механизм, который в сочетании с повышенной скоростью обновления эпителиоцитов усиливает барьерные свойства эпителиального покрова и препятствует транслокации микроорганизмов и их продуктов (Быков В. Л., 1996, Hill M. W., et al, 1981, Кулаева В. В., Быков В. Л., 2007).
При использование окситоцина (и особенно в случаях инфицирования стафилококком) наиболее заметные отличительные изменения в ране (по сравнению с предыдущими сериями опытов) имели место в экссудативную и пролиферативную фазы воспаления. Так электронномикроскопически выявлено возрастание в нейтрофильных лейкоцитах числа свободных рибосом, что свидетельствует об усиление синтеза РНК при продолжающимся фагоцитозе микробов и тканевого детрита.
В условиях применения окситоцина (в чистом виде, либо в сочетании с антибиотиком) уже в течение первых суток формируется лейкоцитарный вал, на границе жизнеспособных и омертвевших тканей, отграничивающих их друг от друга.
Развитие малодифференцированной (грануляционной) соединительной ткни при введении в область раневого канала окситоцина, происходит на 3-е сутки после травмы. Она достигает максимального развития через 5 суток эксперимента, заполняя раневой дефект.
Ее формирование сопровождается интенсивным новообразованием гемокапилляров. Интенсивный васкулогенез сочетается с появлением вокруг сосудов микроциркуляторного русла активизированных и митотически деятельных периваскулярных клеток и концентрацией тучных клеток (лаброцитов).
Важнейшим мобилизирующим клеточным компонентом грануляционной ткани при воздействии окситоцина являются фибробласты (малодифференцированные клеточные формы, функционально специализированные, и, особенно, миофибробласты). Последние, как известно, обеспечивают контрактильные процессы в раневом канале.
По нашим данным основным предшественником клеток фибробластического дифферона являются околососудистые камбиальные клетки. И в этом отношении по этому поводу наши данные согласуются с известными суждениями морфологов (Аничков Н.Н. 1951, Шумкевич Л. Л. 1965, Ross R., Odland J. 1968).
Введение окситоцина (одного, либо в сочетании с антибиотиком) приводит к возрастанию количества фибробластов, и они к 10-15 суткам эксперимента становятся преобладающим пулом клеток в малодифференцированной соединительной ткани. Это в свою очередь создает адекватные условия для репаративной регенерации эпителиальных структур кожной (рис. 6) и слизистой (рис.7) части щеки экспериментальных животных.

Рис. 6 Участок регенерата кожной части щеки крысы через 10 суток после травматического повреждения ЧЛО (введение окситоцина). Фиксация: 10% раствор нейтрального формалина. Окраска: гематоксилин Майера и эозин. Увеличение: об. 40, ок. 10.
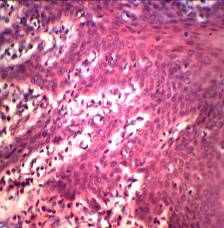
Рис.7 Эпителиальный регенерат слизистой части щеки через 10 суток после сквозного ранения (введение окситоцина). Фиксация: спирт, формалин. Окраска: гематоксилин Майера и эозин. Увеличение: об. 20, ок. 10.
По данным иммунохимического исследования, в фибробластах раневой области, под воздействием окситоцина снижается проапоптотическая доминанта (по показаниям экспрессии гена р53) и возрастает число экспрессирующих синтез белков bcl-2 . Это может свидетельствовать о формировании у фибробластов «готовности» вступать в пролиферативный процесс по механизмам эндомитоза, эндорепродукции, не улавливаемым нашими методическими подходами.
В таких клетках (в отличие от предыдущих сериях экспериментов) отмечались хорошо развитая гранулярная эндоплазматическая сеть, крупные митохондрии со светлым матриксом и разветвленными кристами. Они имели крупные ядра округло-овальной формы с 1-2 ядрышками, расположенными чаще всего прикариолеммно.
Необходимо подчеркнуть, что процессы фибриллогенеза в ране (при использовании окситоцина) были отсрочены по времени (по сравнению с предыдущими сериями опытов) до 30 суток. Именно в этот период происходит внутренняя перестройка фибробластов и формировалась его способность к интенсивному синтезу коллагена.
Наши свидетельствуют о том, что экзогенно вводимый окситоцин интенсифицирует энергетический и метаболический потенциал фибробластов, направлял его на формирование малодифференцированного состояния соединительной ткани, пролонгируя период образования грануляционной ткани, когда коллагенез выражен слабо. Тем не менее подобная пролонгация не исключает соответствующую подготовку соединительнотканных элементов к последующему фибриллогенезу.
Интенсивный коллагенез в ране (в условиях лечебной коррекции окситоцин либо в его комбинации с антибиотиком) происходит в сроки более 15 суток от момента нанесения сквозного ранения щеки. Это обстоятельства обеспечивает необходимые условия для репаративного гистогенеза паренхиматозных структур ЧЛО экспериментальных животных (покровного и железистого эпителиев, миосимпластов, дериватов кожи).
Существенную активизацию под воздействием окситоцина демонстрируют не только фибробласты, макрофаги, но и тучные клетки. В этих условиях мы отметили активизацию процессов дегрануляции этих клеток с появлением вокруг них цитоплазматических гранул просветлений (вакуолей), которые имеют тенденцию к при плазмолеммной локализации.
Под воздействием окситоцина, в том числе и в сочетании с антибиотиком на 5-е сутки эксперимента в грануляционной ткани возрастает число плазматических клеток (по сравнению с нелеченными экспериментальными животными). Они концентрируются, как правило, около кровеносных сосудов микроциркуляции. Следует заметить, что при этом в малодифференцированной соединительной ткани, заполняющий раневой канал микроорганизмы не определяются, как это было отмечено в предыдущих опытах. Микроорганизмы, как жизнеспособные, так и фагоцитированные лейкоцитами и макрофагами регистрируются в некротических массах.
Это лишний раз доказывает то обстоятельство, что применение антибиотикотерапии, в том числе и с использованием окситоцина, не исключает необходимости ранней некрэктомии, тщательного поиска малейших гнойных затеков и их ликвидации (Кузин М. И. с соавт.,1979).
Нами установлено, что параллельно с развитием грануляционной ткани в области сквозного раневого дефекта щеки крыс, под воздействием окситоцина (включая его сочетание с антибиотиками) происходит существенная оптимизация пролиферативной фазы посттравматического воспаления. Этот процесс начинается на 3-5 сутки эксперимента. При этом высокая скорость эпителизации раны обеспечивается митотической репродукцией базальных клеток эпителиального покрова слизистой оболочки щеки и эпидермиса кожи, эпителиоцитов волосяных фолликулов, миоэпителиальных клеток потовых желез, а также малодифференцированных элементов сальных желез.
Миграция пролиферирующих клеток эпителиальных пластов к 10 суткам опытов приводит к адекватному и полному закрытию раневого дефекта, как со стороны ротовой полости, так и со стороны кожных покровов. Следует подчеркнуть, что количество митозов возрастает и среди эпителиоцитов, удаленных от раневого канала.
Важно отметить, что в регенерате кожной части раны, в условиях применения окситоцина, наблюдается органотипическая дифференцировка новообразованных гистоструктур. Это касается не только формирования слоев эпидермиса, но и вторичной дифференцировки сальных, потовых желез и волосяных фолликулов.
Можно сделать заключение о том, что введение в рану окситоцина обеспечивает равновесие фаз воспаления (2-й и 3-й), в итоге приводя к оптимальному течению раневого процесса (т.е. заживлению по типу первичного натяжения).
С другой стороны, мы констатируем, что в случаях инфицированная раны St. aureus, даже при использовании антибиотикотерапии, заживление раны осуществляется с образованием глубокого рубца (вторичным натяжением).
Важно также подчеркнуть то обстоятельство, что использование окситоцина, как лечебного средства, позитивным образом сказывалось и на репарацию поперечнополосатой мышечной ткани щеки. При этом гибель части миосимпластов сопровождались выраженной репаративной регенераторной реакцией со стороны камбиальных элементов (миосателлитоцитов). В сроки наблюдений (5-10 сутки экспериментов) формируются многочисленных мышечные почки, состоящие из овальных или слабо отростчатых клеток с крупными светлыми ядрами. В дальнейшем из них образовывалась мышечные волокна, сформированные в пучки.
