Автореферат разослан
| Вид материала | Автореферат |
- Автореферат разослан " " 1996, 264.76kb.
- Автореферат разослан 22 ноября 2011, 810.64kb.
- Автореферат разослан, 378.04kb.
- Автореферат разослан 2010, 247.49kb.
- Автореферат разослан 2004, 676.99kb.
- Автореферат разослан 2008, 441.97kb.
- Автореферат разослан 3 ноя, 388.48kb.
- Автореферат разослан 2009, 589.75kb.
- Автореферат разослан 2007, 489.7kb.
- Автореферат разослан 2011, 854.41kb.
Далее нами показано, что в клетках К562/4-NQO, и особенно К562/2-DQO, процессы эритроидной дифференцировки протекали более интенсивно по сравнению с родительской линией. Причем обнаруженный эффект имел место только при обработке тимидином (рис. 6), но не бутиратом натрия или ДМСО. Резкое увеличение содержания гемоглобина в клетках сублиний обусловлено повышением синтеза белка (в частности, β-глобина, рис. 7), а не увеличением численности клеток в культурах.
В условиях индуцированной тимидином дифференцировки клеток К562/2-DQO наблюдалось резкое повышение экспрессии гена каспазы-3, но не каспазы-9 (рис. 8). Для клеток К562/4-NQO подобного эффекта не отмечено. Экспрессия генов каспаз в необработанных клетках К562/4-NQO и К562/2-DQO снижена. Снижение экспрессии также имело место при обработке тимидином+дексаметазон. При этом в отличие от родительских, в клетках сублиний апоптоз не индуцировался.
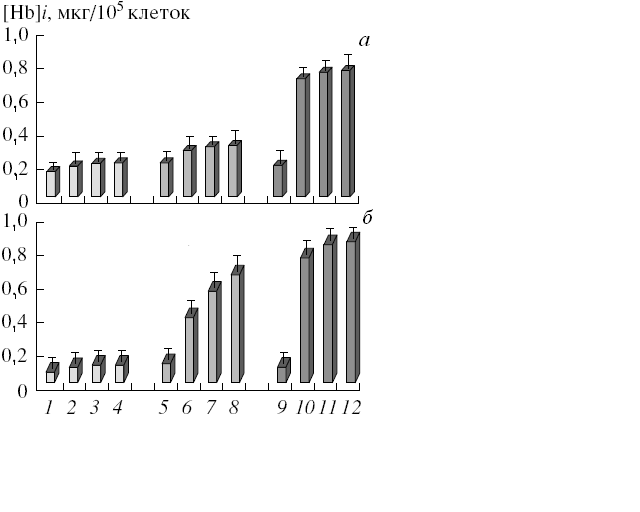
Рис. 6. Влияние обработки клеток К562, К562/4-NQO и К562/2-DQO тимидином на содержание гемоглобина за 2 (а) и 4 (б) суток
1 – необработанные клетки К562 (контроль); 2, 3, 4 – клетки К562, обработанные 1, 2 и 3 мМ тимидина, соответственно; 5 – необработанные клетки К562/4-NQO; 6, 7, 8 – клетки К562/4-NQO, обработанные 1, 2 и 3 мМ тимидина, соответственно; 9 – необработанные клетки К562/2-DQO; 10, 11, 12 – клетки К562/2-DQO, обработанные 1, 2 и 3 мМ тимидина, соответственно. Различия достоверны (p<0,05; p<0,01) в парах: 2-6, 2-10; 3-7, 3-11; 4-8, 4-12
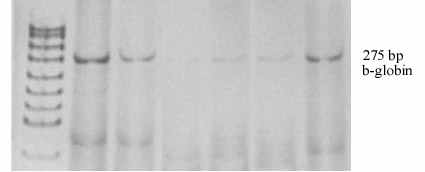
Рис. 7. Электрофореграмма ПЦР-продуктов гена β-глобина клеток родительской линии К562 и сублиний К562/2-DQO, К562/4-NQO
1 – маркер длин фрагментов pUC19/Msp I (0,5 мкг/мкл, 501-67 bp); 2 – клетки К562, обработанные тимидином; 3 – необработанные клетки К562; 4 – необработанные клетки К562/4-NQO (сублиния, резистентная к 1,0×10-6 М 4-NQO); 5 – необработанные клетки К562/4-NQO (сублиния, резистентная к 1,0×10-7 М 4-NQO); 6 – необработанные клетки К562/2-DQO (сублиния, резистентная к 7,6×10-5 М 2-DQO); 7 – клетки К562/2-DQO, обработанные тимидином. Концентрация тимидина – 2 мМ, время обработки – 2 суток
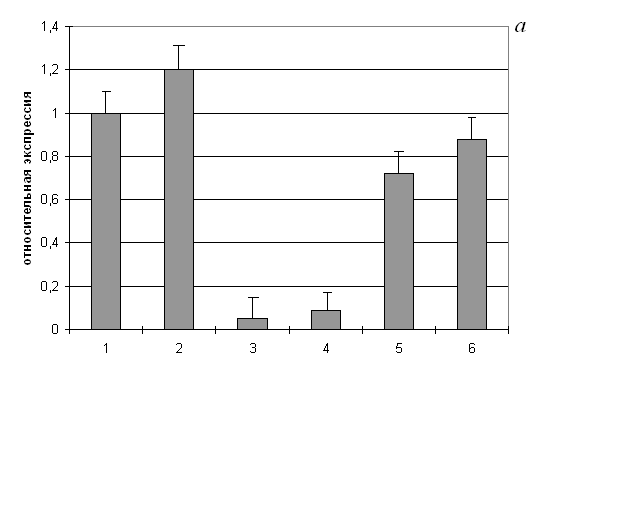
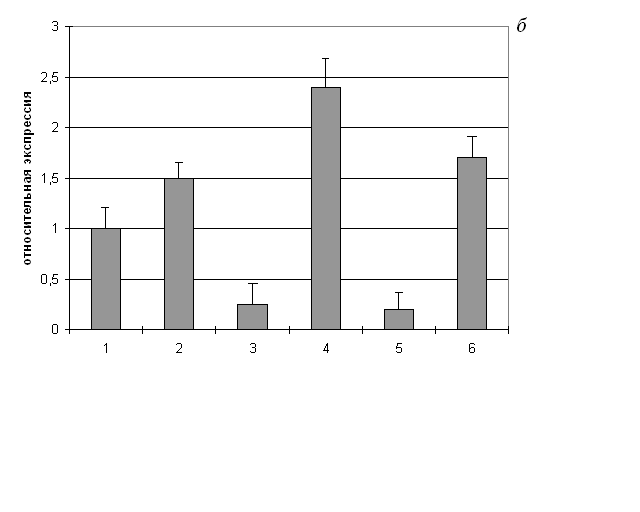
Рис. 8. Относительная экспрессия генов каспазы-9 (а) и каспазы-3 (б) в клетках родительской линии К562 и сублиний К562/2-DQO, К562/4-NQO
1 – необработанные клетки К562; 2 – клетки К562, обработанные тимидином; 3 – необработанные клетки К562/2-DQO; 4 – клетки К562/2-DQO, обработанные тимидином; 5 – необработанные клетки К562/4-NQO; 6 – клетки К562/4-NQO, обработанные тимидином. Концентрация тимидина – 2 мМ, время обработки – 2 суток. Относительная экспрессия гена (ΔСt) в опыте определялась исходя из экспрессии гена в контроле, которая принималась за единицу: ΔСt=2Сt(контроля)– Сt(опыта)
Различия достоверны (p<0,05) в парах: 1-3, 1-5, 2-4 (на рис. а и б); 1-2, 3-4, 5-6 (на рис. б)
Таким образом, в клетках К562, резистентных к 2-DQO и 4-NQO, наблюдается более выраженная индукция дифференцировки и сниженная чувствительность к индукции апоптоза по сравнению с родительской линией. Подобные изменения в сублиниях связаны с развитием устойчивости к 4-NQO, 2-DQO и другим соединениям (агентам группы МЛУ).
3. Биологическая активность структурно-различных химических реагентов на клетки К562/ts-p53
Клетки К562 дефектны по гену р53, который является важнейшим элементом ответа на стрессорные воздействия, в том числе на воздействие химиотерапевтических препаратов. Изменения в гене приводят к нарушению способности клеток вступать в апоптоз, останавливаться в контрольных точках клеточного цикла в ответ на повреждение и к развитию МЛУ (Ставровская, 2000). Чаще всего в гене обнаруживаются миссенс-мутации, приводящие к замене одного из аминокислотных остатков в ДНК-связывающем домене белка, что отражается на особенностях влияния мутантных форм р53 на фенотип опухолевых клеток. Нами было изучено влияние мышиного р53 белка, мутантного по Val 135, на дифференцировку и апоптоз клеток К562/ts-p53 после их обработки N-оксидированными производными хинолина в комбинации с эритроидными индукторами. При 37оС этот белок имеет типичные характеристики мутантного белка, а при 32оС приобретает конформацию и свойства белка дикого типа. В качестве контроля были использованы клетки с введенным пустым ретровирусным вектором pPS/neo (К562/neo).
Из результатов следует (табл. 12), что в клетках К562/ts-р53 процессы эритроидной дифференцировки и апоптоза протекали более интенсивно по сравнению с клетками К562/neo и клетками родительской линии. Тимидин, бутират натрия и ДМСО повышали синтез гемоглобина в клетках K562/ts-p53. Полученные данные подтверждают ранее обнаруженную способность опухолевого супрессора усиливать эритроидную дифференцировку клеток (Chylicki et al., 2000a; Chylicki et al., 2000b; Yao et al., 2004). Ингибирование синтеза гемоглобина и индукция апоптоза наблюдались при обработке QO. Установлено, что в индукции эритроидной дифференцировки клеток участвует каспаза-3, поскольку добавление ингибитора фермента приводило к снижению синтеза гемоглобина. QO не активировал каспазу-3. Обработка клеток тимидином или бутиратом приводила к повышению активности каспазы-9 и индукции апоптоза. При добавлении в культуры QO наблюдалось резкое возрастание активности фермента и выраженный апоптоз. Эффект отсутствовал при обработке ДМСО или ДМСО+QO. Вероятно, ДМСО способствует инактивации р53, что отражается на развитии апоптоза, индуцированного QO.
Особенности клеток K562/ts-p53 объясняются способностью мутантного р53 белка в определенных условиях сохранять некоторые активности белка дикого типа: связываться с р53-респонсивными элементами и увеличивать транскрипцию репортерных генов, участвующих в процессах дифференцировки или апоптоза.
Таблица 12
Биологическое действие индукторов эритроидной дифференцировки и их комбинаций с QO на клетки K562/ts-p53
| Линия клеток | Реагенты | Концентрация | Индукция эритроидной дифференцировки | Повышение активности каспаз | Усиление флуоресценции | Снижение [NAD++NADH]i | ||
| Каспаза-9 | Каспаза-3 | ДАФИ | БЭ | |||||
| K562/ts-p53 | ТИМИДИН | 2 мМ | ++ | + | + | + | ― | ― |
ТИМИДИН + QO | 2 мМ+ 10 мкМ | + | + | + | + | + | ++ | |
| БУТИРАТ НАТРИЯ | 2 мМ | ++ | + | + | + | ― | + | |
| БУТИРАТ НАТРИЯ + QО | 2 мМ+ 10 мкМ | + | + | + | + | + | ++ | |
| ДМСО | 0,1 % | ++ | ― | + | + | ― | ― | |
| ДМСО + QO | 0,1%+ 10 мкМ | ― | ― | ― | + | ― | ― | |
| QO | 10 мкМ | ― | + | ― | + | + | ― | |
