Автореферат разослан
| Вид материала | Автореферат |
- Автореферат разослан " " 1996, 264.76kb.
- Автореферат разослан 22 ноября 2011, 810.64kb.
- Автореферат разослан, 378.04kb.
- Автореферат разослан 2010, 247.49kb.
- Автореферат разослан 2004, 676.99kb.
- Автореферат разослан 2008, 441.97kb.
- Автореферат разослан 3 ноя, 388.48kb.
- Автореферат разослан 2009, 589.75kb.
- Автореферат разослан 2007, 489.7kb.
- Автореферат разослан 2011, 854.41kb.
1. Биологическая активность структурно-различных химических реагентов на клетки родительской линии К562
1.1. Влияние нуклеозидов на пролиферацию, дифференцировку и апоптоз клеток. Биологическое действие нуклеозидов основано на способности вступать в конкурентные отношения с клеточными метаболитами, в частности, с предшественниками нуклеиновых кислот, что приводит к нарушению их синтеза и далее жизнедеятельности клеток. Нами изучено изменение процессов пролиферации, дифференцировки и апоптоза клеток К562 при обработке цитидином, тимидином и гуанозином.
Обработка клеток возрастающими концентрациями (1–3 мМ) нуклеозидов в течение 1–4 суток приводила к дозо- и время-зависимому снижению пролиферации. Так, численность клеток на 2-е сутки составила 138,330,39 тыс./лунку при обработке 2 мМ тимидина и 95,330,47 тыс./лунку в условиях инкубации с 1 мМ гуанозина. Численность клеток, обработанных 2 мМ цитидина, стабилизировалась к 3-м суткам и в течение последующего времени не изменялась. Уровень пролиферации необработанных клеток достигал 229,330,31, 410,421,05 и 723,580,97 тыс./ лунку на 2-е, 3-и и 4-е сутки, соответственно.
Исследуемые нуклеозиды индуцировали синтез гемоглобина (одного из основных маркеров эритроидной дифференцировки) в клетках К562 (рис. 1), причем наиболее сильным индуктором выступал гуанозин. В клетках также имело место повышение активности каспазы-9 и каспаз-3, -7, -10 (рис. 2).
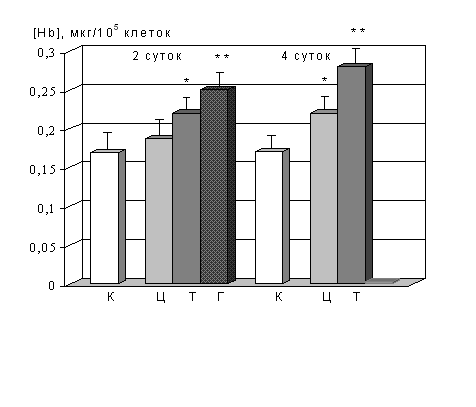
Рис. 1. Концентрация гемоглобина в клетках К562, инкубированных в присутствии нуклеозидов в течение 2-х и 4-х суток
К – необработанные индукторами клетки (контроль); Ц – клетки, культивируемые с цитидином; Т – с тимидином; Г – с гуанозином. Концентрация цитидина и тимидина – 2 мМ, гуанозина – 1 мМ; * достоверное отличие от контроля (р<0,05); ** достоверное отличие от контроля (р<0,01)
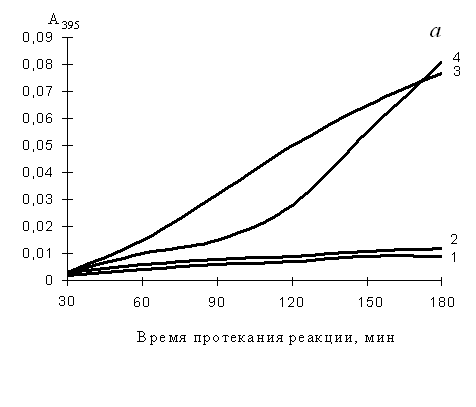
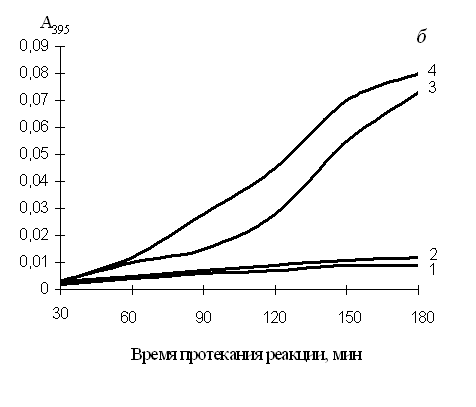
Рис. 2. Изменение активности каспазы-9 (а) и каспаз-3, -7, -10 (б) в клетках К562, обработанных нуклеозидами в течение 2-х суток
1 – базовый уровень активности каспаз для нестимулированных клеток (контроль); 2 – активность каспаз в клетках, обработанных цитидином; 3 – тимидином; 4 – гуанозином. Концентрация цитидина и тимидина – 2 мМ, гуанозина – 1 мМ. По оси ординат: изменение поглощения отщепленного 7-амино-4-трифлуорометилкумарина (AFC), определенное на СФ-46 при 395 нм
Нами выделены варианты, в которых индукция эритроидной дифференцировки и увеличение активности каспаз могли не сопровождаться фрагментацией ДНК опухолевых клеток (например, обработка 2 мМ тимидина в течение 2-х суток или 2 мМ цитидина в течение 4-х суток). Апоптоз в этих вариантах регистрировался позднее – на 3-и и 5-е сутки, соответственно. Поэтому мы предположили, что активация каспаз в данном случае необходима не только для успешного протекания апоптоза, но также для индукции и реализации эритроидной дифференцировки клеток. Использование ингибиторов ферментов экспериментально подтвердило наше предположение.
1.2. Влияние солей жирных кислот на пролиферацию, дифференцировку и апоптоз клеток.
Известно, что масляная кислота и ее натриевая соль подавляют пролиферацию и индуцируют дифференцировку и апоптоз целого ряда линий, включая клетки миелоидного и лимфоидного происхождения (Hoessly et al., 1989, Bernhardt et al., 1999). В основе механизма внутриклеточного действия реагентов лежат ингибирование активности гистоновых деацетилаз (McCue et al., 1984), устойчивая активация JAK/STAT-пути и ингибирование серин-треонин-протеинфосфатазы (Park et al., 2001). Результаты по влиянию бутирата, изобутирата и изовалерата натрия на пролиферацию, дифференцировку и апоптоз клеток К562 представлены в таблице 1. Из результатов следует, что эритроидная дифференцировка, индуцированная в клетках натриевыми солями жирных кислот, как и в случае с использованием нуклеозидов, требует активации определенных групп каспаз, в частности, каспаз-3, -7, -10. Апоптотических изменений при этом может не регистрироваться (см. варианты обработки 2 мМ и 3 мМ изобутирата). Бутират натрия, как более реакционно-способный реагент, сильнее активировал каспазы, индуцировал апоптоз. Данный эффект имел место только при использовании 2 мМ и 3 мМ соединения. Пролиферация клеток во всех вариантах была достоверно блокирована.
Таблица 1
Биологическое действие солей жирных кислот с укороченной
углеводородной цепью на клетки К562
| Реагенты | Концентрация | Подавление пролиферации | Индукция эритроидной дифференцировки | Повышение активности каспаз | Усиление флуоресценции | Снижение [NAD++NADH]i | ||
| Каспаза-9 | Каспазы -3, -7, -10 | ДАФИ | БЭ | |||||
| БУТИРАТ НАТРИЯ | 1 мМ | ++ | + | ― | + | + | ― | ― |
| 2 мМ | ++ | ++ | + | ++ | + | + | + | |
| 3 мМ | ++ | ++ | ++ | ++ | + | + | + | |
| ИЗОБУТИРАТ НАТРИЯ | 1 мМ | + | ― | ― | ― | ― | ― | ― |
| 2 мМ | + | ++ | ― | + | ― | ― | ― | |
| 3 мМ | + | ++ | ― | + | ― | ― | ― | |
Примечание – В таблице приведены показатели клеток, обработанных солями жирных кислот в течение 4-х суток; клетки К562, обработанные реагентами, сравнивали с необработанными К562; “+” изменение исследуемого показателя достоверно (р<0,05); “++” изменение исследуемого показателя достоверно (р<0,01); “–” изменение исследуемого показателя отсутствует. Биологические эффекты изовалерата натрия аналогичны таковым изобутирата натрия
1.3. Влияние диметилсульфоксида и его комбинаций с эритроидными индукторами на пролиферацию, дифференцировку и апоптоз клеток.
В ряде работ по изучению дифференцирующего действия ДМСО на клетки опухолевых линий концентрация реагента составляет 1,9–2,5 % (Baliga et al., 1993; Nathan et al., 1998). ДМСО, используемый в высоких концентрациях (порядка 2,5 % и выше), способен инициировать фрагментацию ДНК клеток (Marthyn et al., 1998). Нами было изучено модулирование пролиферации, дифференцировки и апоптоза клеток К562, обработанных ДМСО (0,1 %, 0,5 %, 1,5 %) на фоне тимидина (2 мМ) и бутирата натрия (2 мМ). Полученные результаты представлены в таблице 2.
Таблица 2
Биологическое действие ДМСО и его комбинаций с тимидином
и бутиратом натрия на клетки К562
| Реагенты | Концентрация | Подавление пролиферации | Индукция эритроидной дифференцировки | Повышение активности каспаз | Усиление флуоресценции | Снижение [NAD++NADH]i | ||
| Каспаза-9 | Каспазы 3, -7, - 10 | ДАФИ | БЭ | |||||
| ДМСО | 0,1 % | ++ | + | ― | + | ― | ― | ― |
| 0,5 % | ++ | + | ― | + | ― | ― | ― | |
| 1,5 % | ++ | ++ | + | ++ | + | + | ++ | |
| ТИМИДИН | 2 мМ | ++ | ++ | + | ++ | + | + | + |
| ТИМИДИН + ДМСО | 2 мМ+ 0,1 % | ― | + | + | ― | + | ― | ― |
| БУТИРАТ НАТРИЯ | 2 мМ | ++ | ++ | + | ++ | + | + | + |
| БУТИРАТ НАТРИЯ + ДМСО | 2 мМ+ 0,1 % | ― | ― | + | ― | + | + | + |
Примечание – В таблице приведены показатели клеток, обработанных реагентами в течение 4-х суток; клетки К562, обработанные одиночными реагентами, сравнивали с необработанными К562; при оценке влияния на процессы комбинаций реагентов сравнение проводили по отношению к первому составляющему комбинации; “+” изменение исследуемого показателя достоверно (р<0,05); “++” изменение исследуемого показателя достоверно (р<0,01); “–” изменение исследуемого показателя отсутствует
Исследуемые соединения (одиночно и в сочетании) обладали выраженным антипролиферативным эффектом на клетки К562. При обработке клеток ДМСО наблюдалось дозо-зависимое повышение синтеза гемоглобина. Эритроидная дифференцировка и увеличение активности каспаз-3, -7, -10 могли не сопровождаться фрагментацией ДНК (см. варианты обработки 0,1 % и 0,5 % ДМСО). Апоптоз в этих вариантах регистрировался на 5–6-е сутки. В культурах, обработанных 1,5 % ДМСО или комбинацией ДМСО с тимидином (бутиратом натрия), индукция эритроидной дифференцировки сопровождалась почти одновременным запуском апоптотических процессов, при этом активировалась каспаза-9. Возможно, в данном случае запуск апоптоза связан с возросшим токсическим эффектом сочетанного действия реагентов на клетки. Следует отметить, что при обработке клеток комбинацией тимидин+ДМСО наблюдался более интенсивный синтез гемоглобина по сравнению с тимидин-обработанными клетками. При замене тимидина на бутират подобного эффекта не регистрировалось.
Таким образом, рассмотренные группы химических реагентов индуцировали дозо- и время-зависимую эритроидную дифференцировку и/или апоптоз клеток К562. При инкубации клеток с комбинациями соединений в модулировании процессов имели место синергический или антагонистический эффекты. Наиболее выраженным дифференцирующим действием обладала комбинация тимидин+ДМСО, апоптоз-индуцирующим – бутират натрия+ДМСО.
1.4. Влияние кортикостероидов и их комбинаций с эритроидными индукторами на пролиферацию, дифференцировку и апоптоз клеток.
В ряде работ показано, что используемые в терапии лейкозов кортикостероиды (глюкокортикоиды) способны индуцировать дифференцировку и апоптоз опухолевых клеток (Анисимов и др., 2001; Nakamaki et al., 1989; Yuksel et al., 2002). Реагенты имеют внутриклеточный рецептор связывания, ассоциированный с гетерогенными ядерными РНП, который, являясь лиганд-зависимым транскрипционным фактором, способен изменять активность генов, связываясь с их респонсивными элементами, либо взаимодействуя с другими транскрипционными факторами или белками-коактиваторами (Eggert et al., 1997). Кроме того, реагенты способны модулировать активность Ca2+-зависимых ферментов (Куцый и др., 1999). Нами проведены исследования по влиянию на пролиферацию, дифференцировку и апоптоз клеток К562 гидрокортизона, преднизолона, дексаметазона и их комбинаций с эритроидными индукторами.
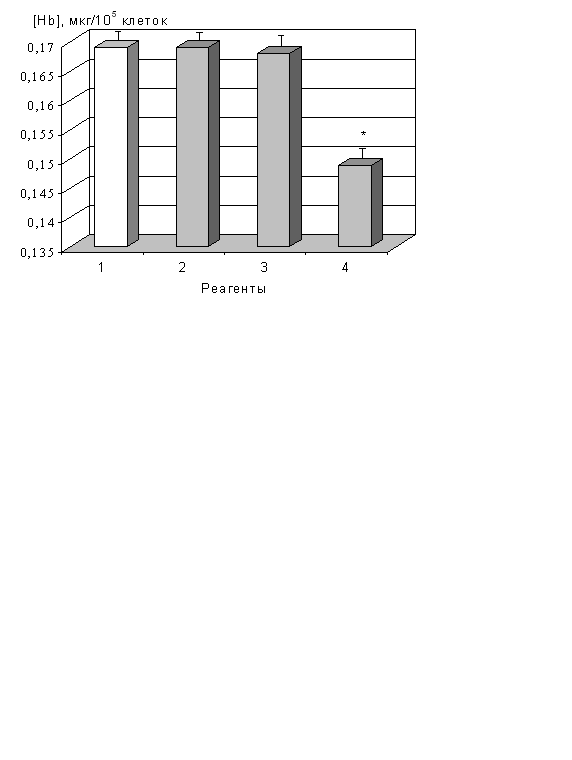
Рис. 3. Концентрация гемоглобина в клетках К562, обработанных кортикостероидами в течение 4-х суток
1 – необработанные индукторами клетки (контроль); 2 – клетки, культивируемые с гидрокортизоном; 3 – с преднизолоном; 4 – с дексметазоном; концентрация реагентов – 10 мкМ; * достоверное отличие от контроля (р<0,05)
Из результатов следует, что гидрокортизон и преднизолон не модулировали эритроидную дифференцировку и апоптоз клеток (рис. 3, табл. 4). Напротив, дексаметазон подавлял синтез гемоглобина, стимулировал экспрессию CD11b, CD14 и CD41-антигенов (табл. 3) и фрагментацию ДНК клеток (табл. 4). При одновременном внесении в среду 5 мкМ дексаметазона и 2 мМ тимидина (или бутирата) параметры флуоресценции БЭ и ДАФИ при связывании с ДНК резко возрастали, активировались каспазы--3, -7, -9, -10. Аналогичный эффект имел место также при замене дексаметазона на преднизолон или гидрокортизон.
Таким образом, кортикостероиды способны индуцировать миелоцитарную дифференцировку клеток К562. Повышенная активация каспаз-9 и -3, -7, -10, а также выраженная фрагментация ДНК клеток, обработанных
Таблица 3
Процент клеток К562, экспрессирующих CD11b, CD14 и CD41-антигены,
после инкубации с кортикостероидами в течение 4-х суток
| РЕАГЕНТ | CD11b+-клетки, % | CD14+-клетки, % | CD41+-клетки, % |
| Контроль | 24,4±1,3 | 36,31,9 | 11,71,8 |
| Гидрокортизон | 25,7±1,9 | 38,11,7 | 11,91,5 |
| Преднизолон | 29,2±1,6* | 38,92,1 | 14,82,7 |
| Дексаметазон | 34,7±1,8* | 45,81,7* | 19,81,6* |
Примечание – Концентрация реагентов – 10 мкМ; * достоверное отличие от контроля (р<0,05)
Таблица 4
Параметры ДАФИ и БЭ флуоресценции нуклеоидов клеток К562,
обработанных кортикостероидами в течение 4-х суток
| РЕАГЕНТ | ДАФИ | БЭ |
| Контроль | 36,900,07 | 6,200,10 |
| Дексаметазон (10 мкМ) | 48,070,08* | 9,280,02* |
| Преднизолон (10 мкМ) | 37,020,12 | 6,530,09 |
| Гидрокортизон (10 мкМ) | 36,920,13 | 6,400,08 |
Примечание – Клетки инкубировали в 96-луночных микропланшетах по 0,02 млн. клеток/лунку; показатели ДАФИ и БЭ для тимоцитов, обработанных 5 мкМ дексаметазона в течение 6 час: 47,860,34* и 9,140,18* (необработанные клетки: 40,810,22 и 6,830,34, соответственно); * достоверное отличие от контроля (р<0,05)
комбинациями реагентов с тимидином или бутиратом натрия, усиленные по сравнению с обработкой только эритроидными агентами, свидетельствуют об участии этих каспаз в индукции апоптоза опухолевых клеток.
1.5. Влияние ФМА и его комбинаций с эритроидными индукторами на пролиферацию, дифференцировку и апоптоз клеток.
Нефизиологические активаторы протеинкиназы С (ПКС) форболовые эфиры способны индуцировать мегакариоцитарную и/или моноцито-макрофагальную дифференцировку лейкозных и нормальных клеток крови (Rosson, O’Brien, 1998). ПКС участвует в активации мегакариоцитарных промоторов посредством функциональной кооперации с GATA-1 (Racke et al., 2001). В некоторые модели клеточной дифференцировки вовлечен ERK/MAPK-киназный каскад (Dass et al., 2000; Kim et al., 2001; Dorsey et al., 2002). Из полученных нами результатов следует, что ФМА оказывал выраженное антипролиферативное и цитотоксическое действие на клетки К562. Одиночная или сочетанная с эритроидными индукторами обработка клеток ФМА, как в случае дексаметазона, приводила к подавлению синтеза гемоглобина, повышению экспрессии CD11b, CD14 и CD41-антигенов, увеличению фагоцитарной активности клеток. Нами установлено, что каспаза-9 является одной из ключевых каспаз, участвующих в апоптозе, индуцированном нуклеозидами или солями жирных кислот (см. выше). При добавлении к реагентам ФМА активность каспазы-9 снижалась (рис. 4б), ингибировался апоптоз (табл. 5). Активация каспазы-6 (рис. 4в) наблюдалась при индукции моноцито-макрофагальной и ингибировании эритроидной дифференцировки и апоптоза клеток (табл. 5), т. е. в присутствии ФMA. Каспаза-3 (рис. 4а) в зависимости от условий участвовала как в протекании дифференцировки, так и в апоптозе клеток. Таким образом, не исключено, что именно с подобным перераспределением функций клеточных каспаз связано ингибирование форболовым эфиром нуклеозид- и бутират-индуцированного апоптоза.
Таблица 5
Параметры ДАФИ и БЭ нуклеоидов клеток К562, обработанных ФМА,
тимидином, бутиратом натрия, а также комбинациями реагентов
в течение 2-х суток
| РЕАГЕНТЫ | ДАФИ | БЭ |
| Необработанные клетки | 36,050,14 | 6,020,11 |
| ФМА (100 нМ) | 35,820,29 | 6,220,60 |
| Тимидин (3 мМ) | 41,040,21** | 7,180,08* |
| Бутират натрия (3 мМ) | 40,960,18** | 8,020,18* |
| Тимидин (3 мМ) + ФМА (100 нМ) | 37,000,09* | 6,320,11* |
| Бутират натрия (3 мМ) + ФМА (100 нМ) | 36,880,17* | 6,200,18 |
Примечание – Условия опыта см. в примечании к табл. 4; * достоверное отличие от контроля (р<0,05); ** достоверное отличие от контроля (р<0,01); различия достоверны в парах: необработанные клетки К562 и клетки, инкубированные с тимидином или бутиратом натрия; клетки, обработанные комбинациями тимидин + ФМА или бутират натрия + ФМА и клетки, растущие в присутствии только тимидина или бутирата, соответственно
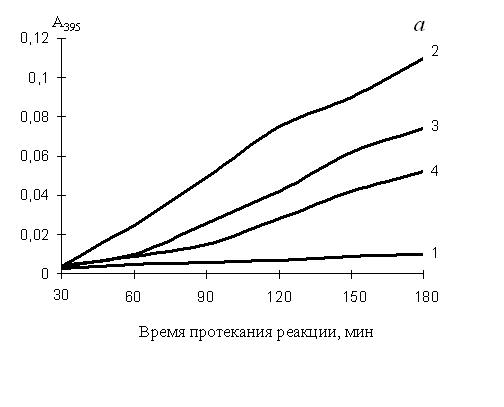
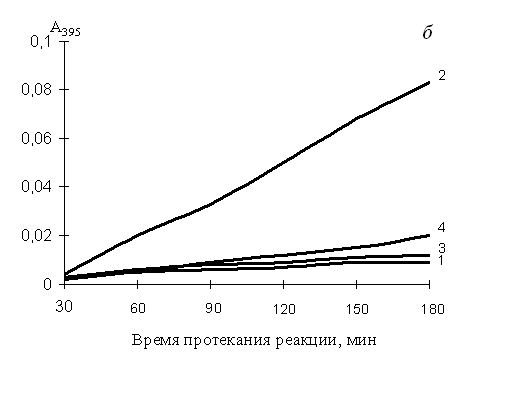
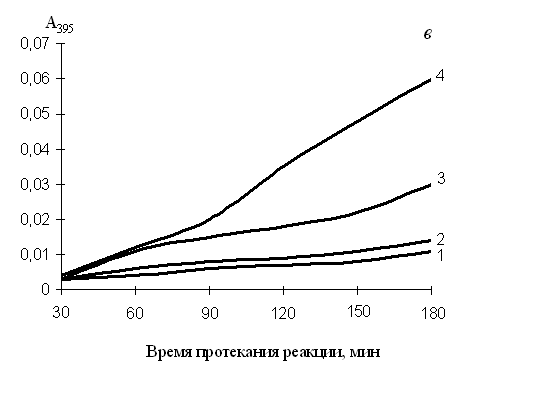
Рис. 4. Изменение активности каспазы-3 (а), каспазы-9 (б) и каспазы-6 (в) в клетках К562, обработанных ФМА, тимидином и комбинацией реагентов в течение 2-х суток
1 – базовый уровень активности каспаз для нестимулированных клеток; 2 – активность каспаз в клетках, обработанных тимидином; 3 – ФМА; 4 – тимидином + ФМА. Концентрация тимидина – 3 мМ, ФМА – 100 нМ. По оси ординат: изменение поглощения отщепленного 7-амино-4-трифлуорометилкумарина (AFC), определенное на СФ-46 при 395 нм
1.6. Влияние хинолина и его N-оксидированных производных в комбинациях с эритроидными индукторами на пролиферацию, дифференцировку и апоптоз клеток.
Среди большого спектра реагентов, применяемых в онкологической практике, особую группу составляют производные N-содержащих гетероциклов. Реагенты являются конкурентными структурными аналогами ключевых молекул клетки (азотистых оснований, нуклеозидов, нуклеотидов, различных коферментов и т. д.) и высокоэффективны для лечения опухолей различного гистогенетического происхождения и локализации. Широкое применение многих из них ограничивается повышенной токсичностью. Поэтому поиск соединений, обладающих высокой противоопухолевой активностью и низкими побочными эффектами представляет несомненный интерес. Нами было изучено биологическое действие комбинаций производных хинолина с эритроидными агентами на клетки К562. Результаты показали, что только N-оксидированные производные ингибировали эритроидную и индуцировали миелоцитарную дифференцировку клеток.
Таблица 6
Биологическое действие хинолина и его производных в комбинации с индукторами эритроидной дифференцировки на клетки К562
| Реагенты | Концентрация | Подавление пролиферации | Ингибирование эритроидной дифференцировки | Изменение активности каспаз | Усиление флуоресценции | Снижение [NAD++NADH]i | |||
| Каспаза-9 | Каспаза-3 | Каспаза-8 | ДАФИ | БЭ | |||||
| ДМСО | 0,1 % | + | ― | ― | + | ― | ― | ― | ― |
| ДМСО + Q | 0,1%+ 0,3 мкМ | + | ― | ― | ― | ― | ― | ― | ― |
| ДМСО + QO | 0,1%+ 10 мкМ | + | + | ― | + ↓ | ― | ― | ― | ― |
| ДМСО + 4-NQO | 0,1% + 1нМ | ++ | + | ― | + ↓ | ― | ― | ― | + |
Примечание – В таблице приведены показатели клеток, обработанных реагентами в течение 2-х суток, изменение эритроидной дифференцировки регистрировалось после 4-х суточной обработки; клетки К562, обработанные ДМСО, сравнивали с необработанными К562; при оценке влияния на процессы комбинаций реагентов сравнение проводили по отношению к первому составляющему комбинации; “+” изменение исследуемого показателя достоверно (р<0,05); “++” изменение исследуемого показателя достоверно (р<0,01); “+++” изменение исследуемого показателя достоверно (р<0,001); “–” изменение исследуемого показателя отсутствует; ↓ – определяемый показатель по сравнению с контролем снижается
4-NQO и 2-Me-4-NQO проявляли выраженное апоптоз-индуцирующее действие, которое блокировалось добавлением ДМСО (табл. 6). В пробах ингибировались активность каспаз-9, -8 и флуоресценция БЭ и ДАФИ, снижалась активность каспазы-3. С тимидином и бутиратом натрия подобного эффекта не обнаружено.
1.7. Влияние стирильных N-оксидированных производных хинолина, пиридина и производных тиазофосфола на пролиферацию, дифференцировку и апоптоз клеток.
Данная группа ксенобиотиков включает новосинтезированные соединения, поэтому биологическую активность стирильных производных хинолина и пиридина сравнивали с предыдущей группой реагентов, а производных тиазофосфола – с широко используемым цитостатиком циклофосфаном. Нами показано, что при попадании в клетку данные гетероциклы биотрансформируются под действием цитохрома Р-450 и пероксидазы. Интересно то, что спектр внутриклеточных метаболитов соединений неодинаков, а их биологическая активность в десятки раз может превышать таковую вещества-родоначальника. Результаты по биологическому действию реагентов на клетки К562 представлены в таблицах 7 и 8.
Индукция эритроидной дифференцировки регистрировалась в условиях обработки 2-NSQO, 4-NSQO (2 суток), DPyO (4 суток; в табл. 8 2-суточные данные), циклофосфаном и третбутиламиновым производным тиазофосфола. При этом наблюдалось повышение активности каспаз, флуоресценции ДАФИ, БЭ, снижение концентрации никотинамидных коферментов (в клетках индуцировался апоптоз). При инкубации с DPyO, 2-DQO, 4-DQO признаки апоптоза регистрировались раньше достоверного увеличения маркеров дифференцировки. Индукция моноцито-макрофагальной дифференцировки клеток отмечена с анилиновым производным тиазофосфола (4 суток) и 2-DQO (к концу 5-х суток). В результате достаточно убедительно можно сделать заключение, что каспаза-8 не задействована в протекании эритроидной дифференцировки, а участвует в апоптозе, индуцированном реагентами.
Таблица 7
Биологическое действие стирильных N-оксидированных производных
хинолина и пиридина на клетки К562
| Реагенты | Концентрация | Подавление пролиферации | Дифференци-ровка | Повышение активности каспаз | Повышение флуорес-ценции | Снижение [NAD++NADH]i | ||||
| Индукция эритроидной [Hb]i | Моноцито-мак- рофагальная, мегакариоци- тарная | Каспаза-9 | Каспазы-3,-7,10 | Каспаза-8 | ДАФИ | БЭ | ||||
| 2-DQO | 1 мкМ | + | ― | ― | + | ++ | + | ++ | + | ++ |
| 4-DQO | 1 мкМ | + | ― | ― | + | ++ | + | + | + | + |
| DPyO | 1 мкМ | + | ― | не определяли | + | ++ | + | + | ― | + |
| 2-NSQO | 1 мкМ | + | + | не определяли | + | ++ | + | + | + | + |
| 4-NSQO | 1 мкМ | + | + | не определяли | + | ++ | + | + | + | + |
Примечание – В таблице приведены показатели клеток, обработанных реагентами в течение 2-х суток, изменение активности каспазы-9 регистрировали после 1-х суток; клетки К562, обработанные реагентами, сравнивали с необработанными К562; “+” изменение исследуемого показателя достоверно (р<0,05); “++” изменение исследуемого показателя достоверно (р<0,01); “–” изменение исследуемого показателя отсутствует
В настоящее время известно, что выход цитохрома С из митохондрий в цитоплазму клетки является очень важным этапом в активации каскадов каспаз и запуске апоптоза. Изучаемые ксенобиотики модулируют процессы окисления и восстановления цитохрома С, влияя на его функциональную активность в электрон-транспортной цепи митохондрий или после выхода в цитоплазму клеток. На рисунке 5 представлен график восстановления цитохрома С микросомами без и в присутствии 2-NSQO. Добавление 2-NSQO в среду инкубации вызывало снижение скорости восстановления, которое со временем прогрессировало.
Прединкубация микросом с 2-NSQO не изменяла скорости восстановления белка по сравнению с предыдущим вариантом. После полного по-
Таблица 8
Биологическое действие циклофосфана и производных тиазофосфола на клетки К562
| Реагенты | Концентрация | Подавление пролиферации | Дифференци-ровка | Повышение активности каспаз | Повышение флуорес-ценции | Снижение [NAD++NADH]i | ||||
| Индукция эритроидной [Hb]i | Моноцито-мак- рофагальная, мегакариоци- тарная | Каспаза-9 | Каспаза-3 | Каспаза-8 | ДАФИ | БЭ | ||||
| ЦИКЛОФОСФАН | 30мкМ | ++ | + | не определяли | + | ++ | ― | ++ | + | + |
| ТРЕТБУТИЛАМИНОВОЕ ПРОИЗВОДНОЕ | 30мкМ | ++ | + | не определяли | ++ | ++ | + | ++ | + | + |
| АНИЛИНОВОЕ ПРОИЗВОДНОЕ | 30мкМ | ++ | ― | ± | ++ | + | + | ++ | + | + |
Примечание – В таблице приведены показатели клеток, обработанных реагентами в течение 4-х суток; клетки К562, обработанные реагентами, сравнивали с необработанными К562; “+” изменение исследуемого показателя достоверно (р<0,05); “++” изменение исследуемого показателя достоверно (р<0,01); “–” изменение исследуемого показателя отсутствует
давления NADPH-цитохром С-редуктазной активности добавление в среду NADH (но не NADPH и/или цитохрома С) частично возобновляло восстановление цитохрома С. При использовании 4-NSQO наблюдалась аналогичная закономерность, однако подавление вышеуказанной активности микросом происходило медленнее, и добавление в среду NADH полностью возобновляло восстановление белка. Окисление цитохрома С данные реагенты ингибировали в одинаковой степени. Обнаруженная нами биологическая активность производных хинолина может вносить существенный вклад в протекание апоптоза опухолевых клеток.
Поскольку в нашей системе инкубация клеток с реагентами приводила к модуляции пролиферации, дифференцировки и апоптоза, далее изучили изменение чувствительности опухолевых клеток к цитотоксическому лизису ЕКК в наиболее значимых вариантах.
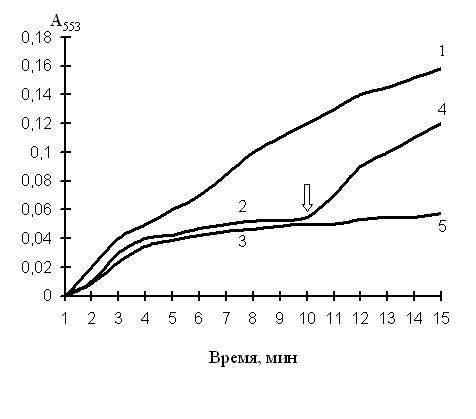
Рис. 5. Восстановление цитохрома С микросомами клеток К562 без (1) и в присутствии 10 мкМ 2-NSQO (2–5)
Цитохром С и NADPH добавляли сразу после введения в суспензию микросом 2-NSQO (2) или после 5 мин преинкубации микросом с указанным реагентом (3). На 10 мин регистрации в систему 2 были добавлены NADH (50 мкМ) (4) или NADPH (50 мкМ) (5)
1.8. Изменение чувствительности клеток к лизису ЕКК периферической крови человека и селезенки крыс при обработке химическими реагентами.
Анализ влияния реагентов на процессы дифференцировки, апоптоза и чувствительность клеток К562 к лизису ЛПК человека показал следующее (табл. 9).
При обработке клеток эритроидными индукторами чувствительность к лизису ЛПК повышали: бутират натрия, 2-NSQO, 4-NSQO (на 2-е сутки), DPyO, третбутиламиновое производное тиазофосфола (на 4-е сутки). Увеличение чувствительности к лизису сопровождалось повышением дифференцировочного статуса клеток и индукцией апоптоза. С бутиратом индуцировалась только эритроидная дифференцировка. С тимидином и циклофосфаном наблюдалась тенденция к повышению чувствительности клеток к лизису, хотя в вариантах индуцировались эритроидная дифференцировка и апоптоз клеток. ДМСО не изменял величину ЦИ в системе.
При обработке клеток индукторами миелоцитарной дифференцировки: дексаметазоном, ФМА, QO, 4-NQO, анилиновым производным тиазофосфола, два первых соединения на 4-е сутки понижали чувствительность
Таблица 9
Влияние химических реагентов на процессы дифференцировки, апоптоза и чувствительность клеток К562 к лизису ЛПК человека
| Комбинации реагентов | Модулирование дифференцировки | Модули-рование апоптоза | Модулирование чувствительности к лизису ЛПК | |||||
| эритроидной | миелоцитарной | |||||||
| 2 суток | 4 суток | 2 суток | 4 суток | 2 суток | 4 суток | 2 суток | 4 суток | |
| Тимидин | ↑ | ↑ | не определяли | не определяли | ↑ | ↑ | 0 | ↑* |
| Дексаме-тазон | 0 | ↓ | 0 | ↑ | 0 | ↑ | 0 | ↓ |
| Тимидин + дексаме-тазон | ↓ ↑ | ↓ ↑ | не определяли | не определяли | ↑ ↑ | ↑ ↑ | 0 (тим.) 0 (декс.) | 0 (тим.) ↑ (декс.) |
| ФМА | ↓ | ↓ | ↑ | ↑ | 0 | 0 | 0 | ↓ |
| Тимидин + ФМА | ↓ ↑ | ↓ ↑ | не определяли | не определяли | ↓ 0 | ↓ 0 | 0 (тим.) 0 (ФМА) | 0 (тим.) ↑* (ФМА) |
| Бутират натрия | ↑ | ↑ | не определяли | не определяли | 0 | ↑ | ↑ | ↑ |
| ДМСО | ↑ | ↑ | не определяли | не определяли | 0 | 0 | 0 | 0 |
| Бутират + ДМСО | ↑ 0 | 0 ↓ | не определяли | не определяли | 0 0 | ↑ ↑ | ↓ (бут.) 0 (ДМСО) | ↓ (бут.) 0 (ДМСО) |
| Бутират + ФМА | ↓ ↑ | ↓ ↑ | не определяли | не определяли | 0 0 | ↓ 0 | 0 (бут.) ↑ (ФМА) | 0 (бут.) ↑ (ФМА) |
| ДМСО + ФМА | ↓ ↑ | ↓ ↑ | не определяли | не определяли | 0 0 | 0 0 | 0 (ДМСО) 0 (ФМА) | 0 (ДМСО) ↑* (ФМА) |
| Бутират + ДМСО + ФМА | ↓ ↑ ↑ | ↓ 0 0 | не определяли | не определяли | ↑ ↑ ↑ | ↑ ↑ ↑ | ↑ (бут + ДМСО) 0 (бут.+ ФМА) ↑ (ДМСО+ ФМА) | ↑ (бут.+ ДМСО) 0 (бут.+ ФМА) ↑ (ДМСО+ ФМА) |
| QO | 0 | ↓ | 0 | ↑ | 0 | 0 | 0 | 0 |
| 4-NQO | 0 | ↓ | 0 | ↑ | ↑ | ↑ | ↑ | ↑ |
| Тимидин + QO | 0 ↑ | ↓ ↑ | не определяли | не определяли | ↑ ↑ | ↑ ↑ | ↑ (тим.) ↑ (QO) | ↑ (тим.) ↑ (QO) |
| Тимидин + 4-NQO | 0 ↑ | ↓ ↑ | не определяли | не определяли | ↑ ↑ | ↑ ↑ | ↑ (тим.) 0 (4-NQO) | ↑ (тим.) 0 (4-NQO) |
| Бутират +QO | 0 ↑ | ↓ ↑ | не определяли | не определяли | ↑ ↑ | ↑ ↑ | 0 (бут.) ↑ (QO) | ↑ (бут.) ↑ (QO) |
| Бутират + 4-NQO | 0 ↑ | ↓ ↑ | не определяли | не определяли | ↑ ↑ | ↑ ↑ | ↑ (бут.) 0 (4-NQO) | ↑ (бут.) 0 (4-NQO) |
| ДМСО+QO | 0 ↑ | ↓ ↑ | не определяли | не определяли | 0 0 | 0 0 | 0 (ДМСО) 0 (QO) | 0 (ДМСО) 0 (QO) |
| ДМСО + 4-NQO | 0 ↑ | ↓ ↑ | не определяли | не определяли | 0 ↓ | ↑ ↓ | ↑ (ДМСО) ↓ (4-NQO) | ↑ (ДМСО) ↓ (4-NQO) |
| 2-DQO, 4-DQO | 0 | 0 | 0 | ↑* | ↑ | ↑ | 0 | 0 |
| DPyO | 0 | ↑ | не определяли | не определяли | 0 | ↑ | 0 | ↑ |
| 2-NSQO, 4-NSQO | ↑ | ↑ | не определяли | не определяли | ↑ | ↑ | ↑ | ↑ |
| Циклофосфан | 0 | ↑ | не определяли | не определяли | 0 | ↑ | 0 | ↑* |
| Третбутил-аминовое производное тиазофосфола | 0 | ↑ | не определяли | не определяли | 0 | ↑ | 0 | ↑ |
| Анилиновое производное тиазофосфола | 0 | ↓ | 0 | ↑ | 0 | ↑ | 0 | 0 |
Примечание – Концентрации реагентов указаны в тексте и подписях к рисункам; при характеристике биологического действия комбинаций соединений в каждом случае представлены две строки: верхняя характеризует модулирование процессов по отношению к первому составляющему комбинации, нижняя – по отношению ко второму составляющему; модулирующее действие на процессы одиночных реагентов оценено по отношению к необработанным клеткам; ↑ – процесс индуцируется, ↓ – процесс ингибируется, 0 – влияние на процесс отсутствует, * – в модулировании процесса имеет место тенденция (0,05
клеток к литическому действию ЛПК. Дексаметазон также индуцировал апоптоз клеток. 4-NQO на 2-е сутки проявлял апоптоз-индуцирующее действие и повышал чувствительность клеток к лизису. Дифференцирующий эффект реагента проявлялся к 4-м суткам. 2-DQO и 4-DQO первично индуцировали апоптоз, однако, чувствительность клеток к лизису не модулировали. Подобный эффект отмечен для QO и анилинового производного тиазофосфола, вместе с тем наблюдалось повышение дифференцировочного статуса клеток, а в случае производного тиазофосфола индукция апоптоза. При использовании комбинаций соединений, когда наблюдалось снижение индуцированной эритроидной дифференцировки (тимидин +дексаметазон, ФМА, QO или 4-NQO; бутират натрия + дексаметазон, ФМА, QO или 4-NQO; ДМСО+ФМА, QO или 4-NQO), имела место неоднотипность действия реагентов на чувствительность клеток к лизису ЛПК. В комбинациях с тимидином повышение чувствительности клеток к лизису регистрировалось с QO или 4-NQO. В этих условиях индуцировался апоптоз, дифференцировка ингибировалась к 4-м суткам. Замена производного хинолина на дексаметазон или ФМА приводила к усилению апоптоза в вариантах с дексаметазоном и ингибированию процесса в вариантах с ФМА, чувствительность клеток к лизису ЛПК по сравнению с тимидином не менялась. Если сравнивать с клетками, обработанными дексаметазоном (или ФМА), то величина ЦИ в опытных пробах к 4-м суткам возрастала, однако, была сопоставима с уровнем необработанных клеток. В результате, в данных комбинациях основной вклад в повышение чувствительности опухолевых клеток к лизису ЛПК вносил тимидин. В вариантах тимидин+QO имел место эффект синергизма действий реагентов. Для комбинации тимидин+4-NQO подобного не обнаружено. Аналогичная закономерность прослеживалась при замене тимидина на бутират натрия. В культурах с бутиратом+ФМА величина ЦИ не отличалась от проб, инкубируемых только с бутиратом, хотя регистрировалось ингибирование апоптоза. Апоптоз ингибировался и в клетках, обработанных ДМСО+4-NQO, величина ЦИ тоже снижалась. В результате, ДМСО – единственный эритроидный агент, который при совместном внесении с 4-NQO, способен снизить его стимулирующее действие на чувствительность клеток К562 к литическому действию ЛПК.
При использовании комбинации, когда введение второго реагента приводило к увеличению дифференцировочного статуса клеток (бутират натрия+ДМСО) по сравнению с культурами, обработанными бутиратом, регистрировалось снижение их чувствительности к лизису ЛПК. Увеличение апоптоза имело место к 4-м суткам. В данном варианте, также как в предыдущем, ДМСО отрицательно влиял на изменение ЦИ в системе.
Наиболее сложной комбинацией соединений в модулировании чувствительности клеток К562 к лизису являлась бутират+ДМСО+ФМА. Нами установлено, что каждый реагент по-разному влиял на изменение ЦИ: бутират натрия повышал чувствительность клеток к лизису ЛПК, ДМСО блокировал его действие, ФМА в составе комбинации способствовал поддержанию ЦИ на достаточно высоком уровне.
Использование в качестве эффекторов клеток селезенки крыс в большинстве случаев не привело к изменению чувствительности клеток К562 к лизису. Увеличение ЦИ отмечено при обработке бутиратом+ФМА, снижение при обработке тимидином+дексаметазон (или ФМА). Подобный эффект связан с видовыми различиями рецепторных структур взаимодействующих клеток.
Таким образом, обработка опухолевых клеток агентами, индуцирующими дифференцировку, в зависимости от концентрации, времени инкубации и способности клеток подвергаться дифференцировке и/или апоптозу, может усилить или ослабить их чувствительность к лизису ЕКК. Изменение чувствительности во многом определяется типом используемого индуктора и связано с процессом, затронутым в опухолевых клетках в первую очередь. Поэтому при клиническом использовании комбинаций антиопухолевых препаратов необходимо учитывать изменения в процессах дифференцировки и апоптоза, возникающие под действием или на фоне каждого составляющего комбинации.
2. Биологическая активность структурно-различных химических реагентов на клетки сублиний К562/4-NQO и К562/2-DQO
Одной из главных причин неудачного использования цитостатиков в клинике является индукция у опухолевых клеток фенотипа МЛУ (Krishna, Mayer, 2000). В настоящее время представляется актуальным поиск соединений, способных усилить дифференцировку резистентных опухолевых клеток, что рассматривается в качестве одного из терапевтических подходов при лечении опухолей (Prados et al., 1998). Итогом такой дифференцировки могут стать замедление или полное прекращение пролиферации, индукция апоптоза, модуляция чувствительности опухолевых клеток к лизису ЕКК. Нами были получены сублинии клеток К562, резистентные к 2-DQO и 4-NQO, и охарактеризованы по способности подвергаться дифференцировке и апоптозу по сравнению с клетками родительской линии.
Клетки сублиний были протестированы на чувствительность к ДНК-интеркалирующему агенту БЭ, ингибитору сборки микротрубочек колхицину, 2-DQO и 4-NQO. Результаты представлены в таблице 10. Клетки К562/4-NQO оказались высокоустойчивыми к БЭ и 2-DQO, но были чувствительны к колхицину. Клетки К562/2-DQO показали одновременно высокую устойчивость ко всем реагентам, однако их устойчивость к БЭ была ниже по сравнению с клетками К562/4-NQO.
