Структура и экспрессия mmtv-родственного провируса у больных раком молочной железы
| Вид материала | Автореферат |
- На правах рукописи бурлаков александр Сергеевич реконструктивная хирургия в лечении, 750.38kb.
- «Воронежская государственная медицинская академия имени Н. Н. Бурденко Федерального, 241.98kb.
- Иммунодиагностика и иммунотерапия рака молочной железы, 241.98kb.
- 20 октября в Украине ежегодно проводиться День борьбы с раком молочной железы. Внашей, 156.69kb.
- Иммунодиагностика и иммунотерапия рака молочной железы, 212.29kb.
- Радионуклидная терапия костных метастазов у больных раком молочной железы, 41.13kb.
- Роль тиреоидной патологии в развитии дисгормональных заболеваний молочной железы, 224.5kb.
- «Медицинский радиологический научный центр», 269.03kb.
- Лучевая терапия различными видами ионизирующего излучения в комплексном лечении больных, 785.18kb.
- Рак молочной железы: вопросы-ответы, 70.08kb.
Рис 10. Результаты ПЦР-анализа ДНК из ГЛУ (1) и ЛПК (2), показаны различные по длине ПЦР-продукты из-за делеции 15 п.н. Sag-кодирующего участка 3’LTR, электрофорез в ПААГе.
Таким образом, мы подтвердили данные о наличии MMTV-гомологичных последовательностей не только в ткани РМЖ, но в ЛПК и ГЛУ больных, страдающих РМЖ и Т-клеточной лимфомой. В то же время, ПЦР-анализ не выявил этих последовательностей в образцах ГЛУ, полученных от пяти пациенток с неходжкинскими лимфомами, но без других онкопатологий, включая РМЖ.
У одной из позитивных больных РМЖ лимфома была обнаружена в ранние сроки беременности. При изучении ассоциации hMTV с РМЖ и лимфомами у человека предполагается сходство механизмов MMTV-индуцированного канцерогенеза РМЖ и лимфом. Скорее всего, эти опухоли развиваются одновременно или с небольшим интервалом времени. Отметим, что гемобластозы, включая лимфомы, могут развиваться и в результате геномной нестабильности клеток вследствие лучевой терапии РМЖ.
Различия в структуре MMTV-гомологичных последовательностей, обнаруженных в ткани РМЖ и Т-клеточных лимфом, указывают на возможность дивергенции латентного провируса, реплицирующегося в ЛПК или на множественную инфекцию человека разными штаммами MMTV (hMTV).
ATCCTCACTGCCAGATCGCCTTTAAGAAGGACGCCTTCTGGGAGGGAGACGAGTCTGCTC |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ATCCTCACTGCCAGATCGCCTTTAAGAAGGACGCCTTCTGGGAGGGAGACGAGTCTGCTC 1496
CTCCACGGTGGTTGCCTTGCGCCTTCCCTGACCAGGGGGTGAGTTTTTCTCCAAAAGGGG 120
|||||||||||||||||||||||||||||||| |||||||||||||||||||||||||||
CTCCACGGTGGTTGCCTTGCGCCTTCCCTGACAAGGGGGTGAGTTTTTCTCCAAAAGGGG 1556
CCCTTGGGCTACTTTGGGATTTCTCCCTTCCCTCGCCTAGTGTA-ATCAGTCAGATCAGA 179
|||||||| ||||||||||||||||||||||||||||||||||| |||||||||||||||
CCCTTGGGTTACTTTGGGATTTCTCCCTTCCCTCGCCTAGTGTAGATCAGTCAGATCAGA 1616
TTTTAAA-CAAAAAGGAGCTCTTTGGGGATTTTATTCTCCCTGTGTATATAGAGGAGGTT 238
|| ||| ||||||||| || ||||| ||| || || |||||| ||| | || |||||
TTA-AAAGCAAAAAGGATCTATTTGGAAATTATACTCCCCCTGTCAATA-A-AG-AGGTT 1672
CATCGGAGTGGTATGAAGCAG-ATGGGTAGAACCTACTTGGTTCTGGGAAAATTCTCCTA 297
||||| | ||||||||||||| ||||||||||||||| ||||||||||||||||||||||
CATCG-A-TGGTATGAAGCAGGATGGGTAGAACCTACATGGTTCTGGGAAAATTCTCCTA 1730
AAGATCCCAATGATAGAGATTTTACTGCTCTAGTTCCCCATACAGAATTGTTTCGCTTAG 357
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
AGGATCCCAATGATAGAGATTTTACTGCTCTAGTTCCCCATACAGAATTGTTTCGCTTAG 1790
TTGCAGCCTCAAGACATCTTATTCTCAAAAAGCCAGGATTTCAAGAACATGAGATGATTC 417
|||||||||||||||||||||||||||||| ||||||||||||||||||||| |||||||
TTGCAGCCTCAAGACATCTTATTCTCAAAAGGCCAGGATTTCAAGAACATGAAATGATTC 1850
CTACATCTGCCTGTGTTACTTACCCTTATGCCATATTATTA 458
|||||||||||||||||||||||||||||||||||||||||
CTACATCTGCCTGTGTTACTTACCCTTATGCCATATTATTA 1891
Б
GGTGGCAACCA-GGACTTATAGGGGACCTTACATCTACAGACCAACAGACGCCCCGCTAC 59
||||||||||| ||||||||||||||||||||||||||||||||||||||||||||||||
GGTGGCAACCAGGGACTTATAGGGGACCTTACATCTACAGACCAACAGACGCCCCGCTAC 736
CATATACAGGAAGATACGATTTAAATTTTGATAGGTGGGTCACAGTCAAACGGCTATAAA 119
||||||||||||||||||||||||||||||||||||||||||||||| ||||||||||||
CATATACAGGAAGATACGATTTAAATTTTGATAGGTGGGTCACAGTC-AACGGCTATAAA 795
GTGTTGTAACAGATTCCTTCCCTTTCGGGAAAGAATCGGCAGAGACTAGAAACTCCTTGT 179
||||||||||||||||||||||||||||||||||||||||||||||| ||||||||||||
GTGTTGT-ACAGATCCCTCCCCTTTCGTGAAAGACTCGCCAGAG-CTAG-ACCTCCTTG- 851
GTGTGTCTGTAAACTCTCAGAGAGAGAAAAGAGAAGATATAAAACAAGGGGTACGTGATT 239
||||||||||||||||||||||||||||||||||||||||||||||| ||||||||||||
GTGTGTGT-T-AA--CTCAG-GA-AGAAAA-AGACGACATAAAACAACAGGTACATGATT 904
ATATTTATCTAGGAAGTGGAATGAACGTTTTGGGGAAAGATTTTTCATTATACCAAGGAG 299
||||||||||||||| ||||||||||| ||||||||||||||||||||||||||||||||
ATATTTATCTAGGAACTGGAATGAACG-TTTGGGGAAAGATTTTTCATTATACCAAGGAG 963
GGGGCAGTGGCTAGACAATTAGAACACATTTTCTGCAGATACTTTTGGCATGAGCTATAA 359
|||||||||||||||||||||||||||| |||||||||||||||||||||||||||||||
GGGGCAGTGGCTAGACAATTAGAACACA-TTTCTGCAGATACTTTTGGCATGAGCTATAA 1022
TGGATAACCTTTATGAGCCCAACCTTGCGGTTCCCAAGGTTTAAGTAAGTTCAGGGTCAC 419
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
TGGATAACCTTTATGAGCCCAACCTTGCGGTTCCCAAGGTTTAAGTAAGTTCAGGGTCAC 1082
AAACTGTTTCTTTAAAACCAAGGATGTGAGACAAGTGGTTTCCTGACTTGGTTTGGTATC 479
|||||| ||| |||||| ||||||||||||||||||||||||||||||||||||||||||
AAACTG-TTC-TTAAAA-CAAGGATGTGAGACAAGTGGTTTCCTGACTTGGTTTGGTATC 1139
AAATGTTTTGATCTAAGCTCTGAGTGTTCTATTCTCCTATGTTCTTTTGGAACTTATCCA 539
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
AAATGTTTTGATCTAAGCTCTGAGTGTTCTATTCTCCTATGTTCTTTTGGAACTTATCCA 1199
AGTCTT 545
||||||
AGTCTT 1205
Рис 11. Сравнение ПЦР-фрагментов, гомологичных gp52-кодирующей области гена envMMTV (А) и области 3’LTR MMTV (Б), амплифицированных на ДНК из ГЛУ больной РМЖ в сочетании с лимфомами (нижняя строка) с каноническими последовательностями MMTV (геном мышей линии GR, верхняя строка); области делеций и/или нуклеотидных замен выделены жирным шрифтом. Гомология между сравниваемыми последовательностями составляет 94%.
2.3.7.Семейный случай РМЖ с острым миелоидным лейкозом.
Мы исследовали ДНК из архивных образцов РМЖ, полученные в результате радикальной мастэктомии у пациентки в возрасте 37-ми лет из онкологически неотягощенной семьи (РОНЦ), а также ДНК из костного мозга, полученного от ее сына 11-ти лет, страдающего ОМЛ и наблюдавшегося в Отд.гематологии РДЦКБ, г.Москва. В контрольной группе было 6 мальчиков в возрасте от 2-х до 13-ти лет и 4 девочки в возрасте от 7-ми до 15-ти лет с первичным диагнозом ОМЛ, наблюдавшихся в отделении детской гематологии НИИ детской онкологии РОНЦ. По результатам цитогенетического анализа, пациенты с ОМЛ отнесены к группе носителей транслокации t(8;21), (данные Е.В.Флейшман и О.И.Соковой, НИИ канцерогенеза РОНЦ).
Амплификация ДНК, выделенной из заключенной в парафин опухолевой ткани пациентки с РМЖ, выявила ПЦР-продукт, гомологичный gp52-кодирующей области гена envMMTV. Гомология выявленного продукта была подтверждена с помощью Саузерн-блотинга. Прямое секвенирование ПЦР-продукта также обнаруживает 96-98% гомологии с геном envMMTV. ПЦР-анализ 11-ти пациентов с ОМЛ выявил 4 MMTV-позитивных образца ДНК из костного мозга (3 мальчика 9,11 и 13 лет и 1 девочка 15 лет), включая пациента, мать кторого страдала РМЖ. Все 6 пациентов с ОЛЛ оказались MMTV-негативными. Секвенирование env MMTV и 3’LTR MMTV-гомологичных продуктов выявило 93-94% гомологии с экзогенным MMTV (линии С3Н и HeJ). MMTV-гомологичные последовательности были впервые выявлены нами у 4-х из 11-ти детей с диагнозом ОМЛ, наблюдавшихся в НИИ детской онкологии РОНЦ. Полученные результаты свидетельствуют о вовлеченности MMTV -родственного ретровируса не только в лимфомагенез, но, возможно, и другие гемобластозы, включая ювенильный ОМЛ (Lushnikova, Smirnova, 2006). По-видимому, главную роль в диссеминации MMTV у таких больных играет инфекция дендритных и/или полипотентных гемопоэтических стволовых клеток миелоидной линии с последующей амплификацией провируса в активно пролиферирующих клетках костного мозга. С другой стороны, у нескольких больных ОЛЛ детей выявить MMTV-гомологичные последовательности нам не удалось (Lushnikova et al., 2006). Это указывает, что инфекция ретровирусом клеток-предшественников В- и Т-лимфоцитов, дающих начало лимфобластам, маловероятна или происходит с меньшей частотой, чем инфекция клеток миелоидной линии. Известно, что инфекция полноразмерным клонированным в плазмиде провирусом MMTV (JYC-MMTV) четырехнедельных беременных самок мышей линии CВА/CaJ, не несущих эндогенных копий MMTV , приводит к появлению инфекционных вирионов в молоке самок, появившихся от скрещивания между собой указанных инфицированных самок. Причем экспрессирующийся экзогенный JYC-MMTV был обнаружен не только в ткани молочной железы, но также в селезенке и костном мозге самок из потомства инфицированных животных. Ретровирус для клонирования был выделен у китайских мышей дикого типа с высокой частотой РМЖ, а его репликация поддерживалась в эпителиальных клетках крысы линии RBA (Xu et al. 2000). Обнаружение MMTV-гомологичных последовательностей в клетках костного мозга у сына MMTV-позитивной пациентки, болевшей РМЖ, подтверждает возможность вертикальной передачи провируса от матери к детям и роль лимфоидных клеток в его диссеминации.
2.3.8. MMTV-гомологичные последовательности у пациентки с РМЖ и другими неоплазиями
Анализ геномной ДНК, выделенной из ЛПК и опухолевой ткани больных РМЖ, а также доноров и пациентов с онкопатологиями другой локализации показывает, что носителями MMTV-гомологичных последовательностей (hMTV) являются далеко не все из исследованных образцов. Отсутствие hMTV в нормальной ткани без неопластических изменений, а также у целого ряда пациентов с неоплазиями четко свидетельтвует об экзогенности этого ретровируса. При исследовании одной из пациенток, страдающей РМЖ в сочетании с раком толстой кишки (РТК) нам удалось проследить пути циркуляции hMTV в организме человека и получить доказательства его экзогенного происхождения. При плановом обследовании пациенток из наследственно отягощенных семей, наблюдавшихся в НИИ клинической онкологии РОНЦ, в ДНК из ЛПК у пациентки К. были выявлены последовательности , на 93-97% гомологичные 3’LTR и гену env MMTV. В возрасте 48 лет этой пациентке был поставлен диагноз рак толстой кишки и хирургически удалена массивная опухоль, а также часть тонкого и толстый кишечник. Гистологически материал был описан и верифицирован в отд. патоморфологии РОНЦ. За три года до этой операции пациентка перенесла одностороннюю мастэктомию по поводу РМЖ. Среди родственников больной у бабушки по материнской линии был диагностирован РМЖ, у деда – рак мочевого пузыря, а у отца – рак легких . Мы исследовали кратковременные культуры клеток, полученных при соскобеэпителия хирургически удаленного кишечника и срезы фиксированной нормальной и опухолевой ткани кишечника этой больной, заключенной в парафин. Контролем служили хирургически удаленные ткани стенки кишечника одной больной полипозом кишечника и двух пациенток с раком толстого кишечника, ближашие родственники которые не болели РМЖ. Нужные микрофрагменты ткани: инфильтрированные лимфоцитами узелки и не инфильтрированные ими участки опухоли выделяли со среза путем микродиссекции. В образцах геномной ДНК, выделенной из ЛПК данной пациентки с помощью ПЦР с последующей гибридизацией по Саузерну были выявлены последовательности, гомологичные геному MMTV (hMTV). Для того, чтобы убедиться в экзогенности этих последовательностей, мы проанализировали с помощью ПЦР образцы ДНК из различных участков тканей кишечника. В ДНК, выделенной из фрагментов стенки кишечника, содержится также лимфоцитарная ДНК из Пейеровых бляшек – морфологически обособленных лимфатических узелков в стенке тонкого и верхнего отдела толстого кишечника. Если MMTV-гомологичные последовательности действительно экзогенного происхождения, т.е. попадают в организм человека извне, то наиболее вероятна передача ретровируса человеку путем инфицирования лимфоидных клеток. Эти клетки по-видимому, играют основную роль в передаче ретровирусного агента вертикально, включая внутриутробную инфекцию пролиферирующих клеток эпителия (Лушникова и др.2009). Механизмы преодоления иммунологического барьера не вполне ясны, однако известны факты передачи инфекции потомству при заражении экспрессирующимся экзогенным MMTV беременных самок мышей (Xu et al., 2000). Возможность инфекции мышиным MMTV эмбриональных клеток эпителия с последующей их трансформацией была продемонстрирована нами на модельных культурах эпителиальных клеток ПКЭПЧ и линии НЕК 293-Т in vitro, однако возможность внутриутробной инфекции in vivo пока не доказана.
2.3.9. MMTV-гомологичные последовательности в отдаленных метастазах у пациенток с РМЖ.
Как было показано в наших работах, MMTV-родственный провирус использует для своей циркуляции в организме человека лимфоидные клетки. Кроме того, анализ клинических особенностей hMTV-позитивных опухолей МЖ говорит о более высокой частоте метастазов по сравнению с hMTV-негативными неоплазиями. Так например, частота отдаленных метастазов у hMTV-позитивных пациенток с РМЖАБ по сравнению с hMTV-негативными была достоверно выше. У одной из таких hMTV-позитивных пациенток в возрасте 37-ми лет с односторонним спорадическим РМЖ 4-й степени и отдаленными метастазами в головной мозг, легкие и скелетные кости были проанализированы образцы ДНК, выделенной из архивных образцов метастатических узлов в теменной области головного мозга, полученные при паталогоанатомическом вскрытии. Пациентка наблюдалась в МОНИКИ им. Вишневского, и прожила после хирургической операции 2,5 года, химиотерапии и лучевой терапии не проводилось. Параллельно был проанализирован образец ДНК, выделенной из заключенной в парафин ткани РМЖ, опухоль была получена после хирургической операции – резекции части пораженной МЖ. Контролем служили 5 образцов замороженной ткани головного мозга здоровых лиц, погибших в ДТП, полученные из Института скорой помощи, Москва. При ПЦР на образцах ДНК из ткани РМЖ и печени в качестве контроля использовали 2 образца хирургически удаленной гепатокарциномы, полученные в Отд.патоморфологии РОНЦ. Анализ образцов ДНК из метастазов у первой пациентки и анализ образцов ДНК из ткани РМЖ и печени у второй позволил выявить MMTV-гомологичные последовательности как в опухолевой ткани, так и в метастазах. Секвенирование ПЦР-продуктов, соответствующих gp52-кодирующей области гена env MMTV и Sag- кодирующей области 3’LTR не выявило значительных различий между соответствующими последовательностями в провирусной ДНК разной локализации у двух исследованных пациенток. Это указывает на общность происхождения MMTV-гомологичных последовательностей в опухоли МЖ и отдаленных метастазах в разные органы.
Гомология указанных последовательностей с геном env MMTV и Sag-
кодирующей областью 3’LTR провирусной ДНК штаммов НеJ и C3H
составила 96-98% и 92-95% , соответственно.
Клонирование и секвенирование провирусных последовательностей, изолированных путем ПЦР, показало от 88 до 94% гомологии с геномом MMTV (gi9626965) и 91-98% гомологии между отдельными клонами hMTV, изолированными из культур РМЖ разными авторами (Liu В. et al. 2001; Ford С. et al 2003). Эти структурные различия обусловлены различиями применяемых методов клонирования и секвенирования отобранных клонов, а также географическими особенностями распростанения различных штаммов MMTV- родственного ретровируса в человеческих популяциях (Levine P.H. et al., 2004).
2.3.10. Структурные особенности hMTV.
Обнаружение провируса hMTV у пациенток, страдавших РМЖ в сочетании с другими неоплазиями, включая гемобластозы, позволяет предполагать дивергенцию MMTV-гомологичных последовательностей и, следовательно, полиморфную структуру провирусного генома, экспрессируюшегося в различных тканях. Напомним, что в организме человека представлен также широкий спектр эндогенных MMTV-гомологичных последовательностей, например суперсемейств HERV, HML и некоторых других. Все это осложняет ПЦР-анализ образцов ДНК, выделенных из ЛПК и опухолей.
В своей работе мы сосредоточились на изучении структуры функционально важных и непротяженных консервативных областей провирусного генома, имеющих минимальную гомологию с соответствующими генами наиболее близкого семейства HERV-K: от 9% до 15%. Выборочное секвенирование выявило несколько структурных вариантов gp52-кодирующей области гена еnv MMTV и Sag- кодирующей области 3’LTR в провирусном геноме. Последовательности, выявленные в опухолевой ткани, лимфатических узлах и ЛПК больных спорадическим контралатеральным двусторонним РМЖ по степени гомологии ближе к геному экзогенного MMTV, чем еnv MMTV–гомологичные последовательности, выявляемые в ткани РМЖ, лимфоузлах и ЛПК пациенток с РМЖАБ и двусторонним РМЖ, а также у пациенток с РМЖ в сочетании с неходжкинскими лимфомами. Этот вариант представляет особый интерес, поскольку содержит однонуклеотидные замены в области env MMTV, что может привести к появлению стоп-кодонов и терминации транскрипции гена на С-конце, т.е. возможна трансляция укороченного предшественника р73. К такому же результату приводит частичная делеция основного промотора Р1 в геноме рекомбинантного провируса. Однако, эта делеция не влияет на гормонозависимую транскрипцию гена еnv MMTV, а приводит к потере вирусом инфекционных свойств,
В основном, выявленный нами полиморфизм провирусной ДНК hMTV представлен однонуклеотидными заменами, не приводящими к сдвигу рамки считывания, но влияющими на степень гомологии провирусной ДНК с мышиным провирусом. В Sag- кодирующей области 3’LTR hMTV мы выявили делеции одного или нескольких нуклеотидов, что также обусловливает полиморфизм в данной области 3’LTR и в С-концевой области белка Sag. С-концевая область суперантигена является гипервариабельной и важна для активации специфичных Т-клеток CD4+, несущих определенные V-β-цепи Т-клеточных рецепторов (TCR). Известно, что Sag MMTV презентируется на поверхности В-и Т-клеток, а также ДК в составе молекул МНС II класса, связанных с гликопротеином оболочки MMTV - gp52. Поскольку разные штаммы передающегося с молоком экзогенного MMTV кодируют суперантиген с разной аминокислотной последовательностью на С-конце, при инфекции этими штаммами происходит стимуляция или делетирование разных субпопуляций Т-клеток. Взаимодействие лигандов CD40 и CD40L на поверхности В- и Т-клеток, соответственно, приводит к активации В-клеток и обеспечивает дальнейшую амплификацию и распространение MMTV в организме мышей (Okeoma et al., 2008). По-видимому, сходные механизмы Sag-зависимой активации лимфоидных клеток действуют и в человеческом организме. Косвенным доказательством этому является вариабельная структура последовательности, кодирующей С-концевой аминокислотный мотив суперантигена. Область 3’LTR MMTV – наиболее протяженная среди длинных концевых повторов известных ретровирусов. Сходный полиморфизм (возможно, следствие структурной дивергенции) Sag-кодирующей области 3’LTR был обнаружен ранее при анализе 3 штаммов MMTV у мышей одной и той же линии с высокой частотой ранних гормонозависимых опухолей МЖ (Sarkar., 2004). Полиморфизм провирусной ДНК, частичная гомология с эндогенными MMTV-родственными ретровирусами и наличие гипервариабельных участков в области 3’LTR hMTV создают трудности для ПЦР-анализа геномной ДНК из лимфоидной и опухолевой тканей и детекции MMTV-гомологичных последовательностей. Этого требуется ПЦР с менее специфичными праймерами, охватывающими область нескольких генов (gag pol env) и длинные концевые повторы, а затем - ПЦР с высокоспецифичными праймерами для выявления gp52-кодирующей области гена env MMTV и Sag- кодирующей области 3LTR, не амплифицирующейся у эндогенного Mtv. В ряде случаев для подтверждения структуры MMTV-гомологичных последовательностей требуется сравнение последовательностей клонированного и напрямую секвенированного ПЦР-продуктов. Путем ПЦР с праймерами к 5’LTR и области гена gag MMTV с последующим клонированием и секвенированием соответствующего продукта мы исследовали изменение структуры гена gag hMTV в области сайта фреймшифта в провирусной ДНК из опухолевой ткани больной РМЖАБ. С помощью вестерн-блотинга и антител против корового белка gag MMTV были обнаружены изменения экспрессии гена gag, возможно, обусловливающие неконтагиозность вирусных частиц, которые обнаруживаются в грудном молоке у некоторых больных РМЖ и здоровых женщин из группы риска (так называемый фактор молока).
По данным гибридизации in situ, в человеческих лимфоцитах имеется несколько сайтов преимущественной интеграции MMTV-гомологичных последовательностей, в частности на хромосомах 1p, 3q, 5q, 8p и 8q ( Lushnikova et al. , 2001: Лушникова и др. 2007). Однако мы не обнаружили каких-либо специфичных сайтов интеграции провируса в геном эпителиальных клеток (ПКЭПЧ, НЕК 293Т). По-видимому, в активно пролиферирующих трансформированных клетках провирус встраивается случайным образом, при этом возможно образование экстракопий провирусной ДНК. По-видимому, это способствует ускоренной репликации провируса в инфицированных эпителиальных клетках. Кроме того, случайная интеграция провируса в геном клеток повышает вероятность активации клеточных онкогенов в области +/- 25 т.п.н. от промотора MMTV(hMTV) с последующей трансформацией клеток. Cтохастическая интеграция провируса в геном стволовых клеток и клеток-предшественников, локализованных в растущей МЖ, по-видимому индуцирует целый каскад событий: от активации клеточных онкогенов (Wnt, FGF, Rspo, Notch4), индуцированной энхансерами MMTV, до нарушения экспрессии ряда клеточных генов и генетической нестабильности (Callahan, Smith, 2008). Различная картина экспрессии целого ряда регуляторных и структурных клеточных генов в MMTV-позитивных и негативных изогенных линиях РМЖ человека подтверждает это предположение (Melana et al., 2001). Диспергированное распределение сайтов интеграции провируса подтверждается также результатами компьютерного анализа сайтов интеграции hMTV, фланкированного короткими повторами длиной 6 п.н. по концам провируса, и ряда других ретровирусов в геном человека.
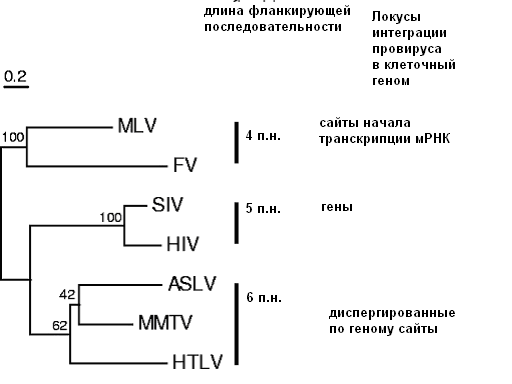
Рис 11. Результаты компьютерного анализа сайтов интеграции МMTV-гомологичного провируса (hMTV) в геном эпителиальных клеток человека по сравнению с другими ретровирусами (цифрами обозначены относительные расстояния, база данных BLAST 2.0).
