Структура и экспрессия mmtv-родственного провируса у больных раком молочной железы
| Вид материала | Автореферат |
- На правах рукописи бурлаков александр Сергеевич реконструктивная хирургия в лечении, 750.38kb.
- «Воронежская государственная медицинская академия имени Н. Н. Бурденко Федерального, 241.98kb.
- Иммунодиагностика и иммунотерапия рака молочной железы, 241.98kb.
- 20 октября в Украине ежегодно проводиться День борьбы с раком молочной железы. Внашей, 156.69kb.
- Иммунодиагностика и иммунотерапия рака молочной железы, 212.29kb.
- Радионуклидная терапия костных метастазов у больных раком молочной железы, 41.13kb.
- Роль тиреоидной патологии в развитии дисгормональных заболеваний молочной железы, 224.5kb.
- «Медицинский радиологический научный центр», 269.03kb.
- Лучевая терапия различными видами ионизирующего излучения в комплексном лечении больных, 785.18kb.
- Рак молочной железы: вопросы-ответы, 70.08kb.
2.3. Результаты и обсуждение
2.3.1. MMTV-гомологичные последовательности у пациенток со спорадическим РМЖ
Ранее MMTV-гомологичные последовательности были обнаружены в некоторых популяциях у 15- 39% пациенток со спорадическим РМЖ (Mok et al., 2008). Последовательности с высокой степенью гомологии кодирующей области генов env MMTV и 3’LTR MMTV были выявлены нами также у 64% больных РМЖАБ и у 52% пациенток, страдающих РМЖ с семейным накоплением РМЖ/РЯ (Lushnikova et al., 2007). Для сравнения мы исследовали частоту встречаемости и геномную структуру hMTV в репрезентативной выборке пациенток с диагнозом спорадический РМЖ. Было проанализировано 104 пациентки с первичным РМЖ, (у 26 из них проанализированы образцы опухолей). Больные наблюдались в РОНЦ РАМН с 1998-2008 гг. Анамнез выявил среди них 10% (10/104) больных с наследственной отягощенностью (более 2-х кровных родственников страдали онкологическими заболеваниями, включая РТК, РЖ, РПЖ, РШМ). Средний возраст пациенток во время постановки диагноза составил 47,7 лет (27 - 65 лет). Для ПЦР использовали праймеры к gp52- кодирующей области гена envMMTV и Sag-кодирующей области 3’LTR MMTV . Позитивными оказались 38,4% пациенток (40/104). Выборочное прямое секвенирование полученных ПЦР–продуктов, а также секвенирование 3-х клонированных ПЦР-продуктов, соответствующих gp52-кодирующей области гена envMMTV, выявило 92-97% гомологии с канонической последовательностью гена env MMTV(С3Н и HeJ). Экспрессия этих последовательностей наблюдалась в 75% (30/40) проанализированных образцов ЛПК и в 54,5% (6/11) образцах опухолей, которые были hMTV -позитивными по результатам ПЦР. Доля hMTV-позитивных пациенток с гормон-положительными опухолями была выше по сравнению с гормон-отрицательными: 29/54 эстроген- и 4/7 прогестерон-положительных опухолей , 5/32 эстроген и 0/7 прогестерон-отрицательных опухолей. Обращает также внимание, что большинство MMTV-позитивных пациенток оказалось с фиброзно-кистозной болезнью (32/40). Пролиферативная форма фиброзно-кистозной болезни и рак молочной железы возникают и развиваются под влиянием одних и тех же эндогенных и экзогенных факторов. Безрецидивная выживаемость пациенток в данной группе составила от 5 мес. до 7 лет, общая выживаемость – от 2,5 до 10 лет. Cравнение пятилетней общей и безрецидивной выживаемости у позитивных (n=31) и негативных (n=28) пациенток со спорадическим РМЖ выявило тенденцию к меньшей безрецидивной выживаемости в первой группе. Оба показателя снижаются через 1,5-2 года после лечения первичного РМЖ и особенно резко – у позитивных больных
2.3.2. MMTV-гомологичные последовательности у пациенток с РМЖ, ассоциированным с беременностью (РМЖАБ).
РМЖАБ встречается в клинической практике достаточно редко: от 1:1500 до 1:10.000, с пиком заболеваемости в возрасте от 32 до 38 лет. Проведенные исследования показали, что больные с РМЖАБ чаще имеют крупные опухоли, метастатически измененные регионарные лимфатические узлы, раковые эмболы, распространяющиеся по лимфатическим щелям. При этом у пациенток с РМЖАБ отдаленные метастазы выявляются в 2,5 раза чаще, чем при спорадическом РМЖ (Пароконная и др., 2008). Эти характерные особенности, а также высокий уровень эстрогенов создают благоприятный фон для аккумуляции и диссеминации hMTV у больных РМЖАБ. Известно 14 случаев метастазирования РМЖ в плаценту плода (Pavlidis, Petrek, 2004). В то же время, в ДНК из клеточной линии хориокарциномы были выявлены последовательности, на 60-65% гомологичные MMTV. Кроме того, обнаружены метастазы в ткани плода при лимфоме, и гепатоцеллюлярном раке у беременных женщин (Rothman, Potter, 2004). При этих неоплазиях также выявлены пациенты-носители MMTV-гомологичных последовательностей (Melana et al, 2009). Эти находки позволяют предполагать вертикальный путь передачи провируса hMTV от матери плоду, хотя механизм преодоления вирусным агентом иммунологического барьера пока не выяснен. Предварительное изучение пациенток с РМЖАБ показало высокую частоту встречаемости MMTV-гомологичных последовательностей как в геномной ДНК из лимфоцитов периферической крови, так и в ДНК из опухолевой ткани таких пациенток (Лушникова и др., 2006). Эти данные были подтверждены другими исследователями ( Faedo еt al., 2007). Сравнительно высокую частоту обнаружения hMTV в этой группе больных (64% против 39% при спорадическом РМЖ) можно объяснить гормонозависимой экспрессией провируса, а также активной пролиферацией эпителиальных клеток в растущей во время беременности молочной железе, что создает благоприятные возможности для циркуляции провируса в организме беременных. Мы исследовали 68 пациенток, лечившихся в РОНЦ им. Н.Н.Блохина РАМН по поводу рака молочной железы, ассоциированного с беременностью и лактацией (табл 1). Последовательности, гомологичные геному MMTV (группа hMTV+) были обнаружены с помощью ПЦР и выборочного секвенирования ПЦР-продуктов у 44 (64,6%) больных, в 24 (35,4%) случаях гомологии геномной ДНК с провирусными последовательностями (ген env MMTV и область LTR) не обнаружено. Экспрессия функционально значимых последовательностей гена env MMTV, включая ITAM-кодирующую последовательность, а также Sag-кодирующей области 3’LTR в подавляющем большинстве образцов MMTV-позитивных опухолевых тканей (8/10, 80%, проверено по 10 образцов) указывает на возможность трансляции вирусных белков и на репликацию провируса. Выборочное секвенирование амплифицированных продуктов (8 образцов) выявило высокую гомологию: 89-95% с геномом экзогенного MMTV. Выявлены протяженные ORF (открытые рамки считывания) в области гена env длиной 670 и 965 н.п. Необычная структурная особенность MMTV заключается в том, что за счет неспаренного аденина формируются две «жесткие» коаксиальные петли и два спиральных участка . Область стыка этих петель играет роль промотора фреймшифта (сдвига рибосомы в положение –1 от открытой рамки, обеспечивающий «перескок» рибосомы через кодон терминации транскрипции гена gag и, следовательно, экспрессию полицистронной мРНК) . Результаты прямого секвенирования ПЦР-продукта, полученного на матрице опухолевой ДНК и соответствующего гену gag MMTV показывают неполную гомологию района псевдоузелка ПЦР-продукта с канонической последовательностью. Анализ этой последовательности с интерполяцией вторичной структуры обнаружил существенные различия, которые могут обусловить нарушение фреймшифта и, следовательно, трансляции полицистронной мРНК так что синтезируется дефектный белок сердцевины, что нарушает инфекционные свойства MMTV (Golovkina et al., 1998). Возможно, это одна из причин дефектности вирионов, обнаруженных в человеческом молоке. Свидетельством тому являются результаты иммуноблотинга разделенных в 7-15% градиентном ПААГе белковых фракций сывороток крови и лизатов опухоли с конъюгированными моноклональными мышиными антителами anti-gag. Сыворотки и опухолевая ткань были получены от 2-х hMTV-позитивных пациенток с РМЖАБ. Оказалось, что соответствующая продукту гена gag MMTV фракция не представлена ни в опухолевой, ни в нормальной ткани МЖ (контроль). Таким образом, в быстро растущих опухолях РМЖАБ наблюдается нарушение сплайсинга полицистронной мРНК, с которой транслируется белок сердцевины вириона. Это наблюдение демонстрирует особенности тканеспецифичной экспрессии MMTV-гомологичного проровируса (рис. 1).
(1) TTGTTTGTTGCTTTCCCCGCGGGGTGTGTT—TC-CCTTCT-GGGTTTTCCT-GC-TGT-TCCTTT—3’
(2) TTTTT-GTTGCTT-CCCCGCGGG-TGTGTTTTCCC-TTC-GGG-TTT-CCTTG—TGTTCCT—TT-3’
(3) АAAAAACUUCGAAAGGGGCGCCCCACUCAAAAGGGGAUGUCCCCUAAAGGUACGUACUAGGAUUAA-3’
Рис. 1. Сравнение последовательностей секвенированных ПЦР продуктов (1-2) в области предполагаемого сайта фреймшифта в области gag-pol (подчеркнутый мотив) и экстраполяция соответствующих последовательностей РНК (3).
При исследовании 21 беременной без онкологических заболеваний аналогичного возраста MMTV-гомологичных последовательностей в лимфоцитарной ДНК у них не выявлено, за исключением одной женщины в возрасте 36 лет с диагнозом фиброзно-кистозная болезнь, которую можно отнести к группе риска. По этому признаку здоровые беременные сходны с донорами, у которых частота детекции hMTV составляет 0-8%.
Анализ характерной для российской популяции мутации 5382insC в экзоне 20 гена BRCA1 в изучаемой группе пациенток с РМЖАБ выявил более высокую ее частоту по сравнению с больными спорадическим РМЖ (17,5% против 5-10%). Обращает также внимание высокая доля пациенток с семейной формой РМЖ в исследуемой группе больных с мутацией BRCA1, поскольку уже в 77% случаев из анамнеза известна их семейная отягощенность. При этом 29 из 43 (70%) hMTV-положительных пациенток с РМЖАБ оказались именно из группы наследственно отягощенных носительниц мутаций генов BRCA1/2, а 76,9% носительниц мутаций были MMTV-положительными. Эта закономерность подтвердилась при иследовании пациенток с двусторонним РМЖ, для которых также характерна высокая частота мутаций генов-супрессоров BRCA1/2 и ТР53 (данные Н.И.Поспеховой, МГНЦ РАМН, Москва). Клинико-патологические характеристики у hMTV-негативных и hMTV-позитивных пациенток с РМЖАБ включая динамику пятилетней выживаемости, характер метастазирования и гистологию опухолей, существенно различались. При отсутствии метастатических лимфатических узлов у hМTV-негативных больных общая и безрецидивная выживаемость была высокой на протяжении всех лет наблюдения. В этой группе случаи смерти и прогрессирования заболевания не отмечены. В то же время, 5 (25%) из 20 -ти hMTV-позитивных пациенток без метастазов в лимфоузлы за время наблюдения умерли. В группе hМTV-позитивных больных отмечается тенденция к снижению общей выживаемости, начиная с 3-лет наблюдения и снижение безрецидивной выживаемости, начиная с 1-го года наблюдения.
Рис 1. Безрецидивная выживаемость hMTV-негативных и hMTV-позитивных больных РМЖАБ
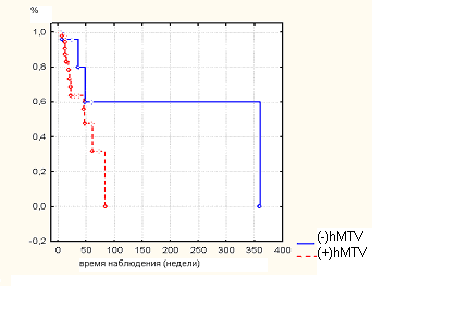
Рис 2. Общая выживаемость hMTV-негативных и hMTV-позитивных больных РМЖАБ.
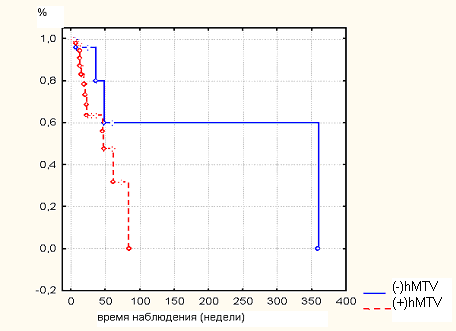
Рис 2. Общая выживаемость hMTV-негативных и hMTV-позитивных больных РМЖАБ.
Частота и локализация отдаленных метастазов у hMTV-позитивных пациенток также отличались от группы hMTV-негативных больных РМЖАБ (рис 3). Это подтверждает нашу гипотезу о роли лимфатической системы в циркуляции и диссеминации провируса.
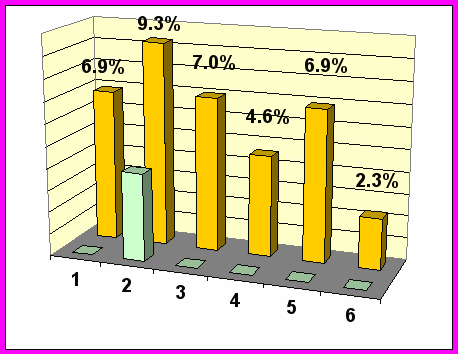
Рис. 3 Частота локальных рецидивов (1) и метастазов в печень (2), легкие (3) головной мозг (4) , средостение (5) и яичники (6) у пациенток с РМЖАБ в группах (hMTV-) первый ряд и (hMTV+) – второй ряд.
2.3.3. MMTV-гомологичные последовательности у мужчин с РМЖ и гинекомастией
Заболеваемость РМЖ у мужчин составляет около 1% от всех случаев РМЖ, в 100 раз реже, чем у женщин. В последнее время отмечена тенденция к росту заболеваемости. Большинство случаев РМЖ у мужчин связано с мутациями в гене BRCA2, которые отвечают за развитие семейных форм РМЖ. К другим генетическим факторам риска РМЖ у мужчин относятся синдром Клайнфельтера, синдром Кауден, семейный анамнез, позитивный в отношении РМЖ. Риск РМЖ как у мужчин, так и у женщин усиливает высокий уровень эстрогенов, стимулирующий пролиферацию клеток эпителия молочных желез; продукты обмена эстрогенов могут оказывать прямое мутагенное действие на эти клетки (Imyanitov, Hanson, 2004). Пониженная чувствительность клеток к андрогенам вследствие мутации гена, кодирующего соответствующий рецептор, также усиливает риск развития РМЖ у мужчин. Этот риск повышен и в других случаях гормонального дисбаланса. Пациентов с гинекомастией относят к группе риска, частота развития РМЖ у мужчин с гинекомастией в 3-5 раз выше среднепопуляционной. Человеческий антиген, родственный gp52 MMTV и ассоциированный с РМЖ, обнаруживается в сыворотке крови пациенток с РМЖ и их здоровых родственний, но не выявляется у мужчин из российской популяции (Крюкова и др., 2001, 2002). Для объяснения этого феномена мы исследовали env MMTV-гомологичные последовательности, пациентов с РМЖ и гинекомастией. Было проанализировано 2 образца нативной опухолевой ткани молочной железы и 3 образца фиксированной ткани, полученных от мужчин, страдающих РМЖ, а также 11 архивных образцов гинекомастийной ткани, заключенной в парафин . У 4-х пациентов с РМЖ и 4 – с гинекомастией были взяты образцы периферической крови. За исключением одного пациента с РМЖ, они не имели ближайших родственников, страдающих РМЖ или гинекомастией. При повторных исследованиях образцов ДНК из ЛПК, полученных от 4-х пациентов с РМЖ и 4-х - с гинекомастией был выявлен всего 1 MMTV-позитивный пациент, страдающий РМЖ. Из 5-ти образцов ДНК, выделенных из опухолевой ткани и 11-ти образцов гинекомастийной ткани позитивным был образец, полученный от этого же пациента с РМЖ, все другие образцы оказались отрицательными. При последующей гибридизации по Саузерну из 16 образцов ДНК также выявлен 1 позитивный. С помощью ОТ ПЦР показано, что обнаруженные env MMTV-гомологичные последовательности экспрессируются. Три амплификата длиной 255 п.н., а также амплификат Sag –кодирующей области 3’LTR были секвенированы, показана 92% (3’LTR) и 96%-ная гомологии (env) с геномом MMTV (штаммы C3H, HeJ). Согласно анамнезу, у env MMTV-позитивного пациента в возрасте 65 – ти лет была диагностирована гинекомастия, а 9 лет спустя - РМЖ на стадии T2N1M0, пациент был оперирован. Его мать также оперировалась по поводу РМЖ в возрасте 46-ти лет, а сестра матери – по поводу двустороннего метахронного РМЖ с множественными метастазами. У бабушки этого пациента по материнской линии был выявлен РТК. Герминальных мутаций гена BRCA2 у данного пациента не обнаружено.
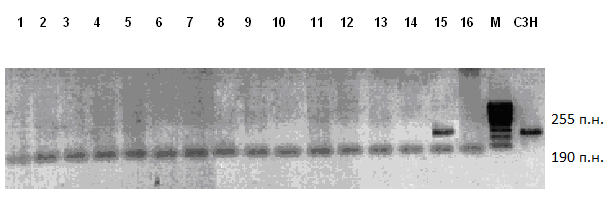
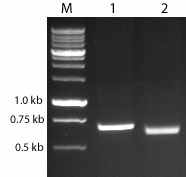
Рис 5. Результаты ПЦР–анализа ДНК из образцов гинекомастийной (1-11) и опухолевой (12-16) тканей, полученных от 16-ти пациентов; М-маркер , С3Н- амплификат ДНК из селезенки мыши линии С3Н длиной 255 п.н. Внизу – амплификат клеточного гена GAPDH длиной 190 п.н. (внутренний контроль).

Рис 6. Результаты гибридизации по Саузерну амплифицированной ДНК из гинекомастийной и опухолевой ткани от тех же 16-ти пациентов с меченной дигоксигенином последовательностью gp52-кодирующей области гена env MMTV; 15-позитивный образец от больного РМЖ, С3Н- образец ДНК из селезенки мыши линии С3Н.

Рис 9. ОТ ПЦР с образцом РНК, выделенной из архивного образца опухоли MMTV-позитивного пациента с РМЖ, праймеры к gp52-кодирующей области гена env MMTV.
Таким образом, в отличие от результатов Форд с соавторами (Ford et al. 2004), частота MMTV-позитивных опухолей молочной железы у российских мужчин оказалось значительно ниже и сопоставима с таковой у доноров: 1 из 5 больных РМЖ и 0 из 11 пациентов с гинекомастией. Это согласуется с результатами анализа человеческого антигена, ассоциированного с РМЖ (ЧАГРМЖ), а также с результатами ПЦР и ОТ ПЦР геномной ДНК в группе доноров. Различия в частоте обнаружения MMTV-гомологичных последовательностей у больных РМЖ мужчин из австралийской и российской популяций по-видимому связаны как с генетическими особенностями популяций, так и с распространением MMTV-родственного провируса.
2.3.4.MMTV-гомологичные последовательности у больных
двусторонним РМЖ, включая семьи с накоплением неоплазий
Двусторонний рак молочной железы (2РМЖ) составляет по различным
данным 1% - 20 % от всех случаев РМЖ, ( Керимов, 2005). Риск
возникновения контралатерального РМЖ значительно выше для больных
молодого возраста и/или имеющих семейную историю онкологических
заболеваний, особенно РМЖ и РЯ. Около 10% случаев РМЖ связано с
наследованием высокопенетрантных мутаций в генах предрасположенности
BRCA1 и BRCA2. Инсерция провируса в геном клеток эпителия МЖ может нарушить экспрессию клеточных генов и обусловить их злокачественную трансформацию. Механизмы такой трансформации различны: от активации клеточных онкогенов до гиперактивации клеточных сигнальных путей с участием иммунорецепторов, несущих домены ITAM. (Callahan, Smith, 2008, Lushnikova et al., 2004). Мы исследовали структуру и частоту провирусных последовательностей у пациенток с контралатеральным РМЖ (2РМЖ) и ассоциацию носительства hMTV с онкопатологическим генотипом, а также клиническими особенностями РМЖ. Было проанализировано 83 пациентки с диагнозом 2РМЖ (табл 1). Среди родственниц I-II степени родства у 51 пациентки из изученной группы имелись случаи заболевания РМЖ и/или РЯ. У 32 пациенток семейная отягощенность отсутствовала. Синхронный 2РМЖ был диагностирован у 17 (20%) пациенток, метахронный рак - у 66 (80%). В группе из 83 больных было выявлено 32 (38,6%) носительницы герминальных мутаций, при этом 27 пациенток имели мутацию в гене BRCA1, 4 – в гене BRCA2 и 1 - в гене ТР53. У 46-ти из 83 (55,4%) исследованных пациенток с помощью специфичных ПЦР были обнаружены последовательности с 95-98%-ной гомологией gp52-кодирующей области гена env MMTV и 93-97 % - ной гомологией Sag- и HRE- кодирующей области 3’LTR MMTV. При этом большинство (37/46 - 80,4%) hMTV-позитивных пациенток были из группы с BRCA1/2-патологическим генотипом. Аналогичная тенденция отмечалась при исследовании группы пациенток с РМЖАБ и свидетельствует о повышенной частоте носительства hMTV на фоне нестабильного генома. . У пациенток со спорадическим 2РМЖ было выявлено 5 мутаций: в гене BRCA1 (4) и в гене ТР53 (1) . При этом у пациентки с мутацией гена ТР 53 выявлены MMTV-гомологичные последовательности. У пациенток с семейным 2РМЖ/РЯ обнаружены герминальные мутации только в гене BRCA1, 5 из них , т.е. 10% общей выборки, были носительницами hMTV . Во всех исследованных нами выборках больных разными типами РМЖ у hMTV-позитивных пациенток преобладал инфильтративно-протоковый РМЖ (до 98%). Мутации в генах предрасположенности BRCA1/2 и генах-модификаторах обусловливают подавляющее число случаев наследственного РМЖ. Результаты нашего исследования показывают, что заметная часть случаев BRCA-ассоциированного наследственного РМЖ связана также и с носительством hMTV.
2.3.5. MMTV–гомологичные последовательности у больных листовидными опухолями молочной железы.
Листовидные опухоли (ЛО) представляют собой смешанные саркомы и фиброаденомы МЖ и составляют около 2% всех злокачественных неоплазий МЖ. Редкость заболевания не позволяет достаточно полно исследовать молекулярно-генетические особенности этой патологии (Воротников , 2000). Мы исследовали 8 пациенток с ЛО (табл 1). У 3-х их них диагноз был поставлен на фоне беременности, у одной – через 6мес. после медицинского аборта. У 2-х пациенток отмечены двусторонние ЛО МЖ: у одной из больных – 2 рецидива, у второй - 4 в интервале 2,5 года. У большинства пациенток (5/8) была диагностирована переходная форма ЛО: листовидная фиброаденома с эпителиальным и стромальным компонентами. Такая пропорция наблюдалась и в других исследованиях этой патологии МЖ (Воротников, Ермилова, 2004). Анализ ДНК, выделенной из ЛПК и опухолевой ткани не обнаружил характерных для РМЖ мутаций генов BRCA1/2. Последовательности, гомологичные геному MMTV, были обнаружены у 2 из 3 пациенток с ЛО МЖ на фоне беременности и у из 2 из пациенток с диагнозом ЛО МЖ. Прямое секвенирование ПЦР-продуктов выявило некоторые структурные особенности. В 2-х образцах опухолевой ДНК были обнаружены инсерции в области гена env MMTV на границе с gp36-кодирующей областью. Возможно, это приводит к трансляции более протяженного аминокислотного мотива и каким-то образом влияет на функцию иммунорецептора, задействованного в сигналинге (Katz et al., 2006). Другой особенностью стала делеция 15-ти п.н. в Sag-кодирующей области U3 LTR MMTV, выявленная в образцах ДНК из ЛПК и опухоли беременной пациентки с быстрорастущей двусторонней ЛО МЖ промежуточного гистологического типа на фоне беременности (Пароконная, Воротников и др., 2008). Небольшие делеции Sag-кодирующей области были описаны нами ранее при анализе секвенированных ПЦР-продуктов, полученных на ДНК из трансформированных клеток эмбриональной почки человека и на ДНК, выделенной из лимфоузлов пациенток с РМЖ в сочетании с лимфомами .
Дальнейший анализ с помощью BLAST 2.0 показал, что эти делеции не оказывают существенного влияния на структуру суперантигена. С помощью ОТ ПЦР на образцах РНК, выделенной из свежей опухолевой ткани, мы убедились в экспрессии описанных функционально важных провирусных последовательностей в 3-х из 4-х проанализированных образцов ЛПК и опухолевой ткани МЖ. При выделении геномной ДНК/РНК MMTV c помощью набора, предназначенного для выделения экстрахромосомного вирусного генетического материала (Virus DNA/RNA Minikit, Invitek) уровень экспрессии был значительно выше. Это указывает на присутствие в опухолевой ткани свободных ретровирусов, возможно дефектных, а также короткоживущих экстракопий провирусной ДНК, которые выявляются также после обработки выделенной фракции РНКазой.
Следует подчеркнуть наличие экспрессирующихся провирусных последовательностей у всех 3-х изученных пациенток с злокачественными ЛО МЖ на фоне беременности и доброкачественной ЛО после медицинского аборта. У одной из этих MMTV-позитивных пациенток наступление беременности стимулировало быстрый рост неоплазий в обеих МЖ и увеличение опухоли в 3 раза, при сроке беременности 20 нед. У другой пациентки беременность сопровождалась четвертым рецидивом ЛО.
2.3.6. MMTV-гомологичные последовательности у больных РМЖ и неходжкинскими Т-клеточными лимфомами.
Одной из причин этого заболевания может служить вирус Эпштейна-Барр, ДНК которого была обнаружена в опухолевой ткани больных. С помощью ПЦР, ОТ ПЦР и электронной микроскопии в сыворотках крови пациентов, страдающих лимфомой в сочетании с РМЖ были выявлены частицы эндогенных ретровирусов семейства HERV-K (HML-2), (Contreras-Galindo et al., 2008). Показано, что у мышей некоторых инбредных линий MMTV может вызывать, помимо РМЖ, В- и Т-клеточные лимфомы ( Dudely et al, 2005, Bhandra et al, 2005). Для лимфомагенного варианта MMTV характерно наличие Т-специфического энхансера и утрата репрессии транскрипции за счёт делеции или супрессии области негативного репрессора (NRE). При инъекции мышам с иммунодефицитом экстрактов тканей РМЖ человека в ряде случаев наблюдалась индукция Т-клеточных лимфом с фенотипом TcR/+CD4/8 (Wakasugi et al, 1995). С помощью ПЦР и секвенирования соответствующих ПЦР продуктов в Т-клеточной лимфоме у пациентки с РМЖ и лимфомой ранее были обнаружены последовательности, на 99% гомологичные гену env MMTV штамма BR6 и на 100% - гену env MMTV штамма C3H. Затем последовательности, гомологичные env MMTV и Sag-кодирующей ORF 3’- LTR MMTV, были обнаружены еще у 6 из 12 больных РМЖ и Т-клеточными лимфомами (Etkind et al., 2004). Если у мышей лимфомагенный вариант MMTV несет делецию в ORF LTR и транскрибируется укороченная иРНК Sag, то у исследованных пациенток такой делеции выявлено не было. Клонирование и секвенирование этих последовательностей показало различие клонированных ПЦР-продуктов, полученных от разных пациенток. Это говорит в пользу множественной инфекции разными штаммами MMTV.
Для уточнения имеющихся в литературе немногочисленых данных мы проанализировали образцы ДНК, полученные от 8 пациенток с РМЖ и Т-клеточной лимфомой (табл.1). Лимфомы были диагностированы у этих пациенток одновременно или вскоре после обнаружения РМЖ, одна из больных в момент диагноза была в первом триместре беременности. Исследовали ткань РМЖ, ДНК из ЛПК и гиперплазированные лимфоузлы (ГЛУ). Для сравнения исследовали опухолевую ткань, полученную от 5 пациенток с неходжкинскими лимфомами, наблюдавшихся в РОНЦ им.Н.Н.Блохина РАМН.
С помощью специфичной ПЦР с праймерами к gp52- кодирующей области гена env MMTV и к Sag-кодирующему участку 3’LTR MMTV последовательности, относящиеся к hMTV, были выявлены у 4 из 8 пациенток. Секвенирование ПЦР-продуктов на матрице ДНК из лимфомной ткани выявило делецию 15-ти нуклеотидов в области 3’ LTR и однонуклеотидные замены в области env MMTV, что может привести к преждевременной терминации транскрипции .