На правах рукописи
| Вид материала | Автореферат |
СодержаниеE. cloacae Tem + ctx-м Практические рекомендации |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
- На правах рукописи, 459.44kb.
Препаратами с максимальной фармакодинамической активностью в отношении антибиотикустойчивых штаммов E. cloacae были карбапенемы (см. табл. 13). Суммарное количество культур, имевших промежуточный и высокий уровень резистентности к цефокситину, составило более 80%. Среди цефалоспоринов III поколения наиболее низкие значения МПК наблюдались у ингибиторозащищенных препаратов. Лишь 56,7% исследованных E. cloacae оставались чувствительными к цефепиму.
Таблица 14
Результаты генотипирования бета-лактамаз молекулярного класса А группы 2be (blaTEM, blaSHV и blaCTX-M) клинических штаммов E. cloacae (n=51)
| Бета-лактамазный генотип | Количество штаммов, абс.1 | Относительное количество штаммов, % |
| TEM | 4 | 7,8 |
| SHV | 1 | 2 |
| CTX-М | 2 | 3,9 |
| TEM + SHV | 11 | 21,6 |
| TEM + CTX-М | 10 | 19,6 |
| SHV + CTX-М | 4 | 7,8 |
| TEM + SHV + CTX-М | 6 | 11,8 |
| Не выявлено бета-лактамаз изучаемых типов | 13 | 25,5 |
Примечание. 1Для абсолютного количества штаммов границы доверительного интервала при
р<0,05 — от 2,665 до 10,085.
У 38 (74,5%) из 51 культур энтеробактера были выявлены гены blaTEM, blaSHV и blaCTX-M, либо их комбинации (см. табл. 14). В изолированном виде гены данных бета-лактамаз обнаружены у 7 (13,7%), а различные их комбинации у 31 (60,8%) штаммов E. cloacae. У 6 (11,8%) изолятов выявлена комбинация трёх генетических детерминант устойчивости одновременно. Среди множества генотипов резистентности к бета-лактамам преобладал — TEM + SHV, так как показатель его абсолютного количества превышал значение верхней границы доверительного интервала для всех установленных генотипов энтеробактера. Детекция blaTEM, blaSHV, blaCTX-M у 13 (25,5%) подозрительных на их продукцию штаммов E. cloacae имела отрицательный результат.
Таким образом, среди клинических изолятов ведущих грамотрицательных патогенов современных внутрибольничных инфекций доминировали фенотипы с множественной лекарственной устойчивостью.
Характеристика и оценка клинической эффективности схем системной эмпирической антимикробной фармакотерапии внутрибольничных инфекций с участием антибиотикустойчивых грамотрицательных бактерий. Оценка назначений антимикробных препаратов проведена у 282 больных внутрибольничной инфекцией с участием антибиотикустойчивых грамотрицательных бактерий, что составило 36,6% от общего количества обследованных пациентов. Всего рассмотрено 59 разных схем системной эмпирической антимикробной фармакотерапии, из которых 12 относились к монотерапии, 19 — комбинированной терапии, направленной против потенциальных грамотрицательных патогенов, а 28 — комбинированной терапии против смешанной грамотрицательной и грамположительной микрофлоры.
Были применены следующие критерии оценки проведенной антимикробной фармакотерапии: качество (адекватная или неадекватная) и клиническая эффективность (выздоровление, отсутствие эффекта или неопределенный результат лечения). Оценку назначений эмпирической антимикробной фармакотерапии целесообразно рассматривать с учетом структуры инфекционной патологии (внутрибольничные пневмония, хирургическая инфекция, инфекция мочевыводящих путей).

Рис. 1. Оценка качества и клинической эффективности схем антимикробных эмпирических комбинированной и монотерапии современной внутрибольничной пневмонии с участием антибиотикустойчивых грамотрицательных бактерий (p>0,05; данные t-критерия Стьюдента)
Анализируя качество эмпирических антимикробной комбинированной и монотерапии нозокомиальной пневмонии (см. рис. 1), выяснилось, что только в 61,7% случаев они были адекватными. В 25 (13,9%) случаях схемы эмпирической монотерапии нозокомиальной пневмонии с участием антибиотикустойчивых грамотрицательных бактерий признаны неадекватными, включая 3 случая назначения препаратов с относительно узким спектром их антимикробной активности (пенициллинов узкого спектра и цефалоспоринов I поколения), 2 случая предписания фторхинолонов детям младшего возраста, 6 случаев применения аминогликозидов и 14 случаев, когда изменялась стартовая монотерапия в течение первых 48-72 часов. Относительное количество неадекватных схем системной эмпирической комбинированной фармакотерапии оказалось в 1,8 раза больше (p>0,05), чем при эмпирической монотерапии. Наиболее часто смена эмпирической комбинированной фармакотерапии вследствие её неэффективности требовалась после назначения аминопенициллинов с гентамицином.
Из 124 пациентов с госпитальной пневмонией после проведения системной эмпирической антимикробной фармакотерапии выздоровление отмечено у 54 (43,5%). Количество выздоровевших в результате назначения эмпирической монотерапии оказалось в 1,6 раза больше, чем в группе пациентов, которым была предписана комбинированная антимикробная терапия. Отсутствие эффекта от эмпирической монотерапии нозокомиальной пневмонии — 8,9% случаев, что в 1,4 раза меньше аналогичного показателя для комбинированного типа фармакотерапии. Однако все выявленные различия в количестве выздоровевших пациентов, либо таковых с отсутствием эффекта от лечения для двух сравниваемых групп были статистически незначимыми (p>0,05).
Рис. 2. Оценка качества и клинической эффективности схем антимикробных эмпирических комбинированной и монотерапии современной внутрибольничной хирургической инфекции с участием антибиотикустойчивых грамотрицательных бактерий (p<0,05; данные t-критерия Стьюдента).

Оценивая качество проведенной фармакотерапии внутрибольничной хирургической инфекции с участием антибиотикустойчивых грамотрицательных бактерий (см. рис. 2), выяснилось, что в 60% случаев она была адекватной. Удельный вес адекватных схем эмпирических комбинированной и монотерапии был неодинаковым, в 1,6 раза больше при назначении нескольких препаратов одновременно (p<0,05). 24 (19,2%) схемы эмпирической монотерапии признаны неадекватными: фармакотерапия пенициллинами узкого спектра, аминопенициллинами, цефалоспоринами I и II поколений, аминогликозидами. 26 (20,8%) схем эмпирической комбинированной фармакотерапии также являлись неадекватными. В их число входили случаи, когда при госпитальной хирургической инфекции были назначены пенициллины узкого спектра, или аминопенициллины, или цефалоспорины I поколения одновременно с фторхинолонами или аминогликозидами. Чаще изменение в течение первых 2-3 суток антимикробной фармакотерапии внутрибольничной хирургической инфекции с участием антибиотикустойчивых грамотрицательных бактерий вследствие её неэффективности требовалось после применения комбинации цефалоспоринов III поколения с аминогликозидами (6,4%) или аминопенициллинов с аминогликозидами (4%).
Из 93 пациентов с госпитальной хирургической инфекцией после проведения системной эмпирической антимикробной фармакотерапии выздоровление отмечено у 53 (57%). Количество выздоровевших в результате назначения эмпирической комбинированной терапии оказалось в 1,4 раза больше, чем в группе пациентов, которым была предписана эмпирическая монотерапия (p<0,05). В тоже время, отсутствие эффекта от эмпирической монотерапии было в 1,3 раза меньше аналогичного показателя для эмпирической комбинированной терапии (p<0,05).
Рис. 3. Оценка качества и клинической эффективности схем антимикробных эмпирических комбинированной и монотерапии современной внутрибольничной инфекции мочевыводящих путей с участием антибиотикустойчивых грамотрицательных бактерий (p<0,05; данные t-критерия Стьюдента)
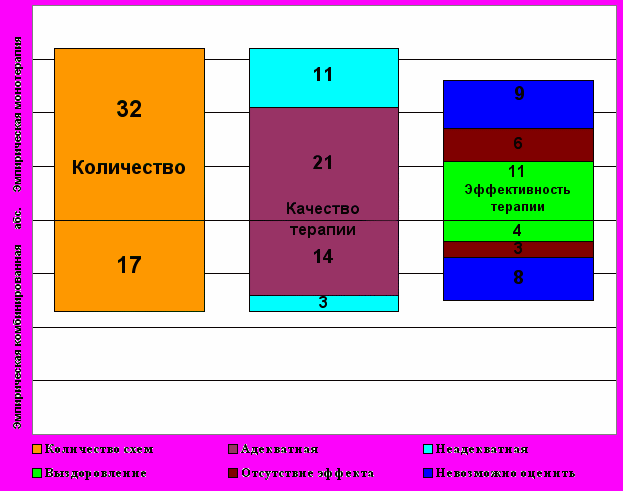
Анализируя качество проведенной фармакотерапии внутрибольничной инфекции мочевыводящих путей с участием антибиотикустойчивых грамотрицательных бактерий (см. рис. 3), выяснилось, что в 71,5% случаев она была адекватной. Удельный вес адекватных схем эмпирических комбинированной и монотерапии был неодинаковым, в 1,5 раза больше при назначении одного антимикробного препарата (p<0,05). В 11 (22,4%) случаях схемы эмпирической монотерапии признаны неадекватными, включая эпизоды использования препаратов с относительно узким спектром антимикробной активности (аминопенициллины, цефалоспорины I поколения, производные 8-оксихинолина) и аминогликозидов. Кроме того, 3 (6,1%) схемы эмпирической комбинированной фармакотерапии были неадекватными, когда использовались аминопенициллины и цефалоспорины I поколения с фторхинолонами или аминогликозидами.
Из 41 пациентов с госпитальной инфекцией мочевыводящих путей после проведения системной эмпирической антимикробной фармакотерапии выздоровление отмечено у 15 (36,6%). Количество выздоровевших в результате назначения эмпирической монотерапии оказалось в 2,7 раза больше, чем в группе пациентов, которым применялась эмпирическая комбинированная терапия (p<0,05). В тоже время, отсутствие эффекта от эмпирической монотерапии было в 2 раза больше аналогичного показателя для эмпирической комбинированной антибактериальной фармакотерапии (p<0,05).
Известно, что микрофлора в случае хирургической инфекции представляет собой сложно взаимодействующую ассоциацию грамотрицательных и грамположительных микроорганизмов, поэтому выделить в ней ведущий патоген — крайне сложно. В ходе настоящего исследования достоверно установлено, полимикробный характер современной внутрибольничной хирургической инфекции, в отличие от мочевых инфекций, обуславливает назначение системной эмпирической комбинированной антибиотикотерапии в отношении смешанной грамотрицательной и грамположительной микрофлоры.
Имипенем, меропенем и цефоперазон/сульбактам — жизненно необходимые и важнейшие лекарственные средства и перспективы их практического использования в Российской Федерации. Собственные клинико-лабораторные исследования подтвердили, что карбапенемы (имипенем и меропенем) и цефоперазон/сульбактам обладают высокой фармакодинамической активностью в отношении ведущих грамотрицательных возбудителей (K. pneumoniae ss. pneumonia, E. coli, P. mirabilis, E. cloacae, P. aeruginosa и A. baumannii) современных внутрибольничных инфекций, клинические штаммы которых являлись устойчивыми не только к бета-лактамам, но и отличались множественной лекарственной резистентностью. Перечисленные выше средства фармакотерапии имеют исключительно парентеральные лекарственные формы и относятся к препаратам госпитального сегмента фармацевтического рынка.
По данным ФГУ «Научный центр экспертизы средств медицинского применения» Росздравнадзора, первый дженериковый препарат имипенема+[циластатин] производства Южной Кореи получил государственную регистрацию в 2006 г. В последующие годы регистрация дженериков имипенема+[циластатин] происходила следующим образом: 2007 г. – 2 наименования, 2008 г. – 4 наименования и 2 субстанции, на 1 декабря 2009 г. – 1 наименование.
В настоящее время дженериковые препараты имипенема+[циластатин], изготовленные на российских предприятиях из импортных субстанций, представлены единственной торговой маркой Гримипенем® (брендированный дженерик имипенема; регистрационный номер — ЛСР-008834/08) от ООО «АБОЛмед» (Россия, г. Москва). Налажен выпуск лекарственной формы дженерика — порошок во флаконах и бутылках для приготовления инфузионного раствора дозировкой 1 г.
Дженериковые препараты меропенема производства России и Индии впервые получили государственную регистрацию в 2006 г. В последующие годы регистрация дженериков меропенема происходила следующим образом: 2007 г. – 6 наименований и 2 субстанции, 2008 г. – 5 наименований и 1 субстанция, на 1 декабря 2009 г. – 13 наименований. На фармацевтическом рынке Российской Федерации 65% производителей и дистрибьютеров дженериков меропенема — индийские, 10% – российские, 14% – китайские.
К сожалению, 96% объема лекарственных форм дженериковых препаратов меропенема на российском фармацевтическом рынке составляет порошок во флаконах для приготовления инфузионного раствора, тогда как оригинальный препарат Меронем® (владелец торговой марки — AstraZeneca) выпускается в форме лиофилизата.
Сегодня дженериковые препараты меропенема в виде порошка во флаконах для приготовления инфузионного раствора в дозировках 0,5 и 1 г, произведенные на российских предприятиях из импортных субстанций, представлены продукцией следующих фармкомпаний: ОАО «Красфарма» (Россия, г. Красноярск), ООО «АБОЛмед» (Россия, г. Москва) и ЗАО «Макиз-Фарма» (Россия, г. Москва).
Первый дженериковый препарат цефоперазона/сульбактама под торговой маркой Сульперацеф® производства ООО «АБОЛмед» (Россия, г. Москва) зарегистрирован в 2003 г. В последующие годы регистрация дженериков цефоперазона/сульбактама происходила следующим образом: 2004 г. – 1 наименование, 2005 г. – 1 наименование, 2006 г. – 4 наименования, 2007 г. – 2 наименования, 2008 г. – 1 субстанция, на 1 декабря 2009 г. – 2 наименования. На фармацевтическом рынке Российской Федерации 42% производителей дженериков цефоперазона/сульбактама — индийские, 25% – российские, 17% – китайские.
В настоящее время дженериковые препараты цефоперазона/сульбактама в виде порошка во флаконах для приготовления раствора для внутривенного и внутримышечного введения в дозировках 0,25 г+0,25 г; 0,5 г+0,5 г; 1 г+1 г, произведенные на отечественных предприятиях, представлены продукцией следующих фармкомпаний: Сульперацеф® (регистрационный номер — P N003060/01) от ООО «АБОЛмед» (Россия, г. Москва), Сульзонцеф® (регистрационный номер – ЛСР-003512/09) от ОАО «Синтез АКО» (Россия, г. Курган) и Сульцефазон® (регистрационный номер – ЛС-001152) от ОАО «Биохимик» (Республика Мордовия, г. Саранск).
Генерические препараты обычно допускаются в обращение после истечения срока патентной защиты оригинального препарата, как правило, на основании оценки регистрационных досье сокращенного объема и данных по биоэквивалентности. В доступной нам медицинской литературе и электронных базах данных информации о терапевтической эквивалентности зарегистрированных в Российской Федерации дженериков имипенема, меропенема и цефоперазона/сульбактама нет. Следовательно, вопрос о терапевтической эквивалентности генерических антимикробных препаратов имипенема, меропенема и цефоперазона/сульбактама, допущенных к обращению на отечественном фармацевтическом рынке, остается до конца неизученным.
В создавшейся ситуации крайне важна информированность медицинских специалистов и пациентов. К сожалению, на сегодняшний день в Российской Федерации нет законодательных положений, регулирующих применение дженериков, с позиции терапевтической эквивалентности и нет национальной централизованной базы данных, подобной той, которая используется, например, в США (Approved Drug Products with Therapeutic Equivalence Evaluations), по оригинальным и воспроизведенным лекарствам. Доступность объективной информации о терапевтической эквивалентности дженериков позволила бы обоснованно использовать генерические, в том числе и импортозамещающие, лекарственные препараты, принимая во внимание их эффективность, безопасность, экономические преимущества, а значит, и обеспечить адекватное медицинское обслуживание в Российской Федерации.
ВЫВОДЫ
- Установлено, что антимикробные лекарственные препараты (из числа включенных в административные списки) для системного лечения внутрибольничных инфекций с участием антибиотикустойчивых грамотрицательных бактерий наиболее часто представлены цефалоспоринами и аминогликозидами III поколения — цефотаксимом, цефтриаксоном и, соответственно, амикацином, а также фторхинолонами (p<0,05). Их назначение осуществляется преимущественно эмпирически в составе схем комбинированной фармакотерапии из 2-6 системных антимикробных препаратов без предшествующего и доказательного фармакоэкономического обоснования.
- В современной этиологической структуре внутрибольничных инфекций с участием антибиотикустойчивых грамотрицательных бактерий выявлена высокая частота выделения патогенов с множественной лекарственной резистентностью. В зависимости от видовой принадлежности устойчивые штаммы составляют 86-100%, а показатели фармакодинамической активности (МПК90) некоторых изученных цефалоспоринов III поколения, аминогликозидов II-III поколений и ципрофлоксацина в отношении соответствующих культур достигают значений 256-512 мкг/мл (в 16-512 раз превышая МПК антибиотиков для чувствительных культур).
- Преобладающими видами в современной этиологической структуре внутрибольничных инфекций с участием антибиотикустойчивых грамотрицательных бактерий являются K. pneumoniae ss. pneumonia, E. coli, P. mirabilis, E. cloacae, P. aeruginosa и A. baumannii. Частота выделения указанных микробов зависит от пола и возраста пациентов. Так, у мужчин в 1,7 и 1,2 раза чаще высевались соответственно E. cloacae и A. baumannii, а у женщин в 1,2 раза чаще — E. coli; у мальчиков в 1,4; 1,9 и 1,2 раза чаще высевались соответственно K. pneumoniae ss. pneumonia, E. cloacae и P. aeruginosa, а у девочек в 1,2 и 2 раза чаще — соответственно E. coli и A. baumannii (p<0,05). В то же время при госпитальных пневмониях и хирургических инфекциях в зависимости от характера происхождения клинического материала выделяются ассоциации с доминированием P. aeruginosa, K. pneumoniae ss. pneumonia и E. coli (p<0,05).
- Углубленное изучение молекулярных механизмов и маркеров распространения устойчивости к бета-лактамам у 4 ведуших видов нозокомиальных возбудителей из числа энтеробактерий подтверждает, что имеет место массовая продукция ферментов БЛРС. Так, среди штаммов E. coli преобладают TEM + CTX-M-1 и CTX-M-1 генотипы антибиотикорезистентности, среди K. pneumoniae ss. pneumonia – TEM + SHV + CTX-M-1 и SHV + CTX-M-1 генотипы, среди E. cloacae — TEM + SHV генотип и гиперпродукция бета-лактамаз молекулярного класса С, среди P. mirabilis — TEM + CTX-M-1 генотип (p<0,05). Полирезистентность 14% всех антибиотикустойчивых госпитальных штаммов P. aeruginosa обусловлена продукцией карбапенемаз группы VIM.
- Проведенные исследования позволили уточнить, что устойчивость ведущих внутрибольничных патогенов семейства Enterobacteriaceae к бета-лактамным антибиотикам определяется субстратным профилем продуцируемых микробных бета-лактамаз в том числе и в случае, когда вырабатывается только один тип ферментов молекулярного класса А группы 2be (или blaTEM, или blaSHV, или blaCTX-M). Доказано, что уровень антибиотикорезистентности изученных энтеробактерий к бета-лактамам не зависит от количества детектируемых бета-лактамаз молекулярного класса А группы 2be (p<0,05).
- Многолетние клинико-лабораторные исследования подтвердили, что имипенем, меропенем и цефоперазон/сульбактам обладают высокой фармакодинамической активностью в отношении K. pneumoniae ss. pneumonia, E. coli, P. mirabilis, E. cloacae, P. aeruginosa и A. baumannii с множественной лекарственной резистентностью к 3-15 антибиотикам.
- Полученный опыт валидации микробиологических методов исследования позволил повысить на 10% точность результатов определения фармакодинамической активности антимикробных лекарственных препаратов в отношении коллекции из 900 клинических штаммов грамотрицательных бактерий (p<0,01).
- Доказано, что наиболее эффективными и экономически обоснованными универсальными вариантами эмпирической антимикробной фармакотерапии современных хирургических инфекций госпитального происхождения является комбинированная антибиотикотерапия, направленная против смешанной грамотрицательной и грамположительной микрофлоры, а при внутрибольничных инфекциях мочевыводящих путей — деэскалационная монотерапия в отношении потенциального возбудителя (p<0,05).
- Итоговые данные свидетельствуют о необходимости пересмотра номенклатуры антимикробных лекарственных средств, из числа включенных в федеральные списки. Так, целесообразно рассмотреть включение комбинации цефоперазона с сульбактамом. Кроме того, провести пострегистрационные исследования фармакодинамической активности и терапевтической эффективности пиперациллина/тазобактама и тикарциллина/клавуланата потенциальным компаниям-производителям на широком клиническом материале с учетом принципов доказательной медицины, чтобы оценить перспективы их более активного и обоснованного использования в лечебной практике.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Проведение рациональной эмпирической антимикробной фармакотерапии внутрибольничных инфекций должно учитывать результаты мониторинга современной этиологической структуры инфекционной патологии и текущие локальные данные фармакодинамической активности антибиотиков в отношении потенциальных возбудителей в каждом отдельном стационаре лечебно-профилактического учреждения.
- Системная эмпирическая антимикробная фармакотерапия современных внутрибольничных инфекций должна включать универсальное применение схем с максимально широким охватом потенциальных возбудителей и учетом их вероятной множественной резистентности к антибиотикам (деэскалационный режим терапии).
- Ввести регулируемое ограничение применения традиционных цефалоспоринов III–IV поколений в фармакотерапии современных внутрибольничных инфекций из-за широко распространенной среди госпитальной грамотрицательной микрофлоры продукции БЛРС.
- Для прогноза фармакодинамической активности препаратов класса бета-лактамов в качестве самостоятельного и оперативного диагностического метода использовать ПЦР-детекцию генов наиболее распространенных и клинически значимых типов бета-лактамаз у грамотрицательных бактерий.
- С учетом фармакоэкономических преимуществ вариантом стартовой эмпирической антимикробной фармакотерапии современных внутрибольничных инфекций с участием антибиотикустойчивых грамотрицательных бактерий рекомендована монотерапия цефоперазоном/сульбактамом.
- Карбапенемы (имипенем и меропенем) должны рассматриваться как средства резерва для фармакотерапии современных внутрибольничных инфекций с участием антибиотикустойчивых грамотрицательных бактерий.
- Для эмпирической антимикробной фармакотерапии современных внутрибольничных хирургических инфекций с участием антибиотикустойчивых грамотрицательных бактерий рекомендовать универсальные комбинированные схемы в отношении смешанной грамотрицательной и грамположительной микрофлоры.
- Исключить препараты гентамицина из схем системной антибиотикотерапии современных внутрибольничных инфекций как малоэффективные и заменить их амикацином. При этом рекомендовать схемы комбинированной антимикробной фармакотерапии крайне тяжелого течения нозокомиальной пневмонии с участием антибиотикустойчивых грамотрицательных бактерий: карбапенем + амикацин, фторхинолон II поколения + амикацин, ингибиторозащищенный цефалоспорин + амикацин или ингибиторозащищенный антипсевдомонадный пенициллин + амикацин.
- При современных внутрибольничных инфекциях с участием антибиотикустойчивых грамотрицательных бактерий целесообразно применять фторхинолоны III-IV поколений (левофлоксацин и моксифлоксацин) для эмпирической антимикробной фармакотерапии в случаях полимикробных инфекций (внутрибольничные хирургические инфекции, вентиляторассоциированные пневмонии).
- С учетом многолетнего практического опыта, достаточного материально-технического обеспечения и соответствующих организационно-методических возможностей организовать на базе ФГУ «Научный центр экспертизы средств медицинского применения» Росздравнадзора целевую структуру по сбору и анализу данных об оригинальных и воспроизведенных лекарственных препаратах.
