В. М. Крейтера рогова ольга юрьевна конспект
| Вид материала | Конспект |
- Перспективный план проведения мероприятий музыкального руководителя Рогова, 31.42kb.
- Казьмина Ольга Юрьевна 2009 г Содержание программа курса, 225.02kb.
- Черненко Ольга Юрьевна, архитектор-дизайнер, педагог дополнительного образования доклад, 39.73kb.
- Кондрашина Ольга Владимировна, Назаров Дмитрий Владимирович, Галкина Людмила Владимировна,, 287.36kb.
- Устюжанина Ольга Юрьевна учитель английского языка первой квалификационной категории,, 128.25kb.
- Конкурс творческих работ «Три поколения женщин: история моей семьи», 212.53kb.
- Лабунец Ольга Юрьевна мытищи 2009 г. Оглавление Введение 3 Использование видеофильмов, 263.17kb.
- Калимулина Ольга Юрьевна Председатель родительского комитета 309 11 72 заседание, 1214.06kb.
- Осипенкова Ольга Юрьевна литература, 796.82kb.
- Основной образовательной программы (уровень бакалавра) Елькина Ольга Юрьевна, доктор, 178.18kb.
10 MgBO2(OH) + 6CaSO4 •2H2O +6CO2 →
сайбелиит гипс
Ca4B10O19•7H2O + 2CaCO3 + 4MgCO3 + 6MgSO4+15H2O
Пандермит кальцит магнезит раствор
или:
MgBO2(OH) + CaSO4 •2H2O + CO2 → CaCO3 + MgSO4 +H3BO3
Безводные эндогенные бораты. Ссайбелиит MgBO2(OH) и людвигит (Mg,Fe)2Fe(BO5) Бораты этой группы генетически связаны с магнезиальными скарнами, образовавшимися на контакте доломитов с алюмосиликатными породами. Наибольшим распространением среди боратов этой группы пользуются людвигит и ссайбелиит. Вопрос о форме переноса бора в гидротермальных растворах является спорным. Большинство исследователей считают, что основной формой переноса является ион [BO3(OH)]-4, который с понижением температуры или при подкислении растворов преобразуется в простой ион BO3-3 или анионную группу B2O5-4, которые при соединении с катионами магния и железа образуют безводные бораты.
Людвигит (Mg,Fe)2Fe(BO5). Образуется совместно с магнетитом, флогопитом в магнезиальных скарнах в виде параллельных или радиально-шестоватых агрегатов или мелкозернистых масс сизо-чёрного цвета. Людвигит кристаллизуется из щелочных растворов по мере падения их щёлочности. Людвигит встречается также в кальцифирах (скарнированных доломитах) в виде отдельных призматических кристаллов.
Ссайбелиит MgBO2(OH). Образуется при разложении людвигита под действием щелочных углекислых вод при температуре 150-250 0С. Процесс замещения людвигита ссайбелиитом можно охарактеризовать следующей реакцией:
(Mg, Fe)2Fe(BO5) +2H2CO3 → MgBO2(OH)+ Fe3O4 + Fe(HCO3)2
людвигит ссайбелиит магнетит раствор
ЛЕКЦИЯ 10. Раздел 4. Соли кислородных кислот.
Класс 8. Силикаты и их аналоги (алюмосиликаты, бериллосиликаты, феррисиликаты, цирконосиликаты, боросиликаты).
Силикаты – это соли кремниевых кислот. Таких кислот в природе не существует, но их можно получить экспериментально. Это очень слабые кислоты:
H2SiO3 метакремниевая
H4SiO4 ортокремниевая
H6Si2O7 пирокремниевая
Литосфера на 75% состоит из силикатов. Если часть кремния в кремний-кислородных тетраэдрах заменена на алюминий, то это алюмосиликаты. Помимо петрогенных элементов (литофильных) – Si, Al, Ca, Na, K - в состав силикатов входят сидерофильные элементы – Fe, Mn, Ti, Co, Ni, Cr, а также халькофильные элементы – Cu, Zn, Pb ( при отсутствии S в экзогенных процессах) и атмофильные элементы – H, F, Cl. В силикатах нередки примеси редких элементов - Cs, Rb, Hf. Особо следует отметить водород, который в составе гидроксильной группы ОН входит в структуру более 50% всех силикатов и алюмосиликатов. Таким образом, силикаты могут содержать практически любые химические элементы. В качестве видообразующих в состав силикатов входят 41 элемент.
Всего насчитывается более 400-450 минеральных видов силикатов, то есть примерно 30 % названий.
С химической точки зрения силикаты – соединения, состоящие из ангидрида какой-либо из кремниевых кислот и основания какого-либо металла. Наиболее устойчивые силикаты получаются при вхождении в их состав катионов Fe2+ и Mg2+ (то есть, элементов, которые могут образовывать слабые и средние по силе основания). А наиболее слабые, неустойчивые – при вхождении в их состав катионов Na и K , так как соли последних легко гидролизуются и растворяются (диссоциируют). Поэтому в природе не образуется силикатов, образованных одновалентными щелочными металлами. Однако, совместно с двухвалентными основаниями – Ca, Ba они могут образовывать двойные соли, которые могут быть устойчивыми. Таким образом, среди устойчивых природных силикатов выделяют две группы:
1. простые силикаты, содержащие в качестве катионной группы Me2+
2. двойные силикаты, содержащие в качестве катионной группы Me2+ и Me+ или Me2+ и Me3+
В форме силикатов существуют в основном соли кальция, магния, железа, марганца, алюминия. Нередко в силикатах присутствует титан, цирконий, бериллий (т.е. своего рода дополнительные анионообразователи) и щелочные металлы, как крупные, так и мелкие типа лития и натрия. В качестве редкостей и ввиду относительно низкого кларка в виде силикатов могут существовать соединения меди, цинка, а также хрома, ванадия и др.
Общие кристаллохимические особенности силикатов.
В силикатах может проявляться двойная роль алюминия, так как он может выступать одновременно и в роли катиона, и входить в состав анионной группировки, часто замещая в нём кремний (до 30%) . При этом соотношение атомов кремния и алюминия в структуре не обязательно должно быть целым числом. Но заряды обязательно должны быть скомпенсированы (иначе устойчивой кристаллической структуры не получится).
Из-за необходимости компенсации зарядов появляется возможность вхождения в структуру дополнительных анионов, компенсирующих избыточный отрицательный заряд структуры (если в её состав вошло то или иное количество алюминия). Располагаются дополнительные анионы в наиболее крупных «пустотах» структуры и называются группы внедрения. К ним относятся O2- (сфен), F-(топаз), Cl-(актинолит), OH-(слюды), CO32- (канкринит) и другие. Часто группы внедрения определяют цвет, твёрдость, спайность и другие физические свойства минералов. Зачастую элементы групп внедрения имеют немагматическое происхождение.
Размеры элементарной ячейки силакатов зависят в основном от количества атомов кислорода, входящих в неё, так как он наибольший. Ri катионов кислорода=1,32А˚, а Ri кремния=0,39 А˚, Ri железа=0,7 А˚, Ri кальция=1,0 А˚.
У силикатов широко развит изоморфизм. Это соединения переменного состава. В силикатах «рассеиваются» многочисленные редкие элементы (с низким кларком). Существуют как изовалентные, так и гетеровалентные изоморфные ряды в силикатах:
Изовалентные c различной валентностью элементов:
+1 Li→Na→K→Rb→Cs (полевые шпаты, лепидолит)
+2 Mg→Fe→Co→Ni→Mg (гранаты, слюды, оливин, пироксены)
+3 Al→Fe→Cr→Ga→Mn (турмалин, нефелин)
+4 Si→Ti→Zr→Hf→Ge→Th (пироксены, циркон)
Гетеровалентные ряды
Li→Mg→Al
K→Ba
Fe→Si
Al→Si
Na[AlSi3O8] →Ca[Al2Si2O8]
В любом изоморфном ряду у любых минералов количество кислорода должно оставаться одинаковым, а их количество всегда должно быть большим, чем сумма атомов других элементов.
Ведущую роль как заместителя кремния играет, разумеется, алюминий. Однако кремний может замещаться также бериллием (гельвин, гадолинит), цирконием (лампрофиллит, астрофиллит), ураном (казолит, складовскит), титаном (рамзаит), бором (датолит, данбурит).
5. При различных (обычно высоких) температурах образования и при различном химическом составе у силикатов сходной структуры наблюдается различная смесимость, обычно ограниченная, что объясняется различными размерами атомов входящих в структуру элементов. «Полная» смесимость известна только в одной системе: клиноэнстатит-диопсид: Ca[Si2O6]-Mg[Si2O6].
6. С возрастанием радиуса иона увеличивается «координационное число» (КЧ=4-10) и возможность изоморфных замещений. Координационное число – это число ионов противоположного знака в ближайшем окружении иона. Координационнное число является своего рода компромиссом между силами притяжения и отталкивания. Чем оно больше, тем сильнее происходит отталкивание ионов (газ, жидкость), чем оно меньше, тем сильнее притяжение (твёрдофазные вещества).
У некоторых катионов может быть несколько координационных чисел:
Fe2+- 4 и 6;
Al3+ - 4, 5, 6;
Fe3+, Mg, Mn, Na, Zr – 6, 8;
Ca – 6, 7, 8;
K – 6, 10.
7. В ряде случаев у силикатов отчётливо проявляется полиморфизм.
Al2O[SiO4] – триклинная сингония - дистен
Al2O[SiO4] – ромбическая сингония - андалузит
Al[SiO5] - ромбическая сингония – силлиманит
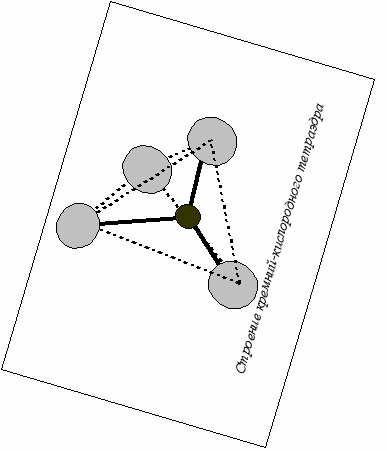
Со структурной точки зрения силикаты – очень сложные образования, что доказывается процессом их образования (полимеризация) и широко распространённым изоморфизмом. В структуре силикатов четко выделяется элементарная структурная единица – кремнекислородный тетраэдр (ККТ). В его центре находится атом кремния, а в вершинах – кислорода. Радиус ККТ равен примерно 1,6 Ǻ. Важнейшим свойством кремнекислородных тетраэдров является способность поликонденсации (полимеризации). При этом соседние тетраэдры объединяются вершинами. Между атомами кислорода и кремния существует сильная ковалентная связь. Изолированные или объединённые в группы ККТ имеют общий заряд. Например, единичный ККТ имеет заряд –4 за счёт нескомпенсированных электронов четырёх атомов кислорода (по одному у каждого). Компенсация общего заряда структуры достигается вхождением в неё атомов-катионов. Таким образом, связь в силикатах в целом можно охарактеризовать как ковалентно-ионную.
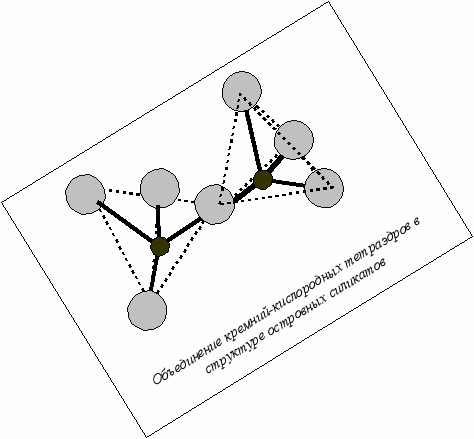
Если структура силикатов представлена одиночными ККТ, то соотношение кислорода и кремния будет равно 4: 1. Если же каждый атом кислорода принадлежит одновременно двум ККТ, то соотношение будет 2:1. Таким образом, можно получить некоторый «полимеризационный ряд», крайним членом которого будет кварц – SiO2. Поэтому некоторые исследователи рассматривают кварц не как оксид, а как силикат. Островные в своей основе имеют изолированные тетраэдры или комбинации из двух тетраэдров в виде «островов». Радикал в этом случае будет иметь формулу SiO44- или Si2O76-. Примерами таких соединений служат островные силикаты (орто- и диортосиликаты по старой номенклатуре), важнейшими представителями являются оливины R2+2 SiO4, гранаты R2+3 К3+2 (SiO4)3 (орто-), везувиан, эпидот (орто-диорто-) Ca2(Al,Fe)Al2(SiO4)(Si2O7)(O,OH) и гемиморфит Zn4(Si2O7)(OH)2•2H2O (диорто). R и К – атомы металла. Существуют островные силикаты с добавочными анионами, чаще всего с гидроксильной группой или фтором. Больше в природе распространены орто-диорто- и диортосиликаты с добавочными анионами.
Если соединить несколько тетраэдров в замкнутое кольцо, то получится основа кольцевых силикатов. В простейшем случае это тройное кольцо с радикалом Si3O96-. Удельный заряд, приходящийся на один атом кремния –2. Такие соединения очень редки. Примером может служить минерал бенитоит BaTi(Si3O9). Можно объединить в кольцо четыре кремнекислородных тетраэдра и получить четверное кольцо, при этом удельный заряд или соотношение атомов кремния и кислорода останется постоянным. Примером может служить редкий минерал баотит Ba4(Ti,Nb)8O16(Si4O12)Cl. Гораздо чаще встречаются минералы с шестерными кольцами Si6O18. Но получившиеся кольца очень большие и громоздкие. Поэтому в структуре обычно присутствуют дополнительные анионные группировки, треугольники BO3 (в турмалине и аксините), или участвуют очень мелкие и высокозаряженные катионы (например, бериллий в берилле), или часть кремния замещается алюминием, что увеличивает заряд анионной группы (в кордиерите). Примерами «чистых» кольцевых силикатов может служить диоптаз Cu(Si6O18)*6H2O. Бериллий - еще один анионообразователь (берилл имеет формулу Al2Be3(Si6O18). Турмалин содержит иные, кроме кремнекислородных, анионные группировки Na(Fe,Mg)3Al6(BO3)3(Si6O18)(OH)4.
Если тетраэдры соединить между собой в двух вершинах, то можно также получить бесконечные цепочки. Нетрудно догадаться, что простейшая цепочка будет иметь период повторяемости два тетраэдра и такая цепочка будет у пироксенов. В ней поочередно тетраэдры развернуты на 180 градусов. Формула такого радикала Si2O4-4. Самые распространенные представители цепочечных силикатов – пироксены R2+2(Si2O6). Можно из одинарных цепочек получить структурные мотивы с другим периодом повторяемости. Например тройная цепочка – волластонит Ca3 (Si3O9), пятерная цепочка у родонита CaMn4(Si5O15). Астрофиллитовая цепочка состоит из чередующихся диортогрупп и имеет формулу радикала Si4O128-.
В ленточных силикатах тетраэдры соединены в плоские ленты. Простейшим случаем является силлиманитовая лента, но в ней часть кремния замещена на алюминий. Формула радикала AlSiO53-, формула силлиманита Al(AlSiO5). Больше распространены ленты амфиболовые, с периодом повторяемости, включающем в себя четыре тетраэдра Si4O116-. В амфиболах всегда присутствуют дополнительные анионы, например гидроксильная группа или фтор Ca2Mg5(Si4O11)2(OH)2. Более сложная ксонотлитовая лента содержит шесть кремнекислородных тетраэдра в периоде повторяемости радикала. Формула ксонотлита Сa6(Si6O17)(OH)2.
Последующая поликонденсация приводит к образованию слоистых силикатов. В них основой структур является бесконечный лист, слой, в котором каждый кремнекислородный тетраэдр соединен с тремя соседями и только один неподеленный кислород. Формула радикала, таким образом Si2O5-2. Примером простейшего слоистого силиката может служить каолинит Al2(Si2O5)(OH)4.
Дальнейшая поликонденсация – образование структур, где все атомы кислорода разделены между двумя соседними кремнекислородными тетраэдрами.
Если часть кремния будет замещена алюминием, то пространственный каркас получает заряд, а природа – возможность формирования новых минералов, например полевых шпатов NaAlSi3O8.
Физические свойства силикатов и алюмосиликатов крайне разнообразны. Распространённым свойством всех силикатов является стеклянный блеск. Ряд физических свойств силикатов и алюмосиликатов тесно связан с их внутренней структурой (с особенностями структурных мотивов). Очень ярко это проявляется в таких свойствах как сингония, габитус или облик кристаллов, спайность и, частично, плотность.
Например, изометричные облики кристаллов (кубическая сингония) имеются только в островном и каркасном подклассах и составляют всего 9% минеральных видов силикатов (группа гранатов, группа лейцита). Удлинённые облики кристаллов: длиннопризматические, игольчатые, волокнистые – характерны для цепочечных силикатов и алюмосиликатов (амфиболы, пироксены). Листоватые, пластинчатые и чешуйчатые облики кристаллов низших сингоний характерны для силикатов слоевых. Коротко призматические и таблитчатые кристаллы характерны для каркасных алюмосиликатов низших сингоний. Гексагональные, тетрагональные и дитригональные призматические кристаллы типоморфны для кольцевого мотива (средние сингонии).
В целом 75% минералов рассматриваемого класса относятся к низшим сингониям. Совершенная спайность в одном направлении характерна лишь для слоевых силикатов и алюмосиликатов. Совершенная спайность в 2 направлениях (по призме или по пинакоидам), но под разными углами друг к другу типична для цепочечных, ленточных и каркасных минералов. Островные и кольцевые силикаты, не содержащие группу внедрения [OH, F] и, как правило, не обладают спайностью (гранаты, оливин, нефелин).
Плотность у каркасных силикатов и алюмосиликатов, которые содержат в своей структуре большие пустоты – низкая – 2,5. У минералов других подклассов плотность примерно 3,5 и зависит от атомного веса катионов: силикаты тория, циркония, урана, свинца обладают плотностями около 4-6,5.
Силикаты – минералы твёрдые (5,5-60, за исключением слоевых, у которых твёрдость низкая – 1,5 2.
Большинство силикатов и алюмосиликатов – бесцветные или имеют светлые аллохроматические окраски. Однако минералы, содержащие элементы-хромофоры (железо, хром, титан, марганец, никель), окрашены преимущественно в различные оттенки зелёного цвета, почти до чёрных или коричневых, либо в розовые цвета двухвалентным марганцем (родонит, спессартин, рубеллит).
ЛЕКЦИЯ 11. Подкласс 1. Островные силикаты.
Подкласс 1. Островные силикаты
Подкласс выделяется по наличию в структуре изолированных анионных группировок - одиночных или сдвоенных тетраэдров. Структурообразующий элемент тетраэдр, в центре которого находится атом Si, окруженный четырьмя атомами кислорода или группа из двух тетраэдров. Радикалы (SiO4)4- и (Si2O7)6-. Следует отметить, что А.Г.Бетехтиным выделяются два подкласса – с изолированными одиночными ККТ и с изолированными группами ККТ (сдвоенными, а также объединёнными в кольца). Мы будем рассматривать островные силикаты как с одиночными ККТ, так и со сдвоенными ККТ в едином подклассе островных силикатов. С другой стороны, ряд сходных черт структуры и физических свойств силикатов с объединёнными в кольца ККТ позволяет выделить их в самостоятельную группу - подкласс кольцевых силикатов.
В структурах минералов, относимых к данному подклассу, возможны различные сочетания ККТ (единичных и сдвоенных), а также добавочных анионов, что позволяет также группировать островные силикаты по указанным признакам.
Островные силикаты (ортосиликаты и диортосиликаты) – по происхождению являются минералами преимущественно эндогенными, высокотемпературными. Некоторые из них – исключительно магматические, большинство полигенные. К экзогенным относится, например, каламин (диортосиликат).
1. Ортосиликаты без добавочных анионов
Группа оливина. (Fe, Mg)2[SiO4]. Непрерывная изоморфная серия от фаялита до форстерита. Существует также марганцевый член группы оливина – тефроит Mn[Si2O6], смесимость которого с основными членами ряда ограничена. Смесимость с кальцием ограничена, однако существует изоморфный ряд т.н. монтичеллитов, в котором кальций с одной стороны и магний и железо – с другой стороны распределены упорядочено.
Оливины-фаялиты – породообразующие минералы магматических пород ультраосновного (дуниты, перидотиты) и основного (габбро, базальты) составов. Из ультраосновных бедных кремнезёмом и высокомагнезиальных расплавов кристаллизуются высокомагнезиальные оливины, состоящие из форстеритовой молекулы на 82-92 %. Из основной базальтовой магмы кристаллизуются более железистые оливины - 55-81% форстерита, характерные для габброидных пород. Железистые оливины состава 5-15% форстерита встречаются в некоторых, относительно редких субщелочных породах, которые образуются в специфических условиях. Чистые члены изоморфного ряда вообще не могут образовываться при кристаллизации магматических расплавов, так как находящиеся одновременно в расплаве магний и железо способны неограниченно замещать друг друга в решётке оливина.
Оливин-фаялит – раннемагматический и бедный кремнезёмом минерал. Присутствует в ультраосновных породах, том числе в породах с повышенной щёлочностью. Соотношение магния к кремнию в нём равно 2:1. На кристаллизацию оливина используется мало кремнезёма из расплава, поэтому магма постепенно обогащается кремнезёмом. Их такого расплава по мере его охлаждения начнут кристаллизоваться моноклинные и ромбические пироксены (Mg,Fe)2[Si2O6] и Ca(Mg,Fe)[Si2O6] – минералы более богатые кремнезёмом. В них соотношение магния к кремнезёму равно 1:1. Так образуется характерный парагенезис оливина с пироксенами.
Магнезиальные оливины обычно ассоциируют с ромбическими пироксенами – энстатитами и акцессорным хромитом. Железистые оливины сопровождаются не только железистыми пироксенами, но и моноклинными кальциевыми – авгитом Ca(Mg,Fe,Al)[(Al,Si)2O6] и диопсидом CaMg[Si2O6] и кальциевыми плагиоклазами. В некоторой зависимости от состава оливинов находится тип магматического оруденения. Например, с магнезиальными оливинами связано хромитовое и медно-никелевое оруденение, а с более железистыми - титаномагнетитовое.
С особой ультраосновной магмой, обогащённой щелочами и углеродом, связано формирование алмазоносных кимберлитов – пород, в которых главным породообразующим также является оливин, сопровождаемый пироксенами и типоморфными акцессорными минералами – флогопитом, ильменитом и пиропом.
В состав оливина всегда входят изоморфные примеси никеля, кобальта, марганца в десятых и сотых долях процента. Поскольку оливин – раннемагматический минерал, то он обычно подвергается изменению. Под влиянием поздних гидротермальных углекислых растворов, отделившихся от магмы, оливин может замещаться серпентином, а иногда хризотил-асбестом или тальком и карбонатами. Таким образом, исходные породы (дуниты и перидотиты) являются материалом для образования месторождений талька и хризотил-асбеста.
Форстерит не может кристаллизоваться из магмы (мешает железо). Этот минерал безводный (следовательно, высокотемпературный) и высокомагнезиальный, следовательно, для его образования необходима высокомагнезиальная среда. Таким образом, форстерит – контактово-метасоматический минерал. Он образуется на контакте доломитов с гранитоидными интрузиями, где под влиянием высокотемпературных растворов образуются магнезиальные скарны. Форстерит является породообразующим минералом скарнов и возникает в щелочной среде при температурах 500оС. Вместе с форстеритом и шпинелью могут также образовываться диопсид, клиногумит и флогопит.
Магнезиальные скарны образуются не только на контакте доломитов с гранитоидными интрузиями, но также за счёт плагиоклазовых гнейсов в кислой среде:
Ca[Al2Si2O8]+Na[AlSi3O8](средний плагиоклаз) +11,5MgCl2(раствор) +10H2O =
5Mg2[SiO4] (форстерит) + 1,5,MgAl2O4(шпинель) + CaCl2 +NaCl + 20HCl
Форстерит может также образовываться в процессе регионального метаморфизма карбонатных пород, загрязнённых кремнезёмом по реакции:
СaMg(СO3)2 (доломит) + SiO2 (кварц) =Mg2SiO4 (форстерит)+CaCO3 +2CO2.
Тефроит стоит особняком и образуется в метаморфитах по первично-осадочным марганецсодержащим породам.
Оливин практически не используется за исключением ювелирной промышленности (хризолит). Добывается из кимберлитов или россыпей попутно с алмазами.
