Учебное пособие министерство Российской Федерации по связи и информатизации Санкт-Петербургский государственный университет телекоммуникаций им проф. М. А. Бонч-Бруевича
| Вид материала | Учебное пособие |
- Федеральное агентство связи санкт-петербургский государственный университет телекоммуникаций, 30.2kb.
- Федеральное агентство связи санкт-петербургский государственный университет телекоммуникаций, 39.82kb.
- М. А. Бонч-Бруевича Кафедра опдс бочелюк Т. В., Доронин Е. М. «Назначение и примеры, 612.04kb.
- Петербургский Государственный Университет телекоммуникаций им проф. М. А. Бонч-Бруевича, 55.39kb.
- «мобильная связь», 49.1kb.
- Название доклада: универсальный, 63.37kb.
- Проблемы формирования учебно-методического комплекса, 151.02kb.
- Название учреждения, 806kb.
- Дорогие друзья и коллеги!, 15.57kb.
- Федеральное агентство связи государственное образовательное учреждение, 361.18kb.
3.2. Электрохимические
Субстратом или продуктом ферментативной реакции часто является соединение, распадающееся на ионы.
Для измерения концентраций, свойств и состава таких веществ в качестве ИП используются электрохимические ячейки:
| Электронный проводник А | Электролит В | Диссоциирующее вещество C | Электролит D | Электронный проводник E |
В ячейках вещество С распадается в растворе на разнополярные ионы, образующие электролиты B и D. Концентрация ионов пропорциональна концентрации вещества в растворе. В ячейку погружены два электрода A и E из проводников с электронной проводимостью.
В различных типах электрохимических ИП получают зависимость между электрическими параметрами электродов и концентрацией анализируемого вещества (аналита) в ячейке.
При этом требуется учитывать основные электрохимические эффекты:
- возникновение на границах разных фаз (металл – электролит, исходное вещество – электролит) электрохимических потенциалов;
- зависимость величины потенциалов от температуры;
- возникновение на границах фаз двойных заряженных слоев, обладающих емкостью, подобно плоскому конденсатору (поэтому ячейка с веществом и электродами может быть описана эквивалентной схемой в виде резистивно-емкостной цепи);
- изменение величины потенциала между металлом и электролитом при протекании тока через электроды (эффект поляризации электродов);
- изменение величины тока, обусловленное разной шероховатостью электрода, т. е. его площадью контакта с электролитом;
- изменение потенциала электрода при окислении его электролитом;
- возникновение эффекта электролиза (выделения ионов в виде вещества на электроде) при протекании постоянного тока через раство, что уменьшает концентрацию ионов в растворе.
Для уменьшения эффекта окисления вещества электродов электролитом их выполняют из благородных металлов (платины, золота). Электроды всегда полируют, обеспечивая максимально гладкую поверхность. Чтобы минимизировать влияние температуры, все электрохимические измерения проводят в условиях термостатирования.
В данном разделе будет рассмотрен ряд электрохимических ИП, применяемых для разработки БСС. Более подробный перечень электрохимических ИП приведен в [28].
3.2.1. Кондуктометрические
Полное электрическое сопротивление (импеданс) электролита на переменном токе включает активную составляющую, обусловленную его проводимостью – величиной, обратной электрическому сопротивлению, и реактивную – емкостную.
Метод кондуктометрии основан на измерении активной составляющей импеданса аналита [28]. Обычно в одно плечо измерительного моста включают электрохимическую ячейку, а в другое – регулируемое сопротивление и переменный конденсатор для минимизации емкостного эффекта.
Сопротивление ячейки измеряется путем уравновешивания плеч моста Вина, когда ток в диагонали моста равен нулю.
На плечи моста подают переменное напряжение небольшой амплитуды, чтобы не произошло поляризации электродов.
Проводимость раствора электролита описывается как
G = f (åz i С i m i ),
(43)
где zi – заряд i-го иона, С i – его концентрация, mi – его подвижность. БО моделируются частицами, удельная проводимость которых (gБО) несколько ниже, чем культуральной среды (gс). Таким образом, микроорганизмы в электролите уменьшают его проводимость.
Проводимость взвеси Gв с БО в среде выражается формулой
GВ = f (CБО,gБОi/gс, m БО),
(44)
где CБО, mБО – концентрация и подвижность БО i-го вида соответственно.
Кондуктометрические и импедансометрические ИП используют для контроля самых разных биологических реакций [18].
а) Измерение концентрации БО. Фирмами разных стран разработана специализированная аппаратура для измерения роста популяций БО (бактерий, мелких инфузорий, микроскопических водорослей). Наиболее известной подобной системой кондуктометрического типа является многоканальная БСС фирмы Malthus АТ для определения качества воды и продуктов (фирма Malthus) с БХП на основе популяций бактерий. Качество измерения обеспечивается мало окисляющимся материалом электрода (керамика с золотым покрытием) и сложной системой термостабилизации.
Необходимо учитывать, что на проводимость взвесей бактерий могут оказывать влияние солевой состав бульонов и выделение микроорганизмами продуктов метаболизма.
б) Контроль ферментативных реакций. В СССР для обнаружения фосфорорганических соединений была разработана кондуктометрическая БСС «Фермент-1» с БХП на основе фермента ацетилхолинэстэразы (пп. 1.3.1, 2.5.1).
в) Контроль иммунных реакций. Разработана экспериментальная кондуктометрическая БСС для анализа иммунных реакций с БХП на основе комплекса биомолекул антиген–антитело (п. 2.5.5). Каждый из элементов БХП моделируется эквивалентной электрической емкостью. Емкость комплекса антиген–антитело за счет последовательного их соединения меньше, чем емкости биомолекул. В результате иммунной реакции возникает уменьшение величины тока во времени:
i(t) = (U/RS) exp(–t/RS CIC),
(45)
где U – разность потенциалов между электродами, RS – сопротивление раствора, CIC – емкость двойного электрического слоя иммунокомплекса.
Идеально гладкие электроды помещаются в проточную ячейку с расстоянием между ними всего 100 мкм. На электроды подается напряжение 50 мВ частотой 750 кГц. Продолжительность измерения 2 мс.
Информативными характеристиками при кондуктометрии биологических веществ являются не только значения проводимости или тока, но и частотный спектр колебаний сигнала.
3.2.2. Потенциометрические
Потенциометрия основана на измерении разности электродных потенциалов, возникающей на границе электрод–электролит [22, 28, 30]. При этом потенциал одного из них (электрода сравнения) не зависит от измеряемого фактора, а потенциал второго (рабочего электрода) изменяется при воздействии на него аналита.
Электрохимический потенциал Е имеет электрохимическую и термодинамическую природу. Его зависимость от концентрации одного вида иона описывается законом Нернста:
E = E0 – (RT/zF) lnQ,
(46)
где E0 – величина потенциала в стандартных условиях (при T=298 °C и давлении 760 мм рт. ст.); R – газовая постоянная; T – температура электролита; z – заряд (валентность) иона; F – постоянная Фарадея (равная количеству электричества, которое приводит к выделению на электроде 1 моля одновалентного иона); Q = aв/ aок, где aв и aок – активности восстановленной и окисленной формы диссоциированного вещества соответственно.
В разбавленных растворах величина Q пропорциональна концентрации С вещества.
В результате окисления и восстановления исходных веществ образуется свободная энергия, которая расходуется на изменение потенциала рабочего электрода. Ионы движутся (диффундируют) к электроду и восстанавливаются на нем или окисляются, соответственно забирая или отдавая электроны. Стабильное значение потенциала возникает при равновесной реакции, т. е. когда в ней поддерживается равновесие между процессами выделения вещества на электроде и диффузии ионов. Ток через ячейку для сведения к минимуму эффекта поляризации должен быть близок к нулю.
Измерительный электрод в БСС всегда предназначен для выделения из раствора только необходимого иона из смеси, т. е. выполняется ион-селективным. Эти свойства достигаются благодаря применению мембран, пропускающих одни элементы и связывающие или задерживающие другие.
Наиболее часто в БСС используют в качестве ИП следующие типы ионоселективных потенциометрических преобразователей: электроды и полевые транзисторы для анализа ионов в жидкостях и газах.
a) Ион-селективные электроды. Логарифмическая зависимость между величиной потенциала и активностью ионов (46) позволяет создавать аналитические приборы с большим диапазоном измерения.
Наиболее распространен рН– электрод, селективный к ионам водорода (pH = –lg[H+], где [H+] – активность ионов водорода). Если определяется только один вид иона и существует электрохимическое равновесие между электродом и раствором, то при стандартных условиях потенциал электрода (46)
E = E0 + 0,05915 lg[H+]
(47)
б) Ион-селективные полевые транзисторы (ИСПТ). Полевой транзистор управляется напряжением, подаваемым на затвор. В ИСПТ затвор является ион-чувствительным [30] в результате того, что на него нанесен дополнительный слой, селективный к ионам с помощью таких соединений как Al2O3, Ta2O5, Si3N4 (рис. 9). Тогда выражение для тока стока приобретает вид
iс = k(Uз – Uп – aUэ–д + const)2,
(48)
где Uз – потенциал затвора; k – коэффициент, определяемый параметрами ион-селективного слоя, a – коэффициент, характеризующий химическую чувствительность мембраны, Uп – пороговое напряжение затвора, Uэ–д – потенциал на границе электролит–диэлектрик, который, подобно pH-электроду, линейно зависит от логарифма концентрации ионов водорода:
Uэ–д = (RT/F) lg[H+].
(49)
в) Газочувствительные электроды. В этих электродах над газовой мембраной размещен тонкий слой промежуточного раствора, изменяющего свои свойства в зависимости от концентрации газа, что воспринимается ион-селективным электродом [3, 28].
г) Газочувствительные полевые транзисторы (ГЧПТ). Свойство металла палладия поглощать водород и катализировать его расщепление было использовано [3] для разработки газочувствительного полевого транзистора.
На границе затвора образуется слой ионов водорода, которые приводят к изменению тока стока транзистора. В присутствии кислорода атомы водорода вступают в реакцию, что уменьшает толщину их слоя, поэтому с помощью транзистора можно измерять концентрацию как водорода, так и кислорода.
Показано [3], что ГЧПТ могут катализировать расщепление сероводорода, аммиака, метана и бутана.
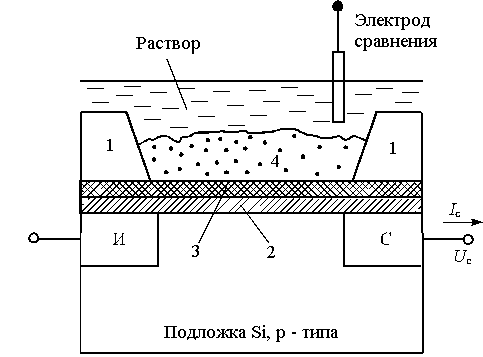
Рис. 9. Схематическое изображение pH - чувствительного полевого транзистора и БСС на его основе:
Si - кремниевая подложка p - типа, И, С - зоны истока и стока;
1- изолирующее покрытие, 2 - диэлектрик из двуокиси кремния;
3 - химически чувствительная мембрана, 4 - иммобилизованный БО;
Ic, U3, Uc - ток стока, подаваемые потенциалы затвора и стока

Рис. 10. Схематическое изображение БСС на основе светочувствительного транзистора: 1 - электрод сравнения, 2 - фоточувствительная мембрана, содержащая фотохромный краситель и ионофор, 3 - светозащитный экран.4 - внутренний электролит, 5 - герметизирующее кольцо.6 - раствор, содержащий измеряемые соединения
д) Светоуправляемые полевые транзисторы (СУПТ). Мембрану затвора полевого транзистора модифицируют фоточувствительными красителями, претерпевающими обратимые фотопревращения, сопровождающиеся изменением их зарядов (рис. 10). Существенной особенностью новых типов ИП является возможность изменять их состояние внешними источниками излучения. Например, УФ-излучение вызывает генерацию потенциала. Фотоиндуцированный потенциал может быть функцией состава электролита, наличия субстратов ферментативных реакций. При освещении мембраны импульсами УФ-излучения измеряют импульсный ток стока транзистора, который зависит от концентрации ионов. Это позволяет простыми методами создавать высокочувствительные миниатюрные БСС, а за счет быстрой замены мембраны с биослоем и красителями настраивать ИП на анализ широкого спектра биологически активных соединений.
Потенциометрические ИП используются в различных видах БСС.
а) Ион-селективные электроды с ферментными и клеточными БХП [45, 48–50, 65]. При ферментативных реакциях дыхания в результате переработки субстратов выделяются газы (пп. 2.3.1, 2.5.1). Пропускание некоторых газов через водный раствор приводит к появлению кислот и понижению значения pH.
Ферментные pH – электроды обычно включают:
- трубку с полупроницаемой мембраной;
- ферменты или организмы, иммобилизованные на мембране;
- полупроницаемую мембрану для измеряемого газа;
- слой водной среды с буферным раствором (для минимизации колебаний pH);
- ИП на основе pH-электрода.
Электрод погружают в аналит (п. 3.2) и через 30–60 мин фиксируют изменение pH. С помощью таких электродов можно оценивать активность соответствующих ферментов и воздействие на нее загрязнений среды. Недостатком их является малый срок службы – около 100 ч.
Помимо электродов, селективных к ионам водорода, разработаны [28] электроды, селективные к ионам Na+, K+, Cu+, Pb2+, Cd2+, F–, Cl–, Br–, J–.
б) Ион-селективные транзисторы с БХП на основе ферментов, организмов и комплекса антиген-антитело [30, 67]. На ион-селективном слое, нанесенном на затвор, иммобилизируют фермент или микроорганизмы и измеряют ток транзистора. На основе pH-чувствительных ИСПТ созданы опытные модели БСС на ацетилхолинэстреразу (п. 1.3.1), хлороароматические уксусные кислоты, ионы Na+. ИСПТ позволяют создавать БСС для определения пестицидов, иммуноглобулина, микробных клеток (в этом случае на мембране ИСПТ иммобилизуют антитела или клетки бактерий, меченые антителами ). В перспективе такиие БСС могут составить конкуренцию иммуно-ферментному анализу (п. 2.5.6).
ИСПТ выпускаются АО «Авангард» (РФ), фирмой IMT (Швейцария).
в) Газочувствительные электроды с ферментными БХП [3]. Эти ИП позволяют упростить конструкцию рассмотренных выше ферментных электродов, и измерять концентрацию таких газов, как CO2, NH3, Cl2.
Наиболее распространены при проектировании БСС электроды фирмы ORION RES. CORP.
Таблица 7
БСС с газочувствительными и ион-селективными электродами [3]
| Вид ИП | Определяемый субстрат/фермент |
| NH3 | Мочевина, аминокислоты, глутамин, нитраты, нитриты, креатинин/ лиазы, деаминазы |
| CO2 | Мочевина, аминокислоты/ декарбоксилазы |
| pH | Пенициллин, РНК, ДНК, глюкоза /ферменты, катализирующие реакции с изменением pH |
| J– | Глюкоза, аминокислоты, холестерин, спирты |
г) Газочувствительные транзисторы (ГЧПТ) с ферментными БХП [3]. Этот тип БСС применяют для измерения активности дегидрогеназ цикла Кребса (п. 1.2.2), отщепляющих водород, для определения кислорода и метана и для оценки активности ферментов анаэробного брожения.
д) Светоуправляемые транзисторы (СУПТ) с ферментными БХП. Данный тип ИП используют для проектирования БСС, чувствительных к иону аммония. Подобные БСС разработаны для оценки активности уреазы, фермента, катализирующего гидролиз мочевины до аммиака и углекислоты [30].
Перспективность полевых транзисторов обусловлена в первую очередь их сравнительно малыми размерами, возможностью смены биопленок, хорошей воспроизводимостью результатов, исключительно высокой чувствительностью, низкой ценой при массовом производстве.
3.2.3. Амперометрические
В ИП измеряют сверхмалый ток электрохимической ячейки, возникающий вследствие окисления или восстановления электрохимически активных веществ на поверхности рабочего электрода при подаче напряжения между рабочим электродом и электродом сравнения [22, 28, 34]. Этот метод позволяет измерять не только концентрацию ионов, но и растворенных газов, так как для амперометрии достаточно, чтобы на электроде мог восстанавливаться или окисляться хотя бы один из реагентов или продукт реакции.
Считается, что концентрация реагента линейно уменьшается в приграничном к поверхности электрода слое от значения С на расстоянии L от электрода до нуля на самом электроде, где он восстанавливается или окисляется. Ионы движутся за счет диффузии, характеризуемой коэффициентом диффузии D, и каждый ион переносит z электронов к электроду.
Толщина слоя L считается постоянной. Для выделения одного вида иона применяют ион-селективные мембраны.
Предельный ток диффузии определяется формулой Коттрела:
i Д = zF Aэ DC /L,
(50)
где Aэ – площадь электрода, F – константа Фарадея (п. 3.2.2). Таким образом, диффузионный ток пропорционален концентрации вещества.
За счет одного процесса диффузии ток нарастает крайне медленно. Чтобы увеличить скорость электрохимической реакции, перемешивают аналит или вращают электроды, в результате чего уменьшается толщина диффузионного слоя L. Это особенно важно в случае использования веществ с малыми скоростями диффузии. Диффузионный ток iд для вязких органических соединений:
iд = k n–5/6,
(51)
где k – константа ИП, n – коэффициент вязкости вещества:
Перенос электронов может быть ускорен за счет увеличения разности потенциалов между электродами, но существенно повышать ее опасно, так как может произойти электролитическое разложение самого аналита. Более эффективен метод использования медиаторов (посредников в переносе электронов) (п. 2.5.1).
Для увеличения скорости диффузии также применяют микроэлектроды, в которых диффузия происходит не через плоский слой (50), а радиально через сферу, центр которой находится на электроде. В результате скорость реакции увеличивается и стабилизируется. Поэтому данные модификации электродов открывают новые возможности в области создания БСС.
Амперометрические ИП используют в БСС медицинского и экологического назначения.
а) Определение глюкозы в крови. Согласно статистике примерно 5% взрослого населения развитых стран являются диабетиками. Для контроля глюкозы в крови все шире применяют БСС (табл. 8, [25]) на основе ферментативной реакции окисления глюкозы (2.5.1) с поглощением O2 или выделением H2O2.
ИП для этой цели (электрод Кларка, рис. 11, [6]) состоит из из следующих элементов:
- стакана для тестируемого раствора;
- погружной трубки;
- полупроницаемой мембраны;
- биослоя с ферментом;
- ион-селективного амперометрического электрода, регистрирующего или уменьшение концентрации О2, или увеличение H2O2.
Для измерения тока используются амперометрические приборы фирм «ORION» и Ingold, имеющие диапазон измерений 10–8–10–11А [30].
Кислородный амперометрический ИП фирмы «ОRION» содержит небольшой объем электролита, в который помещены измерительный микроэлектрод из платины и электрод сравнения [28]. На микроэлектроде поддерживают постоянный потенциал приблизительно 0,8 В относительно электрода сравнения. При этом измеряется ток электрохимической ячейки. Внешний аналит, в котором необходимо определять концентрацию кислорода, и электролит ИП разделены мембраной, проницаемой для кислорода. Электродом сравнения служит каломельный электрод (Hg2Cl2).
Отечественные БСС для амперометрического измерения концентрации глюкозы и аминокислот описаны в [20, 35, 36, 46].
Возможно применение ион-селективного электрода для определения пероксида водорода. Такой метод чувствительнее в 100–1000 раз.
Ток ячейки пропорционален концентрации иона C:
I = k C,
(52)
где k – коэффициент ИП, зависящий от площади рабочей поверхности измерительного электрода, диффузии ионов, pH и температуры (см. введение к п. 3.2).
Задача построения глюкозоанализаторов не исчерпывается проектированием чувствительных ИП. При измерении концентрации глюкозы в цельной крови возникает ряд сложных проблем, для устранения которых требуется искать различные методические и конструкторские решения.
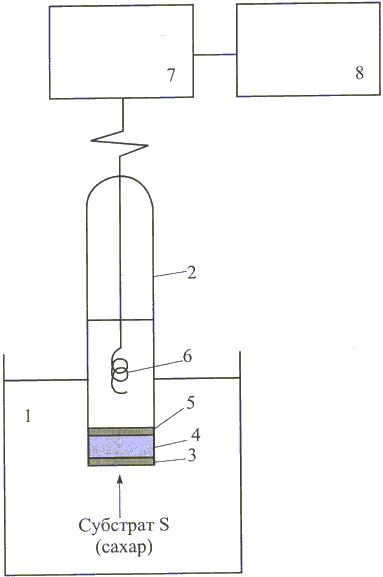
Рис. 11. Схема работы электрода Кларка ( глюкозного биосенсора):
1 - исследуемый раствор, 2 - корпус биосенсора, 3 - внешняя мембрана, 4 - слой глюкозооксида, 5 - внутренняя газопроницаемая мембрана, 6 - платиновый электрод (проволока) для восстановления кислорода, 7 - усилитель сигнала, 8 - самописец ( дисплей, цифровой или световой указатель и т. д. ) [6]
Таблица 8
Глюкозоанализаторы [3]
| Фирма, прибор | Диапазон концентраций, ммоль/л | Объем пробы, мкл | Частота измерений, проб/ч | Погрешность, % | Стабильность |
| Неавтоматизированные анализаторы | |||||
| «Эксан Г» Россия | 0,5...30 | 50 | 60 | 5 | |
| Yellow Springs Instruments (США), модель 23А | 0,5...50 | 25 | 40 | 2 | 300 измерений |
| Seres (Франция), Enzymat | 1...22 | 200 | 60 | | 500 измерений |
| Solea-Tacussel (Франция), глюкозный электрод | 0,0001...1,0 | | | 2 | 1000 измерений |
| Hoffman la Roshe (Швейцария) Глюкозоанализатор 5410* | 2,.5...27,5 | 100 | tизм 60 с | 1,5 | 8 нед. |
| Fuji Electric (Япония), Gluco 20A | 0...27 | 20 | 20 | 3 | 500 измерений |
| Analytical instruments (Япония) Glucorder-E | 0...55,5 | 20...40 | 120...150 | 2,0 | |
| Автоматические проточные анализаторы | |||||
| Daiichi (Япония), Auto&Stat GA1110 | 1...40 | 100...250 | | 1.0 | |
| Карлов университет (Чехия) | 0.006...5,0 | | 60 | 3,5 | 30 дн. |
| Приборы непрерывного действия | |||||
| Life Science Instr, Div. Miles (США, Биостатор GCIIS | до 27,5 | | 2 мин | 5 | 50 ч |
| Университет г. Осака, медицинский факультет | 2,85...22,0 | | | | 3 дн. |
Во всех глюкозоанализаторах использован фермент глюкозоксидаза.
* Дополнительно используется медиатор для переноса электронов.
В биологических препаратах присутствуют вещества, которые влияют на выход продукта реакции H2О2 (аскорбиновая кислота, мочевая кислота и т. п.). Для сведения к минимуму этого эффекта иногда мембранам электродов сообщают заряд, отталкивающий мешающие вещества.
Необходимо учитывать, что концентрация глюкозы в пробе крови за 2 ч понижается на 20 %. В целях стабилизации содержания глюкозы пробу крови подвергают гемолизу (разрушению эритроцитов солевым раствором за счет осмотического давления).
б) Оценка действия целлюлозных ферментов. Для измерения активности целлюлаз, катализирующих разложение целлюлозы применяются амперометрические ИП с вращающимися платиновыми электродами, запаянными в стеклянную трубку (скорость вращения около 600 об/мин). При понижении вязкости растворов целлюлозных полимеров ток ИП увеличивается.
