Учебное пособие министерство Российской Федерации по связи и информатизации Санкт-Петербургский государственный университет телекоммуникаций им проф. М. А. Бонч-Бруевича
| Вид материала | Учебное пособие |
- Федеральное агентство связи санкт-петербургский государственный университет телекоммуникаций, 30.2kb.
- Федеральное агентство связи санкт-петербургский государственный университет телекоммуникаций, 39.82kb.
- М. А. Бонч-Бруевича Кафедра опдс бочелюк Т. В., Доронин Е. М. «Назначение и примеры, 612.04kb.
- Петербургский Государственный Университет телекоммуникаций им проф. М. А. Бонч-Бруевича, 55.39kb.
- «мобильная связь», 49.1kb.
- Название доклада: универсальный, 63.37kb.
- Проблемы формирования учебно-методического комплекса, 151.02kb.
- Название учреждения, 806kb.
- Дорогие друзья и коллеги!, 15.57kb.
- Федеральное агентство связи государственное образовательное учреждение, 361.18kb.
2.4. Методы подготовки структур организмов
2.4.1. Выделение веществ из тканей и клеток
Чтобы выделить необходимые вещества из тканей и клеток, необходимо разрушить их оболочки, в результате чего образуется смесь из макромолекул и органелл. При этом требуется сохранить жизнеспособность биологических объектов [5].
Культивирование тканей. В подразд. 2.2 были рассмотрены проблемы культивирования микроорганизмов. Ткани также выращиваются в специальных питательных средах, но их жизнеспособность труднее поддерживать искусственно.
Некоторые клетки ткани, например лейкоциты периферической крови, приобретают способность к делению и созданию клона вне организма при добавлении в питательную среду белково-полисахаридного препарата ФГА.
Этот метод культивирования применяется для исследования хромосом.
Гомогенизация (с греч. «однородный»). Это метод образования однородного вещества из тканей и клеток. В простейшем виде процесс представляет собой механическое растирание клеток. Применяется также ультразвуковое разрушение оболочек клеток.
Для успешного выделения ферментов из клеточного содержимого необходимо очень тонкое измельчение исходного материала, вплоть до разрушения субклеточных структур: митохондрий (п. 1.2.2), ядер и др., которые содержат в своем составе многие ферменты. Особое внимание при выделении ферментов уделяют проведению всех операций в условиях, исключающих денатурацию белка, так как она всегда связана с потерей ферментативной активности. Этому способствует проведение операций в присутствии защитных добавок и при температуре много ниже температуры денатурации (п. 1.1.2).
Осмотическое разрушение. Создается методом изменения осмотического давления, которое возникает при диффузии солевого раствора через полупроницаемые мембраны клетки. Если давление внутри клетки больше чем снаружи (концентрация соли во внешней среде меньше, чем во внутренней), она распухает и взрывается, если наоборот – сдавливается.
2.4.2. Очистка веществ
Процедура очистки включает разделение веществ (РВ) на фракции. Эти методы необходимы для получения субклеточных структур, белков, нуклеиновых кислот. Из смеси ферментов или белков требуется оставить только один. Задача выделения чистых белков одна из самых сложных. Для ее решения применяется целая группа методов РВ.
РВ по растворимости. Процесс частичного разделения вещества с помощью растворителя, в котором по-разному растворимы различные составляющие вещества, называется экстракцией. Широко распространен метод РВ экстракцией глицерином или спиртами, при котором сохраняются нативные, т. е. природные свойства ферментов.
РВ по устойчивости к рН и температуре. Смесь доводят до уровней pH и температур, при которых одни органеллы и макромолекулы разлагаются, а другие сохраняют жизнеспособность. Особенно удобно с этой точки зрения выделять из смеси белков структуры термофильных бактерий (п. 1.1.2), которые не коагулируют при температуре выше обычной. Это позволяет после нагрева до температуры 50…55 °C легко выделить белки только данных организмов.
РВ по плотности. Метод основан на центрифугировании (п. 2.2.6) клеточных структур.
Например, для разделения нуклеиновых кислот в их смесь добавляется хлористый цезий, создающий при центрифугировании распределение плотности по высоте. После окончания центрифугирования нуклеиновые кислоты в зависимости от плотности образуют слои в пробирке, всплывшие на разную высоту. Освещая пробирку ультрафиолетом, различные нуклеиновые кислоты выявляют за счет полосы поглощения их азотистых оснований (п. 2.5.5).
РВ по заряду. Белки обладают зарядом (п. 1.1.2), величина и знак которого меняются в зависимости от кислотности среды. Этот эффект лежит в основе электрофореза – разделения белков по знаку заряда при приложении высокого постоянного напряжения к среде с известным рН, содержащей белки. В этом случае разноименно заряженные белки движутся к разным электрическим полюсам.
РВ по размерам молекул. При пропускании веществ через ультрафильтры с размерами пор в десятки (сотни) мкм задерживаются более крупные, а проходят менее крупные молекулы белков.
РВ по подвижности компонентов. На данном принципе основан метод хроматографии. В первых хроматографах, разработанных А.Я. Данилевским, жидкое вещество пропускалось сверху вниз через длинную трубку (колонку), заполненную пористым сорбирующим веществом. Более подвижные компоненты из смеси проходили вниз, а менее подвижные оставались наверху. В качестве пористого вещества часто используют волокнистую бумагу или целлюлозу. Для выделения сорбированных белков их затем вымывают из пористого материала веществом-растворителем (элюэнтом), не повреждающим живое
РВ по видам ионов. Иногда в качестве хроматографического сорбента применяют ионообменные смолы, которые позволяют задерживать вещества с определенными ионами.
РВ белков по сродству с антигенами или антителами. Для очистки и стандартизации антител используется аффинная (с греч. «сродство») хроматография [5, 32]. Она основана на свойстве связывания антител антигенами (пп. 1.2.4, 2.5.6).
Антитела – это белки иммуноглобулины, вырабатывающиеся организмом в ответ на иммунизацию организма – введение антигена (вирусов, чужеродных бактерий) в кровь, мышцу лабораторных животных, птиц. Антитела появляются не только в крови у животных, но и в желтках яиц, снесенных иммунизированными птицами.
Иммунный ответ на введение одного антигена сопровождается синтезом антител, различающихся по структуре и функциям. Это иммуноглобулины (Ig) пяти классов (G, D, E, A, M), которые связывают различное число молекул антигена. У молекулы или бактерии существуют отдельные участки (антигенные детерминанты), которые и вызывают образование антител.
Принцип аффинной хроматографии состоит в том, что смесь белков, например, капля крови иммунизированного животного, в которой находятся белки-иммуноглобулины (антитела) пропускается через колонку с полисахаридными шариками, к которым прикреплены определенные антигены (п. 1.2.4). Они связывают из всех белков только специфические антитела, т. е. иммуноглобулины, которые имеют наибольшее сродство к данным антигенам. Связанные антитела затем вымывают из колонки кислым или щелочным раствором. Один цикл аффинной хроматографии позволяет очистить белки в 1000 раз и более (выделить 1 вид белка из 1000).
Для расширения круга объектов аффинной хроматографии было изучено, какие объекты могут являться антигенами. Оказалось, что антигенами могут быть клетки микроорганизмов, вирусы, белки, полисахариды. Они называются полноценными, так как вызывают выработку антител сами по себе. Были открыты неполноценные антигены (гаптены), которые сами не вызывают появления антител, но если их осадить на белок или биополимеры, то они становятся иммуногенными. Таким способом получают антитела к антибиотикам, витаминам, гормонам, лекарственным препаратам. Для выделения подобных антител их пропускают через колонку с гаптенами, осажденными на гормонах и других веществах, превращенных в антигены.
Нуклеиновые кислоты не вызывают появления антител, однако антитела к ним синтезируются, если они находятся в комплексе с белками. Антигенными детерминантами нуклеиновых кислот являются их участки – три- и тетрануклеотиды.
Возможно, наоборот, осадить на сорбенте колонки антитела и выделять антибиотики, гормоны, комплексы белков с нуклеотидами и др. антигены.
Биотехнологические методы очистки органических веществ постоянно обновляются и модернизируются.
2.4.3. Модификация
Наиболее распространенный способ модификации субклеточных структур и веществ – иммобилизация (п. 2.2.6).
Для защиты от вымывания часто применяют химические методы иммобилизации БО, основанные на их «пришивании» к поверхности химическими связями. Подобными методами производят иммобилизацию ферментов, антигенов или антител. Немодифицированные субклеточные структуры в биотехнологии используются крайне редко.
2.5. Биологические вещества и структуры, применяющиеся для биохимических преобразователей
2.5.1. Ферменты
Несмотря на всю сложность получения ферментов и малый выход очищенного ферментного белка (доли миллиграммов на грамм исходной биомассы – менее 0,1%) они остаются наиболее распространенными БО для БХП, так как позволяют решать аналитические задачи выделения веществ из смеси и определение их концентрации в различных средах, тканях и органах живого. При этом следует учесть, что выделенный чистый фермент работает иначе, чем в клетке, где он образует комплексы с ее структурами. Поэтому его действие вне клетки не может полностью моделировать метаболизм организма (п. 1.1.3).
Другое применение выделенных ферментов заключается в том, что они образуют элементы алгоритма синтеза новых белков, реализуя набор операций по их сборке и расчленению.
Ученые 70-х гг. XX в. относились к ферментам как к капризным, быстро разлагающимся веществам, меняющим свою активность во времени. Позже чистые ферменты стали хранить в глицерине и в смеси с белком альбумином, что увеличило продолжительность их активности. Методы иммобилизации (пп. 2.2.6, 2.4.3) позволили существенно повысить устойчивость ферментов. Поэтому всемирный рынок ферментов уже в 1993 г. оценивался в сумму свыше $990 млн.
В прил. 2 приведена таблица, где указаны области применения ферментов сегодня – от заквасок для молока и пива или осветлителей для соков до моющих средств, в которых они выступают в качестве биодобавок.
Чувствительность и воспроизводимость реакции БХП зависит в основном от качества гомогенизации клеток, выделения и очистки фермента (п. 2.4.2), т. е. от инфраструктуры, которая должна обеспечивать работу БХП. Разработчик БСС при этом полагается на поставщиков ферментов.
Ферменты можно наносить в виде простейшего БХП на бумагу, вносить в состав мембран на гелевой или иной основе или применять в виде экстрактов [22, 46].
Применение ферментов в качестве аналитического инструмента предполагает организацию метаболических реакций и измерение количества субстрата или продукта. Можно выделить целую группу тест-реакций ферментных БХП.
Преобразование химических веществ. В БСС для оценки загрязнения окружающей среды определяется активность ферментов дыхательного цикла аэробного дыхания (цикла Кребса, п. 1.2.2):
янтарная кислота + F ––––® фумаровая кислота + F,
(14)
где F – фермент сукцинатдегидрогеназа, выделяемый из митохондрий печени рыб. Янтарная кислота в свою очередь образует с индикатором окрашенное соединение (п. 3.1), что позволяет измерить потребление субстрата ферментативной реакции.
Активность липаз, катализирующих разложение жиров, часто определяют с помощью простого теста, заключающегося во внесении фермента в каплю оливкового масла и измерении скорости растекания капли за счет расщепления жиров.
Выделение газов [3]. Наиболее широкое распространение получили БСС для определения глюкозы в крови с помощью ферментативной реакции:
глюкоза + O2 + F => глюконовая кислота + H2O2 + F,
(15)
где F – фермент глюкозоксидаза (п. 3.2.3).
Для оценки активности фермента нитрогеназы используется ее свойство преобразовывать газ ацетилен в этилен.
Изменение кислотности. Газы, выделяемые в результате ферментативных реакций, при пропускании через водную среду могут изменять ее кислотность (п. 2.3.1).
Выделение тепла. Многие ферментативные реакции идут с выделением тепла [3]. Некоторые типы подобных реакций были указаны в п. 1.2.2. Наиболее простой подход использован в ферментных БХП, в которых фермент или иммобилизовали на поверхности устройства для измерения температуры или помещали в мембрану, надетую на это устройство.
Достоинством данных БХП было обеспечение возможности контроля тепловыделения в течение длительного времени, а также в проточных системах. Методы измерения тепла описаны в п. 3.4.
Электрокатализ. Некоторые ферменты проявляют активность в форме ускорения обмена электронами между субстратом и электродом. Транспорт электронов может происходить [7] несколькими путями:
а) за счет промежуточного низкомолекулярного переносчика электронов – медиатора, который сначала окисляется ферментом, а затем восстанавливается на электроде;
б) за счет биоэлектрокатализа – прямого переноса электронов ферментами.
В качестве медиатора в раствор фермента добавляют вещество – переносчик электронов (ферроцен) или белки – переносчики электронов (п. 3.2.5).
Биоэлектрокатализ был открыт в 1978 г. советскими учеными (И.В. Березин, В.А. Богдановская, С.Д. Варфоломеев и др.). Прямой перенос электронов возникает у ферментов: медьсодержащей оксидазы – лакказы, пероксидазы, гидрогеназы, катализирующих соответственно окисление веществ кислородом (п. 1.2.1), распад H2O2, присоединение групп водорода. Это свойство используется для преобразования продукта H2O2 в электрический ток на электроде.
Многие ферменты катализируют окисление сахаров, аминокислот с выделением H2O2. В этом случае фермент пероксидаза используется для трансформации концентрационного сигнала в электрический:
AH2 (белок, углевод) + O2 –® A + H2O2 (оксидаза),
(16)
H2O2 –® H2O + 2 e– (пероксидаза).
(17)
Цепь реакций позволяет измерять концентрацию сахаров и белков, участвующих в обмене веществ, по величине тока на электродах (п. 3.2.4, 3.2.5).
Биолюминесценция (БЛ). Способностью к БЛ обладают бактерии, грибы, моллюски, насекомые [9, 10,16]. Механизм световых реакций у разных видов включает окисление субстрата люциферина ферментом люциферазой (п. 1.1.3).
Выделено несколько типов ферментов FL, катализирующих реакции БЛ.
а) FL1 – люцифераза насекомых. Ее выделяют из светоизлучающих органов («лампочек») светляков. Реакция катализа проходит в присутствии АТФ – энергетического соединения, необходимого для дыхания (п. 1.2.2).
АТФ при реакции преобразуется в АМФ:
люциферин+ АТФ + F ®
®окисленный люциферин +АМФ +фотон + F L1.
(18)
При отсутствии АТФ биолюминесценция не наблюдается. На этом принципе основан самый чувствительный метод измерения АТФ, когда в изучаемый раствор добавляют люциферин и люциферазу, измеряя свечение.
б) FL2 – ферменты медуз. Из этих организмов выделяется способный к свечению белок фотопротеин. Он содержит связанный люциферин, который светится за счет окисления ферментом в присутствии ионов Ca2+. Белок под названием экворин добавляют в изучаемый объект и по свечению следят за динамикой свободного кальция.
в) FL3 – ферменты люминесцентных бактерий. Свечение бактерий катализируется бактериальной люциферазой. Очищенный фермент обладает способностью к свечению только в присутствии трех субстратов: кислорода (S1), альдегида (S2) и сложного белка (S3), играющего важную роль в аэробном дыхании. Добавляя в раствор постоянные концентрации двух субстратов и фермент – бактериальную люциферазу, по возникающему свечению обнаруживают наличие и концентрацию третьего субстрата.
Если в раствор вносят S2+S3+FL3, можно определять концентрацию О2 (S1) по свечению, интенсивность которого линейно зависит от концентрации О2 в диапазоне 10–8 – 10–6 моль/л.
Если внести в раствор S1+S3+F L3, то по возникновению люминесценции появляется возможность определять альдегиды (S2), к которым, например, относятся половые гормоны насекомых (ферромоны). Ими, например, самки ночных бабочек, привлекают к себе самцов. По свечению раствора удается изучать метаболизм гормонов у одной особи насекомого.
После внесения в раствор смеси S1+S2+FL3 образуется БХП для определения необходимых для люминесценции сложных белков (S3). Ими являются компоненты белков дыхательного цикла на основе витамина B2. Их концентрацию можно измерять по интенсивности свечения.
В свою очередь сложный белок S3 образуется из биологического окисленного кофермента дыхательного цикла (НАДН, п. 1.2.2), являющегося субcтратом S4 для ферментативных реакций окисления с участием фермента F1 – оксидоредуктазы. Добавляя эти ферменты, можно продолжить аналитическую цепочку, где место субстрата S3 займет S4:
S1+S2+S4 ® (при добавлении FL3, F1) ® свечение
(19)
Биологическое окисление НАДН из исходного субстрата S5 (НАД) катализируется другим ферментом – F2 дегидрогеназой, что позволяет измерять уже ее активность по тому же свечению, а вместо S4 использовать S5:
S1 + S2+S5 (при добавлении FL3, F1, F2) ® свечение.
(20)
При всех достоинствах подобных анализов цепочки реакций следует учитывать их недостаток – на свечение будут влиять все нестабильности концентраций исходных субстратов и ферментов.
В России производится набор КРАБ (комплекс реактивов для анализа биолюминесценции), который применяется для биохимических измерений. Ферменты КРАБ выделены из биомассы светящихся бактерий.
Приборы для измерения БЛ приведены в п. 3.1.9, а характеристики люминесцирующих БО – в табл. 5.
Запуск и блокирование реакций. Эти тест-реакции наиболее широко используются в ферментных тест-методах, предназначенных для обнаружения анализируемого вещества.
В основу ферментных тест-методов положено свойство ионов металлов или органических токсикантов ингибировать (п. 1.1.3) процессы каталитического превращения веществ в присутствии биологических катализаторов-ферментов [37]. Принцип их действия можно рассмотреть на примере тест-полоски для определения фосфорорганических веществ [14].
Она представляет собой полоску фильтровальной бумаги, на одном из концов которой иммобилизован фермент ацетилхолинэстераза, участвующий в проведении нервных импульсов (п. 1.4.1). Другой конец этой полоски содержит субстрат (ацетилхолин), скорость каталитического гидролиза которого подавляется в присутствии фосфорорганических веществ. Вместе с субстратом наносится кислотно-основной индикатор.
Наличие вещества-ингибитора выявляют по окраске зоны индикации тест-полоски после того, как полоска складывается для совмещения пятен, содержащих субстрат и фермент, и на нее, например, выжимают сок анализируемого продукта. Если продукт содержит фосфорорганический пестицид, скорость ферментативной реакции понижается, приводя к уменьшению количества выделившийся при этом кислоты, что вызывает изменение окраски индикатора. По цветовой шкале на упаковке тест-полосок можно оценить экологическую чистоту продукта питания. Аналогичная структура тест-наборов для клинической химии [1, 14].
Таблица 5
Состав и свойства светящихся смесей некоторых организмов [16]
| Группа | Организм | Реагирующие соединители | Положение максимума интенсивности излучения (область) |
| I | Медуза (Aeguorera) | белок + Са++ | синяя |
| II | Усоногие рачки (Balanoglossus biminiensis) | H2O2 + LH2 + E | голубая |
| III | Рыба (Apagon) Простейшие (Gonyaulax) Многощетинковый червь (Odontosylis) Ракообразные (Cypridina) | O2 + LH2 + E O2 + LH2 + E O2 + LH2 + E O2 + LH2 + E | 460 синяя 510 460 |
| IV | Грибы (Collibia и Armillaria) Гриб (Omphaly flavida) | O2 + LH2 + E+ДПН – Н или ТПН – Н O2 + LH2 + E+ ДПН – Н | 530 |
| V | Морские анютины глазки (Renilla Reniformis) Светящиеся насекомые | O2 + LH2 + E + АМФ O2 + LH2 + E + АТФ | синяя 562 |
| VI | Бактерии (Ahromobacter и другие) | O2 +LH2+E+ФМН– 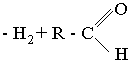 | 405 |
| Моллюск фаллада (Pholas Dactylus) | О2 + ДПН – Н + Е + + ФМН – Н2 | синяя | |
| VII | Млекопитающие (приведены результаты первых исследований) | О2 + липиды О2 + жиры или жирные кислоты то же + адреналин то же + эргостерин то же + лецитин то же + аминокислоты | зеленая и красная синяя, зеленая, красная – – зеленая зеленая |
LH2 – энергетический субстрат люминесцентной реакции, Е – катализатор (люцифераза), ДПН – Н – восстановленный дифосфопириннуклеотид.
АТФ – аденозинтрифосфат, АТМ – аденозинмонофосфат, ФМН – Н2 –
восстановленный флавинмононуклеотид,
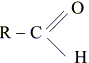 – альдегид.
– альдегид.Общий принцип большей части химических тест-методов заключается в использовании ферментных реакций с так называемыми хромогенными (цветообразующими) реагентами [38, 41]. Реакции проводят в таких условиях, чтобы можно было визуально зафиксировать их результат. Этим результатом могут быть интенсивность окрашивания, цвет бумажной полоски или длина окрашенной части индикаторной трубки с поглощающим веществом. Большинство используемых тест-методов служат измерительной БСС однократного применения.
Тест-системы являются одним из самых коммерчески выгодных товаров. Оборот фирм, торгующих ими, составлял в 1994 г. около $100 млн.
Организация цепи тест-реакций. Метаболические ферментные процессы в организме часто образуют цепи реакций (п. 1.1.3), которые могут использоваться в БХП как тест-реакции.
Если записать формулу цепи метаболизма:
S + F1 + K + I = P1 + F1 = P2 + F1 +F2,
(21)
где S – субстрат, F1 – фермент, катализирующий реакцию образования продукта P1, являющегося субстратом для ферментов до F2, катализирующего образование продукта P2, K – кофактор, I – ингибитор (п. 1.1.3), то можно решать следующие задачи:
- выявлять субстрат-метаболит S;
- измерять активность ферментов по поглощению S или образованию P1 и P2;
- выявлять кофакторы K, запускающие работу фермента;
- выявлять ингибиторы I, подавляющие активность ферментов;
- выявлять цепочки взаимодействия ферментов.
В качестве примера можно привести другой БХП [7] на основе ацетилхолинэстеразы (F1) Для оценки активности этого важного фермента используется цепь реакций, приводящая к образованию пероксида водорода:
ацетилхолин (S) + I + F1 ® холин(P1) + уксусная кислота.
(22)
На следующем этапе фермент F2 холиноксидаза катализирует окисление P1.
холин (P1) + O2 + F2 ® H2O2 (P2) + оксихолин + F2.
(23)
Образование H2О2 будет зависеть от наличия ингибитора исходного фермента. Ингибиторами ацетилхолинэстеразы являются фосфорорганические или хлорорганические пестициды.
2.5.2. Ткани организмов
Растительные и животные ткани содержат специфические наборы ферментов, которые могут быть использованы как катализаторы соответствующих химических реакций [3, 33]. Каталитическими веществами богаты листья, цветки и плоды растений (структуры, связанные с ростом, репродукцией и накоплением питательных веществ), ткани печени, желудка, почек, слизистой оболочки животных.
Поэтому тканевые материалы успешно используют в качестве биокаталитических компонентов БХП. Ткани создают естественное окружение для требуемого фермента, в результате чего его активность стабилизируется. Во многих случаях тканевые БХП служат намного дольше, чем БХП на основе чистых ферментов. Тканевые материалы сохраняют специфичность фермента, в то время как выделенные ферменты в тех же условиях разрушаются.
Селективность тканевых БХП иногда снижается за счет присутствия в тканях не одного, а нескольких ферментов. Однако влияние «лишних» ферментов в каждом конкретном случае можно исключить или значительно ослабить подбором рН, температуры среды либо с помощью соответствующих ингибиторов, кофакторов. Наличие в ткани разных ферментов позволяет в некоторых случаях использовать один БХП для измерения концентрации нескольких субстратов.
Для БХП используют гомогенаты (измельченные ткани, п. 2.4.2) или срезы тканей в питательной среде, фиксируя их в полупроницаемой пленке (например нейлоновой) на поверхности измерительного преобразователя – ИП (разд. 3). Иногда измельченные частицы включают в порошки, пасты, гели. В результате ферментативной реакции, протекающей в ткани, выделяются вещества, концентрация которых определяет величину выходного сигнала ИП, в качестве которого чаще всего используется газочувствительный датчик (п. 3.2.4, 3.2.5). В гибридных БХП, кроме ткани, иммобилизованы еще и ферменты.
Тканевые БХП для отдельных веществ. В табл. 6 приведены примеры подобных БХП для определения различных веществ.
Зависимость скорости образования продукта от концентрации субстрата нелинейна, если количество фермента постоянно (п. 1.1.3). В табл. 6 приведен диапазон концентраций, при котором сохраняется линейная зависимость между концентрацией измеряемого и количеством выделяемого или потребляемого вещества в процессе ферментативной реакции. Время работы БХП – это время сохранения им линейного отклика на анализируемое вещество.
Таблица 6
Характеристика тканевых БХП [33]
| Определяемое вещество | Биокаталитический материал / фермент | Вещество: выделение–В, потребление–П | Диапазон концентраций, Моль | Время анализа / долговечность БХП | Значение определяемого вещества |
| Мочевина | Мука из бобов канавалии мечевидной / уреаза | NH3 (аммиак, В) | – | – /94 дн | Болезни почек, диабет, болезни печени |
| | Кашица тычинок хризантемы / уреаза | NH3 (аммиак, В) | 210–5... 310–4 | – | отравления фосфором, мышьяком |
| Пируват | Срез кукурузного зерна / пируватдекарбоксилаза | CO2, В | – | – | Болезни печени, токсикозы, травмы черепа |
| Пероксид водорода | Лист капусты кольраби / пероксидаза | О2, В | 4 10–5... 6 10–4 | 2 ... 6 с/ – | Контроль действия фармакологических |
| | Ткани корней хрена / пероксидаза | О2, В | 2,510–5... 2,310–4 | 3 мин / 2 мес. | препаратов, генетические патологии |
| Катехол | Срез ткани картофеля / полифенолоксидаза | О2 , П | 2,510–5... 2,310–4 | 3 мин / 3 мес. | Вещество, входящее в состав гормонов |
| | Ткань шпината / катехолоксидаза | О2 , П | 2,010–5... 810–4 | – / 18 дн | мозгового слоя надпочечников |
| Катехоламины | Ткань печени крысы / моноаминоксидаза | Аммоний, В | – | – / 20...25 дн | (адреналина и норадреналина) |
| Аскорбиновая кислота | Сок огурца / аскорбатоксидаза | О2 , П, вода В | 2,510–4... 1,610–3 | 3 ... 6 мин / – | Витамин |
| Дофамин | Мякоть банана / полифенолоксидаза | О2, П | 1,310–6... 910–5 | 12 с /10 дн | Вещество, дейсвующее на нервную систему |
| Тирозин | Срез сахарной свеклы / тирозиназа | О2, В | | – /8 дн | Аминокислота гормонов (инсулина и др.) |
Помимо приведенных примеров в литературе описан целый ряд биосенсоров на пероксид водорода с применением кожуры кабачка и огурца, сенсоры на аминокислоты, содержащие в качестве биокаталитического материала компоненты цветков растений (кашицу тычинок хризантемы, ткани цветка магнолии, срезы пестика, ткани семян петрушки). Тычинки, пестики, семена содержат ферменты, катализирующие соответствующие реакции. Проведены опыты с применением в качестве БХП чешуи рыбы для определения гормона норадреналина, ткани мочевого пузыря жабы для определения антидиуретического гормона.
Биопотенциал нервной ткани (п. 1.3.1), измеряемой с помощью микроэлектрода, позволяет индицировать воздействие на нее кислот, щелочей, некоторых тяжелых металлов, фармакологических препаратов. По усилению либо угнетению биоэлектрической активности нерва лягушки можно оценивать содержание хлорида марганца. Высокой чувствительностью к микроэлементам обладают мозговые сосуды. На основе метода измерения биоэлектрической импульсной активности антеннул (рецепторов) краба были созданы БХП для обнаружения 20 аминокислот.
БХП для выделения веществ из смесей. Существенно, что с помощью тканевых БХП возможно выделять вещество из смесей. БХП на основе тканей корней хрена позволяет по разложению H2O2 определять концентрацию перекисей не только в водных растворах, но и в органических растворителях. Аскорбиновую кислоту с помощью тканей растений можно определять в смесях органических кислот, фенолов, аминокислот и глюкозы.
К недостаткам тканевых биосенсоров следует отнести трудность стандартизации БО, что ухудшает воспроизводимость результатов анализа.
Активированная хемолюминесценция. Хемолюминесценцией называется свечение, сопровождающее некоторые биохимические реакции. Клетки и ткани животных обычно излучают свет в процессе жизнедеятельности, но такой слабый, что его долгое время не удавалось обнаружить. Эффект активированной хемолюминесценции (АХЛ) заключется в тысячекратном усилении свечения в присутствии некоторых веществ-активаторов – физических факторов и химических веществ (п. 3.1.9).
Некоторые вещества-активаторы (кумарин и его соединения) усиливают хемолюминисценцию, возникающую при окислении липидов (п. 1.1.2), при котором образуются возбужденные молекулы. Активатор свечения люминол усиливает свечение тканей в присутствии атомарного кислорода и радикалов OH–. Поэтому диагностика с применением АХЛ связана с реакциями, приводящими к их образованию.
Атомарный кислород возникает при разложении пероксида водорода (H2O2 = H2O + O) в присутствии металлов переменной валентности и гемсодержащих (железосодержащих) веществ. В отличие от O2 атомарный кислород обладает значительно большей химической активностью.
У больных инфарктом миокарда в моче могут появляться небольшие концентрации гемсодрежащего белка – миоглобина, которые усиливают свечение люминола в присутствии Н2О2 . Активные формы кислорода возникают при заживлении ран (п. 1.2.4), что позволяет контролировать эти процессы по проявлению эффекта АХЛ. Клетки крови выделяют активные формы кислорода при действии кратковременных электрических импульсов или при добавлении к лейкоцитам суспензии бактерий, которые они воспринимают как чужеродных агентов. Такой же эффект возникает при добавлении к клеткам крови кристаллов кварца, сульфата бария и других химических веществ, получивших название стимулов АХЛ. Способность клеток крови вырабатывать активные формы кислорода отражает общую сопротивляемость организма.
2.5.3. Фотосинтезирующие пигменты
В тканях организмов-фотоавтотрофов (п. 1.2.1) содержатся пигменты, поглощающие солнечное излучение и преобразующие его в химическую энергию. Фотосинтезирующие пигменты делятся на две группы – хлорофиллы и каротиноиды. Они различаются по строению и оптическим свойствам.
В БСС используются фотосинтетические пигменты, включенные в ткань листа, а также находящиеся во взвеси микроводорослей, в осажденном после центрифугирования слое водорослей, в гомогенате (измельченной ткани) листьев.
Можно выделить несколько тест-реакций пигментов.
а) Поглощение. Хлорофиллы поглощают главным образом красный и сине-фиолетовый свет, отражая зеленый свет, что придает растениям зеленую окраску (рис. 5). При загрязнении среды хлорофиллы распадаются первыми, при этом возникает явление хлороза – пожелтение части растительной ткани.
Каротиноиды – желтые, оранжевые, красные и коричневые пигменты. Они имеют три максимума поглощения в сине-фиолетовой области спектра (рис. 5,а). Каротиноиды обычно не видны на фоне хлорофиллов, но обнаруживаются при их распаде. При полном подавлении фотосинтеза вредными веществами возникает явление некроза (отмирания ткани растений).
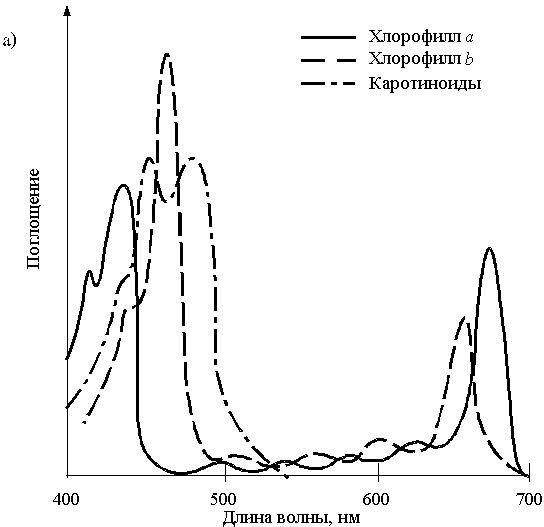
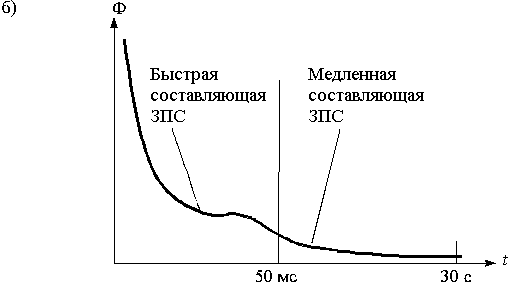
Рис. 5. а) спектры поглощения хлорофиллов a и b и каротиноимдов
б) кривая замедленного послесвечения (ЗПС) хлорофилла -
б) Поглощение и рассеяние возникают за счет того, что пигменты включены в состав хлоропластов, образующих рассеивающие и поглощающие частицы ткани листа.
в) Флуоресценция. Пигменты характеризуются спектром возбуждения – зависимостью интенсивности флуоресценции (кратковременной люминесценции) пигментов от длины волны в результате их возбуждения источниками излучения [43].
Например, при освещении хлорофиллов кратковременным, мощным импульсом сине-фиолетовых длин волн возникает эффект испускания пигментами излучения красных длин волн. Интенсивность свечения за время, много меньшее мс, достигает пика, затем быстро (за десятки мс) уменьшается в тысячи раз, после этого медленно спадает до нуля в течение нескольких секунд (рис. 5,б). Вещества, подавляющие фотосинтез (п. 1.2.1), уменьшают амплитуду быстрой составляющей послесвечения.
Измерение спектров поглощения и послесвечения позволяет определять концентрацию пигментов для оценки степени загрязнения среды.
Спектр поглощения гомогената листьев или взвеси водорослей измеряют с помощью спектрофотометра (п. 3.1.3). Поверхность ткани с поглощающими частицами пигментов анализируется методами измерения отраженного потока (п. 3.1.5). Послесвечение пигментов обычно исследуют путем нанесения однородного слоя носителей пигментов на поверхность вещества, не обладающего свойством люминесценции (3.1.9).
2.5.4. Носители генетической информации
Свойства хромосом, используемые в БХП. Согласно международной классификации хромосом человека они нумеруются попарно по мере уменьшения их длины от 1 до 22-й. Их классифицируют по морфологическим признакам: форме, величине, положению связки (центромеры) и по расположению локусов, окрашенных разными видами красителей, в том числе флуоресцентными.
При рассмотрении структурной изменчивости хромосом под действием вредных факторов выделяют три основных вида нарушений: разрывы хромосом, ведущие к образованию фрагментов (делеций), перестановки локусов внутри хромосом и обмен локусами между разными хромосомами. Последние два вида перестройки хромосом называются аберрациями.
Исследование делеций и аберраций хромосом широко используется для оценки мутагенности загрязнений окружающей среды, воздействующих на живое в течение времени, за которое сменилось несколько десятков поколений клеток у животных или растений.
Клетки лейкоцитов возможно получать лабораторным методом (п. 2.4.1), поэтому в 1971 г. Международная организация здравоохранения при ЮНЕСКО рекомендовала для анализа мутагенных эффектов загрязнителей (в том числе сельскохозяйственных ядов) метод изучения структурных мутаций хромосом с помощью клонов лейкоцитов.
Свойства ДНК, применяемые в БХП [3, 13]. Двойная цепь нуклеотидов, не свернутая в трехмерную структуру, позволяет наблюдать и контролировать следующие тест-реакции:
- поляризацию света оптически активным веществом ДНК;
- поглощение излучения в ультрафиолетовой области за счет азотистых оснований ДНК (хромофор, п. 1.2.3);
- поглощение излучения в других областях спектра при взаимодейсвии с различными химическими веществами, которые присоединяются к ДНК всегда в фиксированном месте цепи, при этом поглощение будет пропорционально концентрации вещества;
- комплементарность, т. е. объединение цепей нуклеотидов ДНК;
- удлинение и укорочение цепи ДНК при воздействии некоторых ферментов мутагенных веществ;
- образование множеством молекул ДНК структуры жидкого кристалла (п. 3.1.10).
Гибридизация, ДНК-зонды. Новая ДНК может возникать в результате обмена фрагментами ДНК или их соединения. Этот процесс называется гибридизацией ДНК. Для выявления наследственных болезней используют ДНК-зонды, т. е. ДНК, копирующие участки генов. Их получают из мРНК (п. 2.2.7). Необходимые фрагменты помечают изотопом. Если болезнь обусловлена отсутствием гена, то эффект гибридизации ДНК пациента с ДНК-зондом понижается, т. е. не возникает эффекта его прикрепления. Так диагносцируют наследственные мутации (отсутствие необходимых участков генов).
Из цепочек нуклеотидов путем ферментных перестроек возможно создавать геномные последовательности для диагностических и терапевтических целей [11, 40].
Например, разработана искусственная нуклеиновая кислота (НК), соответствующая области генома вируса гепатита С [11]. Искусственную НК помещают в условия, способствующие ее скрещиванию (гибридизации) с геномом вируса гепатита С. Обнаружение продукта гибридизации является показателем наличия генотипа вируса гепатита С. Это способ создания вакцины и антител против вируса гепатита С.
2.5.5. Комплекс антиген-антитело
Свойства комплекса антиген-антитело. Образование комплекса антиген-антитело в процессе преципитации (пп. 1.2.4, 2.4.2) изменяет физико-химические свойства исходных белковых молекул.
При формировании БХП можно использовать следующие тест-реакции [32, 33] комплекса антиген-антитело:
- образование крупных клеточных агрегатов, если антиген расположен на поверхности клеток (антитела «склеивают» клетки, и они оседают на дно);
- образование отчетливых линий в густеющем геле (п. 2.2.6) с клетками-антитигенами после того, как туда добавляют антитела за счет возникновения клеточных агрегатов;
- увеличение силы тяжести, действующей на поверхность, если на ней иммобилизованы антитела, а клетки с антигенами находятся в питательной среде (образование комплекса приводит к выпадению осадка), что используется в гравиметрических датчиках (п. 3.3);
- изменение электрических свойств (емкости) антигена и антитела при образовании комплекса, суммарная емкость которого уменьшается за счет последовательного соединения емкостей исходных биообъектов (п. 3.2.1);
- изменение оптических и электрических характеристик приповерхностного слоя электрических проводников при осаждении на них комплекса (п. 3.1.6).
Воздействие комплекса антиген-антитело на нервные клетки. Подобный комплекс может воздействовать на проводимость нервных клеток (п. 1.3.1). Если рецепторный белок (G-белок, п. 1.3.2) нервной клетки является антигеном для антител, то его связывание в комплекс приводит к возникновению электрофизиологических эффектов: уменьшению потенциала действия и изменению его полярности.
Перспективным направлением является создание БХП с использованием мембран нервных клеток, в которые встроены антитела. Тогда образование комплекса антиген-антитело изменяет электрический потенциал мембраны.
2.5.6. Комплекс антиген–антитело–фермент
В иммуно-ферментном анализе (ИФА) [21, 32] реакция фермента с субстратом используется в качестве индикатора наличия антител к определенным антигенам (пп. 1.2.4, 2.5.5). Реакцию субстрат-фермент используют для обнаружения комплексов антиген-антитело вместо прежнего, радиоактивного метода, при котором антитела метили изотопами.
Гетерогенный ИФА. Данный анализ включает подготовку веществ и материалов и проведение собственно анализа.
Подготовительные этапы ИФА:
1) культивирование, очистка (п. 2.4.2) антигена Aг, например вирусного белка, который должен иметь сродство не менее чем к двум классам антител;
2) иммобилизация антигена (обычно химическим путем, (п. 2.4.3) на дно и стенки прозрачной ячейки Аг;
3) культивирование, очистка антител (Аг) – Aт;
4) культивирование носителей ферментов, выделение из них ферментов и очистка (получение энзимов E);
5) прикрепление к анителам фермента-энзима в качестве метки (Ат+ E).
Для реализации последнего этапа необходимо подобрать фермент, который длительно сохраняет свою активность, не теряет ее при связывании с анителом (или антигеном), обладает высокой избирательностью к субстрату, катализирует реакцию с изменением цвета субстрата.
Например: пероксидаза хрена (F) катализирует реакцию:
AH2 + H2O2 + F ——® A + H2O + F
(24)
В качестве AH2 подбирается соединение, которое в пероксидазной реакции превращается в окрашенную форму с максимумом оптического поглощения при длине волны 414 нм.
«Прикрепление» фермента к антителу осуществляется разными способами:
- разъединением белковых антител ферментами нуклеазами (катализирующими разложение молекул белка на компоненты) и соединением реакционно-способных частей антител с ферментом;
- связыванием антитела с промежуточным ферментным белком Ат–Б, а основного фермента – с его ингибитором ИБ –E (п. 2.5.1), в результате чего ингибитор соединяет цепь Ат–Б ИБ –E = Ат + E;
- методами генной инженерии (п. 2.2.7).
На подготовительных этапах создают диагностикумы – наборы иммунохимических реагентов для определения антигенов (или антител) и полистироловые многолуночные планшеты, на которые нанесены антигены определенных вирусных или инфекционных заболеваний.
Этапы выполнения гетерогенного ИФА:
1) взятие у пациента пробы крови для анализа на наличие антител
(АтП);
2) одновременное добавление в ячейку планшета с иммобилизованными на ее поверхности антигенами раствора «меченых» антител и пробы крови пациента;
3) связывание антигенов с антителами «мечеными» энзимами
(Аг +Ат+ Е)
или антителами из пробы крови пациента
(Аг+ АтП);
4) отмывание ячейки от крови;
5) образование в ячейке прикрепленного к поверхности комплекса антиген-антитело, меченого энзимом* (при связывании антигенов с антителами растворов диагностикума)
*(Аг + Ат + Е)
и не меченого° (при связывании антигенов с антителами пробы),
°(Аг+ АтП)
и добавление в ячейку субстрата (S) ферментативной реакции:
*(Аг + Ат + Е) + S = *(Аг + Ат + P) + E,
(25)
°(Аг+ АтП) + S;
6) образование продукта ферментативной реакции, который полностью заполняет дно ячейки, если в пробе не было антител
P P P P P P P P P P
или не полностью, если антитела в пробе крови были
P P P P P P P;
7) отмывание ячейки от субстрата, антител и антигенов, фиксация слоя продукта на дне ячейки в виде тонкого окрашенного слоя, поглощающего излучение источника света;
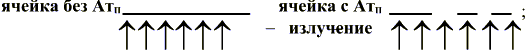
8) измерение прозрачности (оптической плотности слоя) специализированным вертикальным фотометром – денситометром (п. 3.1.1).
Осаждая на поверхности планшета антитела и используя помеченные ферментом антигены, аналогично можно обнаруживать антигены в пробе.
Гетерогенный ИФА называется сэндвич-метод (пластиковая подложка, антиген, антитело с ферментом образуют своего рода «бутерброд»). В англоязычной литературе подобный вид ИФА именуется ELISA (enzyme-linked immunosorbent assay) – реакция фермента, связанного с иммуносорбентом.
Гомогенный ИФА. В нем используются антитела Ат и антигены, меченные ферментом Аг+E. При образовании комплекса антигенантитело фермент инактивируется. Потеря активности может быть связана с изменением активного центра фермента или с тем, что антитело закрыло доступ к субстрату. Когда же появляются свободные антигены, то они, конкурируя за антитела, восстанавливают активность фермента.
Иногда используют ферменты, катализирующие биолюминесценцию (п. 2.5.1), что позволяет выявить наличие антител пациента по уменьшению свечения лунок планшета.
Ограничения ИФА. Возможности увеличения чувствительности ИФА ограничиваются фоном анализируемого соединения, т. е. наличием его не только в анализируемом образце, но и в используемых реактивах и растворителях. К ограничениям ИФА относится также наличие в тестируемых образцах кофакторов, ингибиторов и стимуляторов активности ферментов. Еще один недостаток — ИФА не позволяет различать нативные белки и их биологически неактивные фрагменты, сохранившие антигенные детерминанты. Ограничением ИФА является его применимость лишь к хорошо изученным системам, где есть очищенные антигены и высокоспецифические антитела.
Чувствительность ИФА. Высокая чувствительность в сочетании с быстротой анализа, возможностью одновременного тестирования большого количества образцов, наличие различных диагностикумов являются неоспоримыми достоинствами ИФА. Поэтому ИФА находит широкое применение в здравоохранении, различных областях сельского хозяйства, в экологии.
Реагенты для проведения ИФА сегодня стали коммерческими продуктами и могут быть приобретены по каталогам известных фирм.
Применение ИФА. Любое заболевание можно быстро и точно диагностировать путем идентификации возбудителя, его отдельных антигенных компонентов, антител к этим компонентам или веществ, не свойственных здоровому организму и синтезируемых при его патологических состояниях.
Диспансеризация населения, эпидемиологические обследования, выявление отравлений, наличия наркотиков в крови, определение содержания лекарственных соединений в тканях, вирусные заболевания растений, определение антибиотиков, витаминов и других биологически активных соединений при отборе активных штаммов-продуцентов в промышленной биотехнологии, контроль за качеством медицинских препаратов из донорской крови на отсутствие вирусов-возбудителей СПИДа и гепатита В – это лишь небольшой перечень практического применения ИФА. Современные фундаментальные исследования в биохимии, клеточной физиологии и иммунологии, микробиологии, вирусологии, онкологии трудно представить без ИФА.
Если протестировать пробу крови к набору антигенов, можно выявить Аг, к которым у человека не вырабатывается Ат, и получить своеобразный «паспорт» защитной системы организма, называемый «иммунным статусом». Его изменение у находящихся долгое время в загрязненной среде людей и животных может стать объективным показателем ослабления организма.
