Методическое пособие к лабораторным работам по физической и коллоидной химии для студентов биологических факультетов
| Вид материала | Методическое пособие |
- Методические указания к электронным лабораторным работам по курсу физической химии, 2388.82kb.
- Учебное пособие Ставрополь 2005 удк 577. 1 (075. 8) Бкк 28. 072, 277.1kb.
- Учебное пособие Ставрополь 2005 удк 577. 1 (075. 8) Бкк 28. 072, 240.13kb.
- Настоящее учебное пособие подготовлено для студентов факультетов физической культуры., 2524.83kb.
- Календарно-тематический план лекций по физической и коллоидной химии для студентов, 67.53kb.
- Методическое пособие по лабораторным работам для студентов специальности 201400 «аудиовизуальная, 446.61kb.
- Методическое пособие по выполнению (подготовке) и защите для студентов отделений, 810.13kb.
- Учебно-методическое пособие для студентов биологических факультетов специальности 011600, 1207.48kb.
- Методические указания к лабораторным работам по биологической химии для студентов, 948.06kb.
- Учебно-методическое пособие для иностранных студентов. Волгоград 2004, 415.65kb.
На основании данных табл. 5.5 и 5.6 строят изотермы адсорбции и поверхностного натяжения, откладывая по оси абсцисс значения равновесных концентраций растворов, а по оси ординат – величины адсорбции Г в кмоль/м3 и поверхностного натяжения () в Н/м.В заключении по характеру изменения делают вывод о принадлежности бутилового спирта к ПАВ. Если Δσ< 0, а Г будет (+),вещество накапливается в поверхностном слое и является поверхностно - активным (ПАВ).
Если Δσ > 0, Г будет отрицательной - вещество поверхностно - неактивно.
ЗАДАНИЕ 4. Определение поверхностного натяжения и установление влияния длины цепи на поверхностное натяжение алифатических спиртов методом поднятия жидкости в капилляре.
Опыт проводят согласно методике , описанной в задании 5.3.
Таблица 5.7 Данные для определения поверхностного натяжения
| Исследуемая жидкость | С, кмоль/м3 | Показание масштабной линейки, h м | Масса 10см3жидкости, m, кг | Плотность, уд.вес ж-ти, d кг/м3 | , Н/м |
| Н 2О | 0,000 | 1…… | … | | |
| 2… h0 | | 1000 | | ||
| 3…… | … | | | ||
| С2Н5ОН | 0,1 | 1…… | m1 = | | |
| | 2…… | | | | |
| | 3…… | | | | |
| С3Н7ОН | 0,1 | …. …. | m2= | | |
| С4Н9ОН | 0,1 | …. …. | m3 = | | |
| С5Н11ОН | 0,1 | ……… | m4 = | | |
| ………. | | ……… | m5 = | | |
| ………… | | ……… | m6 = | | |
Результаты измерений заносят в табл. 5.7.
Затем рассчитывают поверхностное натяжение спиртов по формуле (5.12) и по результатам строят график, откладывая на оси абсцисс число атомов углерода, а на оси ординат – значения .
Понятие в разбавленных растворах может служить мерой поверхностной активности.
Найдя последовательное отношение спиртов, необходимо показать, во сколько раз уменьшается поверхностное натяжение с удлинением углеродной цепи на группу - СН2 -, т.е., соблюдается ли правило Траубе-Дюкло (с увеличением длины углеводородной цепи на –СН2 –адсорбционная активность возрастает в 3-3,2 раза.
ЗАДАНИЕ 5. Определение величины адсорбции уксусной кислоты на угле или почве
Для изучения адсорбции уксусной кислоты активизированным углем или почвой определяют ее концентрацию в испытуемом растворе методом титрования до и после адсорбции.
В титровальные колбы отбирают по 10 см3 растворов, добавляют к ним 1-2 капли раствора фенолфталеина и титруют из бюретки 0,1 н раствором щелочи до появления слабой малиновой окраски, не исчезающей в течение одной минуты. Титрование каждого раствора следует проводить в 2-3-х кратной повторности.
Расчет концентрации кислоты в растворах осуществляют, используя усредненные данные результатов титрования, по формуле:
С К =
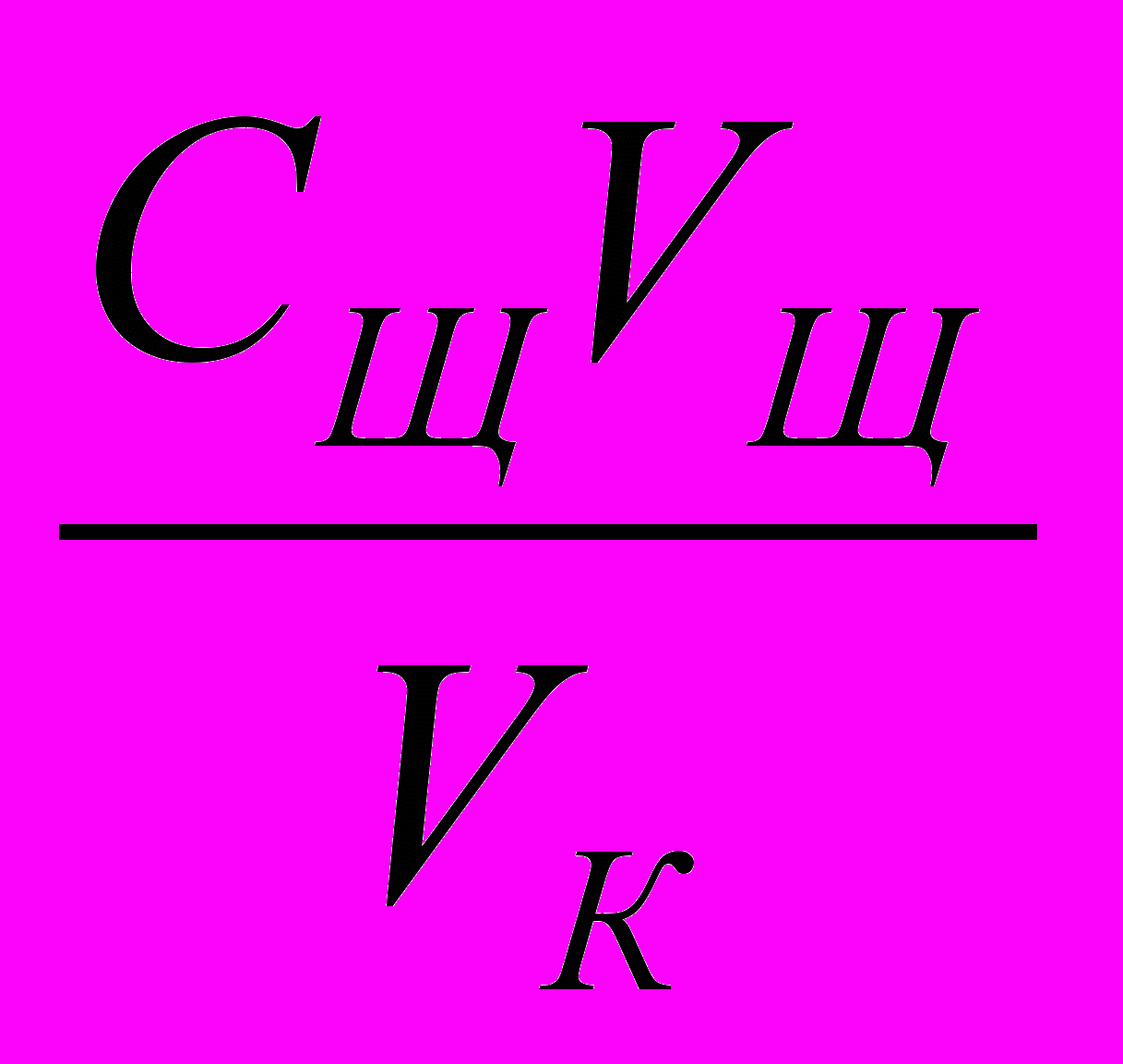 5.15
5.15где: Ск – молярная концентрация эквивалента кислоты, моль/дм3;
Сщ – молярная концентрация эквивалента щелочи, моль/дм3;
Vк - объем кислоты, см3;
Vщ - объем щелочи, см3.
Адсорбцию проводят в отдельных колбах, куда помещают по 1 г активированного угля или по 10 г почвы, заливают 50 см3 исходных растворов уксусной кислоты и содержимое перемешивают или встряхивают.
Затем адсорбент отфильтровывают через двойной складчатый фильтр, а фильтрат используют для титрования. Результаты титрования заносят в табл. 5.8.
Таблица 5.8 Результаты титрования при адсорбции.
| Раствор N по порядку | До адсорбции | После адсорбции | |||||||
| Измерение, Vщ | Ск | Измерение, Vщ | Ск | Г | |||||
| 1 | 2 | среднее | 1 | 2 | среднее | ||||
| | | | | | | | | | |
и по данным рассчитывают величину адсорбции по уравнению Ловица (см ур. 5.8)
При изучении адсорбции из растворов для нахождения константы адсорбции удобнее применять графические выражения уравнения Фрейндлиха и Ленгмюра (см ур. 5.3 -5.5, рис 5.2, 5.3 )
Значение константы К и 1/n находят из графика изотермы адсорбции по Фрейндлиху (см ур. 5.3-5.4, рис 5.3 ) откладывая на оси абцисс значения lgC на оси ординат –lg Х / m.
ЗАДАНИЕ 6. Определение обменных катионов Н+ в системе почва -раствор
10 г воздушно-сухой почвы и 50 см3 дистиллированной воды встряхивают в конической колбе в течение 6 мин. Затем суспензию отфильтровывают через складчатый бумажный фильтр. Последние капли фильтрата наносят на полосу фильтровальной бумаги, добавляют каплю индикатора (метилового оранжевого или фенолфталеина) и проверяют наличие ионов Н+. Если индикатор дает положительную реакцию, то промывку продолжают, приливая еще 10 см3 дистиллированной воды на фильтр с почвой. Операцию продолжают до тех пор, пока индикатор не дает отрицательную реакцию на ионы Н+.
Отмытую от свободный ионов Н+, почву с фильтра переносят снова в коническую колбу, смывают почву с фильтра 50 см3 1,0 н KCl, энергично встряхивают и фильтруют через бумажный складчатый фильтр в мерную колбу объемом 50 см3. Фильтрат доводят до метки водой и, отобрав 25 см3, добавляют индикатор (фенолфталеин) и титруют 0,001 н NaOH до изменения окраски индикатора. Титрование повторяют, данные заносят в табл. 5.6.
Таблица 5.9. Результаты титрования при ионном
обмене
| Объем отобранного фильтрата Vк, см3 | Ср(щ), моль/дм3 | Vщ, см3 | Сн(к), моль/дм3 | Vф, см3 | mН, г | |
| 1 титрование | 2 титрование | |||||
| | | | | | | |
По усредненным данным титрования рассчитывают концентрацию ионов Н+ в фильтрате, используя формулу (5.15).
Затем определяют содержание Н+ в почвенном растворе и по уравнению:
mx = CH+VФЭХ 10-3 5.16
где Vф - общий объем фильтрата, см3;
Эх – эквивалент определяемого иона (Э(Н+) =1)
Почва, как известно, состоит из органической и минеральной части. Содержащиеся в почве в поглощенном состоянии ионы водорода могут обмениваться в эквивалентных количествах на любые другие ионы. Общее уравнение ионного обмена Б.П.Никольского (ур. 5.10).
При обмене ионов Н+ в почве происходит процесс
ПН++ К+ + Cl— → ПК++ Н+ + Cl—.
Вытесненный ион Н+ и определяется титрованием. Сделайте выводы.
Количественная характеристика ионного обмена в почве впервые изучена К.К.Гедройцем.
ЗАДАНИЕ 7. Определение содержания ионов в пробе питьевой или технической воды в пересчете на анион ОН-
Для определения общего количества анионов в исследуемом растворе, в основном, используются аниониты, которые предварительно переводят в ОН- форму. Для этого через предварительно набухшей под водой анионит ЭДЭ-10П, находящийся в ионообменной колонке, пропускают 10 см31 н раствора NaОН.
Затем анионит отмывают от не поглощенных ионов ОН- небольшими порциями дистиллированной воды до отрицательной реакции по фенолфталеину. Для проверки на полноту промывания каплю фильтрата помещают на предметное стекло и добавляют к ней одну каплю фенолфталеина. Отсутствие окраски при этом свидетельствует о полноте промывания анионита от ионов ОН-.
Во всех случаях пропускания через ионообменную колонку жидкостей над анионитом следует оставлять столбик жидкости 1-1,5 см, иначе в колонке могут образоваться воздушные пузырьки, которые уменьшат ее емкость и затруднят прохождение жидкости через ионит.
Испытуемую жидкость (питьевую или техническую воду) в объеме 25 см3 пропускают через подготовленный анионит и промывают его 2-3 раза небольшими порциями дистиллированной воды. Фильтрат и промывные воды собирают в мерную колбу объемом 50 см3.
Раствор доводят до метки дистиллированной водой, отбирают 25 см3, добавляют 1-2 капли индикатора (фенолфталеин) и титруют из бюретки 0,01 н раствором кислоты (НCl) до исчезновения малиновой окраски. Титрование повторяют, а данные заносят в табл. 5.10
По среднему значению Vк-ты, пошедшего на титрование, рассчитывают концентрацию ионов ОН- в пробе из выражения:
СН+ *Vк-ты
Сон- = ————— 5.17
Vпр
Таблица 5.10. Результаты титрования при анионном обмене
| Объем отобранного фильтрата Vпр, см3 | СН+ , моль/дм3 | Объем кислоты, пошедшей на титрование Vк-ты, см3 | Спробы на ОН-ион, моль/дм3 | Vф, см3 | mОН-, г | ||
| 1 титрование | 2 титрование | среднее | |||||
| | | | | | | | |
Затем рассчитывают содержание ионов ОН- ионов в 25 см3 взятой на анализ воды:
mОН-= СОН _ VФ ЭОН _ 10 -3 г / 25 см3 воды. 5.18
Далее выражают mОН_ на 1 дм3 (1 л) питьевой или технической воды и делают вывод об общем содержании анионов в пробе в пересчете на ОН—ион.
На границе раздела раствор сильного электролита и полярное твердое тело (анионит) возникает двойной электрический слой. Ионы внешней обкладки этого слоя, сравнительно слабо связанные с твердой фазой силами электростатического взаимодействия, могут обмениваться с одноименными ионами из раствора в эквивалентных количествах.
Процессы ионного обмена на твердой поверхности характеризуются уравнениям Б.П. Никольского (см. ур –ние 5.10).
При обмене анионов в пробе с анионитом в ОН- форме происходит процесс, который схематично можно записать:
Cl- │Cl-
А
 нионит X OH— +SO42- Анионит SO42 + X OH—
нионит X OH— +SO42- Анионит SO42 + X OH—CO32- и др │ CO32
и др.
Концентрация ОН- анионов определяется титрованием HCl и будет характеризовать суммарное количество анионов в пробе воды в перерасчете на ион ОН-.
ТЕМА 6.
