На правах рукописи
| Вид материала | Документы |
СодержаниеГруппы пострадавших, у которых осуществлялась клиническая оценка результатов хирургического лечения Результаты исследований |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
Для изучения эффективности способов общего и местного лечения среди пострадавших выделены группы наблюдений (табл. 3). Проведено проспективное, рандомизированное, контролируемое исследование. Критерии включения в группы наблюдения: возраст от 18 до 60 лет; площадь глубокого ожога 20% п.т. и более, поступление в стационар в первые 6 ч после травмы, адекватная противошоковая терапия на догоспитальном этапе. Критерии исключения: органическая патология ЦНС, почек, печени, сердца, легких; диабет; онкологические заболевания; наркомания, токсикомания, комбинированные поражения.
Таблица 3- Группы клинических наблюдений, данные о которых
использованы при оценке методов лечения пострадавших с ОГО
| № | Группы пострадавших, у которых осуществлялась | Число пациентов |
Клиническая оценка общих результатов лечения | ||
| 1. | в период ожогового шока и токсемии на фоне введения: супероксиддисмутазы (эрисод или рексод) цитохрома-С актовегина мафусола реамберина цитофлавина полиоксифумарина | 19 27 33 39 23 16 14 |
| 2. | в период септикотоксемии на фоне введения: ронколейкина дерината тималина пентаглобина | 14 12 22 12 |
| Всего : | 231 | |
клиническая оценка результатов хирургического лечения | ||
| 3. | обожженных с ОГО, которым выполнялись ранняя некрэктомия некрэктомия электрохирургическим аппаратом некрэктомия радиохирургическим диссектором некрэктомия аргоно-плазменным скальпелем | 29 18 23 6 |
| 4. | обожженные с ОГО, которым выполняли ауто-аллопластику: методом "двойных сеток" методом “почтовых марок” или Моулем-Джексона методом микроаутодермопластики | 21 18 18 |
| 5. | обожженные с ОГО, раны которых обрабатывались: многокомпонентными антибактериальными мазями мазями с антиоксидантами и иммунотропными препаратами мазями и кремами, содержащими серебро пленочными раневыми покрытиями раневыми покрытиями в виде губок из природных полимеров многокомпонентными раневыми покрытиями | 34 12 22 27 33 8 |
| Всего : | 269 | |
Изучали непосредственные и отдаленные результаты лечения (летальность, частота осложнений, структура инвалидизации) с учетом тактики. Оценивали результаты инструментальных и лабораторных (общеклинических, биохимических, микробиологических, иммунологических) исследований. Осмотры реконвалесцентов после ОГО проводили через 1, 3, 6, 12 месяцев, а также 2, 3, 5 лет после выписки. Программа реабилитации включала медикаментозную и хирургическую коррекцию, использование компрессионной одежды, препаратов силикона, лечебную физкультуру, физиолечение, бальнеотерапию.
Специальный раздел исследования включал финансовый анализ затрат на лечение с учетом хирургической тактики, продолжительности госпитализации в ЛПУ разного ранга. Использован метод расчета “общего времени болезни” (Белевитин А.Б. и соавт., 2004) по ценам 2007 г.
В экспериментальных исследованиях использовали 1 526 взрослых белых беспородных крыс обоего пола, 220 белых беспородных мышей-самцов. Животных получали из питомника “Рапполово” (ЛО) в 1996–2002 гг. Количественные характеристики экспериментов приведены в табл. 4.
Таблица 4 – Группы животных, на основании данных о которых проведена сравнительная оценка эффективности методов хирургического лечения ОГО
| Группы животных с ОГО, в экспериментах на которых изучали эффективность | Число крыс / мышей |
| схем противошоковой терапии | 520 / 120 |
| местного лечения мазями и раневыми покрытиями | 380 / 0 |
| лечебного действия иммунотропных препаратов | 80 / 100 |
| методов оперативного восстановления кожного покрова | 546 / 0 |
| Итого | 1526 / 220 |
Ожоги кожи площадью 20%, 30%, 40%, 60% и 80% п.т. воспроизводили по собственной методике (рационализаторские предложения №7474/4 от 02.07.01; №1687 от 25.07.03; №9923/2 от 04.04.06). Эффективность методов лечения изучали в острых опытах, при этом определяли выживаемость и среднюю продолжительность жизни погибших животных. Биохимическое исследование крови, гомогенатов внутренних органов включало определение малонового диальдегида, лактата, пирувата, кислотно-основного состояния. Биоптаты тканей изучали методами светооптической и электронной микроскопии с использованием методов морфометрии.
Результаты исследований анализировались c помощью компьютерной системы STATISTICA 5.5 for Windows, программы MS-Excel. Для сравнения частотных показателей применялись непараметрические методы хи-квадрат, в т.ч. с поправкой Йетса, критерий Фишера. Количественные параметры исследуемых групп сравнивались с использованием t-критерия Стьюдента, непараметрических критериев Манна-Уитни, медианного хи-квадрат, Вальда. Оценка изменений исследуемых параметров в динамике выполнялась посредством критериев знаков, Вилкоксона, t-критерия Стьюдента для связных выборок. Доверительные интервалы для частотных показателей рассчитывались на основе точного метода Фишера. Критерием достоверности считали величину p < 0,05.
Результаты исследований
Установлено, что в МУЗ ЛО в 1996-1998 гг. продолжительность лечения пострадавших с ОГО колебалась от 110 до 118 (114,23 ± 7,8) суток без тенденции к снижению, определяясь, главным образом, площадью глубокого ожога (табл. 5), наличием осложнений. Средние сроки лечения превышали аналогичные по ЛПУ РФ (Алексеев А.А., 1998). Средняя продолжительность лечения пострадавших с ОГО в ожоговом центре ЛОКБ колебалась от 116 до 94 (102,2 ± 5,1) суток с тенденцией к снижению.
Таблица 5 - Средний срок лечения обожженных с ОГО в МУЗ
ЛО в 1996-1998 гг. с учетом площади глубокого ожога (Х m)
| Площадь глубокого ожога, % п.т. | Средний койко-день в годах | ||
| 1996 | 1997 | 1998 | |
| 21-30 | 106,2 ± 6,5 | 109,8 ± 9,4 | 111,1 ± 12,7 |
| 31-40 | 122,8 ± 22,2 | - | 125,8 ± 19,6 |
| Средняя | 113,8 ± 13,7 | 109,8 ± 9,4 | 117,2 ± 15,8 |
Таблица 6 - Средний койко-день обожженных с ОГО в ожоговом
центре ЛОКБ в 1999-2007 гг. с учетом площади глубокого ожога (Х m)
| Площадь глубокого ожога, % п.т. | Средний показатель койко-дней (сутки) в | ||||||||
| 1999 г | 2000 г | 2001 г | 2002 г | 2003 г | 2004 г | 2005 г | 2006 г | 2007 г | |
| 21-30 | 79±6 | 75±5 | 77±4 | 73±5 | 73±6 | 78±6 | 71±6 | 64±5 | 61±6 |
| 31-40 | 104±11 | 106±11 | 101±9 | 96±8 | 95±9 | 89±11 | 92±11 | 94±12 | 95±9 |
| 41-50 | 131±15 | 122±15 | 127±11 | 116±15 | 119±13 | 106±11 | 101±13 | 97±9 | 96±9 |
| >50 | 156±22 | 134±21 | 139±19 | 127±19 | 129±21 | 122±18 | 111±18 | 114±17 | 116±11 |
| Средняя | 117±13 | 109±13 | 111±10 | 103±12 | 104±11 | 98±10 | 93±12 | 93±11 | 92±9 |
Среди пациентов ожогового центра ЛОКБ отмечена тенденция к снижению сроков госпитализации при разных величинах площади глубокого ожога. Продолжительность лечения пострадавших с ОГО в МУЗ ЛО в 1996-1998 гг. оказалась на 24-29% больше (p<0,05), чем в 1999-2007 гг. в ожоговом центре.
Эффективность оказания медицинской помощи пострадавшим от ОГО существенно зависият от качества противошоковой терапии. Полученные результаты свидетельствуют о том, что её объемы у пациентов МУЗ достоверно меньше таковых на 30-40% у пациентов ожогового центра ЛОКБ (рис. 1).
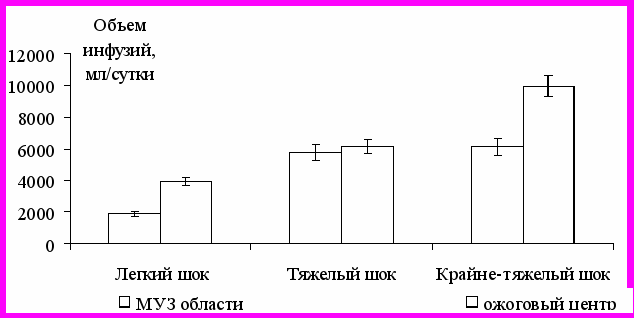
Рисунок 1 - Объемы противошоковой ИТТ
в первые сутки ОГО в ЛПУ разного ранга
Качество противошоковой терапии определило общую продолжительность пребывания пострадавших с ОГО в отделении реанимации, общий срок госпитализации. В МУЗ эти периоды оказались достоверно больше (на 23 и 13 суток), чем у пациентов ожогового центра ЛОКБ (рис. 2).
При лечении пострадавших с ОГО в условиях специализированного стационара (1999-2007 гг.), расстройства внутренних органов в периодах ожоговой токсемии и септикотоксемии развивались достоверно реже, при этом структура осложнений ожоговой болезни претерпела существенные изменения.
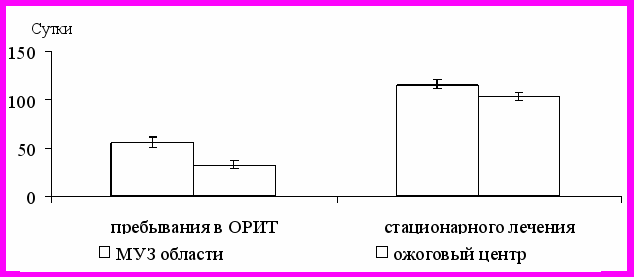
Рисунок 2 - Сроки лечения ОГО при поведении
противошоковой ИТТ в ЛПУ разного ранга
Сердечно-сосудистая недостаточность выявлена у 348 (59,7%) пациентов ожогового центра ЛОКБ, что на 12% меньше, чем у обожженных, лечившихся в отделениях МУЗ (1996-1998 гг.). У пациентов с ОГО, лечившихся в ЛОКБ, осложнения ожоговой болезни со стороны органов дыхания развивались в 318 (55%) клинических наблюдениях, что на 34% реже (р<0,05), чем у пациентов провинциальных больниц. При лечении тяжелообожженных в ожоговом центре на 29% достоверно реже (p<0,01), чем у пациентов муниципальных ЛПУ, регистрировались проявления почечной недостаточности. При оказании помощи пострадавшим от ОГО в специализированном ожоговом стационаре у последних достоверно (на 8%) снижалась частота желудочных кровотечений.
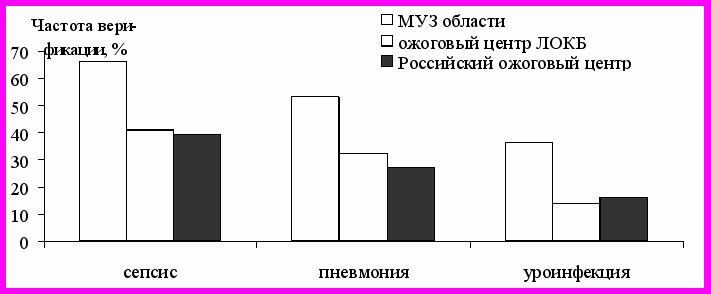
Осложнения
Рисунок 3 - Частота гнойных осложнений ОБ (в %) у пациентов
с ОГО, проходивших лечение в ЛПУ разного ранга в 1996-1998 гг
Показатели частоты инфекционных осложнений у пострадавших с ОГО в ЛПУ разного ранга приводятся на рис. 3, из данных которого следует, что частота сепсиса при ОГО в случае их лечения в ожоговом центре ЛОКБ почти на 25% достоверно реже, чем у пациентов провинциальных МУЗ (p<0,01), что соответствует результатам работы Российского ожогового центра. Частота развития пневмоний и уроинфекции у обожженных с ОГО, лечившихся в региональном ожоговом центре, оказалась, соответственно на 22 и 21% достоверно меньше, чем при лечении пострадавших в МУЗ (p<0,05).
Сведения о частоте ошибок при оказании медицинской помощи пострадавшим с ОГО в больницах малых городов и сельских поселений в сравнении с результатами работы регионального ожогового центра приводятся в табл. 7, данные которой свидетельствуют о том, что в первом случае эта величина значительно больше (p<0,001).
Таблица 7 - Основные ошибки оказания медицинской помощи
пострадавшим с ОГО в ЛПУ в 1996-2007 гг
| Ошибки лечебно-диагностического процесса | Число случаев (в %) при лечение пациентов в | |
| МУЗ | ЛОКБ | |
| Неправильное определение - площади ожога - глубины ожога | 42,2 33,4 | 1,6 3,2 |
| Неправильная оценка тяжести состояния, в т.ч.: - не диагностирован ожоговый шок - не диагностировано термо-ингаляционное поражение | 31 66 | 0 1,1 |
| Ошибки, допущенные при эвакуации, в т.ч.: - отсрочка эвакуации - транспортировка пострадавшего в состоянии ожогового шока без проведения инфузий (перед и в процессе) | 15,2 19,3 | 0,7 1,6 |
| Ошибки противошоковой терапии, в т.ч.: - недостаточный либо избыточный объем инфузий - неадекватный состав инфузий | 92 83 | 1,1 0,4 |
| Ошибки местного лечения ожоговых ран, в т.ч.: - отказ от проведения туалета ожоговых ран - использование мазей (эмульсий) на жировой основе | 11 35 | 0 4,3 |
| Ошибки оперативного лечения, в т.ч.: - невыполнение декомпрессионной некротомии - отсрочка ампутации при наличии показаний - применение устаревших способов аутодермопластики | 9 14 20 | 2 4 0 |
| Отказ от энтеральной регидратации и лечебного питания | 88 | 3,1 |
| Ошибки при проведении антибиотикотерапии | 64 | 3,8 |
| Ошибки при проведении иммунотерапии | 56 | 7,7 |
| Дефекты оформления медицинской документации | 56 | 3,1 |
Хирурги и травматологи МУЗ на 35-40% чаще допускают ошибки при определении площади и глубины поражения, в одном из трех случаев не диагностируют ожоговый шок, в двух из трех наблюдений – термоингаляционное поражение. Каждый пятый пострадавший с ОГО транспортируется в МУЗ без проведения инфузий в пути. У большинства пациентов с ОГО (в 9 из 10 наблюдений) при лечении в МУЗ объем и состав инфузий при противошоковой терапии следует признать неадекватным. В ожоговом центре частота таких ошибок не превышает 1-3% от всех наблюдений. При лечении пострадавших с ОГО в больницах малых городов часто используются устаревшие малоэффективные виды антисептиков, а также мази на жировой основе – в 35% наблюдений. Почти в 20% клинических наблюдений ОГО хирурги МУЗ не выполняют некротомию, используют устаревшие методы кожной пластики. Лечебное питание в хирургических отделениях МУЗ использовалось лишь у каждого десятого тяжелообожженного. В 60 и 50% наблюдений ОГО отмечены ошибки при антибиотико- и иммунотерапии.
Как следствие ошибок, показатель общей летальности среди пострадавших от ОГО, лечившихся в МУЗ области, составил 79%, что достоверно выше (р<0,001), чем в ЛОКБ. При лечении аналогичного контингента пострадавших в ожоговом центре ЛОКБ летальные исходы констатированы в 53,6% случаев, что лишь на 5,5% выше средней величины, отражающей результаты работы ожоговых центров РФ. Основной причиной летальных исходов при ОГО в 1996-2007 гг., независимо от ранга ЛПУ, где оказывалась медицинская помощь, оказывались сепсис и полиорганная недостаточность. Непосредственной причиной смерти каждого третьего пациента с ОГО, лечившегося в МУЗ, оказывался шок, а каждого пятого - почечная недостаточность. В группе обожженных, проходивших лечение в ЛОКБ, данные осложнения констатировались реже, соответственно на 19% и 13% (табл. 8).
Таблица 8 – Причины летальных исходов пострадавших
с ОГО в ЛПУ разного ранга в 1996-2007 гг
| Непосредственная причина смерти | Частота (в %) у обожженных с ОГО в | |
| МУЗ ЛО | ожоговом центре ЛОКБ | |
| сепсис | 63 | 69 |
| ожоговый шок | 29 | 10 1 |
| пневмония | 30 | 25 |
| респираторный дисстресс-синдром | 22 | 28 1 |
| острая почечная недостаточность | 21 | 8 1 |
| тромбоэмболия легочной артерии | 3 | 1 |
| желудочное кровотечение | 3 | 3 |
| инфаркт миокарда | 2 | 0,2 1 |
| 1 - достоверно по сравнению с пациентами МУЗ (р<0,05) | ||
При увеличении площади глубокого ожога показатель летальности закономерно и достоверно возрастает, однако при лечении обожженных в ожоговом центре головного ЛПУ региона показатели частоты случаев летальных исходов пострадавших достоверно ниже, чем при лечении в МУЗ, что соответствует показателям работы клиники термических поражений ВМедА (табл. 9).
Технологические составляющие путей повышения эффективности оказания медицинской помощи пострадавшим от ОГО включают: совершенствование методов противошоковой и иммунотропной терапии; разработку, апробацию и внедрение способов местного лечения ран, направленных на ускорение их подготовки к кожной пластике; оценку эффективности и внедрение в клиническую практику малотравматичных методов удаления ожогового струпа и восстановления кожного покрова.
Таблица 9 – Показатели летальности с учетом площади глубокого ожога
| Площадь глубокого ожога, % п.т. | Частота случаев летальных исходов (в %) у пациентов | ||
| МУЗ (1996-1998 гг.) | ЛОКБ (1999-2007 гг.) | ВМедА (1997-2001 гг.)2 | |
| 0-10 | 12,5 | 3,7 1 | 1,9 |
| 11-20 | 56,6 | 26,8 1 | 29,4 |
| 21- 30 | 82,7 | 63,7 1 | 75,0 |
| 31-40 | 87,6 | 71,7 1 | 77,3 |
| 41-50 | 100 | 74,8 1 | 83,3 |
| свыше 50 | 100 | 84,4 1 | - |
| 1 - достоверно по сравнению с пациентами МУЗ (р<0,001); 2 – по М. Муталибову (2006) | |||
Один из путей повышения эффективности противошоковой терапии при ОГО основан на применении инфузионных сред с антигипоксантным и антиоксидантным действием. В ходе экспериментов установлено, что при ОГО противошоковая терапия мафусолом, реамберином или цитофлавином в объемах 10 мл/кг достоверно снижает (р<0,05) летальность животных, соответственно на 29%, 28% и 22%; при увеличении объема инфузий до 30 мл/кг летальность достверно снижается (р<0,01) еще более, соответственно на 38%, 32% и 24% (рис. 4). Включение в состав противошоковой терапии препарата, содержащего фермент супероксиддисмутазу, снижает летальность животных лишь на 10%.
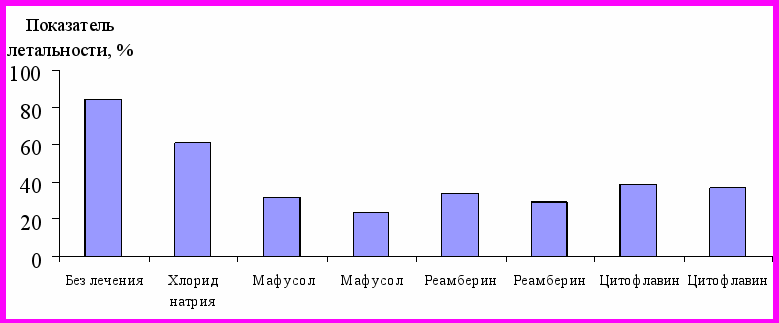
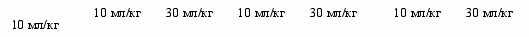
Рисунок 4 – Показатели летальности среди крыс
с ОГО после инфузии антигипоксантов
Кристаллоидный раствор мафусол оказывал слабое влияние на центральную гемодинамики и диурез. Напротив, введение ПОФ сопровождается выраженным гемодинамическим и диуретическим эффектом на протяжении всего периода введения препарата и 4-6 ч спустя, что свидетельствует об улучшении адаптации системы гемодинамики к ОГО: ЦВД повышается на 26,5 5,5 мм. вод. ст. (р<0,05); систолическое АД увеличивается на 18,2 3,1 мм. рт. ст.; почасовой диурез увеличивается на 53,1 14,2 мл/ч (р<0,05). При тяжелом ожоговом шоке спустя 30 минут после начала инфузии ПОФ, по сравнению с группами, где переливали мафусол и хлорид натрия, систолическое АД увеличилось на 13 и 17% (р0,05); ЦВД возросло на 50 и 60% (р<0,05); диурез на 37 и 46% (р<0,05). Спустя 6 ч введения ПОФ ЦВД увеличилось на 28 и 41% (р<0,05), а диурез на 20 и 48% (р<0,05) соответственно (табл. 10).
Таблица 10 – Показатели гемодинамики и диуреза при тяжелом
ожоговом шоке с учетом использования мафусола и ПОФ
| Показатели | Средние значения показателей (Х ± m) | ||||||
| до ин-фузии | через 30 мин после начала | через 6 ч после начала | |||||
| 0,9% NaCl | мафусола | ПОФ | 0,9% NaCl | мафусола | ПОФ | ||
| сист. АД, мм. рт. ст. | 10319 | 10611 | 1119 | 12712 | 1129 | 11513 | 12216 |
| ЦВД, мм. вод. ст. | 124 | 174 | 214 | 426 1 | 5610 | 6812 | 9415 1 |
| ЧСС, уд. / мин | 10716 | 10319 | 10520 | 12015 | 11418 | 11516 | 11215 |
| диурез, мл/ч | 4823 | 549 | 6321 | 9912 1 | 9412 | 14316 1,2 | 17818 1,2 |
| 1 – достоверно (р<0,05) по сравнению с инфузией 0,9% NaCl; 2 – достоверно (р<0,05) по сравнению с предыдущим этапом | |||||||
Инфузии мафусола и ПОФ в остром периоде ожоговой болезни купируют гипергликемию. При тяжелом ожоговом шоке содержание глюкозы в плазме спустя 30 минут после инфузии снижалось на 1,4 и 1,2 г/л. Спустя 6 ч уровень глюкозы достоверно снижался на 59% и 54% от исходного уровня (р<0,05).
Инфузия реамберина в периоде ожогового шока сопровождалась снижением уровней общего билирубина на 42%, АсТ на 34%, АлТ на 36% (р<0,05). Как и при введении мафусола и ПОФ, после инфузии реамберина почти вдвое достоверно снижался уровень глюкозы плазмы (р<0,05) (табл. 11).
Таблица 11 – Лабораторные показатели при тяжелом
ожоговом шоке с учетом использования реамберина
| Показатели | Средние значения показателей (Х ± m) | ||||
| до инфузии | через 30 мин после начала | через 6 ч после начала | |||
| 0,9% NaCl | реамберина | 0,9% NaCl | реамберина | ||
| мочевина, ммоль/л | 6,23,1 | 7,12,4 | 7,01,2 | 7,62,6 | 4,61,2 |
| билирубин, ммоль/л | 9,13,4 | 8,52,7 | 8,11,4 | 9,43,1 | 4,71,1 1,2 |
| глюкоза, г/л | 9,12,5 | 10,62,2 | 8,42,5 | 8,22,5 | 4,11,0 1,2 |
| АлТ, нмоль/л | 32,24,8 | 30,22,3 | 31,41,9 | 29,72,1 | 20,31,9 1,2 |
| АсТ, нмоль/л | 34,54,6 | 34,84,8 | 32,23,5 | 30,62,7 | 21,42,1 1,2 |
| 1 - достоверно (р<0,05) по сравнению с инфузией 0,9% NaCl; 2 - достоверно (р < 0,05) по сравнению с предыдущим этапом | |||||
Введение цитофлавина в первые сутки тяжелого ожогового шока сопровождается достоверным снижением содержания глюкозы (на 2,8 г/л), креатинина (на 4,6 ммоль/л), мочевины (на 3,2 ммоль/л) плазмы. На протяжении всего периода введения препарата и сутки спустя в 47% наблюдениях констатировано уменьшение содержания глюкозы (р<0,05), у 66% пациентов - трансаминаз, в 79% случаев – уровня мочевины (р<0,05) (табл. 12).
Таблица 12 - Лабораторные показатели при тяжелом
ожоговом шоке с учетом использования цитофлавина
| Показатели | Средние значения показателей (Х ± m) | ||||
| до инфузии | через 30 мин после начала | через 6 ч после начала | |||
| 0,9% NaCl | цитофлавина | 0,9% NaCl | цитофлавина | ||
| мочевина, моль/л | 6,2±3,1 | 7,1±2,4 | 6,6±1,9 | 7,6±2,6 | 5,3±1,5 |
| креатинин, ммоль/л | 9,8±2,2 | 9,9±2,0 | 10,2±2,4 | 10,7±2,4 | 10,9±2,0 |
| билирубин, ммоль/л | 9,1±3,4 | 8,5±1,7 | 7,5±1,7 | 9,4±1,1 | 8,1±1,5 |
| глюкоза, г/л | 6,1±1,0 | 8,6±1,2 | 8,0±1,0 | 8,2±2,5 | 7,2±0,9 |
| АлТ, нмоль/л | 32,2±4,8 | 30,2±2,3 | 27,5±2,0 | 29,7±2,1 | 21,5±1,5 1,2 |
| АсТ, нмоль/л | 34,5±4,6 | 34,8±4,8 | 28,0±2,4 | 30,6±2,7 | 33,5±2,0 2 |
| 1 - достоверно (р<0,05) по сравнению с инфузией 0,9% NaCl; 2 - достоверно (р<0,05) по сравнению с предыдущим этапом | |||||
Типовым патологическим процессом при ОГО является окислительный стресс. Для оценки его выраженности, а также эффективности проводимой антиоксидантной терапии у пострадавших с ОГО при поступлении в стационар, а также на фоне противошоковой терапии, в пробах крови люминесцентным методом определяли уровень активных форм кислорода. Установлено, что ОГО сопровождаются повышением их уровня, о чем свидетельствует увеличение люминесценции артериальной и венозной крови уже через час после ожога.
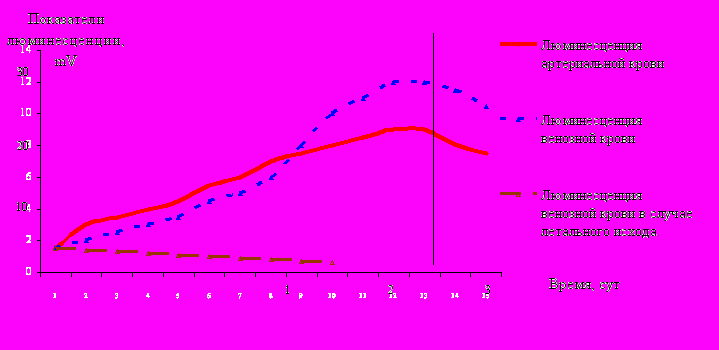

А
Б
Рисунок 5 – Показатели люминесценции крови пострадавших после ОГО
В первые часы после ОГО люминесценция артериальной крови увеличивалась больше, чем в венозной. На 2-3-и сутки наблюдали значительное увеличение люминесценции венозной крови по сравнению с артериальной. Люминесценция крови увеличивалась в течение 3-х суток после травмы, достигая максимума в период выхода пострадавшего из состояния шока. Через 4-5 суток после ОГО наблюдали её снижение, не достигающее нормы. В зависимости от тяжести травмы и особенностей течения ожогового шока разрешение спазма микроциркуляции (точка А на рис. 5) и выход пострадавшего из состояния шока (точка Б на рис. 5) происходили в разные сроки. Динамика интенсивности люминесценции и ее максимальные значения в каждом случае ОГО оказались различны, её интенсивность зависела от тяжести травмы. Внутривенное введение супероксиддисмутазы пострадавшим с ОГО сопровождалось достоверным снижением уровня активных форм кислорода спустя 15 мин - на 21%, спустя
18 ч - на 30%, через 24 ч – на 37% по сравнению с плацебо (рис. 6).
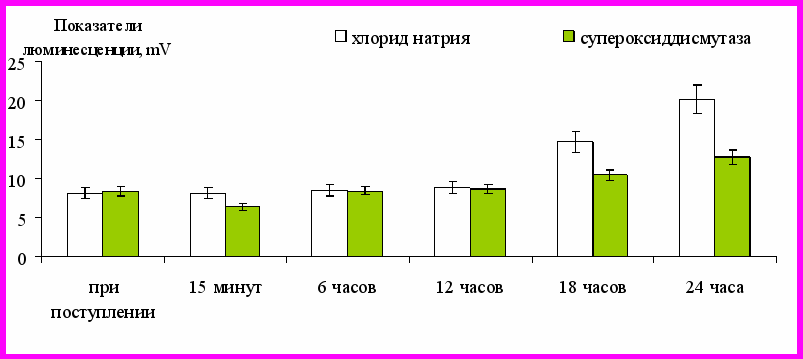
Время
Рисунок 6 – Показатели люминесценции венозной крови пострадавших
после ОГО на фоне введения супероксиддисмутазы
Клинико-иммунологическая эффективность иммунотропных препаратов оценивали в острых опытах на грызунах после воспроизведения ОГО. При однократном введении экспериментальным животным тималина и дерината выживаемость после ОГО 35% (на 10% больше плацебо, р>0,05). Двухкратное введение дерината повышало выживаемость после ОГО на 15%. Однократное введение ронколейкина увеличило выживаемость на 20% (р>0,05), а двухкратное – достоверно на 45% (р<0,05).
У пострадавших с ОГО иммунотропные препараты применяли при развитии тяжелого сепсиса, для верификации использовали критерии, принятые на согласительной конференции в г. Калуга (по В.С. Савельеву и соавт., 2004).
Курсовое введение дерината (по 75 мг дважды в сутки) к исходу первых суток сопровождалось тенденцией к достоверному снижению клинико-лабораторных признаков интоксикации у 68% пациентов: температура тела снижалась с 39,0 до 38,70С, частота пульса с 109 до 106 ударов в минуту, число дыхательных движений с 25,4 до 24,8 в минуту, количество лейкоцитов с 16,7 до 14,5.109/л. Спустя 7 суток в 88% случаев у пострадавших с ОГО температура тела снижалась до 37,20С (р<0,05), пульс – до 94 ударов в минуту (р<0,05), число дыхательных движений – до 22,6 в минуту, количество лейкоцитов – до 10,1.109/л (р<0,05), что свидетельствует о купировании признаков интоксикации и проявлений системной воспалительной реакции.
У выживших пациентов к 7-м суткам введения дерината отмечено снижение количества лейкоцитов (с 16,4 до 10,1.109/л, р < 0,05), повышение абсолютного и относительного количества лимфоцитов (соответственно с 2,1 до 3,4.109/л и с 15,2 до 27,2%), абсолютного и относительного количества Т-лимфоцитов (соответственно с 0,9 до 1,6.109/л и с 36,3 до 46,8%, р<0,05), а также Т-хелперов (соответственно с 0,7 до 1,7.109/л и 33,1 и 42,1%, р<0,05). Содержание иммуноглобулинов классов А и М достоверно повышалось, соответственно, с 1,7 до 2,4 и с 1,5 до 2,0 г/л, уровни циркулирующих иммунных комплексов снижались с 94 до 52 ед. (р<0,05).
При верификации тяжелого сепсиса у пострадавших с ОГО применение ронколейкина в дозе 1 млн. МЕ обеспечивало купирование клинико-лабораторных проявлений интоксикации в 79% наблюдений уже после однократной инфузии: температура тела достоверно снижалась с 39,0 до 36,90С (р<0,05), частота пульса с 109 до 92 в минуту (р<0,05), частота дыхания с 25,4 до 21,5 в минуту. Количество лейкоцитов в крови снижалось с 16,7 до 9,2.109/л. Одновременно у пациентов отмечена достоверная тенденция к восстановлению показателей иммунитета: повышалось абсолютное и относительное количество лимфоцитов (соответственно, с 2,5 до 3,5.109/л и с 18,5 до 26,7%), абсолютное и относительное количество лимфоцитов, Т-лимфоцитов (соответственно, с 1 до 1,7.109/л и с 42% до 49%, р<0,05). Со стороны гуморального иммунитета констатирована тенденция к повышению уровней иммуноглобулинов классов А и М, соответственно на 180% и 190%. Уровни циркулирующих иммунных комплексов достоверно снижались с 89 до 56 ед. (р<0,05), одновременно уменьшались проявления функциональной недостаточности клеточного иммунитета, оцениваемые по реакции торможения миграции лейкоцитов в ответ на фитогемаглютинин (с 82% до 63%, р < 0,05) и конкавалин А (с 92% до 59%, р<0,05). В 21% клинических наблюдений введение ронколейкина на тяжести состояния не отразилось, состояние не стабилизировалось. В дальнейшем эти пострадавшие погибли на фоне прогрессирования ПОН, в крови при этом сохранялись выраженная лимфопения, пониженное относительное содержание лимфоцитов.
Инфузия пентаглобина в дозе 5 мл/кг/сутки со скоростью 28 мл/ч пострадавшим с ОГО с верифицированным тяжелым сепсисом уже спустя сутки сопровождалась регрессом тяжести интоксикации и проявлений системной воспалительной реакции: температура тела снижалась с 39,3 до 37,10С (р<0,05), пульс с 116 до 94 (р<0,05), частоты дыхания с 26,2 до 20,2 в минуту. Уже через 24 ч после инфузии пентаглобина у пострадавших с ОГО достоверно снижался лейкоцитоз с 19,2 до 10,2 .10 9/л (р<0,05), повышалось абсолютное и относительное количество лимфоцитов, соответственно, с 1,8 до 3,6.109/л и с 16,4 до 27,4% (р<0,05), абсолютное и относительное количество Т-лимфоцитов, соответственно с 0,9 до 1,9.109/л и с 39,8 до 53,7% (р<0,05), абсолютное и относительное количество Т-хелперов, соответственно с 0,6 до 1,6.109/л и с 27,2 до 39,2% (р<0,05). Одновременно отмечено уменьшение абсолютного количества Т-супрессоров с 0,71 до 0,58.109/л, а также циркулирующих иммунных комплексов с 95 до 51 ед. (р<0,05). При оценке гуморального иммунитета констатировано закономерное значительное повышение уровней иммуноглобулинов классов А и G, соответственно с 1,9 до 3,7 и с 13,3 до 21,1 г/л (р<0,05).
В экспериментах на моделях ожогов разной глубины изучена эффективность ряда ранозаживляющих средств, при этом целенаправленно изучалась целесообразность применения в системе хирургического лечения пострадавших с ОГО различных видов раневых покрытий. При ожоговом поражении IIIа степени местное применение мазей интерлейкина-1, кластерного серебра и супероксиддисмутазы достоверно сокращало срок заживления на 5,7; 5 и 3,8 суток, т.е. на 13,8; 12,1 и 9,2% (р<0,05). При ожогах IIIб степени местное применение мазей кластерного серебра, интерлейкина-1, супероксиддисмутазы, а также смеси последних ускорило репарацию лишь на 3-5,8 суток, т.е. на 6-11,7% (табл. 13). Мазь интерлейкина-1 ускоряла на 25-30% срок очищения ОГО от струпа. Местное применение мази с супероксиддисмутазой, не оказывая влияния на скорость отторжения струпа, ускоряло эпителизацию на 22-26%. Наиболее эффективным оказалось применение гидрофильной мази, содержащей активированное кластерное серебро, её использование обеспечило ускорение процессов заживления ОГО почти на 6 суток (т.е. 12%).
