Учайкин Василий Федорович. Российский государственный медицинский университет Доктор медицинских наук, профессор Коровина Нина Алексеевна Российская академия постдиплом
| Вид материала | Диплом |
- В. С. Васильев профессор кафедры инфекционных болезней с курсом детских инфекций Учреждения, 414.81kb.
- Минкина Галина Николаевна Доктор медицинских наук, профессор Ткачева Ольга Николаевна, 285.5kb.
- Машков Александр Евгеньевич Доктор медицинских наук, профессор Гельдт Вадим Георгиевич, 634.94kb.
- Гембицкая Татьяна Евгеньевна профессор доктор медицинских наук Луговская Светлана Алексеевна, 231.82kb.
- Президента Республики Беларусь», профессор, доктор медицинских наук Э. Е. Малевич;, 526.91kb.
- Сергиев Владимир Петрович Член-корреспондент рамн, доктор медицинских наук, профессор, 829.91kb.
- Уважаемые коллеги! Приглашаем Вас принять участие, 66kb.
- Профессор Токаревич, 1082.53kb.
- И. О. Походенько-Чудакова, заведующая кафедрой хирургической стоматологии Учреждения, 682.39kb.
- «Лучший преподаватель медицинского вуза», 118.51kb.
*тестирование специфических анти-ЦМВ IgG и IgM проводится при условии, что в предоперационном периоде ребенок не получал препараты крови и иммуноглобулины.
** - проведение повторного теста необходимо при нарастании уровня трансаминаз или появлении других клинико-лабораторных признаков холангита.
*** - Цитотект – 2 мл/кг/сут через день – 3-х кратно.
Рис 6. Схема вирусологического обследования и специфического лечения больных с БА в раннем послеоперационном периоде
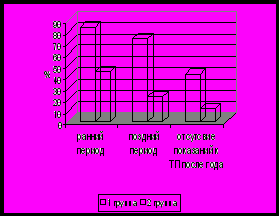
Рис 7. Процент восстановления проходимости желчевыводящей системы у детей с БА после операции по Касаи в зависимости от проводимой терапии.
В раннем периоде после операции нормализация цвета стула и снижение уровня билирубина отмечалась у 16 детей (84%) гр. 1 по сравнению с 4 детьми (44%) гр.2 (р<0,05) Нормализация билирубина и снижение или нормализация других клинико-лабораторных проявлений в дальнейшем отмечалась у 14 детей (74%) гр.1, тогда как в гр.2 – только у 2 больных (22%) (р<0,05). Выживаемость детей более 1 года без желтухи с хорошим качеством жизни и без показаний к трансплантации печени составила 42% (8/19 человек) в гр.1 и 11% (1/9) в гр. 2 (р.<0,05).
После выписки из стационара не менее важным аспектом, определяющим выживаемость детей с БА, является динамическое их наблюдение, направленное на выявление возможных осложнений (таб 6).
Таб 6. Схема амбулаторного обследования детей с БА после хирургического лечения.
| Время после операции: | Обследования: |
| 1-2 месяц | Осмотр, ОАК, Б/х анализ крови-2/мес УЗИ, липидограмма кала – 1/мес |
| 3-6 месяцев | Осмотр, ОАК, Б/х анализ крови, УЗИ – 1/мес Липидограмма кала -1/2 мес до нормализации ФЭГДС- 1/6 мес. |
| 7-12 месяцев | Осмотр, ОАК, Б/х анализ крови-1/1,5-2 мес. УЗИ – 1/3 мес ФЭГДС - 1/6 мес |
| После 12 месяцев | Осмотр, ОАК, Б/х анализ крови, УЗИ – 1/ 2-3мес ФЭГДС -1/6 мес. |
В нашем исследовании установлена высокая частота развития холангита: в течение первого послеоперационного месяца у 76% детей, в более поздние сроки – у 61%. Изучено течение 40 случаев острого холангита у 21 ребенка в период от 2,5 недель до 12 месяцев после операции. Развитие холангита у всех детей сопровождалось повышением температуры до фибрильных значений, которая плохо купировалась жаропонижающими препаратами. У большинства выявлено увеличение размеров селезенки и печени, а также эпизоды гипо/ахолии стула. У 60% больных отмечалось появление или нарастание желтухи. У 14% детей на фоне острого холангита отмечалось развитие портальной гипертензии в виде асцита и варикозного расширения вен пищевода 2-3 степени. У всех выявлено повышение СРБ в среднем в 6,5+2,6 раз и СОЭ в 4,6+1,8 раз, изменения лейкоцитаной формулы (лейкоцитоз со сдвигом формулы влево -78%, лейкопения со сдвигом формулы влево -22%). У большинства (83%) - снижение уровня гемоглобина в 1,4+0,3 раз. Более чем в 70% отмечалось повышение биохимических маркеров холестаза (билирубина в 6,2+3,8 раз, ГГТ – в 8,2+3,2 раз, холестерина 2,5+0,8 раз) и синдрома цитолиза в среднем в 3,5+0,9 раз. Стартовая антибактериальная терапия назначалась с учетом предполагаемой этиологии и особенностями метаболизма препаратов, в дальнейшем на основании результатов микробиологических исследований. В более чем половине случаев (26/40) в связи с отсутствием эффекта в течение 3-х дней от начала лечения проводилась смена антибиотика (монотерапия была эффективна в 11 случаях, сочетание 2-х препаратов потребовалось в 15 наблюдениях). Длительность лечения с использованием парентерального пути введения препаратов варьировала от 2 недель до 3,5 месяцев, в среднем 3,5+0,5 недель и включала от 1 до 6 курсов. После нормализации клинико-лабораторных проявлений осуществлялся переход на пероральное введение. В большинстве случаев (81%) на фоне проводимой антибактериальной терапии отмечалась положительная динамика с постепенным купированием клинических и уменьшением лабораторных проявлений. Полученные нами результаты явились основой рекомендовать длительный (в течение 3-6 месяцев после операции) профилактический прием антибактериальных препаратов под контролем клинико-лабораторных маркеров воспаления, а при развитии острого холангита – смену антибактериального препарата и по показаниям – парентеральное введение.
Независимо от этиологии заболевания, дети с длительно сохраняющимся синдромом холестазом, требуют проведения лечения, включающего УДХК, лечебное питание и жирорастворимые витамины. Изучение эффективности УДХК в комплексной терапии неонатального холестаза, являющегося следствием осложненного течения перинатального периода проведено у 60 детей (рис 8).
а б
в

 г
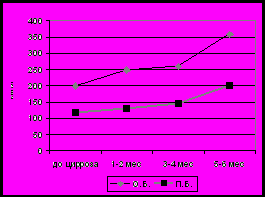
гРис 8. Сывороточный уровень О.Б. и П.Б (а), АЛТ, АСТ, ГГТ (б), желчных кислот (в) и клинические проявления холестаза на фоне лечения препаратом урсодезоксихолевой кислоты.
Через 7-10 дней от начала лечения у детей гр.1 размеры печени были достоверно меньше (3,2+1,1 см против 4,5+0,8см, р<0,05), ниже уровень О.Б. (76,9мкМ/л+45 против 166,1+82,1мкМ/л, р<0,01) и П.Б. (39+25мкМ/л против 94+60мкМ/л, р<0,05). Через 14-21 день у всех детей гр.1 клинические проявления холестаза купировались, уровень О.Б, холестерина, В-ЛПД нормализовались, в половине случаев - ПБ, в то время как в гр.2 у 89% сохранялось увеличение печени и желтуха, оставались повышенными биохимические показатели. Показатель ГГТ через 3 недели превышал норму в гр.1 и достоверно не отличался от уровня до лечения препаратом УДХК; тогда как в гр.2 показатель ГГТ достоверно увеличился от исходного уровня (p<0,05) (рис 8).
На фоне приема препарата УДХК через 14-21 день в обеих группах отмечалось повышение ферментов цитолиза. Достоверного прироста АЛТ и АСТ в гр. 1 на фоне лечения не отмечалось, тогда, как в гр. 2 отмечается достоверное повышение активности АСТ (p<0,05). Мы считаем, что, по-видимому, у новорожденных детей с тяжелой внепеченочной перинатальной патологией, повышение уровня данных ферментов может быть обусловлено и другими факторами - гипоксически-ишемическими состояниями перинатального периода, а также использованием потенциально гепатотоксичных лекарств и препаратов крови. Подтверждением является отсутствие отличий в уровне АЛТ, АСТ у детей, получающих УДХК и группой сравнения. Нормализация размеров печени при УЗИ отмечалось у 20 (71%) детей гр.1 и только у 1-го в гр.2. При сравнении результатов желчных кислот отмечалось снижение всех фракций, независимо от возраста ребенка. Достоверное снижение глициновых конъюгатов (ГДХ и ГХД) отмечалось у детей 23-30 дней жизни (p<0,05) и у детей 31-58 дней жизни (p<0,01), а также снижение суммы конъюгированных желчных кислот (p<0,05). У детей в возрасте 31-58 суток жизни отмечалось достоверное снижение Х (p<0,001), ДХ (p<0,05) и общей суммы желчных кислот (p<0,01). Тогда как достоверное снижение ЛХ и ДХ (p<0,05) и суммы свободных желчных кислот и общей суммы желчных кислот (p<0,001) было характерно для детей 23-30 дней жизни. Ни у одного ребенка гр.1 не отмечено клинических побочных явлений при приеме препарата УДХК, тогда как в гр.2 при использовании других желчегонных препаратов отмечались диспептические явления (вздутие, колики, диарея). Катамнестическое наблюдение после выписки из стационара свидетельствовало об исчезновении у всех детей гр.1 остаточных проявлений холестаза (ГГТ, холестерин, триглицериды) а также ферментов цитолиза АЛТ, АСТ и УЗ признаков холестаза в течение 4 недель-2,5 месяцев. В гр.2 увеличение размеров печени и повышение биохимических показателей холестаза и синдрома цитолиза сохранялось в течение 3-6 месяцев, а у 2-х больных – в течение 8 месяцев жизни.
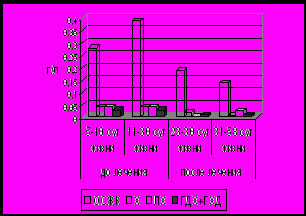
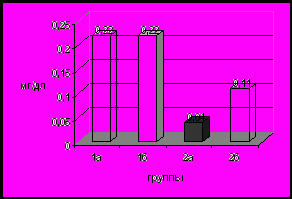
Неизбежным осложнением холестатических заболеваний является нарушение нутритивного статуса, своевременная коррекция которого имеет исключительно важное значение. При использовании лечебного питания с повышенным содержанием СЦТ показано обеспечение более адекватного физического развития и, в том числе, уменьшение дефицита массы тела у детей с тяжелыми прогрессирующими заболеваниями гепатобилиарной системы Степень уменьшения дефицита веса была прямо пропорциональна возрасту ребенка и соответственно длительности болезни (рис 9). Подобные закономерности выявлены при оценке степени экскреции липидов с калом. Отмечалось достоверное снижение уровня липидов в кале, особенно у детей, продолжительность холестаза которых составляла не более 2-х месяцев (рис 9). Следует отметить, отсутствие каких-либо существенных изменений в сывороточном уровне липидов. Полученные результаты позволяют рекомендовать назначение лечебного питания в максимально ранние сроки.
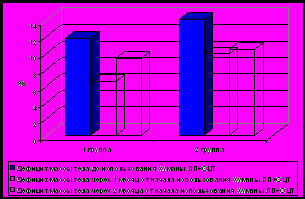
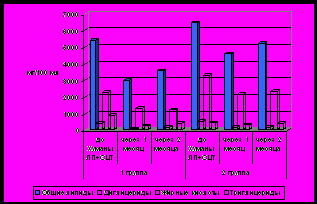
Рис 9. Динамика изменений дефицита массы тела и экскреции липидов с калом у детей 1 и 2 группы через 1 и 2 месяца использования лечебного питания (Хумана ЛП+СЦТ).
При исследовании концентрации жирорастворимых витаминов А (ретинол) и Е (токоферол) в крови доказано значительное снижение их уровня (рис 10).
а
 б
б
Рис 10. Сывороточный уровень токоферола (а) и ретинола (б) у детей с заболеваниями гепатобилиарной системы в зависимости от возраста и приема данных витаминов.
Референсные значения: ретинол 30-80 мг/дл, токоферол 0,8-1,5 мг/дл
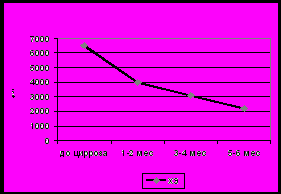
Отмечено более раннее и более выраженное формирование дефицита витамина Е по сравнению с витамином А. Наиболее низкие значения получены у детей, не получавших дополнительно данные витамины и имеющих признаки нарушения синтетической функции печени. Показана необходимость использования высоких доз данных витаминов.
При сопоставлении клинико-лабораторных проявлений с сывороточным уровнем данных витаминов не удалось выявить четких эквивалентов их дефицита. Полученные результаты определяют необходимость тестирования токоферола и ретинола в сыворотке крови с целью корректного подбора лечебной дозы этих витаминов.
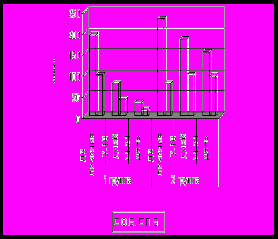
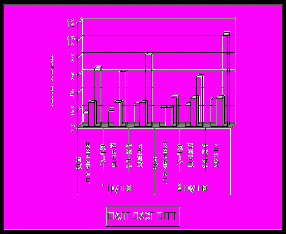
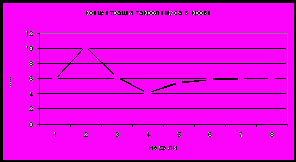
Неизбежным следствием многих заболеваний гепатобилиарной системы является формировании билиарного цирроза. На основании динамического наблюдения 90 детей было показано, что характерной особенностью цирроза печени, в исходе врожденных и наследственных заболеваний является раннее его развитие и быстрое прогрессирование. Наиболее ранним признаком является снижение активности фермента ХЭ в крови (рис 11). В большинстве случаев снижение данного показателя ниже нормы предшествовало появлению других отклонений, что позволяет рассматривать его в качестве прогностически неблагоприятного признака, свидетельствовавшего о высокой вероятности клинической манифестации цирроза печени в течение 3-6 месяцев. При изучении динамики биохимических маркеров холестаза от стадии болезни гепатобилиарной системы до стадии билиарного цирроза определены следующие закономерности: нарастание общего и прямого билирубина, снижение активности фермента ГГТ, уровня холестерина и В-ЛПД), активности трансаминаз (рис 11). При этом следует отметить достоверно более раннее и более выраженное снижение активности фермента ГГТ по сравнению с активностью трансаминаз (p<0,05). Кроме того, снижение ГГТ в большинстве случаев сочеталось со снижением фермента ХЭ. В связи, с чем динамическое наблюдение детей с БА позволяет выявить снижение активности фермента ГГТ, что является также ранним признаком, формирующегося цирроза печени. Существенно позже наблюдалось снижение холестерина и В-ЛПД. Низкий уровень данных показателей является одним из критериев неблагоприятного прогноза, свидетельствующего о высокой вероятности летального исхода в течение 3-х месяцев.
а
 б
б 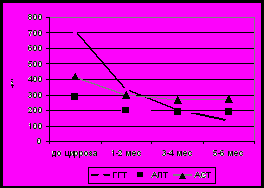
в
 г
г 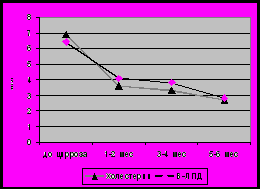
Рис 11. Сывороточный уровень ХЭ (а), ГГТ, АЛТ,АСТ (б), О.Б. и П.Б (в), холестерина и В-ЛПД (г) у детей с билиарной атрезией в период формирования цирроза печени (n-40).
Референсные значения: ХЭ 5100-11700 Ед/л, ГГТ до 50 Ед/л, АЛТ до 55 Ед/л, АСТ 5-40 Ед/л, О.Б. 1,7-20,7 мкМ/л, П.Б. 0-7,9 мкМ/л, холестерин 3,7-6,5 мМ/л, В-ЛПД 1,4-4,5 мМ/л.
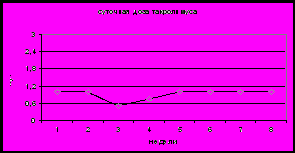
Единственным радикальным методом лечения цирроза печени является ТП. Нами проведен анализ результатов динамического наблюдения 30 детей, трансплантация которым выполнена в период с 1997 по 2007 гг. Длительность наблюдения варьировала от 1 до 10 лет. Наиболее частым осложнением после ТП являются инфекционные заболевания различной этиологии и реакция отторжения. Наиболее опасным осложнением является ЛПБ. Основной задачей динамического наблюдения детей после ТП является выявление возможных осложнений на начальных этапах их развития. Наиболее ранним отклонением, выявляемым при плановом обследовании детей, служит повышение активности ферментов (трансаминаз и ГГТ). Эти изменения могут быть обусловлены разными причинами и, в том числе реакцией отторжения, которая нами установлена у 9 детей. Показано, что на начальном этапе реакции отторжения характерно повышение активности ферментов (АЛТ, АСТ, ГГТ), которое сочетается со снижением концентрации такролимуса в крови и отсутствием признаков инфекционного процесса (рис 12). Повышение базовой иммуносупрессии, а в случае неэффективности – пульс терапия преднизолоном способствовали восстановлению функционального состояния трансплантата печени.
1а
 2а
2а 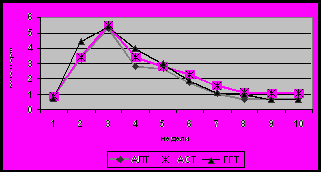
1б
 2б
2б 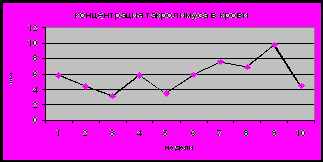
1в
 2в
2в 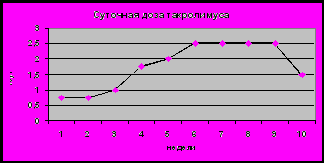
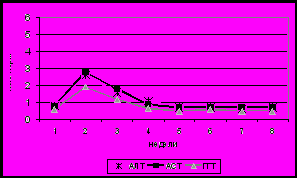
Рис 12. Сывороточный уровень АЛТ, АСТ, ГГТ (а), концентрация такролимуса в крови (б) и суточная доза такролимуса (в) при реакции отторжения (1) и на фоне неспецифических вирусных инфекций (2) у детей после трансплантации печени.
Гиперферментемия может быть следствием инфекционных осложнений после ТП. Нами проанализировано 35 случаев у 20 детей дисфункции трансплантата, вызванной неспецифическими инфекциями. Отличительной особенностью явилось сочетание повышенной активности ферментов (АЛТ, АСТ, ГГТ) с клиническими и лабораторными признаками инфекционного процесса, а также повышением концентрации такролимуса в крови (рис 12.). Лечебная тактика включала этиотропную терапию и снижение дозы такролимуса.
Наиболее опасным осложнением после ТП является лимфопролиферативная болезнь, представляющая В-клеточную лимфопролиферацию, вызванную вирусом Эпштеин-Барр. В нашем исследовании ЛПБ выявлена у 5 детей (17%). У одного ребенка наблюдалось 2 эпизода с интервалом более года и разной локализацией. Возраст детей при развитии ЛПБ в среднем составлял 19,7+10,5 месяцев жизни (от 7 до 34 месяцев), 9,2+7,8 месяцев после ТП (от 2 до 24 месяцев). Появление первых клинических признаков ЛПБ в 4-х случаях отмечалось спустя 2 недели после купирования клинических признаков ВЭБ инфекции. В одном случае - спустя 7 дней и у одного ребенка – спустя 5 дней. У всех детей увеличивались периферические лимфоузлы. У 4-х детей появлялся кашель и смешанная одышка, выявлено увеличение миндалин без воспалительных изменений. В 4-х случаях отмечалось небольшое повышение температуры до субфебрильных значений. Лабораторные проявления включали повышение сывороточного уровня фермента ЛДГ в среднем в 1,7+0,4 раза выше нормы и гамма-глобулинов в среднем составляло 1,4+0,2 нормы. В 5 наблюдениях снижался гемоглобин (в среднем 90+21 г/л (от 60 до 110 г/л)). Небольшая тромбоцитопения (139+10×109/л) выявлена в 3-х случаях. У всех детей определялась ДНК ВЭБ в крови, которая варьировала от 2.500 до 50.000 копий в мл. Четырем детям в связи с затрудненным дыханием, проведена ларингоскопия с биопсией увеличенного лимфоузла гортани. Выявлены увеличенные лимфоузлы, уменьшающие просвет гортани и явившиеся причиной затрудненного дыхания. Одному больному проведена тонзилэктомия с последующим гистологическим исследованием и определением ДНК ВЭБ в ткани миндалины. Одному ребенку выполнена пункционная биопсия миндалины. В результате, проведенных исследований обнаружены, характерные для ЛПБ гистологические изменения, а также ДНК ВЭБ методом ПЦР в биоптате. При УЗИ органов брюшной полости у одного ребенка показано увеличение лимфоузла в воротах печени (d-3,5-4 см), у другого - увеличение внутрибрюшных лимфоузлов (в воротах печени (d-14×20 мм), селезенки (d-19 мм) и мезентеральных (d до 20 мм)).
Таким образом, характерной особенностью лимфопролиферативной болезни является лимфоаденопатия любой локализации в сочетании с повышением активности фермента ЛДГ и гамма-глобулинов в сыворотке крови и выявлением ДНК ВЭБ в крови. При установлении данной болезни проводилось снижение дозы такролимуса на 50% или временная его отмена под контролем функционального состояния трансплантата. Предрасполагающим факторов является ВЭБ инфекция и особенно первичная, которая во всех случаях предшествовала развитию ЛПБ. Важным компонентом профилактики развития данной болезни мы считаем мониторинг ВЭБ в крови, позволяющий превентивно уменьшить иммуносупрессивную терапию. Схема мониторинга ВЭБ представлена в диссертации.
Выживаемость детей после ТП зависит не только от качества хирургического лечения но, также от адекватного подбора иммуносупрессивной терапии, предупреждения, раннего выявления и своевременной коррекции возможных осложнений. Наш опыт является тому подтверждением. В настоящее время под нашим наблюдением находится 37 детей после ТП. За более чем 11 летний период умер один больной, причиной смерти которого явился миелобластный лейкоз. Состояние здоровья всех остальных детей в пределах нормы.
Выводы:
- Основным проявлением поражений гепатобилиарной системы у детей первых месяцев жизни является синдром холестаза. Частота функциональных нарушений и этиологическая структура органических поражений печени и желчных путей у детей зависит от возраста. В периоде новорожденности более чем у половины детей (55%) нарушение функции печени носит вторичный характер и купируется по мере разрешения основного заболевания на фоне этиотропной и посиндромной терапии. С 3-х до 6 месяцев жизни доля вторичных поражений гепатобилиарной системы уменьшается в 2,5 раза; у детей старше 6 месяцев вторичные поражения перестают регистрироваться, заметно увеличивается процент билиарного цирроза (68%).
- В структуре заболеваний гепатобилиарной системы у детей первого полугодия жизни ведущее место занимает билиарная атрезия (45%) Далее по частоте встречаемости располагается синдром Алажиля (17%), болезнь Байлера (13%), неонатальный гепатит (5%), дефицит а-1-антитрипсина (4%), билиарный цирроз (4%), галактоземия (2%) и другие заболевания (10%).
- В периоде новорожденности патогномоничным признаком билиарной атрезии является сочетание постоянной ахолии стула и отсутствия визуализации желчного пузыря или его определение в виде «тяжа» при УЗИ натощак (чувствительность и специфичность –100%). Отличительным признаком поражений, обусловленных нарушениями синтеза или экскреции желчных кислот, является низкий уровень фермента ГГТ. При других заболеваниях, клинические и биохимические проявления холестаза не имеют специфических особенностей. Диагностическое значение имеет выявление сочетанных изменений других органов и результаты дополнительных исследований.
- Изменения гепатобилиарной системы при синдроме Алажиля имеют два варианта развития. Первый вариант, отмеченный у 70% больных, характеризуется формированием патологических состояний, нарушающих качество жизни больного и требующих проведения трансплантации печени. При втором варианте (30%) - характерно субклиническое течение болезни. Нормализация уровня билирубина во втором полугодии жизни является прогностически благоприятным признаком, свидетельствующим о легком варианте.
- Патогномоничным признаком болезни Байлера является синдром холестаза с низким уровнем фермента ГГТ сыворотки крови. Дети с данной болезнью составляют группу риска по развитию онкологических заболеваний гепатобилиарной системы, что определяет необходимость проведения соответствующего мониторинга.
- Морфологическое исследование биоптата печени позволяет подтвердить клинический диагноз при синдроме Алажиля, болезни Байлера, неонатальном гемохроматозе и дефиците а-1-антитрипсина. При билиарной атрезии морфологические изменения биоптата печени не являются специфичными. Диагностическое значение имеет их сочетание с макро- и микроскопическим исследованием желчевыводящей системы.
- Выявлена тесная взаимосвязь между активностью фермента ГГТ сыворотке крови и морфологической степенью выраженности фиброза по Десмет у детей с билиарной атрезией, что позволяет рассматривать данный биохимический показатель в качестве маркера морфологических изменений.
- Установлена высокая частота выявления ДНК ЦМВ в биоптатах печени больных с билиарной атрезией, что позволяет рассматривать данный вирус как один из вероятных этиологических факторов, приводящих к облитерации желчных протоков во внутриутробном периоде. Обоснована необходимость ПЦР мониторинга ДНК ЦМВ в крови, а в случае реактивации данной инфекции– введение специфического иммуноглобулина.
- Показана эффективность терапии, включающей кортикостероиды в раннем периоде после хирургического лечения билиарной атрезии, значительно повышающая выживаемость больных. Наиболее частым осложнением после оперативного лечения билиарной атрезии является развитие холангита (76% в раннем периоде и 61% - в отдаленные сроки), раннее выявление и адекватное лечение которого предупреждает развитие билиарного цирроза.
- Включение в комплексную терапию заболеваний, проявляющихся синдромом холестаза урсодезоксихолевую кислоту, лечебное питание с повышенным содержанием СЦТ и жирорастворимые витамины, способствует более быстрому купированию патологического процесса гепатобилиарной системы и предупреждает развитие целого ряда осложнений.
- Наиболее ранним признаком формирующегося билиарного цирроза является снижение сывороточного уровня фермента ХЭ ниже нормы и уменьшение в динамике активности ГГТ. Предложенный комплекс терапии осложнений цирроза печени позволяет поддержать состояние больного на этапе ожидания трансплантации печени.
- Разработаны методы ранней диагностики и лечения дисфункции трансплантата, вызванной инфекционными заболевания, различной этиологии, и реакцией отторжения, основанные на сочетанной оценке активности сывороточного уровня ферментов (АЛТ, АСТ, ГГТ), концентрации такролимуса в крови и клинико-лабораторных признаков инфекционного процесса.
- Наиболее опасным осложнением после трансплантации печени является лимфопролиферативная болезнь, выявленная у 17% детей. Обосновано проведение мониторинга ВЭБ в крови, позволяющего превентивно уменьшить иммуносупрессивную терапию и риск развития лимфопролиферативной болезни.
Практические рекомендации:
- Выявление синдрома холестаза в периоде новорожденности диктует необходимость дифференциального диагноза между вторичными нарушениями и заболеваниями гепатобилиарной системы. Определение факторов, способствующих нарушению экскреторной функции печени, зависимость этого нарушения от тяжести и продолжительности основного заболевания наиболее часто свидетельствует о вторичном характере поражения. Наличие холестаза у детей старше 3-х месячного возраста в большинстве случаев является достоверным признаком заболевания гепатобилиарной системы и требует углубленного обследования.
- В течение первого месяца жизни у детей с синдромом холестаза для диагностики билиарной атрезии необходима визуальная оценка цвета стула и проведение УЗИ желчного пузыря натощак. Выявление признаков внутрипеченочного холестаза с низким уровнем фермента ГГТ позволяет предположить поражения печени, обусловленные нарушениями синтеза или экскреции желчных кислот.
- У детей старше 2-х месяцев жизни с синдромом холестаза для подтверждения диагноза билиарной атрезии необходимо исключение других заболеваний гепатобилиарной системы и проведение теста с урсодезоксихолевой кислотой. Назначение данного препарата в дозе 20 мг/кг/сут в течение 1,5-2-х недель при билиарной атрезии не меняет картину УЗИ желчного пузыря, а стул остается обесцвеченным.
- При динамическом обследовании детей с синдромом Алажиля прогностическое значение имеет уровень билирубина, нормализация которого во втором полугодии жизни свидетельствует о высокой вероятности отсутствия показаний к проведению трансплантации печени в течение длительного времени, возможно, в течение всей жизни. Диагноз болезни Байлера всегда является показанием к трансплантации печени. При наблюдении детей наряду со стандартными исследованиями, рекомендовано определение альфа-фетопротеина, позволяющее выявить злокачественные образования гепатобилиарной системы на ранних сроках их развития.
- С целью подтверждения диагноза синдрома Алажиля, болезни Байлера, неонатального гемохроматоза необходимо проведение морфологического исследования биоптата печени. Для диагностики билиарной атрезии проведение биопсии печени не целесообразно. У детей с билиарной атрезией в возрасте от 1 до 4 месяцев жизни повышение активности ГГТ менее чем в 10 раз свидетельствует о значительной степени выраженности фиброза печени, соответствующей 3-4 степени по шкале Десмет.
- Первым этапом алгоритма дифференциальной диагностики служит сочетанная оценка стойкости ахолии стула и визуализации желчного пузыря при УЗИ натощак, позволяющая определить уровень поражения гепатобилиарной системы. Следующий этап включает выявление характерного для той или иной болезни симптомакомплекса и установление конкретной нозологической формы.
- У детей с билиарной атрезией необходимо определение ДНК ЦМВ методом ПЦР в биоптате печени и в крови интраоперационно и в крови после операции. При реактивации данной инфекции показано введение специфического иммуноглобулина (Цитотект 2 мл/кг/сут не менее трех раз внутривенно капельно) с последующем определением ДНК ЦМВ в крови методом ПЦР.
- У детей с билиарной атрезией в раннем периоде после операции рекомендовано проведение терапии преднизолоном по схеме.
- При синдроме холестаза, независимо от причины его развития показано проведение терапии, включающей препарат урсодезоксихолевой кислоты в дозе 20 мг/кг/день, лечебное питание с повышенным содержанием СЦТ и высоких доз жирорастворимых витаминов.
- Важным компонентом динамического обследования детей с заболеваниями гепатобилиарной системы является исследование активности фермента ХЭ сыворотки крови, низкий уровень которого свидетельствует о высокой вероятности формировании билиарного цирроза в течение 3-6 месяцев. Это определяет необходимость направления больных в центр трансплантации печени.
- После трансплантации печени рекомендовано динамическое обследование детей, включающего наряду со стандартными исследованиями определение концентрации иммуносупрессивного препарата (такролимуса) в крови. Коррекция иммуносупрессивной терапии осуществляется с учетом полученных результатов и срока после операции.
- Повышение активности ферментов (АЛТ, АСТ, ГГТ) наряду с отсутствием признаков инфекционного процесса и снижением концентрации такролимуса в крови свидетельствует о высокой вероятности развития реакции отторжения. Подтверждением служат результаты гистологического исследования биоптата печени. Лечение включает повышение дозы такролимуса, а в случае недостаточной эффективности – пульс терапию преднизолоном.
- Дисфункция трансплантата печени, обусловленная неспецифическими вирусными или вирусно-бактериальными инфекциями проявляется повышением активности ферментов (АЛТ, АСТ, ГГТ) и сопровождается повышением такролимуса в крови. Это состояние является показанием к снижению дозы такролимуса на 25-50% и проведению этиотропной терапии. В случаи инфекции, вызванной вирусом Эпштеин-Барр показан также ПЦР мониторинг данного вируса в крови и динамическое определение сывороточного уровня ЛДГ и гамма глобулинов.
- Критерием диагностики развития лимфопролиферативной болезни после трансплантации печени является лимфоаденопатия любой локализации в сочетании с повышением сывороточной активности ЛДГ, уровня гамма-глобулинов и выявлением ДНК ВЭБ в крови. При данной болезни проводится снижение дозы такролимуса на 50% или временная его отмена под контролем функционального состояния трансплантата и концентрации препарата в крови.
