Учайкин Василий Федорович. Российский государственный медицинский университет Доктор медицинских наук, профессор Коровина Нина Алексеевна Российская академия постдиплом
| Вид материала | Диплом |
- В. С. Васильев профессор кафедры инфекционных болезней с курсом детских инфекций Учреждения, 414.81kb.
- Минкина Галина Николаевна Доктор медицинских наук, профессор Ткачева Ольга Николаевна, 285.5kb.
- Машков Александр Евгеньевич Доктор медицинских наук, профессор Гельдт Вадим Георгиевич, 634.94kb.
- Гембицкая Татьяна Евгеньевна профессор доктор медицинских наук Луговская Светлана Алексеевна, 231.82kb.
- Президента Республики Беларусь», профессор, доктор медицинских наук Э. Е. Малевич;, 526.91kb.
- Сергиев Владимир Петрович Член-корреспондент рамн, доктор медицинских наук, профессор, 829.91kb.
- Уважаемые коллеги! Приглашаем Вас принять участие, 66kb.
- Профессор Токаревич, 1082.53kb.
- И. О. Походенько-Чудакова, заведующая кафедрой хирургической стоматологии Учреждения, 682.39kb.
- «Лучший преподаватель медицинского вуза», 118.51kb.
ЖП – желчный пузырь, УЗИ – ультразвуковое исследование.
В неонатальном периоде чувствительность и специфичность этих показателей составила 100% (чувствительность = ПТ/(ПТ+ЛО), где ПТ - положительный тест, ЛО – ложно отрицательный тест, специфичность = ОТ/(ЛП+ОТ), где ОТ- отрицательный тест, ЛП – ложно положительный тест). У детей старше месяца специфичность снижается до 96,6%, что определяет необходимость дополнительного обследования. У новорожденных и детей первых месяцев жизни наиболее частой причиной внепеченочного холестаза является БА. Вместе с тем, нарушение проходимости внепеченочной желчной системы может быть обусловлено кистой общего желчного протока и желчными пробками и/или камнями общего желчного протока. Для дифференциальной диагностики между этими заболеваниями наиболее информативным методом мы считаем - УЗИ, при котором наряду с отсутствием визуализации желчного пузыря могут быть выявлены изменения, характерные для кисты общего желчного протока, желчнокаменной болезни, "желчных пробок" общего желчного протока и БА.
Среди заболеваний, проявляющихся внутрипеченочным холестазом, диагностическое значение имеет активность фермента ГГТ, низкий уровень которого служит патогномоничным признаком болезней, в основе которых лежит нарушение синтеза или экскреции желчных кислот. Нарушение синтеза желчных кислот может быть обусловлено пероксисомальными нарушениями и ферментопатией. Нарушение экскреции желчных кислот лежит в основе доброкачественного семейного внутрипеченочного холестаза, болезни и синдрома Байлера. С целью проведения дифференциальной диагностики между этими болезнями необходимо определение желчных кислот в крови и желчи, а у детей старше 3-6 месячного возраста наличие кожного зуда. В нашем исследовании у всех детей (15 человек) с болезнью Байлера отмечалось значительное повышение уровня желчных кислот в сыворотки крови, которое превышало норму, в среднем в 46,5+14,2 раз. В 6 случаях проводилось также исследование спектра желчных кислот в сыворотке крови, при котором желчные кислоты были повышены за счет первичной холевой кислоты, синтезируемой в печени, тогда как вторичные кислоты (диоксихолевая и литохолевая), образование которых происходит в кишечнике из первичных, были существенно ниже нормы. Следовые концентрации желчных кислот в сыворотке крови и в желчи при повышении промежуточных продуктов их синтеза в сыворотке крови отражает нарушение синтеза ЖК. Две принципиально разные причины обуславливают нарушение синтеза ЖК: дефицит фермента, ответственного за синтез ЖК и пероксисомальные нарушения. Дифференциальная диагностика между этими состояниями основана на оценке состояния ЦНС и почек, а также определении уровня длинноцепочечных (С22) жирных кислот. Для пероксисомальной недостаточности характерны патологические изменения ЦНС и почек, а также повышение уровня длинноцепочечных (С22) жирных кислот. Указанные изменения не встречаются при нарушении синтеза ЖК, вследствие ферментопатий. Учитывая наследственный характер представленных заболеваний, их подтверждением могут быть также результаты молекулярно-генетического тестирования специфического локуса.
Синдром внутрипеченочного холестаза с высоким уровнем ГГТ сыворотки крови включает широкий спектр заболеваний и вызывает наибольшие диагностические трудности. В нашем исследовании было показано при ряде заболеваний сочетанное изменение гепатобилиарной системы и других органов, а также нарушение общего состояния больного, что мы считаем целесообразным использовать для проведения дифференциальной диагностики. Тяжелое общее состояние больного наряду с патологическими изменениями других органов и систем могут быть обусловлены тяжелым патологическим процессом вследствие бактериальных или вирусных инфекций, эндокринных или метаболических нарушений. Может отмечаться при хромосомных абберациях, длительном полном парентеральном питании или токсическом поражении. Характерной особенностью заболеваний с преимущественным поражением внутрипеченочных желчных протоков (синдром Алажиля, несиндромальная форма гипоплазии внутрипеченочных желчных протоков, прогрессирующий семейный внутрипеченочный холестаз 3 типа), а также дефицита--1-антитрипсина является удовлетворительное самочувствие больных и отсутствие патологических изменений других органов и систем. Диагностика синдрома Алажиля основана на выявлении характерных особенностей фенотипа и 2-х или более типичных аномалий и/или пороков развития других органов. В нашем исследовании наиболее частыми аномалиями явились: периферический стеноз (16 - 80%) или гипоплазия (4 - 20%) легочной артерии, эмбриотоксон (16-80%), расщепление тел позвонков в виде бабочки (11 - 55%), особенности строения лицевого черепа (20 - 100%) а также признаки внутриутробной гипотрофии (14 - 70%). Для подтверждения диагноза в 11 случаях проводилась пункционная биопсия печени, при которой выявлялась гипоплазия внутрипеченочных желчных протоков. Для проведения дифференциального диагноза между другими заболеваниями с преимущественным поражением внутрипеченочных желчных протоков требуется проведение пункционной биопсии печени и по показаниям ретроградной или чрезкожной холангиографии. В
 ыявление гипоплазии внутрипеченочных желчных протоков (при отсутствии характерных для синдрома Алажиля признаков) свидетельствует о несиндромальной форме гипоплазии внутрипеченочных желчных протоков. Обнаружение пролиферации желчных протоков требует дополнительного проведения ретроградной или чрезкожной холангиографии. Деформация желчных протоков, выявляемая при холангиографии в сочетании с пролиферацией желчных протоков при гистологическом исследовании биоптата печени позволяет установить диагноз перинатального склерозирующего холангита. Отсутствие изменений при этом исследовании свидетельствует о прогрессирующем семейном внутрипеченочном холестазе (ПСВХ) 3 типа, подтверждением которого является отсутствие фосфолипидов в желче.
ыявление гипоплазии внутрипеченочных желчных протоков (при отсутствии характерных для синдрома Алажиля признаков) свидетельствует о несиндромальной форме гипоплазии внутрипеченочных желчных протоков. Обнаружение пролиферации желчных протоков требует дополнительного проведения ретроградной или чрезкожной холангиографии. Деформация желчных протоков, выявляемая при холангиографии в сочетании с пролиферацией желчных протоков при гистологическом исследовании биоптата печени позволяет установить диагноз перинатального склерозирующего холангита. Отсутствие изменений при этом исследовании свидетельствует о прогрессирующем семейном внутрипеченочном холестазе (ПСВХ) 3 типа, подтверждением которого является отсутствие фосфолипидов в желче.В нашем исследовании представлено динамическое обследование 20 детей с синдромом Алажиля в возрасте от 3 дней до 12 лет. Установлено два варианта течения данной болезни. Тяжелое течение характеризуется формированием патологических состояний, являющихся показанием к трансплантации печени. При легком варианте сохраняются отдельные биохимические изменения. При сравнении клинико-лабораторных показателей при разных вариант данного синдрома показано статистически достоверно более значимое увеличение размеров печени (3,4+0,5 см по сравнению с 2,5+1,2 см, соответственно, р<0,05) и активности фермента ГГТ (1366,7+546,7 Ед/л по сравнению с 632,3+260,0 Ед/л, р<0,05) у детей с тяжелым вариантом синдрома в течение первых 5 месяцев жизни. Во втором полугодии также выявлены различия в клинических и лабораторных показателях (таб 3).
Таб 3. Клинико-лабораторные показатели у детей с легким (1 гр.) и тяжелым (2 гр.) вариантом синдрома Алажиля в возрасте 7-12 месяцев жизни.
| показатели | 1 группа n-6 | 2 группа n-11 | |
| Печень, см (N до 2) | 2,9+1,0 | 4,8+1,0 | р<0,05 |
| О.Б. мкМ/Л (N 3,4-20,7) | 10,4+6,7 | 154,8+36,0 | р<0,001 |
| П.Б. мкМ/л (N 0,83-3,4) | 4,5+2,1 | 110,3+40,0 | р<0,001 |
| АЛТ, Ед/л (N 0-55) (число норм) | 202,0+58,7 (5,1+1,5) | 408,0+222,5 (10,2+5,6) | р<0,05 |
| АСТ, Ед/л (5-40) (число норм) | 153,0+89,4 (3,8+2,2) | 384,0+92,9 (9,6+2,2) | р<0,05 |
Наиболее значимым показателем мы считаем уровень билирубина, нормализация которого является прогностически благоприятным признаком, свидетельствующим о высокой вероятности легкого варианта течения болезни и отсутствии показаний к ТП в течение всей жизни. Независимо от варианта течения, формирование цирроза печени не типично для синдрома Алажиля, тогда как показанием к ТП являются осложнения, длительно сохраняющегося холестаза, значительно нарушающие качество жизни ребенка. Следует особенно подчеркнуть, что любое хирургическое вмешательство на желчевыводящей системе при данном синдроме значительно ухудшает состояние ребенка и способствует формированию билиарного цирроза, что показано у 3-х детей в нашем исследовании.
Динамически обследовано также 15 детей с болезнью Байлера в возрасте от 10 дней жизни до 6 лет. Болезнь Байлера всегда является показанием к ТП. Оптимальные сроки ее проведения определяются появлением патологических состояний, нарушающих качество жизни или признаков билиарного цирроза. В нашем исследовании сроки проведения ТП варьировали от 9 месяцев до 8 лет. Во всех случаях своевременно определены показания и эффективно выполнена данная операция. Установлен высокий риск развития онкологических заболеваний гепатобилиарной системы, которые были выявлены у 4 детей (27%), в среднем в возрасте 2,2+0,5 лет: печеночно-клеточная карцинома –у 3-х и холангиокарцинома – у одного больного. Полученные результаты определили необходимость рекомендовать УЗИ мониторинг и динамическое определение уровня а-ФП в процессе наблюдения детей с болезнью Байлера.
С целью выявления патогномоничных морфологических изменений и определения показаний к проведению биопсии печени изучены результаты гистологического исследования при различных заболеваниях гепатобилиарной системы. У детей с БА установлены различной степени выраженности холестаз, пролиферация желчных протоков и фиброз (таб 4).
Таб 4. Основные морфологические изменения печени у детей с билиарной атрезией в зависимости от возраста.
| Гистологические признаки | Дети с билиарной атрезией | | ||
| 1,0+0,5 мес. жизни n-10 | 2,0+0,5 мес. жизни n-9 | 3,0+0,5 мес. жизни n-11 | ||
| Активность воспаления по Кнодель (баллы) | 3,7+1,5 | 2,8+1,5* | 4,1+2,4* | |
| Перипортальные и мостовидные некрозы | 8/10 | 6/9 | 7/11 | |
| Внутридольковая дегенерация и очаговые некрозы | 8/10 | 7/9 | 8/11 | |
| Портальное воспаление | 10/10 | 9/9 | 11/11 | |
| Степень выраженности фиброза по Desmet, баллы | 1,7+0,4 | 1,8+0,5* | 2,6+1,1* | |
| Порто-портальный фиброз | 6/101 | 7/92 | 5/11 | |
| Фиброзные септы | 1/10 | 1/9 | 4/11 | |
| Цирроз | 0/10 | 0/9 | 2/11 | |
| Пролиферация желчных протоков | 10/10 | 9/9 | 11/11 | |
| Степень выраженности холестаза: | | | | |
| Внутриклеточный | 10/10 | 9/9 | 11/11 | |
| В желчных капилярах | 8/10 | 9/9 | 6/11 | |
| В желчных протоках | 8/10 | 7/9 | 7/11 | |
* р < 0,05, 1 – у 3-х детей 1 группы и 2 - у 1-го пациента 2 группы гистологические признаки фиброза в препаратах отсутствовали.
У всех отмечались воспалительные изменения низкой или минимальной степени активности по Кнодель. Степень выраженности холестаза и пролиферации желчных протоков была минимально выражена в 1 месяц и значительно нарастала к 3 месяцам жизни. Аналогичные закономерности выявлены в динамике формирования фиброза. Выявлена прямая зависимость между степенью выраженности морфологических изменений и возрастом ребенка (r-0,92, p<0,05). Суммарная активность воспаления по Кнодель у детей гр.1 была выше по сравнению с больными гр. 2 и ниже чем у детей гр 3, однако статистически значимых отличий не выявлено. У детей гр.2 степень выраженности воспаления была достоверно ниже, чем у детей гр.3 (р<0,05). Вместе с тем, следует отметить невысокую суммарную оценку воспаления по Кнодель у всех обследованных больных, соответствующую низкой или очень низкой гистологической степени активности.
Выявлена обратная зависимость между активностью сывороточного уровня фермента ГГТ и степенью выраженности фиброза по шкале Десмет у детей старше 1 месяца жизни (r-0,93, p<0,05), что позволяет говорить о диагностической ценности данного биохимического показателя (рис 4).
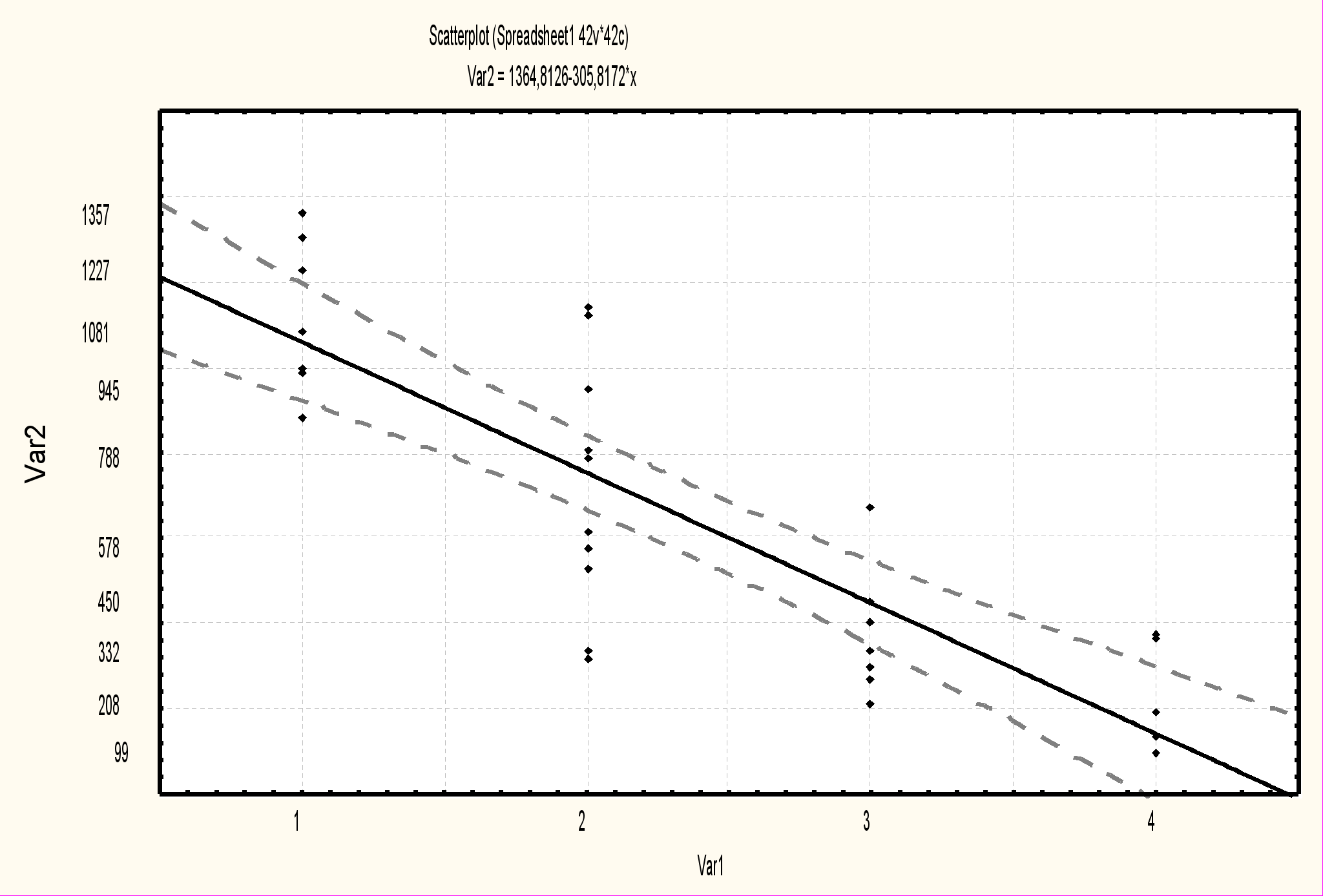
Рис.4. Взаимосвязь между степенью выраженности фиброза (в баллах по Десмет) и сывороточным уровнем фермента ГГТ у детей с билиарной атрезией (r -0,93, p<0,05).
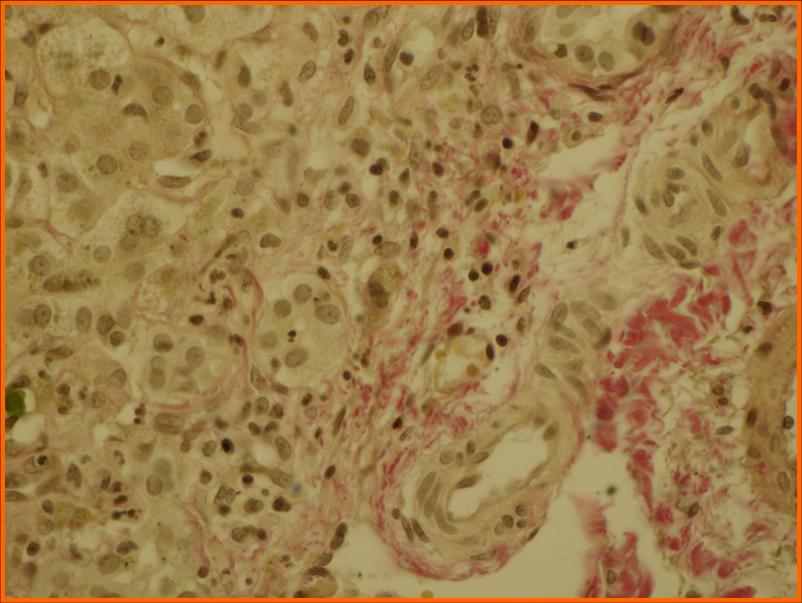
Повышение ГГТ менее чем в 10 раз с высокой вероятностью свидетельствует о значительной степени (3-4 балла по шкале Десмет) выраженности фибротических изменений в ткани печени. Других клинико-лабораторных показателей, достоверно отражающих степень морфологических изменений при БА, выявить не удалось. При заболеваниях, проявляющихся внутрипеченочным холестазом, с целью уточнения диагноза морфологическое исследование биоптата печени проведено 35 детям в возрасте от 1 до 4 месяцев жизни. Из них с болезнью Байлера 9 детей, с синдромом Алажиля -11, с несиндромальной формой гипоплазии желчных протоков 4 ребенка, с ПСВХ 3 типа - 4, с дефицитом а-1-АТ 3 ребенка, с неонатальным гемохроматозом двое и с галактоземией двое. У всех детей выявлен холестаз, минимальная или низкая степень активности воспаления по Kнодель и фибротические изменения. Максимальная степень выраженности фиброза описана при 3 типе ПСВХ (3,75+0,5 баллов), достоверно отличающаяся от детей с болезнью Байлера (1,5+0,5 баллов) и синдромом Алажиля (1,3+0,5 баллов) (р<0,05). Характерным гистологическим признаком синдрома Алажиля является гипоплазия внутрипеченочных желчных протоков. Во всех исследованиях отношение внутрипеченочных желчных протоков к портальным трактам было меньше 0,6. Кроме того, единичные желчные протоки, которые определялись в препаратах, в большинстве случаев оказывались аномальными (рис 5). Типичным для болезни Байлера является внутриклеточное скопление крупных гранул желчи «желчи Байлера» наряду со значительным увеличением размеров гепатоцитов, выявленное у всех детей (рис 5). Характерным проявлением неонатального гемохроматоза служит внутриклеточное скопление железа (рис 5), дефицита а-1-АТ - ПАС-позитивные включения.
а
 б
б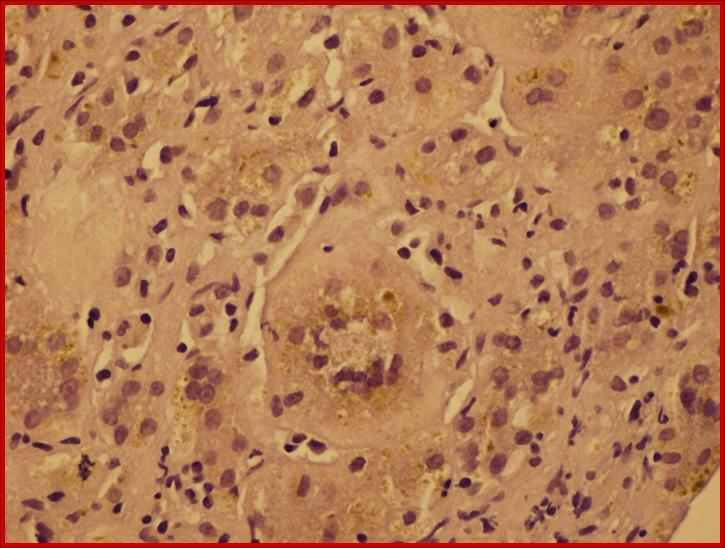 в
в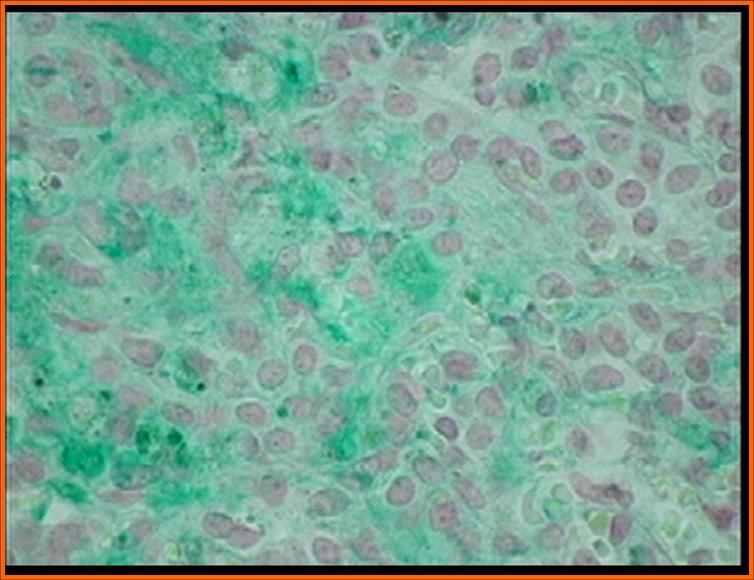
Окр. по Ван-гизону Окр. гематоксилином и эозином, Окр. по Перлсу
Рис 5. Аномальный желчный проток при синдроме Алажиля (а), внутриклеточное скопление глыбок желчи – «желчь Байлер» при болезне Байлера (б), Внутриклеточное скопление железа при неонатальном гемохроматозе (в).
С целью изучения роли вирусных инфекций в генезе заболеваний гепатобилиарной системы нами проведено исследование ДНК вирусов семейства Герпес и вирусов гепатита В и С методом ПЦР в биоптате печени и в крови. Параллельно проводилось гистологическое исследование биоптата печени. В исследование включен больной с генерализованной ЦМВ инфекцией, одним из проявлений которой был гепатит. В биоптате печени ДНК ЦМВ выявлена у большинства детей с БА и у больного с генерализованной формой ЦМВИ (таб 5.). При других заболеваниях, имеющих известный этиопатогенез, данный вирус выявлен только у 2 детей.
Таб 5. Частота выявления ДНК ЦМВ в биопатате печени детей с заболеваниями гепатобилиарной системы.
| Диагноз | Биоптат печени | кровь |
| БА | 27 / 30 | 5 / 30 |
| ПСВХ 1-3 типов | 1 / 7 | 0 / 7 |
| Синдром Алажиля | 1 / 5 | 0 / 5 |
| ПСХ | 0 / 2 | 0 / 2 |
| Неонатальный гемохроматоз | 0 / 2 | 0 / 2 |
| Другие | 0 / 3 | 0 / 3 |
| ЦМВ гепатит. | 1 / 1 | 1 / 1 |
Учитывая высокий процент выявления ДНК ЦМВ в биоптате печени у детей с БА, нами проведено сопоставление результатов их морфологического исследования с таковыми у ребенка с остаточными проявлениями ЦМВИ. Единственной отличительной особенностью была степень выраженности холестаза – минимальная у больного с остаточными явлениями ЦМВ – гепатита и более выраженная при БА. Сходство гистологических изменений печени при БА с таковыми после перенесенного ЦМВ-гепатита, а так же высокая частота выявления данного вируса у больных с БА позволяют рассматривать ЦМВ как один из вероятных этиологических факторов, приводящих к облитерации желчных протоков во внутриутробном периоде. Подтверждением этого можно считать отсутствие ДНК ЦМВ в биоптате печени пациентов с другими заболеваниями гепатобилиарной системы, имеющими известный этиопатогенез. Полученные результаты явились основанием предположить высокий риск реактивации ЦМВ-инфекции после хирургического вмешательства. Из 20 прооперированных больных ДНК ЦМВ в биоптате печени выявлена у 17 (85,0%). У 13 из 17 детей с БА, имеющих положительный результат исследования ДНК ЦМВ в биоптате печени, зарегистрирована реактивация ЦМВИ с развитием холангита через 5-7 дней после операции. Двоим из 17 больных с положительным ДНК ЦМВ в биоптате печени, послеоперационное вирусологическое обследование не проводилось. У 2-х из 3-х больных с отрицательным ДНК ЦМВ в биоптате печени в связи с нарастанием клинико-лабораторных признаков холангита, проведено повторное тестирование спустя 7 и 12 дней после операции. При этом ДНК ЦМВ выявлена в крови методом ПЦР. В период выявления ДНК ЦМВ в крови у большинства детей отмечалось увеличение размеров печени на 1,0+0,5 см и селезенки на 1,5+0,5 см от исходного уровня. У двух больных появился обесцвеченный стул. В биохимическом анализе крови выявлено нарастание активности фермента ГГТ (в среднем в 10 раз), АЛТ (в среднем в 4,7 раза, АСТ в среднем в 2,5 раза). У большинства детей (10/12) отмечалось небольшое повышение уровня общего билирубина в среднем в 1,5 раза, и прямого билирубина в 8,4 раза. Положительные результаты ДНК ЦМВ в крови наряду с нарастанием клинико-лабораторных признаков холангита явились основанием для назначения специфической иммуноглобулина (Цитотект из расчета 2 мл/кг/сут через день 3-6 кратно под контролем ДНК ЦМВ в крови методом ПЦР). На фоне лечения отмечалось достоверное уменьшение интенсивности желтухи, размеров печени и селезенки (р<0,05). У 2-х больных с ахолией появился окрашенный стул. Отмечалось статистически достоверное снижение активности фермента ГГТ (р<0,05), и трансаминаз (р<0,05). Уровень билирубина снижался у всех детей, однако статистически достоверные отличия отсутствовали. У всех пациентов отмечалось повышение уровня тромбоцитов и гемоглобина, у 4-х из них – нормализация этих показателей. Мы считаем, что своевременная профилактика и лечение реактивации ЦМВ инфекции является одним из важных факторов влияющих на выживаемость детей с БА после операции по Касаи. На основании полученных результатов, мы рекомендуем организацию вирусологического или ПЦР мониторинга за ЦМВ инфекцией у пациентов с БА в послеоперационном периоде (рис 6.).
Современные рекомендации по лечению детей с БА и в раннем периоде после операции предусматривают использование кортикостероидов: Метилпреднизолон по схеме: в/в – 10 мг/кг/сут – 1, 8 мг/кг/сут – 2 день, 6 мг/кг/сут – 3 день, 5 мг/кг/сут – 4 день, 4 мг/кг/сут -5 день, 3 мг/кг/сут – 6 день, 2 мг/кг/сут. – 7 день, далее 0,5 мг/кг/сут перорально до уровня билирубина ниже 40 мкмоль/л. Также назначается урсодезоксихолевая кислота – 20 мг/кг/сут перорально в 2 приема - постоянно и антибактериальные препараты широкого спектра действия. При использовании данной терапии нами показан достоверно более высокий процент положительных результатов лечения, как в раннем периоде, так и в отдаленные сроки после операции (рис 7.).
 | | О   пределение ДНК ЦМВ методом ПЦР в биоптате печени и крови во время операции пределение ДНК ЦМВ методом ПЦР в биоптате печени и крови во время операции | | | ||||||||
| | | | | | ||||||||
| Биоптат «+», Кровь «+» | | Биоптат «+» Кровь «-» | | Биоптат «-» Кровь «-» | ||||||||
 | |  |  | | ||||||||
 Специфическая противовирусная терапия*** Специфическая противовирусная терапия*** | | | Повторное определение ДНК ЦМВ + анти-ЦМВ IgG и IgM* через 4-5 дней и/или при появлении клинико-лабораторых признаков холангита | | ||||||||
| Повторное определение ДНК ЦМВ в крови. | |  |  | | ||||||||
  «+» | «-» | «+» и/или повышение титра анти-ЦМВ IgM | | «-»  | ||||||||
 Продолжить лечение до получения отрицательного результата |  наблюдение** |  Специфическая противовирусная терапия*** | | Наблюдение** | ||||||||
