План-конспект открытого урока по химии в 10 классе. Учитель химии: Берцева М. Д
| Вид материала | Урок |
- Конспект урока по химии в 8 классе Тема : " Митя, Дмитрий, Дмитрий Иванович", 197.78kb.
- Конспект урока химии в 10 классе Тема урока, 54.04kb.
- Конспект урока: Вступительное слово учителей химии и географии о целесообразности проведения, 152.66kb.
- Конспект открытого урока. Организация интегрированной деятельности на уроках химии, 104.51kb.
- Етодические особенности изучения органической химии место органической химии в школьном, 462.44kb.
- Урок химии в 9 классе Тема: История в металлах, металлы в истории, 101.92kb.
- Рогожина Татьяна Петровна, учитель химии мосш №2 Образовательные ресурсы Интернета, 88.34kb.
- Уроке химии в 11 классе Тема урока: Химия и повседневная жизнь человека, 88.09kb.
- Урок-презентация по химии, биологии, географии. Тема урока : «Нефть, состав нефти, 132.15kb.
- План-конспект урока тема : «Алканы. Состав, строение и изомерия». Цель: Сформировать, 75.42kb.
МОУ Ганусовская средняя общеобразовательная школа
План-конспект открытого урока по химии в 10 классе.
Учитель химии: Берцева М.Д.
План урока.
1. Проверка знаний учащихся по теме «Общие свойства металлов». –слайд 2
2. Тема урока, цели, эпиграф. - слайд 3
- Определение, классификация. – слайд 4
- Химическая коррозия. Электрохимическая коррозия. – слайд 5
Демонстрационные опыты:
№1 Р-р поваренной соли + железо.
№2 Р-р поваренной соли + медь
№3 Р-р поваренной соли + железо и цинк.
№ 4 Вода + железо.
Железо + вода (кип.)
Железо + вода (сыр.)
- Лабораторный опыт «Коррозия металлов». – слайд 6
- Способы борьбы с коррозией - слайд 7
Демонстрационный опыт
Железо + серная кислота (нагрев.) +
сухое горючее-ингибитор
- Презентация учащихся «Коррозия металлов». – слайд 8
- Видео «Виды коррозии». – слайд 9
- Домашнее задание – индивидуальное по карточкам.
- Сообщения учащихся.
Цели урока: сформировать понятие о коррозии металлов, рассмотреть классификацию коррозионных процессов, способы защиты металлов от коррозии. Рассмотреть влияние коррозии на здоровье человека. Рассмотреть экологические проблемы, связанные с коррозией металлов.
Оборудование: заранее подготовленные образцы:
учащимся – Р-р HCl, 2 пробирки CFe, Fe + C₄
учителю - H₂SO₄ + Fe (уротропин, сухое горючее)
пробирка № 1 – раствор хлорида натрия + ж. гвоздь
пробирка № 2 - раствор хлорида натрия + ж. гвоздь обвитый медной пров.
пробирка № 3 - раствор хлорида натрия + ж. гвоздь + цинк
пробирка № 4 – вода + ж. гвоздь
компьютер, экран, проектор
Тип урока: изучение нового материала.
Ход урока.
1. Вступительное слово учителя.
Тема, которую мы будем рассматривать, - коррозия металлов.
Мы должны выяснить, что такое коррозия металлов? Какие виды коррозии бывают? Как протекает этот процесс? Какова роль коррозии в жизни человеческого общества и зачем её изучать? Какие способы защиты от неё существуют? Какое влияние может оказать коррозия на здоровье человека?
Урок мы будем проводить с использованием компьютерных технологий. После закрепления материала подведём итоги работы.
2. Коррозия металлов.
«Ржа ест железо» - гласит русская народная поговорка. Ржавчина, которая появляется на поверхности стальных и чугунных изделий, - это яркий пример коррозии.
Ржавлением называют только коррозию железа и его сплавов. Другие металлы коррозируют, но не ржавеют.
И так, что же такое коррозия металлов?
Коррозией металлов называют самопроизвольный процесс разрушения металлов и изделий из них под воздействием окружающей среды.
Коррозию можно классифицировать:
По механизму процесса
Электрохимическая
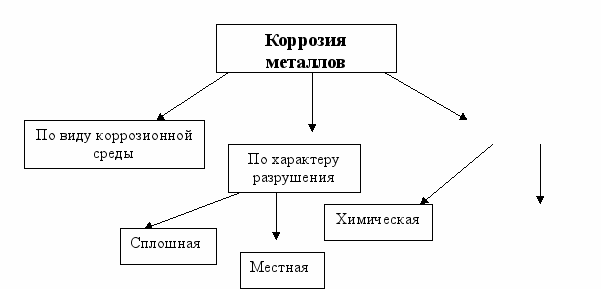
По характеру разрушения металла различают коррозию сплошную и местную.
Сплошная коррозия распределяется равномерно по всей поверхности металла или сплава (например, процесс ржавления сплавов железа на воздухе или их взаимодействие с сильными кислотами).
При местной коррозии её очаги распределяются неравномерно – в виде коррозионных пятен или точек, что особенно опасно для промышленной химической аппаратуры.
Химическая коррозия металлов – это разрушение металлов в результате их химического взаимодействия с веществами окружающей среды.
Наиболее распространённым видом химической коррозии является газовая коррозия, проистекающая в сухих газах при полном отсутствии влаги. Газообразное вещество окружающей среды реагирует с металлом на поверхности металлического изделия и образует с ним соединения. 2Fe + 3Cl₂ → 2FeCl₃
Электрохимическая коррозия – это разрушение металлов, которое сопровождается возникновением электрического тока. Это такая коррозия, в результате которой наряду с химическими процессами (отдача электронов атомами коррозируемого металла – процесс окисления) протекают электрические (перенос электронов от одного участка изделия к другому).
Давайте рассмотрим химическую коррозию металлов на воздухе.
Как протекает этот процесс? Вспомним, что представляет собой воздух?
Ученик: - Это смесь газов, которая имеет состав по объёму:
Азот 78,095%
Кислород 20,939%
Диоксид углерода 0,031%
Благородные газы 0, 935 %, а остальные примеси
Учитель: Железо под воздействием O₂ , H₂ O и ионов водорода постепенно окисляется. Этот процесс является окислительно-восстановительным, где металл является восстановителем. Коррозия железа может быть описана упрощённым уравнением
4Fe + 3O₂ + 6H₂O = 4Fe(OH)₃
Fe º - 3e = Fe³⁺
Oº₂ + 4e = 2O²¯
Fe(OH)₃ и является ржавчиной.
Проведём такой опыт
Опыт № 1.
Взяли две пробирки, налили в них воду. В одной из них воду прокипятили. Поместили в обе пробирки по очищенному железному гвоздю. Закрыли колбы пробками. Гдй пойдёт процесс коррозии быстрее?
Ученик: Признаки реакции появились быстрее в пробирке с некипячёной водой.
Учитель: В этом опыте мы выяснили роль кислорода воздуха в коррозии железа. Давайте сделаем вывод: кислород является одним из агрессивных её факторов.
Учитель: Если кислород является одним из агрессивных её факторов, тогда почему вода в алюминиевом чайнике при нагревании кипит, но не действует на металл, и чайник служит довольно долгое время?
Ученик: алюминий – очень активный металл и теоретически с водой должен был бы взаимодействовать в соответствии с уравнением
2Al + 3H₂O = Al₂O₃ + 3H₂
Однако его поверхность покрывается плотной плёнкой оксида AlO, которая защищает металл от воздействия воды и кислорода.
Учитель: значит окисная плёнка защищает металл от воздействия воды и кислорода.
Особенно разнообразные процессы химической коррозии встречаются в среде кислот, щелочей, солей, а также в расплавах солей и других веществ.
Большие неприятности связаны с хлоридом натрия (в некоторых странах используют отход производства – хлорид кальция), разбрасываемым в зимнее время на дорогах и тротуарах для удаления снега и льда. В присутствии солей они плавятся, и образующиеся растворы стекают в канализационные трубопроводы. Соли и особенно хлориды являются активаторами коррозии и приводят к ускоренному разрушению металлов, в частности транспортных средств и подземных коммуникаций.
Основополагающим звеном для понимания электрохимических процееов является ряд напряжения металлов. Металлы можно расположить в ряд, который начинается с химически активных и заканчивается наименее активными благородными металлами.
РЯД НАПРЯЖЕНИЯ МЕТАЛЛОВ
Li, Rb, K, Ba, Sr, Ca, Mg, Al, Be, Mn, Zn, Cr, Ga, Fe? Cd, Tl, Co, Tl, Co, Ni,Sn, Pb, H, Sb, Bi, As, Cu, Hg, Ag, Pd, Pt, Au.
Рассмотрим влияние различных электролитов на процесс коррозии металлов.
В пробирку № 1 – раствор хлорида натрия + ж. гвоздь
В пробирку № 2 - раствор хлорида натрия + ж. гвоздь обвитый медной пров.
В пробирку № 3 - раствор хлорида натрия + ж. гвоздь + цинк
В пробирку № 4 – вода + ж. гвоздь
Приложение
Результаты опытов 1 и 2. В обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с медью, а в другом – нет. И там и здесь произошла коррозия, и появился бурый осадок ржавчины. Но в опыте 1 ржавчины получилось мало, а в опыте 2 – много. Результаты опытов 1 и 3 в обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с цинком, а в другом – нет. Наблюдается сильная коррозия, но в опыте 2 осадок бурого цвета – ржавчина, а в опыте 3 осадок белого цвета – это гидроксид цинка. Следовательно, в опыте 3 коррозировало не железо, а цинк. Таким образом, железо практически не коррозирует, если оно соприкасается с цинком. Сравним результаты опытов 1 и 4.
Ученик: Добавка к воде хлорида натрия усилила коррозию металла.
Учитель: Мы убедились, что коррозия – это универсальное явление не только для железа, но и для всех металлов. Рассмотрим работу гальванического элемента.
Сущность работы гальванического элемента.
Сначала наполним химический стакан вместимостью 250 мл до середины 10%-ным раствором серной кислоты и погрузим в неё не слишком маленькие куски цинка и меди. К обоим электродам приклепаем медную проволоку, концы которой не должны касаться раствора.
Пока концы проволоки не соединены друг с другом, мы будем наблюдать растворение цинка, которое сопровождается выделением водорода. Цинк, как следует из ряда напряжения, активнее водорода, поэтому металл может вытеснять водород из ионного состояния. На обоих металлах образуется двойной электрический слой. Разность потенциалов между электродами проще всего обнаружить с помощью вольтмера. Непосредственно после включения прибора в цель стрелка укажет примерно 1В, но затем напряжение быстро упадёт.
Рассмотрим процессы в медно-цинковом элементе несколько подробнее. На катоде цинк переходит в раствор по следующему уравнению: Zn = Zn²⁺ + 2e
На медном аноде разряжаются ионы водорода серной кислоты. Они присоединяют электроны, поступающие по проволоке от цинкового катода, и в результате образуются пузырьки водорода: 2H⁺ + 2e = H₂
Через короткий промежуток времени медь покроется тончайшим слоем пузырьков водорода. При этом медный электрод превратится в водородный, а разность потенциалов уменьшится. Этот процесс называют поляризацией электрода. На практике применяют гальванические цепи, электроды которых не поляризуются, или цепи, поляризацию которых можно устранить, добавив деполяризаторы.
Учитель: А теперь поговорим о способах защиты металлов от коррозии.
Способы защиты от коррозии.
легирование металлов, т.е. получение сплавов. Например, в настоящее время создано большое число нержавеющих сталей путём присадок к железу никеля, хрома, кобальта и др. Такие стали, действительно, не покрываются ржавчиной.
- нанесение на поверхность металлов защитных плёнок: лака, краски, эмали, других металлов.
Листовое железо, покрытое цинком, называют оцинкованным железом, а покрытое оловом – белой жестью. Первое в больших количествах идёт на кровли домов, а из второго изготавливают консервные банки. И то и другое получают главным образом протягиванием листа железа через расплав соответствующего металла.
Покрытия из цинка и олова (так же, как и других металлов) защищают железо от коррозии при сохранении сплошности. При нарушении покрывающего слоя (трещины, царапины) коррозия изделия протекает даже более интенсивно, чем без покрытия. Это объясняется «работой» гальванического элемента железо – цинк и железо – олово.
- введение ингибиторов (замедлителей коррозии).
Проведение эксперимента. В пробирку на 1/5 объёма налили разбавленную серную кислоту, затем поместили в неё железные стружки. Довели до кипения. Наблюдали выделение пузырьков газа водорода. Затем в эту пробирку добавили ингибитор уротропин (1 измельчённую таблетку). Уротропин можно заменить тиомочевинной или сухим горючим. Реакция с кислотой прекратилась.
- протекторный метод защиты от коррозии.
Цинк электрохимически защищает железо от коррозии. На этом принципе основан протекторный метод защиты от коррозии металлических конструкций и аппаратов. Английское слово «претект» - означает защищать, предохранять.
- Влияние коррозии на организм человека и роль коррозии в жизни человеческого общества.
Коррозия металлов наносит большой экономический вред. Коррозия приводит к уменьшению надёжности работы оборудования: аппаратов высокого давления, паровых котлов, металлических контейнеров для токсичных и радиоактивных веществ. Коррозия приводит к простоям производства из-за замены вышедшего из строя оборудования, к потерям сырья и продукции. Коррозия также приводит к загрязнению продукции, а значит, и к снижению её качества. Один из американских миллионеров, не жалея денег, решил построить самую шикарную яхту. Её днище было обшито дорогим металлом (сплав 70% никеля и 30% меди), а киль, форштевень и раму руля изготовили из стали. В морской воде в подводной части яхты образовался гальванический элемент с катодом из металла, а анодом из стали. Он настолько энергично работал, что яхта ещё до завершения отделочных работ вышла из строя, ни разу не побывав в море. Иногда зубные коронки, изготовленные из различных металлов (золота и стали) и близко расположенные друг к другу, доставляют их носителям неприятнейшие болевые ощущения. Поскольку слюна является электролитом, эти коронки образуют гальванический элемент. Электрический ток протекает по десне и вызывает зубную боль.
Способность металлов пассивироваться широко используют для их защиты от коррозии. Например, известно, что хранение лезвий безопасных бритв в растворах солей хромовых кислот позволяет дольше сохранять их острыми. Так под действием влажного воздуха железо, особенно на острие лезвия, окисляется и покрывается рыхлым слоем ржавчины.
Чтобы предотвратить глобальные катастрофы на судах, фабриках, заводах, нужно упорно изучать методы защиты от этой проблемы. И в то же время необходимо найти применение коррозии металлов. Одним из направлений может быть её применение для разрушения конструкций в труднодоступных местах. Изучая коррозию более подробно, мы видим, что она оказывает как отрицательное, так и положительное влияние. Разрушение металлов и сплавов можно применить как один из способов борьбы с космическим мусором. Если бы железо, подобно серебру и золоту, не ржавело, то мы не существовали бы, и ни одно растение не зеленело бы на Земле. Растворённая в воде его ржавчина составляет часть пищи растений и придаёт им зелёный цвет. Та же «ржавчина» снабжает железом нашу кровь и придаёт ей красный цвет, т.е. Fe – кроветворное, Fe² - противоязвенное и противоожоговое средство.
3. Закрепление.
Требуется скрепить железные детали. Какими заклёпками следует пользоваться медными или цинковыми, чтобы замедлить коррозию железа? Ответ обоснуйте.
- Как называются вещества, замедляющие коррозию?
- Введение каких элементов в сталь повышает её коррозионную стойкость?
- К стальному днищу машины была предложена протекторная защита. Какой металл этого лучше применить: Zn, Cu или Ni?
- Почему многие детали быстрее корродируют вблизи предприятий?
- Лист железа, покрытый цинком, и лист железа, покрытый оловом, процарапали до железа. Будет ли подвергаться коррозии железо в обоих случаях?
4. Подведение итогов. Тестирование учащихся.
5.Домашнее задание: составить кроссворд по теме «Коррозия металлов».
