Физико-химические и технологические основы повышения эффективности комплексной переработки нефелинсодержащего сырья кислотными методами
| Вид материала | Автореферат |
- Ериментальные каскады разделительных центрифуг позволяют не только вести технологические, 353.87kb.
- Программа вступительных испытаний в магистратуру по направление 260100. 62 «Продукты, 46.1kb.
- 2. 2 Использование пектинсодержащего сырья при откорме молодняка крупного рогатого, 158.15kb.
- Практикум по химии Анкудимова И. А., Гладышева, 2202.13kb.
- Программа ХII международной конференции Физико-химические основы ионообменных процессов, 465.27kb.
- Научные основы субхлоридной комплексной переработки нещелочного сырья на примере титаномагнетитовых, 503.93kb.
- И товарных нефтепродуктов лежат физико-химические процессы и управление этими процессами, 133.38kb.
- И товарных нефтепродуктов лежат физико-химические процессы и управление этими процессами, 124.23kb.
- И товарных нефтепродуктов лежат физико-химические процессы и управление этими процессами, 151.03kb.
- Физико-химические свойства и технологические основы получения пирротинов из пирита, 328.59kb.
| Расход затравки, % | Продолжительность дозирования нефелина, час | |||||
| 1.5 | 2 | 3 | ||||
| скорость фильтров., м3/(м2ч) | влажность осадка, % | скорость фильтров., м3/(м2∙ч) | влажность осадка, % | скорость фильтров., м3/(м2∙ч) | влажность осадка, % | |
| 0 | 0.15 | 62.5 | 0.40 | 59.2 | 0.75 | 57.5 |
| 10 | 0.60 | 56.7 | 1.28 | 54.3 | 1.40 | 53.2 |
| 20 | 0.95 | 54.8 | 1.56 | 52.2 | 1.76 | 51.2 |
| 30 | 1.10 | 53.5 | 1.44 | 51.5 | 1.72 | 49.5 |
| 40 | 1.0 | 52.6 | 1.32 | 50.5 | 1.37 | 48.6 |
В указанных условиях быстро и во все большем количестве возникают зародыши новой фазы, которые растут как за счет осаждения на них мономерного кремнезема, так и вследствие присоединения более мелких частиц. Эти процессы являются результатом взаимодействия силанольных групп SiOH с образованием силоксановых связей Si-O-Si и отщеплением воды. В результате этого происходит формирование частиц кремнезема в виде относительно плотноупакованных дискретных ассоциатов. Выполненные исследования показали, что варьирование параметров разложения нефелина (концентрации кислоты, температуры, скорости дозирования нефелина, расхода затравки) позволяет направлять процесс полимеризации кремнезема по пути формирования и укрупнения дискретных частиц, легко отделяемых от раствора.
Установлено, что нерастворимый остаток от разложения нефелина представляет собой механическую смесь аморфного диоксида кремния и примесных минералов, что обусловливает возможность выделения аморфного кремнезема в виде самостоятельного ценного продукта, занимающего по своим физико-химическим свойствам и структуре промежуточное положение между белой сажей и силикагелем.
В четвертой главе изложены результаты физико-химических исследований переработки растворов от кислотного разложения нефелина.
Известно, что наиболее перспективным методом выделения алюминия из растворов сернокислого алюминия или квасцов является их гидролитическое разложение при повышенных температурах (в автоклавах). При этом алюминий осаждается в виде основных солей. Всесторонними исследованиями многих авторов однозначно установлено, что максимально возможная степень гидролиза (немногим более 80%) достигается при температурах выше 230оС, что требует высоких энергозатрат и связано с трудностями аппаратурного оформления процесса. Это является одной из основных причин, по которой метод гидролитического выделения из сернокислых растворов пока не нашел практической реализации.
В разделе 4.1.2 приведены результаты исследования процесса гидролиза сернокислого алюминия (СА) и алюмокалиевых квасцов (АКК) в присутствии аммонийных солей сульфитного ряда – (NH4)2SO4 и NH4НSO3. Первая соль использовалась в виде твердого моногидрата, вторая – в виде 75%-ного раствора. Экспериментальные данные, приведенные в табл. 2, со всей очевидностью показывают, что сульфит аммония оказывает существенное влияние на ход процесса гидролиза сернокислых солей алюминия. Аналогичные результаты получены при использовании гидросульфита аммония, но при его вдвое большем молярном расходе.
Роль сульфитных солей аммония в процессе гидролиза сернокислых солей алюминия заключается в обменном взаимодействии с исходной сернокислой солью алюминия по уравнению (на примере средней соли и сульфата алюминия)
Al2(SO4)3 + n(NH4)2SO3 → Al2(SO4)3-n(SO3)n + n(NH4)2SO4 2)
(0< n ≤ 2)
с образованием сульфат-сульфита алюминия, который гидролизуется по реакции:
Al2(SO4)3-n(SO3)n + nН2О → Al2(SO4)3-n(OH)2n + nSO2↑. (3)
Суммарное уравнение процесса гидролиза имеет вид:
Al2(SO4)3 + n(NH4)2SO3 + nH2O →
→ Al2(SO4)3-n(OH)2n + n(NH4)2SO4 + nSO2↑. (4)
Таблица 2 – Показатели гидролиза сульфата алюминия и алюмокалиевых квасцов
| № п/п | Температура, оС | Расход сульфита аммония, моль/моль Al2O3 | Степень гидролиза, % | |
| СА | АКК | |||
| 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 | кипения - - 125 - - 150 - - 175 - - 200 - - | - 1.0 2.0 - 1.0 2.0 - 1.0 2.0 - 1.0 2.0 - 1.0 2.0 | - 42.7 61.9 - 44.9 67.9 - 57.1 85.9 - 61.2 90.8 - 72.8 93.0 | - 74.9 88.3 39.5 86.3 94.1 58.3 97.4 98.8 70.7 98.2 99.2 76.9 99.1 100.0 |
В соответствии с предложенным механизмом процесс идет через стадию образования промежуточного соединения, более склонного к гидролизу, чем исходные соли алюминия.
Исследование кинетики гидролиза алюмокалиевых квасцов в присутствии среднего сульфита аммония выявило наличие двух последовательных стадий, характеризующихся величиной энергии активации 26.75 и 42.23 кДж/моль соответственно. Исходя из этих значений и предложенного механизма процесса первую стадию следует отнести к обменной реакции с образованием сульфат-сульфита алюминия, а вторую – к гидролизу этого промежуточного соединения с образованием основной сернокислой соли алюминия (ОСС). При этом обе стадии лимитируются условиями химической кинетики.
По химическому составу ОСС, полученные как в отсутствие, так и в присутствии сульфитных солей аммония, близки к формуле R2O∙(2.8-3)Al2O3∙(4.3-5)SO3∙(7.5-10)Н2О, т.е. содержат несколько больше сульфатных групп, связанных с алюминием, чем природный алунит. Необходимо отметить, что при гидролизе в присутствии сульфита аммония Fe(III) восстанавливается до Fe(II), поэтому получаемые ОСС содержат на порядок меньше Fe2O3. По данным РФА, ДСК, ТГ, ДТГ и кристаллооптического анализов, исследуемые основные соли по структуре аналогичны природному алуниту и представляют собой изоморфную смесь водородной, аммониевой, натриевой и калиевой ОСС (в зависимости от состава исходных растворов). Некоторое отличие образцов, полученных в присутствии сульфита аммония, заключается в несколько большей обводненности и худшей откристаллизованности, что обусловлено существенно более низкой температурой их получения (150оС против 225оС). Наиболее явное отличие отмечено во внешнем облике (рис. 2). Основная соль, выделенная из сернокислого раствора (образец 1), представляет собой мелкокристаллическое вещество в виде квадратных и прямоугольных пластинок с примесью зерен псевдокубической, ромбической и неправильной формы, образующих, как правило, агрегатообразные скопления. Соли, выделенные в присутствии сульфита аммония (образцы 2 и 3), в основной своей массе представлены сферическими агрегатами, в свою очередь состоящими из округлых первичных частиц.
 Образец 1 |  Образец 2 |
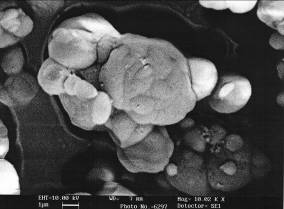 Образец 3 | Рисунок 2 – Морфология основных сернокислых солей (увеличение в 10000 раз) |
Выполненные исследования впервые показали возможность практически полного гидролиза сернокислых солей алюминия при относительно невысоких температурах. При этом полученные ОСС по основным физико-химическим свойствам являются аналогами природного алунита и поэтому могут переработаны по любой из известных, но упрощенных технологических схем переработки этого минерала.
В процессе гидролиза сернокислых солей алюминия в присутствии сульфита аммония образуется эквивалентное количество сульфата аммония. В разделе 4.2 приведены результаты исследований по получению (регенерации) сульфита аммония на основе продуктов термического разложения сульфата аммония. Предложено термическое разложение (NH4)2SO4 проводить в присутствии восстановителя, например углерода. В зависимости от его расхода разложение сульфата аммония может пойти по реакциям в соответствии с суммарными уравнениями:
2(NH4)2SO4 + С = 4NH3 + 2SO2 + СО2 + 2Н2O (5)
или
(NH4)2SO4 + С + 1/2О2 = 2NH3 + SO2 + СО2 + Н2O. (6)
Газообразные продукты реакции охлаждали с получением высокодисперсного порошка, идентифицированного методами РФА (рис. 3) и ИКС как безводный сульфит аммония (NH4)2SO3, выход которого составил 98.5-100% от теоретически возможного.
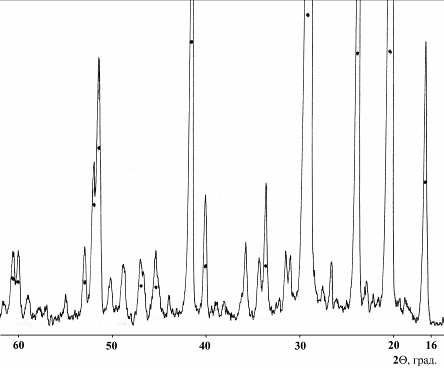
Рисунок 3 – Дифрактограмма безводного сульфита аммония
Выполненные исследования способствуют решению важной задачи регенерации сульфита аммония, необходимого для осуществления процесса гидролиза, при одновременном снижении выхода малоценной попутной продукции на 1 т товарного глинозема.
В разделе 4.3 приводятся результаты исследований твердофазного гидролиза кристаллических водосодержащих солей алюминия, а также титана и циркония под действием газообразного аммиака.
Основным методом получения гидратированных оксидов металлов (ГОМ) является их осаждение из растворов соответствующих кислых солей под действием оснований, например раствора аммиака. Образование малорастворимых ГОМ происходит в результате
гидролиза, реализуемого по механизму депротонирования молекул воды, координированных вокруг катиона металла. Однако гидролиз не носит простого ступенчатого характера, а осложнен полимеризационными процессами, приводящими к формированию полиядерных гидроксокомплексов (ПГК) металлов. Гидроксокомплексы отличаются многообразием полиядерных форм, первой ступенью которых являются обычно димеры, которые формируются за счет образования водородной связи между ОН-группой одного мономера и координированной молекулой воды другого:
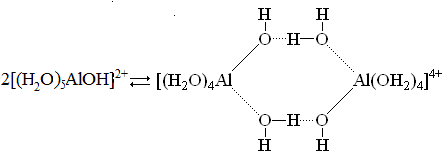
Далее происходит образование оловых соединений, которые являются результатом дегидратации димера:
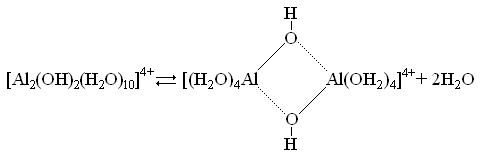
Формирование более сложных полимерных комплексов происходит также через протолитическую диссоциацию координированной воды, присоединение нового элемента и дегидратацию. В ходе поликонденсации образуется не произвольный, а определенный набор комплексов – «тупиковых» форм ПГК, из которых и формируются первичные частицы. Например, при гидролизе солей алюминия таковыми являются комплексы состава Al13O4(OH)24(H2O)127+ и Al7O2(OH)14(H2O)103+. При этом фаза, наследующая структуру ПГК с числом атомов алюминия 13, при старении кристаллизуется в виде Al(OH)3, а фаза со структурой ПГК с числом атомов алюминия 7 – в виде псевдобемита.
Процесс полимеризации трудно поддается регулированию и сопровождается неравновесным распределением ПГК на стадии поликонденсации акваионов металла, что является принципиальной причиной невоспроизводимости свойств получаемых осадков ГОМ.
Полимеризация является результатом столкновения и взаимодействия акваионов, имеющих в растворе достаточно высокую подвижность. Очевидно, что для предотвращения полимеризации необходимо существенно ограничить подвижность ионов. В связи с этим было высказано предположение о возможности осуществления процесса гидролиза сернокислой соли алюминия, находящейся в твердом состоянии кристаллогидрата, когда ионы имеют минимальную подвижность, под действием газообразного аммиака. Теоретическим обоснованием этого предположения послужило то обстоятельство, что в составе кристаллогидратов ион алюминия находится в виде аквакомплекса, т.е., как и в растворе, каждый атом алюминия окружен шестью молекулами воды, и поэтому существуют объективные предпосылки для осуществления процесса гидролиза по механизму депротонирования координированных молекул под действием газообразного аммиака:
[Al(Н2О)6]3+ + NH3 → [Al(Н2О)5(ОН)]2+ + NH4+. (7)
На первом этапе исследований в качестве объекта были использованы алюмокалиевые квасцы (АКК), которые являются комплексным соединением с очень небольшой степенью устойчивости комплексных ионов. По данным рентгеновского анализа, их структура соответствует виду [К(Н2О)6](SO4)2 [Al(Н2О)6]. АКК весьма легко и в достаточно чистом виде могут быть выделены при охлаждении сернокислых растворов от разложения нефелина.
Обработку АКК вели посредством пропускания газообразного аммиака через слой частиц квасцов при температуре не выше 70оС. О полноте протекания реакции судили по значению рН суспендированного в воде продукта аммиачной обработки. По достижении величины рН не менее 7 считали процесс завершенным. Выполненные исследования показали, что крупность частиц в диапазоне 0.5-3 мм практически не оказывает влияния на степень завершенности процесса. Это объясняется тем, что реакция идет с увеличением объема исходных частиц в 1.2-1.4 раза, т.е. первичные кристаллы растрескиваются, в результате чего не возникает препятствий для контакта NH3 c непрореагировавшим веществом. Продукт аммонизации обрабатывали водой при температуре 40-60оС в течение 10-15 минут, полученную суспензию фильтровали, отделяли осадок аморфного гидратированного оксида алюминия (ГОА) от раствора, содержащего сульфаты калия и аммония, тщательно промывали и сушили при 105оС до постоянной массы. Удельная производительность по раствору в ходе основной фильтрации составляла 1.2-1.5, а при промывках – 1.7-2.0 м3/(м2∙ч). Влажность осадков аморфного ГОА находилась на уровне 73-76%. Осадок на фильтре представлял собой сухую с виду, нерастрескивающуюся рассыпчатую массу, что свидетельствует о дисперсной структуре осадка.
Для проведения сравнительной оценки некоторых свойств продукта твердофазного гидролиза (образец 1) был использован осадок ГОА, полученный при быстром смешении растворов АКК (50 г/л Al2O3) и гидрата аммиака (20% NH3) (образец 2). При этом скорость фильтрования основного раствора при отделении осадка ГОА составила 0.22 м3/(м2∙ч), в ходе промывки она снизилась до 0.15-0.18 м3/(м2∙ч). В процессе фильтрования наблюдалось образование трещин, что является признаком формирования гелеобразной структуры осадка, влажность которого составила 87.5%.
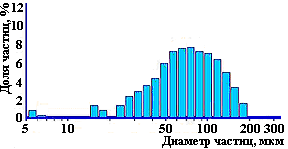
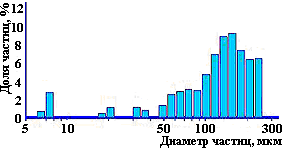
Методами РФА, ИКС и кристаллооптического анализов установлено, что образец 1 имеет тенденцию к появлению кристаллизующейся фазы. Морфология исследуемых образцов представлена на рис. 4. На микрофотографиях видно, что оба образца представляют собой агломераты более мелких частиц. При этом размер и частиц и агломератов в образце 1 существенно меньше, чем в образце 2, а сами частицы и агломераты первого образца имеют преимущественно округлую форму и более однородны по крупности, что подтверждено также анализом гранулометрического состава, выполненным на приборе SALD-201V (рис. 5).
 Образец 1 |  Образец 2 |
Рисунок 4 – Морфология осадков аморфного ГОА
Необходимо отметить, что условия проведения данного анализа не позволили с достаточной достоверностью оценить абсолютный размер частиц ГОА.
Характер осадков ГОА определяется их структурой и формой содержащейся в нем воды. Предполагалось, что осадки ГОА, полученные при твердофазном гидролизе, по числу структурных оксо- и гидроксогрупп, приходящихся на 1 атом алюминия, соответствуют кристаллической форме гидроксида. Напротив, гелеобразные осадки ГОА, полученные при гидролизе в водной среде, должны содержать значительно большее количество структурной воды. С целью проверки этого предположения была оценена динамика дегидратации двух образцов аморфного ГОА, имевших одинаковую стартовую влажность –
~74.6%. Экспериментальные данные, приведенные в табл. 3, показывают, что первый осадок гораздо легче отдает влагу. Это означает, что основная часть содержащейся в нем воды не входит в структуру, а находится в слабосвязанном состоянии. Во втором осадке, напротив, значительная часть воды является структурносвязанной, что требует более длительного времени для ее удаления.
Образец 1
Образец 2
Рисунок 5 Распределение частиц ГОА по крупности
Таблица 3 Зависимость степени дегидратации от продолжительности сушки
-
Продолжительность
сушки, ч
Степень дегидратации, %
образец 1
образец 2
1
54.2
35.3
2
86.8
78.7
3
100
89.6
4
-
97.1
5
-
100
Результаты проведенных исследований свидетельствуют в пользу того, что при гидролизе кристаллических алюмокалиевых квасцов под действием газообразного аммиака образующийся аморфный ГОА состоит преимущественно из одной фазы и формируется в виде высокодисперсного соединения, содержащего слабосвязанную воду. Из-за отсутствия полимеризации акваионов алюминия размер первичных частиц существенно меньше, чем в аналогичных осадках, полученных при гидролизе в растворе. Кроме того, аморфный ГОА, полученный твердофазным гидролизом, характеризуется более равномерным дисперсным составом.
Известно, что при гидролизе солей алюминия в водной среде значительное влияние на состав и структуру формирующихся ГОА оказывает природа аниона. В ряду SO
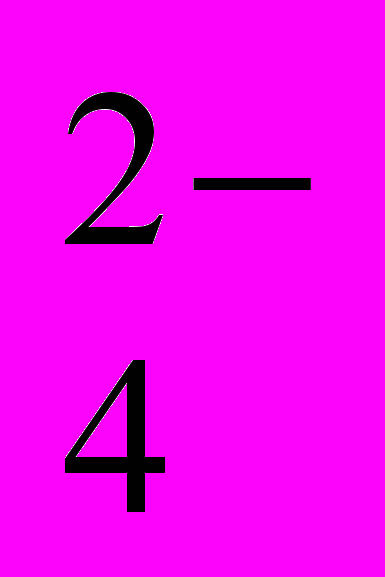 - Cl- - NO3- при прочих равных условиях поликонденсации растет доля ПГК с максимальным числом атомов алюминия – 13. Для проверки влияния природы аниона на ход твердофазного гидролиза обработке газообразным аммиаком были подвергнуты нонагидрат нитрата алюминия – Al(NO3)3∙9H2O и гексагидрат хлорида алюминия – AlCl3∙6H2O. Выполненные эксперименты не выявили каких-либо заметных отличий получаемых осадков ГОА (внешний вид, консистенция, влажность) от полученных при аммиачной обработке алюмокалиевых квасцов. Очевидно, что при данном способе осуществления гидролиза форма образующихся осадков ГОА практически не зависит от природы аниона соли.
- Cl- - NO3- при прочих равных условиях поликонденсации растет доля ПГК с максимальным числом атомов алюминия – 13. Для проверки влияния природы аниона на ход твердофазного гидролиза обработке газообразным аммиаком были подвергнуты нонагидрат нитрата алюминия – Al(NO3)3∙9H2O и гексагидрат хлорида алюминия – AlCl3∙6H2O. Выполненные эксперименты не выявили каких-либо заметных отличий получаемых осадков ГОА (внешний вид, консистенция, влажность) от полученных при аммиачной обработке алюмокалиевых квасцов. Очевидно, что при данном способе осуществления гидролиза форма образующихся осадков ГОА практически не зависит от природы аниона соли. С учетом того, что явление полимеризации характерно почти для всех гидратированных ионов металлов, представляло большой научный и практический интерес установить правомерность выявленных закономерностей твердофазного гидролиза применительно к солям других металлов, в частности циркония и титана, гидроксиды которых находят широкое применение в производстве катализаторов, адсорбентов, пигментов, наполнителей полимеров и др. В качестве объектов были выбраны октагидрат хлорида цирконила ZrOCl2∙8Н2О (ХЦ) и моногидрат сульфата титанила и аммония (NH4)2SO4∙TiOSO4∙Н2О (СТА). Выполненные исследования показали, что ход процесса гидролиза этих солей принципиально не отличался от хода гидролиза соли алюминия. Для осадков гидратированных диоксидов циркония и титана, образующихся в результате твердофазного гидролиза, также характерна более высокая скорость отделения от маточных растворов и пониженная обводненность. Осадки имеют существенно меньший размер частиц и более равномерный полидисперсный состав, чем осадки, полученные при смешении растворов солей металлов и аммиака.
Таким образом, установлена возможность осуществления гидролиза водосодержащих солей алюминия, титана и циркония, находящихся в твердом состоянии, за счет депротонирования аквакомплексов металлов под действием газообразного аммиака. Вероятно, при твердофазном гидролизе гидратированные оксиды алюминия, титана и циркония формируются в виде высокодисперсных соединений, а не полимерных образований, как при гидролизе в растворах. Отмеченные особенности обусловлены отсутствием жидкой фазы и, тем самым, условий для трудно контролируемой полимеризации акваионов металлов с образованием их полиядерных гидроксокомплексов. По нашему мнению, метод твердофазного гидролиза может быть использован для получения гидратированных оксидов и других металлов Периодической системы, в частности переходных, не образующих аммиакатов.
Аморфные гидратированные оксиды алюминия подвергают старению, которое ведут, как правило, в маточных растворах. В результате внутренней структурной перестройки первичных частиц в зависимости от условий старения (рН, температуры, продолжительности), а также от состава аморфной фазы формируется та или иная кристаллическая структура гидроксида алюминия (ГА). Представляло большой научный и практический интерес установить, по какому пути пойдет процесс кристаллизации аморфного ГОА, полученного твердофазным гидролизом алюмокалиевых квасцов под действием газообразного аммиака. С этой целью осадки аморфного ГОА подвергали старению в растворе аммиака при различных условиях. Экспериментальные результаты, приведенные в табл. 4, показывают, что независимо от условий в ходе старения формируется только одна кристаллическая фаза – псевдобемит (ПБ). При этом определяющее влияние оказывает рН среды: с его ростом при прочих равных условиях происходит непрерывное увеличение содержания фазы псевдобемита, а также удельной поверхности частиц. Влияние температуры старения проявляется в гораздо меньшей степени и выражается в том, что ее повышение приводит к некоторому увеличению удельной поверхности частиц. Продолжительность старения определяется, главным образом, величиной водородного показателя: если при рН = 11 процесс кристаллизации практически завершается уже через 30 минут, то при рН = 10 продолжительность процесса необходимо увеличить до 2 часов.
