Планирование урок «Общая характеристика элементов-халькогенов. Кислород.» урок «Серная кислота и ее свойства»
| Вид материала | Урок |
| Ход урока 4. «Угадай вещество»(каждой группе по цитате) 5. «Найди ошибку» 6. «Логические цепочки» 7.Тестовая работа (выполняют все группы) |
- Серная кислота справочные данные, 123.28kb.
- Тема урока: Алкены. Получение, химические свойства и применение алкенов. Цели и задачи, 108.44kb.
- Урок «Азотная кислота», 12.42kb.
- Урок в 9 классе по теме «Бериллий, магний и щелочноземельные металлы.», 43.76kb.
- Урок по теме "Водород. Общая характеристика, нахождение в природе, физические свойства, 284.93kb.
- Анастасией Викторовной Павловой источник: Поурочное планирование •Вводный урок, 288.83kb.
- Тема урока: Общая характеристика элементов подгруппы азота. Свойства азота, 85.69kb.
- Произведения Александра Дюма "Три мушкетёра", "Двадцать лет спустя", "Виконт де Бражелон", 1258.59kb.
- Урок по химии в 9 классе на тему: «Алюминий. Его физические и химические свойства., 78.68kb.
- Тематическое планирование по математике (Л. Г. Петерсон) 2 класс, 508.71kb.
(цели, задачи те же, что и на первом уроке)
Реактивы: Цинк гранулированный, HCl разб. и конц., H2SO4 разб. и конц., кусочки меди.
ХОД УРОКА
- Организационный момент. Проверка усвоения материала прошлого урока.(запись на доске)
1) → MgSO4
H2SO4 2) → CuSO4
3) + Pb(NO3)2 →?+?
Учитель:
Ребята для закрепления свойств разбавленной серной кислоты осуществим эту схему на доске, для этого 3 ученика выходят и пишут уравнения реакций.А все остальные выполняют следующее задание - даны вещества: Fe, Fe2O3, SO3, Fe(OH)3, BaCl2, Ag; С какими из них будет реагировать разбавленная серная кислота. Напишите уравнения осуществимых реакций.
Учитель:
2.Работа над восприятием нового материала. Продолжаем работать над темой – свойства серной кислоты.(формированию более углубленных знаний о серной кислоте, помогает последовательное применение приемов сравнения).
Прием сравнения.
Учитель:
Ребята, мы сейчас посмотрим опыты:
- Взаимодействие цинка с разбавленной соляной и серной кислотами.
Вывод по опыту делают ребята: Zn + HCl → ZnCl2 + H2
Zn + H2SO4 → ZnSO4 + H2
- Взаимодействие меди с разбавленной соляной и серной кислотами.
Вывод по опыту делают ребята: Cu + раз.HCl →
Cu + раз.H2SO4 →
- Взаимодействие меди с концентрированной HCl, H2SO4.
- без нагревания;
- при нагревании
Вывод по опыту делают ребята: концентрированная серная кислота в отличие от разбавленной и от соляной кислоты разной концентрации при температуре реагирует с медью H2SO4(конц.) + Cu t→ ?
Учитель:
А какие продукты образуются в ходе реакции? И только ли с медью идет реакция? ( как правило бывает много разных высказываний, вопрос вызывает затруднение у ребят).
Учитель:
Ребята, экспериментально изучая свойства кислот, мы выявили специфические свойства конц. серной кислоты. В чем проявление?(после некоторых предположений учеников)
Учитель:
В том, что концентрированная серная кислота вступает в реакцию с Me, стоящим в ряду активности в промежутке [ Li – Ag ] , продукты зависят от температуры, активности Me.
В тетради составляем схему:
0 +1 +6 -2 +n +1 -2 1) H2S-2 [Mg-H]
Me + (конц)H2SO4 → MeSO4 + H2 H2О + 2) S0 до Mg
[Li-Ag] 3) +4SO2 правее Н
(Схема из пособия для поступающих в ВУЗы. Сидоров Е.П. 1992г.)
Учитель:
Ребята, с позиции ОВР, чем является концентрированная серная кислота? За счет какого элемента? А разбавленная за счет какого элемента? Делаем вывод в виде схемы
[ Элемент – окислитель ]
в H2SO4
+1 0 разб.↓ ↓ конц+6 →1)H2S-2
H → H2 S → 2)S0
→3) S+4O2
Работа по трем вариантам:
Вариант-1. Ca + (конц.)H2SO4→
Вариант-2. Mg + (конц) H2SO4 →
Вариант-3. Ag + (конц) H2SO4 →
Проставить коэффициенты методом электронного баланса.
Учитель:
- Ребята, во всех этих реакциях, происходит замещение Н на Ме. Как двухосновная серная кислота образует два ряда солей.
В тетради составим схему
H─ O ─ ═ O
S
H─ O ─ ═ O
соли кислые Ме и HSO4. соли средние Ме и SO4.
Организуется работа по вариантам:
Вариант-1. Составляют формулы кислых солей Na, Ca. Назвать.
Вариант-2. Составляют формулы средних солей Na, Ca. Назвать.
Вывод: (формулируют ученики )Мы выявили, что серная кислота как представитель класса кислот имеет общие свойства и свое «я» - сильнейший окислитель за счет элемента S(серы).
3.Домашнее задание
Вопросы на размышление для трех пар учеников, как индивидуальное задание.
- почему медь в реакции с серной кислотой вначале почернела?
- если концентрированная серная кислота вступает в реакцию со всеми Me , то почему ее хранят и перевозят в стальных резервуарах?
- можно ли с помощью кусочка мела определить, в какой склянке разбавленная соляная кислота, а в какой – разбавленная серная кислота?
Для всех остальных:
Кузьменко Н.Е. §40 стр.188 №11б, №13.
Рудзитис Г.Е. §13 стр. 32 №2 задача.
Заключительный урок по теме:
«Халькогены и основные закономерности протекания химических реакций»
Цель: Проверить уровень усвоенности темы.
Задачи: Выявить умение работать с тестовым материалом.
Три варианта тестов: два варианта по сложности одинаковые, третий посложнее.
Первый вариант разбираем в результате коллективной работы,
второй и третий варианты предлагаются в качестве дифференцированного
контроля знаний.
Первый этап урока.
Вариант – 1.
- Оксид серы(4) является оксидом: а) основным, б) амфотерным, в) кислотным, г) несолеобразующим.
2) В одну стадию оксид серы(6) можно получить из: а) оксида серы(4), б) серы, в) сульфата натрия, г) серной кислоты.
3) Какой газ нельзя осушать с помощью концентрированной серной кислоты: а) оксид серы(4), б) азот, в) H2S, г) О2.
- Концентрированная и разбавленная серная кислота ведут себя по
разному в реакции с : а) цинком, б) MgO, в) NaOH, г) K2CO3.
- Самая высокая скорость реакции серной кислоты с гранулами:
а) медь, б) цинк, в) марганец, г) железо.
6) Условие, которое не влияет на смещение равновесия в системе:
H2(г) + J2(г) ↔ 2HJ(г) – Q
а) ↑P, б) ↑t, в) ↓C(H2), г) ↓t.
Второй этап урока– самостоятельная работа по тестам, дифференцированная.
Вариант-2.
- Сульфид железа(2) нельзя получить:
а) взаимодействием железа с серой;
б) окислением пирита;
в) взаимодействием раствора FeCl2 с раствором Na2S;
г) можно получить любым способом.
2) При растворении в воде SO2 образуется кислота: а) сероводородная,
б) сернистая, в) серная, г) тиосерная.
3) Оксид серы(6), как типичный кислотный оксид, реагирует с:
а) основными оксидами, щелочами, водой;
б) неметаллами, шелочами, водой;
в) основаниями, солями, основными оксидами;
г) амфотерными оксидами, кислотами, основаниями.
Напишите уравнения трех соответствующих реакций.
- Концентрированная и разбавленная серная кислота одинаково ведут
себя по отношению к: а) Cu; б) KCl ; в) CuO ; г) Al.
- С наибольшей скоростью протекает реакция:
а) C с О2;
б) железа с раствором уксусной кислоты;
в) железа с соляной кислотой;
г) раствора NaOH и H2SO4.
6) Смещение химического равновесия в системе
SO2 + 2H2S ↔ 3S(тв) + 2H2O(г)
не произойдет в случае: а) ↑C(H2S) ; б) ↑C(SO2); в) ↓C H2O (пара)
г) ↓количества S.
Третий вариант (для успевающих)
- Получение H2S из H2 и S – процесс обратимый. Предположите, как
влияет повышение температуры на состояние равновесия в реакции
H2 + S ↔ H2S
а) равновесие сместится вправо;
б) равновесие сместится влево;
в) равновесие не сместится;
г) верного ответа нет.
2) Оксид серы(6) обладает:
а) только восстановительными свойствами;
б) только окислительными свойствами;
в) и окислительными и восстановительными свойствами;
г) ни окислительными ни восстановительными свойствами.
3) Напишите уравнение диссоциации гидросульфата калия. Число частиц в обеих частях уравнения равно: а) 2; б) 3; в) 4; г) 5.
4) Концентрированную серную кислоту можно перевозить в цистерне:
а) из алюминия; б( из цинка; в) из латуни; г) из бронзы.
5) Скорость химической реакции, в которую вступает твердое вещество,
увеличивается в результате:
а) изменения концентрации участвовавших в реакции веществ;
б) уменьшения температуры;
в) изменения давления;
г) увеличения площади поверхности соприкосновения реагирующих
веществ.
- Деревянная лучина при погружении в концентрированную серную
кислоту обугливается, так как:
а) при взаимодействии кислоты с древесиной происходит сильное
разогревание;
б) происходит окисление древесины до углерода;
в) концентрированная серная кислота – сильнейшее водоотнимающее
средство;
г) концентрированная серная кислота имеет плотность в 1,9 раза больше
плотности воды.
Общественный смотр знаний
Тема: «Халькогены»
Цели:
1.Обобщить, закрепить пройденные вопросы.
2.Проверить уровень усвоенности темы.
Реактивы: раствор Na2S, растворы H2SO4, Na2SO4, Na2CO3, Zn (гранулы),
твердые вещества Na2SO4, Na2SO3, конц.Н2SO4
Этапы урока.
1.Цифровой диктант
2. Информационная разминка
3. Эксперимент
4. Угадай вещество
5. «Найди ошибку»
6. «Логические цепочки»
7. Тестовая работа
(работа проводится в группах)
- Цифровой диктант
Цель: активизация познавательной деятельности, мотивация на работу.
Учитель:
Ребята, я буду читать утверждения. Если вы согласны ставите 1, если нет ставите 0.
В итоге у вас получится цифра (представители от групп ответ пишут на доске для обсуждения)
- NaHS – сульфид натрия.
- Степень окисления серы в нем +2.
- В H2SO4 сера проявляет высшую степень окисления.
- Соединения серы(4) в реакциях проявляют только окислительные свойства.
- Соли H2SO4 – сульфаты°.
- Реакция окисления SO2 в SO3 экзотермическая, обратимая.
- Соединения серы(2) в реакциях только восстановители.
2.Информационная разминка.
Цель: Повторить знания о сере – простом веществе, элементе и ее соединениях.
Обозначения: - простое вещество - □
- элемент - ∆
- соединение - o
(от каждой группы выходят представители к доске и пишут свой ответ)
1.Сера нам необходима –
Нам без серы не прожить
Всем известно, что без серы
Нам огня не запалить
2.Сера есть в белках, сульфатах
И в сульфиде есть она
И для сероуглерода
Обязательно нужна.
3.Портит сера атмосферу
А верней – ее оксид
Пожелтели листья в сквере
Дождь кислотный моросит.
3.Эксперимент.(у каждой группы свое задание. Объясняют свои результаты, пишут уравнение реакции).
Первая группа: Доказать наличие сульфид – иона в Na2S.
Вторая группа: Распознать среди двух солей, соль серной кислоты.
Третья группа: Доказать содержание ионов водорода в серной кислоте.
Четвертая группа: Доказать, что выданный образец сульфита натрия содержит примесь Na2SO4.
Пятая группа: Среди выданных трех кислот распознать серную.
4. «Угадай вещество»(каждой группе по цитате)
а) Она прозрачна как вода
Не пахнет и густа как масло
Но воду лить в нее опасно:
Из колбы пар, вода шумит
Как будто в ней змея лежит
И вольно иль невольно
Ужалить может больно.
б) Я растворю любой металл
Меня алхимик получал
В реторте глиняной простой
Слыву я главной кислотой
Когда сама я растворяюсь
В воде, то сильно нагреваюсь.
в) Я всюду есть – но понемножку
Черню серебряную ложку
Когда испорчено яйцо
Я тоже сразу налицо,
Я отбиваю аппетит
И очень сильно ядовит.
г) Когда пирит в печи горит
То в горле от меня першит
А мой гидрат планете всей
Грозит кислотностью дождей
д) Достоин этот газ удивленья –
Его применяют сейчас
Для резки металлов, в сталеваренье
И в доменных мощных печах.
Берет его летчик в высотные дали,
Подводник с собою берет
Вы верно уже угадали,
Что это - …….
5. «Найди ошибку»
Цель:Проверка умения подбора коэффициентов ОВР.
Учитель:
Ребята, на доске написаны уравнения реакции, в которых преднамеренно допущены ошибки. Работая в группах со своим уравнением находите и исправляете ошибку.
Первая группа: Cu + H2SO4 = CuSO4 + SO2 + 2H2O
Вторая группа: Mg + H2SO4 = 3MgSO4 + S + 3H2O
Третья группа: C + 2H2SO4 = CO2 + SO2 + 2H2O
Четвертая группа: 2H2S + H2SO4 (к) = 3S + SO2 + 2H2O
Пятая группа: S + 3H2SO4 (к) = 4SO2 + 3H2O
6. «Логические цепочки»
Цель: Повторить взаимосвязь между основными классами неорганических соединений.
Учитель:
Ребята, на доске запись пяти цепочек. Работаем в группах.
Первая группа: SO2 → SO3 → H2SO4 →KHSO4
Вторая группа: SO3 → CaSO4 → Ca(OH)2→ Ca(NO3)2
Третья группа: S → H2S → Na2S → CuS
Четвертая группа: H2S → SO2 → K2SO3 → SO2
Пятая группа: H2SO4 → CuSO4 → Cu(OH)2 → CuO
По окончанию работы показываем на доске.
7.Тестовая работа (выполняют все группы)
1) Электронная формула атома химического элемента 1S22S22P63S23P4. Укажите химический знак элемента и формулу высшего оксида:
а) S, SO2; б) S, SO3; в) Se, SeO2; г) Se , SeO3
2) В уравнении реакции горения серы в кислороде коэффициент перед формулой восстановителя равен:
а) 1; б) 2; в) 3; г) 4.
3) С каким веществом не реагирует разбавленная серная кислота?
а) Al ; б) Ag ; в)Fe ; г) Mg.
4) С помощью какого иона можно обнаружить SO2-4?
а) Н+ ; б) ОН- ; в) Ag+ ; г) Ва2+
Каждый этап урока направлен на решение конкретной учебной задачи, в целом – целей урока. Через такое взаимодействие в сотворчестве учителя и учащихся хочется думать об улучшении качества образовательной подготовки, повышении мотивации к учению, развитии способности анализировать, решать учебные задачи.
Тема: Фенолы
Цель: Познакомить учащихся с новым классом органических кислородо- содержащих веществ. Рассмотреть строение, физические и химические свойства.
Задачи: Продолжить формирование понятия «функциональная группа», зависимость свойств от строения. Закрепить положение теории А.М.Бутлерова о взаимном влиянии групп атомов в молекуле.
Тип урока: Комбинированный (изучение нового на основе закрепления пройденного)
Технология: проблемно-поисковая.
Реактивы: фенол кристалл, раствор щелочи, металлический натрий, этиловый спирт 95%. ( тема не написана, цель не названа)
- Проверяется домашнее задание и еще раз проговаривается определение и классификация спиртов.
2.Восприятие новой темы (создание проблемной ситуации).
Ребята, на доске видите запись формулы вещества (1).
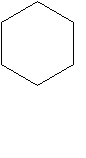
 ОН К какому классу соединений вы бы отнесли?
ОН К какому классу соединений вы бы отнесли? (Как правило отвечают, что отнести можно
(Как правило отвечают, что отнести можно к спиртам ароматическим)
Тогда пишу вторую формулу на доске.
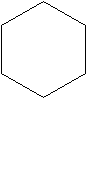
 СН2ОН
СН2ОН
А это к какому классу отнесли бы?
(тоже ароматические спирты)
Создается проблемная ситуация : на основании знакомых групп атомов определить принадлежность веществ к классу. К какому же классу на самом деле они относятся?
Отмечаем сходства и различия в строении этих двух веществ между собой и с классами веществ при изучении которых эти группы встречались.
Учитель:
На примере изучения классов веществ перечислите, что может влиять на свойства?
- состав;
- строение;
- взаимное влияние групп атомов;
В каком из этих двух веществ влияние групп атомов проявляется сильнее?
На основе рассуждений заключаем, что вещество под формулой (2) – это ароматический спирт, а строение вещества под формулой (1) настолько отличается по свойствам от ароматических спиртов, что позволило выделить его в отдельный класс, называемый фенолами. И это простейший представитель класса – фенол.
(Пишем название темы и проговаривается цель).
Учитель:
Какое определение можно дать фенолам? (Дается определение и записывается в тетрадь).
-Предъявление к классу учебной задачи:
Что лежит в основе выделения фенолов в отдельный класс? Что мы должны знать, чтобы это определить?
-Решение учебной задачи:
Демонстрационный эксперимент (если есть фенол)
1.Сравнение растворимости бензола и фенола в воде.
а) С6Н6 в воде не растворим
б) С6Н5ОН при большой температуре растворяется
В чем причина такого отличия? (На уроке разобрать возникновение водородных связей не представляется возможным, поэтому это будет поисковым заданием конкретному ученику).
2.Химические свойства фенола.
а) Сходен ли фенол с предельными одноатомными спиртами? Как это сходство повлияет на химические свойства фенола? (Опыт с фенолом проводится в вытяжном шкафу).
Реакции по ОН – группе:
- 2C2H5OH + 2Na → 2C2H5ONa + H2↑
- 2C6H5OH + 2Na → 2C6H5ONa + H2↑
- C2H5OH + NaOH →
- C6H5OH + NaOH → C6H5ONa + H2↑
На основе этих реакций выявляем сходства и различия С2Н5ОН и С6Н5ОН Вывод: кислотные свойства водного раствора С6Н5ОН больше, чем у С2Н5ОН (водород в ОН группе замещается легче). Это подчеркивается и другим названием фенола – карболовая кислота.
Оформляем схему:
О ← Н ( Н более подвижен)
↓
С6Н5
С2Н5 → О ← Н ( Н подвижен)
Н в ОН группе
(подвижность)
↓ ↓
С2Н5-; СН3- С6Н5-
уменьшают увеличивают
б) Сходен ли фенол с аренами? Как это сходство повлияет на свойства фенола?
Реакции по С6Н5 – кольцу:
FeBr3
- С6Н6 + Br2 t→ C6H5Br + HBr
(чист)
- С6Н5ОН + Br2 → C6H2(Br3)OH↓ + 3HBr
(раст) (белый осадок)
В чем причина?
После выдвижения предположений строим схему:

 ОН
ОН 6 2 (Н в положениях 2, 4, 6 бензольного кольца
6 2 (Н в положениях 2, 4, 6 бензольного кольцаиз-за наличия ОН группы более подвижен,
чем в самом бензоле)
4
Ответ (вывод): Причиной определения фенолов в отдельный класс являются…….
строение фенолов и взаимное влияние групп атомов непосредственно связанных друг с другом.
С6Н5 ↔ ОН
усиливает облегчает и
подвижность ↓ ↓ направляет
Н в ОН-гр. замещ.Н в С6Н5
3.Закрепление материала темы.
1) Что определяет разную растворимость в воде С6Н6 и С6Н5ОН?
2) Как доказать, что С6Н5ОН является «кислотой?»
3) Упражнение. Являются ли гомологами следующие пары веществ:
а) С6Н5ОН и С6Н4(ОН)2 гидрохинон
б) С6Н5ОН и С6Н4(СН3)ОН крезол
Дайте обоснованный ответ в свете теории строения органических веществ.
4. Домашнее задание: Работая с параграфом обратить внимание на получение фенола и применение.
Осуществить цепочку превращений и назвать вещества.
СН4 → С2Н2 → ? → С6Н5Br → C6H5OH → C6H2(NO2)3OH
