Урок по теме "Водород. Общая характеристика, нахождение в природе, физические свойства и получение"
| Вид материала | Урок |
- Тема урока: Сера, ее физические и химические свойства, 107.64kb.
- Реферат по химии на тему: «Неметаллы», 140.25kb.
- Вопросы к коллоквиуму по теме: «Лекарственные растения и сырье, содержащие фенольные, 15.75kb.
- Схема-конспект №6 ч. 1 Заготовка к схеме-конспекту №6 ч. 2 для учащихся на бумажном, 114.13kb.
- Планирование урок «Общая характеристика элементов-халькогенов. Кислород.» урок «Серная, 488.3kb.
- Урок-игра «Покорение вершины» Тема «Общая характеристика плоских, круглых, кольчатых, 37.5kb.
- Урок природоведения в 5 классе на тему «Гидросфера», 25.32kb.
- Урок по теме: "Общие свойства металлов", 64.04kb.
- Урок-сказка по математике в 5-м классе по теме "Уравнение", 43.25kb.
- Урок в 9-м классе по теме: "Водород", 154kb.
Урок по теме "Водород. Общая характеристика, нахождение в природе, физические свойства и получение"




 Цель: Дать общую характеристику водороду, ознакомиться с его физическими свойствами, методами получения и нахождением в природе.
Цель: Дать общую характеристику водороду, ознакомиться с его физическими свойствами, методами получения и нахождением в природе.Образовательные задачи: Охарактеризовать водород как элемент и как простое вещество, показать большое распространение водорода в природе, ознакомить учащихся с аппаратом Киппа, лабораторным и промышленным способами получения водорода и выяснить, какие свойства водорода лежат в основе методов его собирания.
Воспитательные задачи: Продолжить формирование у учащихся диалектико-материалистического понимания природы.
Развивающие задачи: Развитие общеучебных умений и навыков: работа с учебником и дополнительной литературой, правила работы на рабочем столе, умение систематизировать и обобщать, устанавливать причинно-следственные связи, доказательно и грамотно излагать свои мысли, делать выводы, составлять схемы, зарисовывать.
Развитие специальных умений и навыков: Наблюдать химические явления, обращаться с химическими приборами, реактивами, соблюдать технику безопасности при работе с химическим оборудованием, оформлять демонстрационный эксперимент, закрепить умения уравнивать химические уравнения и определять типы химических реакций, применять полученные знания для объяснения новых фактов.
Форма: Модульный урок.
Ход урока
УЭ-1
Цель: вспомнить основные особенности газов.
- Дополните запись: Молекула газов состоит из ---------атомов.
- Рассчитайте: Водород легче или тяжелее воздуха. Массу воздуха принять за 29
- Какими методами можно пользовать при собирании газов?
- Разгадайте загадку: «Гость из космоса пришёл, в воде себе приют нашёл» О каком газе идет речь?
- В тетради запишите тему нашего урока.
- Чтобы вы хотели узнать об этом удивительном элементе? В тетради составьте схему.
?
? Водород ?
? ?
?
УЭ – 2
Цель: дать общую характеристику водорода и ознакомиться с его нахождением в природе.
2.1 Пользуясь таблицей Д.И. Менделеева дайте общую характеристику водорода по плану:
Химический знак -
Порядковый номер –
Относительная атомная масса Ar (Н) =
Химическая формула -
Относительная молекулярная масса Mr (Н) =
Молярная масса -
Валентность - .
Ответ запишите в тетрадь.
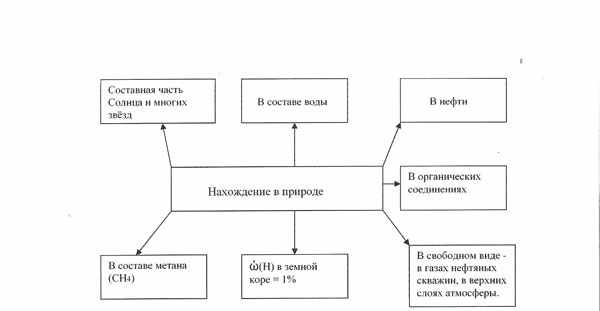
2.2 Прочитайте о нахождении водорода в природе в учебнике на странице 71 и в тетради составьте схему, указав области нахождения водорода в природе.
 Вывод: Водород является самым распространённым элементом во Вселенной.
Вывод: Водород является самым распространённым элементом во Вселенной.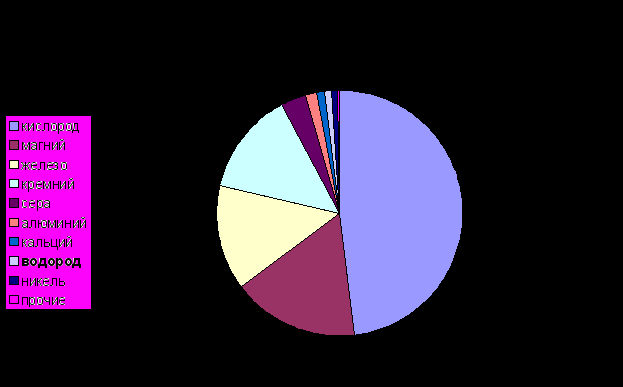
УЭ – 3
Цель: Ознакомиться с физическими свойствами водорода, выяснить, какими способами получают водород в промышленности и в лаборатории.
3.1 Ознакомьтесь с текстом. Назовите фамилию ученого открывшего водород и год открытия. Подчеркните в тексте физические свойства водорода.
Впервые этот газ в чистом виде выделил 240 лет назад английский химик Генри Кавендиш. Свойства полученного им газа были настолько удивительны, что ученый принял его за легендарный «флогистон», «теплород» — вещество, по канонам науки того времени определявшее температуру тел. Он прекрасно горел (а огонь считался почти чистым флогистоном), был необычайно легок, в 15 раз легче воздуха, малорастворим в воде, без цвета, без запаха, хорошо впитывался металлами и так далее. Однако другой великий химик, француз Антуан-Лоран Лавуазье, уже в 1787 году доказал, что полученное Кавендишем вещество — вполне обычный, хотя и очень интересный химический элемент. Свое название он получил оттого, что при горении давал не дым, сажу и копоть, а воду. Кстати, именно эта его особенность больше всего привлекает сегодняшних экологов и «зеленых».
- Исходя их физических свойств водорода, укажите способы его собирания. Ответ запишите в тетрадь.
- Ознакомиться с параграфом 26 в учебнике, абзац 2, назвать способ получения водорода.
- В сопровождении учителя проделать опыт: взаимодействие кислот с металлами (краткий инструктаж по технике безопасности при работе с кислотами). Уравнение реакции записать в тетрадь. Определить к какому типу химических реакций оно относится.
- Соберите полученный водород и докажите его наличие.
- Знакомство с аппаратом Киппа.
Ознакомьтесь с устройством аппарата Киппа. Действие его рассмотрите, используя мультимидейное пособие.
- Аппарат Киппа - химический прибор, имеющий свой аналог в природе! Аппарат Киппа существует в природе, в организме жуков-бомбардиров.
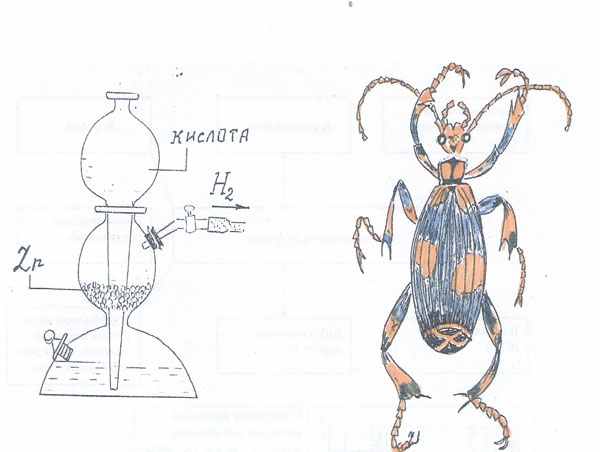
- Ознакомьтесь с текстом и укажите, действие аппарата Кипа в организме жука-бомбардира. Ответ подчеркните карандашом в тексте.
Аппарат Киппа - прибор для получения небольших количеств углекислого газа, водорода, сероводорода из двух негазообразных веществ - твёрдого и жидкого, изолированных друг от друга до реакции. Прибор изобрёл в середине XIX века голландский фармацевт Якоб Кипп. Аппарат Киппа существует в природе, в организме жуков-бомбардиров. Небольшое оранжево-синее насекомое, защищаясь от нападения врага, выбрасывает нагретую до высокой температуры газовую струю. Газовая струя обращает в бегство напавшего на жука муравья, вызывает небольшой ожог на коже человека. Газовую струю образуют две крохотные железы, расположенные в конце брюшка. В организме насекомого, как и в аппарате Киппа, нет запаса сжатого газа. Он создаётся по мере необходимости в результате реакции негазообразных веществ. Различие между железами жука и аппаратом Кипа в способе прекращения реакции негазообразных веществ. В аппарате Киппа надо перекрыть кран газоотводной трубки, тогда накапливающийся газ вытесняет жидкий реагент из реакционной камеры в воронку. В железе жука мышца-«кран» расположена не на выходе, а на входе в реакционную камеру и регулирует поступление новых порций реагентов. Аппарат Киппа работает непрерывно, аппарат жука - периодически. При этом жук использует не только продукты реакции, но и выделяющуюся теплоту
- Прочитайте абзац 2 параграфа 26 и укажите способ получения водорода. В сопровождении учителя проделать опыт: взаимодействие воды с активными металлами (краткий инструктаж по технике безопасности)
Уравнение реакции записать в тетрадь. Определить к какому типу химических реакций оно относится.
3.10 Используя мильтимидейное пособие проделайте опыты взаимодействия различных металлов с водой. Уравнения реакций запишите в тетрадь.
3.11 Получение водорода в промышленности. Почитайте последний абзац параграфа 26 и запишите в тетради химические реакции, с помощью которых получают водород в промышленности.
УЭ – 4
Цель: Проверить уровень освоенности изученного материала.
Выполнить задания тестов.
1. Химический знак водорода:
А) Н б) О в) Р
2. В соединениях водород:
А) трехвалентен б) одновалентен в) двухвалентен
3. Водород не получают следующим способом:
А) разложением воды под действием постоянного электрического тока.
Б) взаимодействием некоторых металлов с кислотами
В) взаимодействием активных металлов с водой
Г) при разложении оксида алюминия (Al2O3)
4. Собирают водород:
А) методом вытеснения воздуха и воды
Б) методом разложения воды
5. Водород впервые получил:
А) Менделеев
Б) Бутлеров
в) Кавендиш.
6. Решите задачу: Какая масса водорода выделиться при разложении воды под действием постоянного электрического тока массой 48 г?
УЭ - 5
Цель: Выяснить, достигнута ли поставленная цель в начале урока.
5.1 Прочитайте ещё раз цель урока и ответьте на вопрос: Достигли ли вы цели урока? В какой степени? На все поставленные цели нашли ответ? Что вы знали о водороде до изучения материала и что узнали нового в течении урока? Закончите предложение: Меня удивило ----------------------
5.2 Оцените свою работу на уроке: «Отлично», «хорошо», или «удовлетворительно».
5.3 Запишите домашнее задание: учебник параграф 25,26,
Вопросы на закрепление учебного материала, записанные на доске.
- Если бы вы вносили интересные факты в Книгу рекордов Гиннеса, водород попал бы туда по своим характеристикам? Дайте обоснованный ответ.
5. Домашнее задание и инструктаж по его выполнению.
Соответствующий параграф учебника.
- Водород можно получить при взаимодействии алюминия с раствором соляной кислоты, калия с водой. Составьте уравнения этих реакций. Поясните, к какому типу относятся эти реакции.
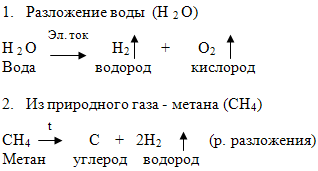
- Разложение воды электрическим током:
| Порядок выполнения | Рисунок, уравнения | Особенности | Вывод |
| Открыли газоотводную трубку. Кислота поднялась и полностью закрыла цинк. Стали выделяться пузырьки газа. Собрали водород в пробирку и поднесли пробирку к пламени спиртовки, а потом к газоотводной трубке - таким образом, зажгли газ. Раздался лающий хлопок, собранный газ - водород! | 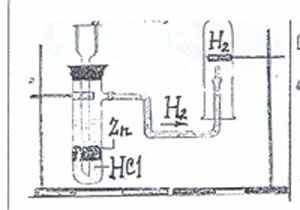 Zn+2H → ZnCl2+H2 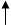 Цинк соляная кислота водород. (р. замещения) 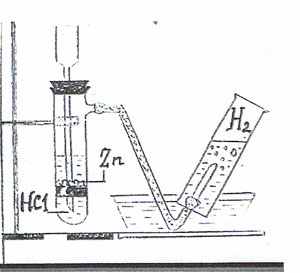 | Собирание водорода методом вытеснения воздуха, так как газ легче воздуха. Собирание водорода методом вытеснения воды, так как газ мало растворим в воде. | Получен водород взаимодействием металлов с кислотами. Учитывая физические свойства газа, собирали его двумя способами. |
3. Взаимодействие активных металлов с водой. Демонстрация.
| Порядок выполнения | Рисунок, уравнения | Особенности | Вывод |
| 1.Закрепив трубку в штативе, опустили её в стакан с водой. 2. Бросим кусочек натрия в трубку. 3. Обнаружили водород горящей спичкой. 4. Прилили 2-3 капли фенолфталеина к воде, наблюдали розовое окрашивание. |  2Na+2HOH → NaOH+H2 (р. замещения) | С помощью индикатора определили наличие щёлочи, а с помощью горящей спички - водород. Реакция протекает бурно, необходимо строго соблюдать технику безопасности. | Получен водород взаимодействием активных металлов (Na, К, Ca) c водой. |
Рассказ учителя.
Физические свойства.
Водород - бесцветный, не имеющий вкуса и запаха газ. Лабораторный водород имеет неприятный запах. Длительное время считали, что это запах самого водорода. Во второй половине XIX века учёные установили, что тщательно очищенный водород запаха не имеет, неприятный запах вызван примесями сероводорода и других газов. Водород - самый лёгкий газ! Он в 14,5 раз легче воздуха (1л весит 0,09 г). Поэтому если мыльные пузыри наполнить водородом, то они поднимаются вверх (см. рисунок в учебнике). Беседа: «Использует ли человек это свойство водорода в своей жизни?»
Растворимость водорода в воде очень мала, а температура сжижения чрезвычайно низкая (-252,8°С) [2].
Раздача дидактического материала – карточек [1].
| Если шар объёмом 22,4 м3 наполнить водородом, то в воздухе он может поднять груз массой 27 кг. В первой половине XX века началось строительство летательных аппаратов большой грузоподъёмности - дирижаблей, которые наполняли водородом. Однако водород - взрывоопасный газ, и в 1930-е гг. с дирижаблями произошло несколько крупных аварий. После этого строительство дирижаблей с водородом во всём мире на многие годы прекратилось. Воздушный шар наполняют водородом  Рисунок 2 |
Я познаю мир. Химия: энцикл/авт. - сост. И.А. Савина. - М.: АСТ: Астрель: Транзиткнига, 2006.Водород
Урок в 9-м классе по теме: "Водород"
Цели урока: Сформировать понятие об особенностях строения и свойствах водорода,
представление о специфических свойствах, роли в природной среде и жизни человека.
Задачи:
- в процессе исследования изучить физические и химические свойства водорода и его соединений;
- развивать дальнейшие умения составлять уравнения химических реакций;
- учить сравнивать, обобщать, анализировать и делать выводы;
- развивать познавательную деятельность через эксперимент и посредством заданий развивающего характера;
Метод обучения: Объяснительно-иллюстративный, проблемно-поисковый.
Организационные формы: беседа, самостоятельная и практическая работа, сообщения учащихся
Средства обучения: таблицы, химическое оборудование и реактивы, медиапроектор.
Приёмы активизации мыслительной деятельности учащихся:
1. Анализ учебной информации
2. Раскрытие межпредметных связей между химией, биологией, географией, астрономией.
3. Выдвижение гипотез
4. Анализ и составление обобщающих таблиц.
Основные особенности использования цифровых образовательных ресурсов:
Во время изучения данной темы будут использованы иллюстративные материалы интернет-ресурсов, содержащие справочные данные по физико-химическим свойствам и значении водорода и воды; ресурсы компакт-дисков, содержащих информацию и иллюстративный материал по данной теме; компьютерные программные средства – Microsoft Word, Microsoft Power Point, и другие для подготовки материалов к уроку и самостоятельной работы учащихся.
Компьютерная презентация к уроку (Приложение №1)
Ожидаемые результаты обучения:
В результате изучения данной темы учащиеся:
· Получают знания о строении, свойствах и значении водорода на Земле и во Вселенной
· Получают представление о распространенности водорода в природе
· Приобретают знание физических и химических свойств водорода
· Знакомятся с важнейшими областями применения водорода и методами его получения из природного сырья
· Приобретают умение объяснить причину опасности работы с водородом
· Приобретают навыки работы с химическими веществами и оборудованием
· Умеют использовать средства Microsoft Word, Microsoft Excel, Microsoft Power Point, Front Page, Microsoft Office для подготовки презентаций, рефератов, докладов, проектных работ по данной теме.
Используемая литература:
1) С.С.Бердоносов, Е.А. Менделеева «Особенности содержания и методики преподавания некоторых избранных тем курса химии 8-9 классов.»Москва Педагогический университет 2006.
2) В.В.Еремин Н.Е Кузьменко.» Сборник задач и упражнений по химии. Школьный курс. Москва «ОНИКС21 век»Мир и Образование 2003.
3) Энциклопедический словарь юного химика.Москва. «Педагогика» 1990.
4) Журнал «Вокруг Света» Июль 2006. Разворот на водород.
Структура урока
I.Ориентировочно-мотивационный блок (Предъявление темы, обоснование её актуальности, возбуждение интереса к ней). Вводная беседа, создание проблемной ситуации.
II. Информационный блок (Формирование стержневой проблемы, организация обсуждения по этапам, составление опорного конспекта.)
III. Генерализация (Обобщение и систематизация результатов поиска и ответа на проблему, составление схем обобщающих поисковую деятельность )
IV. Рефлексия.
V. Домашнее задание.
Ход урока
Эпиграф к уроку:
И если вчера человечество благоговело перед новым видом энергии- электричеством, а позавчера перед паровым котлом, то сегодня мы управляем реакцией распада атомного ядра, а завтра будем управлять реакцией синтеза ядер- создадим земные солнца!
Д.И.Щербаков.
Учитель:
Опорный конспект:
Общая характеристика:
Водород занимает первое место в периодической системе (Z = 1). Он имеет простейшее строение атома: ядро атома окружено электронным облаком. Электронная конфигурация 1s1.
В одних условиях водород проявляет металлические свойства (отдает электрон), в других — неметаллические (принимает электрон). Однако по свойствам он более сходен с галогенами, чем со щелочными металлами. Поэтому водород помещают в VII группу периодической системы элементов Д.И. Менделеева, а в I группе символ водорода заключают в скобки.
Водород в природе:
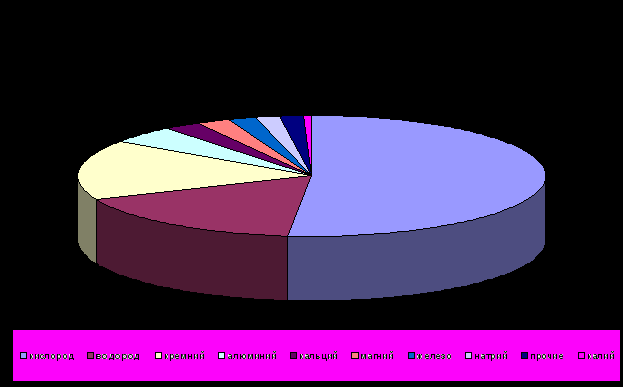
Водород широко распространен в природе — содержится в воде, во всех органических соединениях, в свободном виде — в некоторых природных газах. Содержание его в земной коре достигает 0,15% ее массы (с учетом гидросферы — 1%). Водород составляет половину массы Солнца.
Когда-то люди обожествляли Солнце. Но теперь оно стало объектом точных исследований, и мы редко задумываемся о том, что само наше существование целиком и полностью зависит от происходящих на нем процессов.
Каждую секунду Солнце излучает в космическое пространство энергию, эквивалентную примерно 4 млн т массы. Эта энергия рождается в ходе слияния четырех ядер водорода, протонов, в ядро гелия; реакция идет в несколько стадий, а ее суммарный результат записывается вот таким уравнением:
411Н+ → 42Не2+ + 2е+ + 26,7 МэВ.
Много это или мало –26,7 МэВ на один элементарный акт? Очень много: при «сгорании» 1 г протонов выделяется в 20 млн раз больше энергии, чем при сгорании 1 г каменного угля. На Земле такую реакцию еще никто не наблюдал: она идет при температуре и давлении, существующих лишь в недрах звезд и еще не освоенных человеком.
Солнце - это сферически симметричный раскаленный плазменный шар, находящийся в равновесии. Оно, вероятно, возникло вместе с другими телами Солнечной системы из газопылевой туманности примерно 5 млрд. лет назад. В начале своей жизни солнце, примерно на 3/4 состояло из водорода. Затем, из-за гравитационного сжатия, температура и давление в недрах настолько увеличились, что самопроизвольно начала происходить термоядерная реакция, в ходе которой водород превращаться в гелий. В результате этого очень сильно поднялась температура в центре Солнца, (порядка 15.000.000о К), а давление в его недрах возросло настолько ( 1,5х105 кг/м3), что смогло уравновесить силу тяжести и остановить гравитационное сжатие. Так возникла современная структура Солнца. За время существования Солнца уже около половины водорода в его центральной области превратилось в гелий и вероятно ещё через 5 млрд. лет, когда в центре светила водород будет на исходе, Солнце ( жёлтый карлик в настоящее время) увеличится в размерах и станет красным гигантом.
В природе водород встречается в виде двух изотопов — протия (99,98%) и дейтерия (0,02%). Поэтому в обычной воде содержатся большие количества тяжелой воды
Молекула водорода состоит из двух атомов. Возникновение связи между ними объясняется образованием обобщенной пары электронов (или общего электронного облака):
Н:Н или Н2
Благодаря этому обобщению электронов молекула Н2 более энергетически устойчива, чем его отдельные атомы. Чтобы разорвать в 1 моль водорода молекулы на атомы, необходимо затратить энергию 436 кДж:
Н2 = 2Н, ?H° = 436 кДж/моль
Этим объясняется сравнительно небольшая активность молекулярного водорода при обычной температуре.
Физические свойства.
Водород — это самый легкий газ (он в 14,4 раза легче воздуха), не имеет цвета, вкуса и запаха. Мало растворим в воде (в 1 л воды при 20°С растворяется 18 мл водорода). При температуре — 252,8°С и атмосферном давлении переходит в жидкое состояние. Жидкий водород бесцветен.
Кроме водорода с массовым числом 1 существуют изотопы с массовыми числами 2 и 3 — дейтерий D и тритий Т.
Газообразный водород может существовать в двух формах (модификациях) — в виде орто- и пара- водорода.
В молекуле ортоводорода (т. пл. -259,20 °С, т. кип. -252,76 °С) ядерные спины направлены одинаково (параллельны), а у параводорода (т. пл. -259,32 °С, т. кип. -252,89 °С) — противоположно друг другу (антипараллельны).
Химические свойства
Для водорода характерны следующие реакции с простыми веществами (с Al, B, Si, P соединения водорода получают косвенным путём):
Взаимодействие с неметаллами
При поджигании или в присутствии платинового катализатора реагирует с кислородом
O2 + 2H2 = 2H2O, реакция протекает со взрывом.
Смесь двух объёмов водорода и одного объёма кислорода называется гремучим газом.
При нагревании водород обратимо взаимодействует с серой:
S + H2 ⇔ H2S
С азотом — при нагревании, повышенном давлении и в присутствии катализатора (железо):
N2 + 3H2 = 2NH3
С галогенами образует галогеноводороды:
F2 + H2 = 2HF, реакция протекает со взрывом при любой температуре,
Cl2 + H2 = 2HCl, реакция протекает только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 = CH4
] Взаимодействие со щелочными и щёлочноземельными металлами
Водород образует с активными металлами гидриды:
Na + H2 = 2NaH
Ca + H2 = CaH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O = Ca(OH)2 + 2H2 ↑
Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
CuO + H2 = Cu + H2O
Fe2O3 + 3H2 = 2Fe + 3H2O
WO3 + 3H2 = W + 3H2O
Гидрирование органических соединений
При действии водорода на ненасыщенные углеводороды в присутствии никель-катализатора и повышенной температуре происходит реакция гидрирования:
CH2=CH2 + H2 = CH3-CH3
Водород восстанавливает альдегиды до спиртов:
CH3CHO + H2 = C2H5OH
Получение:
Вплоть до конца XIX века получение водорода было делом достаточно хлопотным. Добывали его в мизерных количествах, растворяя обычные металлы в кислотах, а также щелочные и щелочноземельные в воде. Только после того, как электричество начали производить в промышленных масштабах, появилась возможность относительно легко добывать его тоннами с помощью электролиза. Выглядит электролитический процесс примерно так: в ванну с водой опускают два электрода, на одном — положительный потенциал, на другом — отрицательный. На плюсе в результате прохождения тока выделяется кислород, а на минусе — водород.
Эксперимент по получению водорода из воды с помощью солнечной энергии (Университет Нового Южного Уэльса, Австралия). В этой технологии солнечный свет сначала преобразуется в электричество, которое уже разлагает воду на кислород и водород в присутствии катализатора (диоксида титана)
В промышленности
1.Электролиз водных растворов солей:
2NaCl + 2H2O → H2 + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
H2O + C ⇔ H2 + CO
3.Из природного газа.
Конверсия с водяным паром:
CH4 + H2O ⇔ CO + 3H2 (1000°C)
Каталитическое окисление кислородом:
2CH4 + O2 ⇔ 2CO + 4H2
4. Крекинг и реформинг углеводородов в процессе переработки нефти.
В лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и соляную кислоту:
Zn + 2HCl = ZnCl2 + H2
2.Взаимодействие кальция с водой:
Ca + 2H2O = Ca(OH)2 + H2
3.Гидролиз гидридов:
NaH + H2O = NaOH + H2
4.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e = H2 + 2H2O
Применение:
В качестве перспективного горючего водород начал рассматриваться уже в середине прошлого века, а до этого он успел поработать в дирижаблях и сварочных аппаратах, ныне же часто трудится в роли одного из самых эффективных аккумуляторов энергии. Внедрение водорода в качестве горючего долго тормозилось его взрывоопасностью, а самое главное, себестоимостью его добычи. Но скоро ситуация может резко измениться
Наработав в достаточном количестве этот легкий газ, люди сначала приспособили его для воздушных полетов. В этом качестве первый элемент Таблицы Менделеева применяли вплоть до 1937 года, когда в воздухе сгорел крупнейший в мире, в два футбольных поля размером, заполненный водородом немецкий дирижабль «Гинденбург». Катастрофа унесла жизни 36 человек, и на таком использовании водорода был поставлен крест. С тех пор аэростаты заправляют исключительно гелием. Гелий — газ, увы, более плотный, но зато негорючий. .
Водород используют при синтезе аммиака NH3, хлороводорода HCl, метанола СН3ОН, при гидрокрекинге (крекинге в атмосфере водорода) природных углеводородов, как восстановитель при получении некоторых металлов. Гидрированием природных растительных масел получают твёрдый жир — маргарин. Жидкий водород находит применение как ракетное топливо, а также как хладагент. Смесь кислорода с водородом используют при сварке.
Одно время высказывалось предположение, что в недалёком будущем основным источником получения энергии станет реакция горения водорода, и водородная энергетика вытеснит традиционные источники получения энергии (уголь, нефть и др.). При этом предполагалось, что для получения водорода в больших масштабах можно будет использовать электролиз воды. Электролиз воды — довольно энергоёмкий процесс, и в настоящее время получать водород электролизом в промышленных масштабах невыгодно. Но ожидалось, что электролиз будет основан на использовании среднетемпературной (500—600 °C) теплоты, которая в больших количествах возникает при работе атомных электростанций. Эта теплота имеет ограниченное применение, и возможности получения с её помощью водорода позволили бы решить как проблему экологии (при сгорании водорода на воздухе количество образующихся экологически вредных веществ минимально), так и проблему утилизации среднетемпературной теплоты.
В 1979 году компания BMW выпустила первый автомобиль, вполне успешно ездивший на водороде, при этом не взрывавшийся и выпускавший из выхлопной трубы водяной пар. В эпоху усиливающейся борьбы с вредными выхлопами машина была воспринята как вызов консервативному автомобильному рынку. Вслед за BMW в экологическую сторону потянулись и другие производители. К концу века каждая уважающая себя автокомпания имела в запаснике хотя бы один концепт-кар, работающий на водородном топливе.
Баварские автомобилестроители в рамках программы CleanEnergy («чистая энергия») приспособили под езду на Н2 несколько «семерок» и MINI Cooper.
Оборудованная 4-литровым двигателем водородная «семерка» развивает мощность в 184 лошадиные силы и проходит на одной заправке (170 литтров жидкого водорода «под завязку») 300 км.
Но большинство производителей пошли по пути создания электромобилей на топливных элементах. Ибо кроме «экологичности» у них есть масса других преимуществ. Например, гораздо более высокий (до нескольких раз) КПД двигателя или бесшумность.
А больше всех новым топливом заинтересовались японцы. И это понятно. Эта страна, практически лишенная хоть каких-нибудь природных запасов нефти и газа, обладает неограниченными объемами сырья для водорода (в виде океанской воды) и поистине завидной сообразительностью населения. А поэтому здесь водородные аналоги есть практически у любого вида техники — от работающего на топливных элементах локомотива до человекоподобного робота SpeecysFC. К тому же японцы вовсю ведут разработки топливных элементов для ноутбуков и мобильных телефонов. Вопрос? Так как же хранят водород?
Водородное топливо сберегают тремя способами: в сжатом виде, в сжиженном и в металлогидридах. Самое простое, конечно, — закачать водород в бак мощным компрессором. В баках той же Mazda водородное топливо содержится под давлением 350 атмосфер. Но способ этот, будучи самым дешевым, и самый небезопасный. При таком высоком давлении любая слабинка в системе грозит протечкой газа. А где протечка, там пожар, а то и взрыв.
Более надежный и практичный способ — держать водород в жидком виде. Но для этого его нужно охладить до –253 градусов Цельсия. В BMW топливо хранится именно в таком виде: поэтому почти половину топливной системы занимает мощнейшая теплоизоляция. И все равно, стоит оставить машину на стоянке, скажем, на недельку, и она встретит вернувшегося хозяина с пустыми баками. Никакая изоляция не может полностью защитить систему от нагрева. В результате водород начинает испаряться, давление в баке растет, и газ просто стравливается в атмосферу через предохранительный клапан. По техническим условиям полная заправка испаряется всего за три дня…
Самый перспективный способ — хранение в металлогидридных композициях. Водород, оказывается, очень хорошо растворяется металлами, как вода впитывается губкой. Причем он поглощается в огромных объемах, значительно превосходящих объемы «губки». Такие «напитанные» водородом металлы называются металлогидридами. При охлаждении они вбирают водород, при нагревании — активно его отдают.
Представьте себе такой опыт. В приборе для электролиза воды катод изготовлен в виде пластинки. Вы включаете ток, и... пластинка сама собой начинает изгибаться! Секрет этого фокуса заключается в том, что пластинка изготовлена из палладия и с одной стороны покрыта слоем лака. При электролизе на не лакированной стороне пластинки выделяется водород и тотчас же растворяется в металле; а так как при этом объем палладия увеличивается, то возникает усилие, изгибающее пластинку.
Это явлении, называется окклюзией.
Водород и будущее
Слова «дейтерий» и «тритий» напоминают нам о том, что сегодня человек располагает мощнейшим источником энергии, высвобождающейся при реакции:
21Н + 31Н → 42Не +10n + 17,6 МэВ.
Эта реакция начинается при 10 млн градусов и протекает за ничтожные доли секунды при взрыве термоядерной бомбы, причем выделяется гигантское по масштабам Земли количество энергии.
Водородные бомбы иногда сравнивают с Солнцем. Однако мы уже видели, что на Солнце идут медленные и стабильные термоядерные процессы. Солнце дарует нам жизнь, а водородная бомба – сулит смерть...
Но когда-нибудь настанет время – и это время не за горами, – когда мерилом ценности станет не золото, а энергия. И тогда изотопы водорода спасут человечество от надвигающегося энергетического голода: в управляемых термоядерных процессах каждый литр природной воды будет давать столько же энергии, сколько ее дают сейчас 300 л бензина. И человечество будет с недоумением вспоминать, что было время, когда люди угрожали друг другу животворным источником тепла и света...
Домашнее задание: Ответить на контрольные вопросы,
Контрольные вопросы по теме:
1. Какой элемент характеризуется наибольшей распространенностью во Вселенной?
2. Кто впервые выделил водород в чистом виде?
3. Какова электронная конфигурация водорода?
4. Назовите изотопы водорода.
5. Чем объясняется сравнительно небольшая активность молекулярного водорода при обычной температуре.
6. В каких модификациях может существовать газообразный водород?
7. Охарактеризуйте химические свойства водорода.
8. Что называют гремучим газом?
9. Какие соединения водород образует с активными металлами?
10. Оксиды каких элементов восстанавливаются до металлов водородом?
11. Что такое реакции гидрирования?
12. Каковы способы получения водорода в промышленности?
13. Как получают водород в лаборатории?
14. Перечислите основные области применения водорода.
15. Что такое водородное топливо?
16. Почему баллоны, содержащие сжатый кислород можно хранить в помещениях, а баллоны с водородом нельзя?
17. Каково значение водорода в природе.
Проверочные задания по теме водород:
1) Какой минимальный объем гремучего газа нужно использовать для получения
2 л воды?
2) Какую массу цинка (г) надо растворить в соляной кислоте, чтобы полученным водородом можно было восстановить 14.4 г оксида меди(II)?
3)Самый тяжелый из изотопов водорода- тритий- радиактивен. В какой элемент превращается радиактивный водород при β-распаде?
4)Рассчитайте количество водорода, которое может быть получено из 21 г гидрида кальция в случае: а) термического разложения твердого образца; б) реакции такого же образца с водой.
5) В солнечной атмосфере содержится 82% водорода-1 и 18 % гелия-4 по числу атомов. Рассчитайте массовую долю атомарного водорода в атмосфере солнца.
6) Допишите уравнения реакций:
Zn + 2HCl = ? + H2
? + 2H2O = Ca(OH)2 + H2
NaH + H2O = NaOH + ?
2Al + 2NaOH + 6H2O = ? + 3H2
Zn + ? + 2H2O = K2[Zn(OH)4] + H2
Водород, его общая характеристика и нахождение в природе. Получение водорода в лаборатории и его физические свойства
Цель урока. Конкретизировать знания о химическом элементе и простом веществе на примере изучения водорода. Сформировать представления о способах получения и собирания водорода в лаборатории.
Основные понятия. Химический элемент, простое вещество, физические свойства, валентность кислотного остатка.
Планируемые результаты обучения. Знать состав молекул водорода и способ его получения реакцией замещения. Уметь характеризовать физические свойства водорода, собирать водород методом вытеснения воздуха, доказывать его наличие, проверять водород на чистоту. Соблюдать меры предосторожности при работе с химическими реактивами.
Демонстрации. Получение водорода в аппарате Киппа. Ознакомление с физическими свойствами водорода. Проверка водорода на чистоту. Наполнение водородом мыльных пузырей.
Лабораторный опыт. Получение и свойства водорода.
Краткое содержание урока. В начале урока учитель продолжает формировать умение решать расчетные задачи с использованием термохимических уравнений. К доске вызываются несколько человек, которые получают индивидуальные задания. Класс в это время обсуждает выполнение домашнего задания.
При изучении нового материала продолжается конкретизация знаний о химическом элементе и простом веществе. Используя план характеристики химического элемента (см. урок 19), учащиеся самостоятельно характеризуют водород как химический элемент.
Далее учитель демонстрирует получение водорода в аппарате Киппа: объясняет устройство аппарата и показывает, как проверить водород на чистоту, разъясняет, почему работать с водородом опасно. Затем учитель демонстрирует способы собирания водорода. Учащиеся, наблюдая за демонстрационным экспериментом, отмечают физические свойства водорода. Обсуждение физических свойств водорода необходимо проводить в сравнении с физическими свойствами кислорода.
Говоря о том, что водород самый легкий из газов, можно продемонстрировать наполнение водородом мыльных пузырей. Готовят из туалетного мыла пену, в которую для прочности мыльных пузырей добавляют несколько капель глицерина.
Затем учитель подробно разбирает запись уравнения реакции получения водорода в лаборатории, отмечает, что эта реакция относится к реакциям замещения. Обращает внимание на формулы сложных веществ — соляной кислоты НСl и серной кислоты Н2SO4. Вводит понятие о валентности кислотного остатка. Затем учащиеся выполняют лабораторный опыт 9 (с. 77 учебника), закрепляя практические умения получать водород, собирать его вытеснением воздуха, проверять на чистоту, доказывать наличие образовавшейся соли.
Материал § 26 (с. 73 учебника) лучше рассмотреть при изучении химических свойств воды.
Аппарат Киппа
[ссылка скрыта]
Материал из Википедии — свободной энциклопедии
| ссылка скрыта [ссылка скрыта] (ссылка скрыта) | (+/-) |
| Данная версия страницы ссылка скрыта участниками с соответствующими правами. Вы можете прочитать последнюю проверенную или т. н. ссылка скрыта от 4 июня 2009, однако она может значительно отличаться от текущей версии. Проверки требуют ссылка скрыта. | |
Перейти к:навигация, поиск
ссылка скрыта в 1853 году.
[ссылка скрыта] Устройство прибора
Аппарат Киппа изготовляется из стекла и состоит из нескольких частей:
- Колба-реактор с резервуаром;
- Воронка с длинной трубкой;
- Газоотводная трубка;
- Ловушка для улавливания паров соляной кислоты.
Нижний резервуар прибора служит для того, чтобы газ не выделялся через воронку во время опыта, он имеет тубулус, закрытый притёртой стеклянной пробкой, он необходим для слива жидкости после использования прибора. Нижний резервуар и колба-реактор разделены резиновой прокладкой с отверстиями, через них проходит в нижний резервуар длинная трубка воронки, на прокладку насыпают твёрдые вещества (мрамор, цинк, сульфид натрия, сульфит натрия). Колба-реактор также имеет тубулус, в который вставляется газоотводная трубка, снабженная краном или зажимом Мора. В колбу-реактор с резервуаром вставлена воронка с длинной трубкой, трубка практически доходит до дна нижнего резервуара.
[ссылка скрыта] Использование
Проверяют герметичность всех соединений, наличие трещин. В нижний тубулус вставляют пробку и закрепляют её с помощью скобы или резинки. Воронку с длинной трубкой плотно втавляют в колбу-реактор. Прибор наклоняют и через средний тубулус засыпают твердое вещество, затем средний тубулус закрывают пробкой с газоотводной трубкой, кран на трубке закрывают. Далее в воронку заливают раствор кислоты (ссылка скрыта), в воронку вставляют ловушку, заполненную водой. При открытии крана кислота поступает через трубку в нижний резервуар, а затем в колбу-реактор, где происхотит реакция взаимодействия с твёрдым веществом с выделением газа, время заполнения колбы-реактора газом составляет около 5 минут. Затем кран закрывают, выделяющийся газ из-за повышения давления в колбе-реакторе вытесняет кислоту в воронку, реакция прекращается. Прибор готов к работе, для этого необходимо открыть кран на газоотводной трубке.
Также аппарат Киппа можно использовать в качестве ссылка скрыта
УРОК 1
Тема урока: Распространенность водорода в природе и его физические свойства. Получение водорода в лаборатории.
Оборудование и ресурсы:
Компьютеры с подключением к интернет, компакт-диски.
Перечень используемых цифровых ресурсов и программных средств на уроке:
При подготовке и проведении урока используются информационные и иллюстративные материалы следующих интернет-ресурсов:
ссылка скрыта
Свойства водорода ссылка скрыта
ссылка скрыта
ссылка скрыта
Металлический водород ссылка скрыта
Модель атома водорода ссылка скрыта, ссылка скрыта
Химическая связь в молекуле диводорода ссылка скрыта
Получение водорода ссылка скрыта
Водород и Солнце ссылка скрыта
Для проведения урока используются также материалы компакт-дисков: “Открытая химия” (Физикон); “Химия: базовый курс. 8-9 класс” (Лаборатории систем мультимедиа, МарГТУ); “Общая и неорганическая химия: 10-11 класс” (Лаборатории систем мультимедиа, МарГТУ); “Химия: виртуальная лаборатория. 8-11 класс” (Лаборатории систем мультимедиа, МарГТУ);
“Репетитор по химии” (Кирилл и Мефодий); “1С: репетитор. Химия” (1С); «Химия» (Просвещение-медиа).
Программные средства: Microsoft Power Point, Front Page, Microsoft Word, Microsoft Excel, Microsoft Office используются учителем для подготовки материалов к уроку; используются учащимися при самостоятельной работе и в домашней работе при подготовке презентаций, сайтов, рефератов, докладов.
Отличительные особенности данного урока:
Демонстрация учащимся материалов, анимированных средствами Microsoft Power Point:
- моделей строения атома водорода
- термоядерных реакций в Космосе
Использование учащимися интерактивных моделей для изучения:
- строения водорода
- образование связей водород-водород в молекуле диводорода
Демонстрация примеров получения водорода в лаборатории с использованием интернет-ресурсов и материалов компакт-дисков.
Демонстрация опытов (c использованием интернет-ресурсов и материалов компакт-дисков):
- “Взаимодействие металлов с кислотами”
- “Взаимодействие щелочных металлов с водой”.
Работа учителя на уроке:
- Объяснение (на основе сопоставления водорода и кислорода) строения молекулы водорода и его свойств, обусловленных особенностями строения
- Организация самостоятельной работы учащихся с использованием компьютера для изучения строения и свойств водорода. Работа включает просмотр иллюстративного материала с использованием интернет-ресурсов и материалов компакт-дисков
- Организация интерактивной деятельности учащихся для изучения: строения атома водорода, молекулы водорода; физических свойств водорода
- Демонстрационный опыт: получение водорода в аппарате Киппа
- Объяснение: расчет массовой доли водорода в соединениях.
- Организация самостоятельной работы учащихся с использованием компьютера для получения сведений о значении водорода как «горючего» в термоядерном синтезе. Работа включает просмотр иллюстративного материала с использованием интернет-ресурсов и материалов компакт-дисков.
- Подготовка и организация обсуждения изученной темы.
- Домашнее задание.
Описание деятельности учащихся:
Изучение строения, свойств и способов получения в лаборатории водорода с помощью подготовленных учителем материалов, выбранных из ресурсов интернет.
Изучение выбранных учителем материалов компакт-дисков.
Самостоятельная работа с использованием интерактивных моделей.
Лабораторный опыт: взаимодействие кислот с металлами.
Участие в обсуждении пройденной темы.
Вид классной доски:
Название темы.
Фрагмент Периодической системы – 1 период.
Электронная формула атома водорода, атомные свойства водорода
Диаграммы «Водород во Вселенной», «Энергетика звезд»
Таблица «Физические свойства водорода»
Уравнения реакций: получение водорода различными способами
Домашнее задание.
Что должно появиться в тетрадях учащихся:
- Атомные характеристики водорода
- Строение атома водорода и молекулы H2
- Таблица «Физические свойства водорода»
- Уравнения реакций получения водорода
- Наблюдения по демонстрационным опытам
- Сведения об истории открытия водорода
Межпредметные связи на уроке:
География: распространение водорода и его соединений на Земле .
Астрономия: сведения о присутствии водорода на внеземных объектах и в космическом пространстве, термоядерные реакции как источник энергии во Вселенной
Физика: плотность водорода, адсорбция его платиной.
Биология: элемент водород как важная составная часть органических веществ
Домашнее задание, в том числе те, при подготовке которых должен быть использован компьютер:
- Прочесть параграф учебника (в соответствии с используемой Программой).
- Знать материалы, данные учителем на уроке и записанные в тетради.
- Подготовить средствами Microsoft Power Point, с использованием ресурсов интернет и сканированием иллюстративного материала на бумажных носителях, презентацию, или средствами Front Page, небольшой сайт как по общей теме урока, так и по более мелким темам:
“Химическая связь в молекуле водорода ”
“Водород во Вселенной”
“Огниво Деберейнера”
“Кто автор открытия водорода?”.
“Старинные способы получения водорода”.
- Подготовить, используя средства Microsoft Word, Microsoft Excel, Microsoft Office и ресурсы интернет реферат и доклад по теме пройденного урока.
Некоторые итоги урока:
Учащиеся знают:
- атомные и молекулярные характеристики водорода
- особенности строения молекулы водорода
- физические свойства водорода
- значение водорода на Земле и во Вселенной
- распространенность водорода в природе
Умеют, используя полученные на уроке знания, с помощью средств Microsoft Word, Microsoft Excel, Microsoft Power Point, Front Page, Microsoft Office подготовить презентацию, сайт, реферат, доклад о значении водорода.
