Сравнительная оценка параметров центральной гемодинамики при анестезии севофлураном и изофлураном при лапароскопических операциях
| Вид материала | Документы |
СодержаниеЦель исследования Материалы и методы Полученные результаты и обсуждение. |
- Астахов В. А, Хачатурова Э. А., Астахова И. А., Троицкий, 57.07kb.
- Рациональный мониторинг параметров гемодинамики при проведении региональной анестезии, 123.01kb.
- Emergency Medicine Scott H. Plantz and J. N. Adler 1998. 780 p учебник, 44.15kb.
- Тематический план лекций и практических занятий по основам реаниматологии для студентов, 42.34kb.
- Оценка показателей водного баланса у больных с хроническим легочным сердцем, 89.38kb.
- Одновременно, дается сравнительная оценка параметров изделий, выпущенных Россией, сша,, 7.1kb.
- В. Г. Пасько, М. И. Руденко, В. Н. Андрюшкин,, 97.06kb.
- Ставропольская государственная медицинская академия, 386.05kb.
- Лекционный курс Мастер класс Научная конференция 23 ноября 2009 года, 83.48kb.
- Инструкция о порядке и методах измерений при учетных операциях с нефтепродуктами, 325.48kb.
СРАВНИТЕЛЬНАЯ ОЦЕНКА ПАРАМЕТРОВ ЦЕНТРАЛЬНОЙ ГЕМОДИНАМИКИ ПРИ АНЕСТЕЗИИ СЕВОФЛУРАНОМ И
ИЗОФЛУРАНОМ ПРИ ЛАПАРОСКОПИЧЕСКИХ ОПЕРАЦИЯХ
Скобелев Е.И., Перов О.И., Кузьмин М.А., Перова Т.В., Веденина И.В.
Учебно – научный медицинский центр Управления делами Президента РФ, Москва; кафедра анестезиологии и реаниматологии л/ф РГМУ.
В мировой анестезиологической практике всё чаще используют галогенсодержащие ингаляционные анестетики из-за их управляемости и предсказуемости действия. Естественно, предпочтение отдают препаратам последних генераций, при разработке которых важным условием является минимизация гемодинамических супрессивных эффектов (17-19).
Цель исследования: изучить в сравнительном аспекте особенности воздействия анестезии изофлураном и севофлураном на центральную и периферическую гемодинамику у пациентов пожилого возраста с сопутствующими ишемической болезнью сердца и артериальной гипертензией (АГ) при лапароскопических холецистэктомиях (ЛХЭ).
Материалы и методы. Нами обследовано 55 больных в возрасте от 60 до 75 лет. Сопутствующие заболевания сердечно-сосудистой системы (ССС) в виде ишемической болезни сердца (стенокардия, инфаркт в анамнезе, нарушения сердечного ритма, хроническая сердечная недостаточность и др.) отмечена у 24 больных, артериальная гипертензия (АГ) - II степени выявлена у 26 больных, АГ - III степени - у 5 больных.
Операционно-анестезиологический риск соответствовал III степени по МНОАР. Все без исключения пациенты поступили в клинику на фоне регулярного приема β - блокаторов (атенолола в дозе 25- 50мг/сут.) или ингибитора АПФ (эналаприла в дозе 10 – 20 мг/сут.).
В зависимости от метода анестезии пациенты были разделены на две группы. У 28 пациентов, составивших 1-ю группу, поддержание анестезии проводилось с помощью изофлурана (ИФ); у 27 хирургических больных, вошедших во 2-ю группу, в качестве основного анестетика был применен ингаляционный анестетик севофлуран (СФ).
Стандартная премедикация включала: внутримышечно за 40 мин до операции - мидазолам в дозе 0,03 мг/кг; наркотический анальгетик промедол в дозе 0,3мг/кг, димедрол - 10мг в/м и холинолитик атропин – в дозе 0,07мг/кг в/м. Вводный наркоз у пациентов обеих групп осуществляли внутривенным болюсным введением пропофола (ПФ) со скоростью 40 - 60 мг/мин. (не менее чем за 4 мин), до утраты сознания, роговичных и корнеальных рефлексов. Максимальная доза ПФ не превышала 1,8 - 2,0 мг/кг, фентанила 3 - 4мкг/кг. Далее вводили антидеполяризущий миорелаксант нимбекс в дозе 0,15 мг/кг. Через 2-3 мин после наступления тотальной миоплегии проводили интубацию трахеи. ИВЛ осуществляли аппаратом Dräger Fabius (Германия) вентиляцией по объёму смесью N2 О : О2 = 2 : 1. Критерием завершенности вводного наркоза считали стабилизацию показателей гемодинамики, а также данные индекса AAI, значения которого соответствовали 21 ± 5,2 ед. по монитору Alaris AEP (Саrdinal Health, Великобритания).
Параметры центральной и периферической гемодинамики (ЦиПГ) оценивались неинвазивно с помощью монитора импедансной кардиографии Niccomo (Medis, Германия) по методу Кубичека в модификации Бернштнейна и Шрамека.
Поддержание анестезии у больных 1-ой группы проводили ИФ в концентрации 0,6 – 1,0 МАК. Доза фентанила на данном этапе – 3,6 ± 0,6 мкг/(кгּч). Миоплегию, как в первой, так и во второй группах, поддерживали введением нимбекса 0,8±0,01мкг/(кгּмин).
У пациентов 2-ой группы поддержка анестезии осуществлялась ингаляцией паров СФ в концентрации 0,8 - 1,2 об%. Фентанил вводили в дозе 3,8 ± 0,9 мкг/(кгּч). Ингаляцию анестетика в обеих группах прекращали за 15-20 мин до конца оперативного вмешательства.
Известно, что чрезвычайно быстрая элиминация СФ и ИФ из организма и столь же быстрое исчезновение анальгезии могут привести к появлению возбуждения, боли, дрожи и судорог в момент восстановления сознания. Эти осложнения в ближайшем послеоперационном периоде являются неспецифической реакцией ЦНС на операционный стресс. Для предупреждения вышеописанных нарушений использовался анальгетик трамадол в дозе 100мг, который вводили за 5 - 10 минут до планируемой экстубации.
Для предупреждения послеоперационной тошноты и рвоты за 15-20 минут до планируемого окончания операции в/в вводили ондансетрон (50 мкг/кг), который по механизму действия является блокатором 5-РT3 – рецепторов центральной и периферической нервной системы.
При применении предложенных нами методик мы получили удовлетворительный и хороший обезболивающий эффект – ни один больной в течение двух часов после операции не жаловался на наличие сильных болей; ни у одного не было тошноты и рвоты.
Экстубацию трахеи производили после восстановления сознания, адекватного дыхания и мышечного тонуса. После операции больные доставлялись на 6 часов в послеоперационную палату, и далее в хирургические отделения больницы.
Исследование ЦиПГ проводилось на 4-х этапах оперативного вмешательства: 1-й этап (исходный) – при поступлении в операционную; 2-й этап – после наложения пневмоперитонеума; 3-й этап – вершина операционной травмы ( холецистэктомия); 4-й этап – после экстубации.
Полученные результаты и обсуждение.
Проблемы анестезиологического обеспечения пациентов пожилого и старческого возраста с каждым десятилетием становятся все более актуальными [1,4,9,10,22]. Более половины лиц старше 60 лет в той или иной степени страдают атеросклерозом, АГ и ИБС. Во время проведения анестезии у пациентов возможно снижение сократимости миокарда, во многом определяющего исход операций, проводимых в условиях общей анестезии [3,24,26]. В тоже время нельзя сбрасывать со счетов особенности регуляции кровообращение у стареющего человека, которые характеризуются повышением систолического (АДс) и диастолического (АДд) давлений, увеличением общего периферического сосудистого сопротивления (ОПСС), уменьшением минутного объема сердца (МОС) и ударного объема (УО), как в покое, так и при нагрузке. При волемической нагрузке у пожилых больных также может уменьшаться производительность сердца, вследствие повышения конечного диастолического давления в левом желудочке [8,23]. В этом случае метаболические запросы организма удовлетворяются за счет роста тканевой экстракции кислорода, что является признаком латентной гипоксии [17-19].
Пожилые больные реагируют на анестетики иначе, чем больные среднего возраста, что при наличии сопутствующих заболеваний увеличивает риск хирургического вмешательства и анестезиологического пособия. Поэтому выбор анестетических средств и их дозировка должны быть приведены к реальной клинической ситуации [7,13-15,17-19,20].
В настоящее время никто не подвергает сомнению эффективность ингаляционной анестезии при оперативных вмешательствах любой продолжительности и травматичности. Более того, обсуждаемый вариант интраоперационной защиты, по свидетельству большинства фундаментальных руководств по анестезиологии, является эталоном качества и надежности [25]. Полученные результаты исследования центральной гемодинамики лишь утвердили нас в сложившемся мнении. Результаты представлены на диаграммах 1-5.
На 1-ом этапе исследования у всех больных отмечено умеренное ассоциированное повышение АДср. (рис.1) и ОПСС (рис.2) при субнормальных значениях показателей производительности миокарда. Данный режим кровообращения можно охарактеризовать как нормодинамический с мягкой или умеренной артериальной гипертензией. Наполнение брюшной полости газом (2-й этап) и, как следствие, повышение внутрибрюшного давления, приводило к снижению сердечного индекса (СИ) на 13,3% (рис.3) и ударного индекса (УИ) на 20% (рис.4) с фоновым увеличением ОПСС на 18%, в первой группе больных. АД ср. также характеризовалось тенденцией к снижению до 17,5%. Результаты измерений у пациентов 1-ой группы достоверно отличались от исходных значений. Изменения гемодинамического профиля во 2-ой группе больных, носили менее выраженный характер. На 3-ем этапе изменение гемодинамики не были достоверными. К концу операции (4-й этап), гемодинамический профиль в обеих группах пациентов походил на дооперационный. Остальные параметры кровообращения у пациентов после декомпрессии брюшной полости достоверно не отличались ни от предоперационных, ни от аналогичных нормативных значений.
Таким образом, наложение пневмоперитонеума вело к гиподинамическому ответу кровообращения (снижение СИ, УО, АД ср.) на фоне увеличения ОПСС и ЧСС (рис. 5) у пациентов первой группы и к менее выраженным изменениям гемодинамики во второй группе больных.
Суммируя результаты исследования, мы пришли к выводу, что при ингаляционной анестезии с использованием СФ и ИФ центральная гемодинамика сохранялась достаточно стабильной, а ингаляционная анестезия на основе СФ наиболее предпочтительна у пожилых пациентов, страдающих ИБС и АГ, ввиду менее выраженных гемодинамических сдвигов на момент наложения пневмоперитонеума, при ЛХЭ.
Список литературы
1. Белоконев И.И.. Столяров Е.А., Александров И.К. и соавт. Гериатрическая хирургия и анестезиология. // Практическая гериатрия. – Самара: Самарский дом печати. – 1995. – С. 378 - 475.
2. Бражникова Н.А., Цхай В.Ф. Возраст и осложнения - причины риска оперативного лечения // Материалы 9 конференции хирургов - гепатологов России и стран СНГ. – С. - Петербург. – 2002. – С. 91
3. Бунятян. А.А. // Руководство по анестезиологии. – М.: Медицина. – 1994. – С. 656.
4. Галкин Д.В., Голуб А.В. Современная антибактериальная профилактика в абдоминальной хирургии. // Consilium Medicum. – Хирургия. – №2. – 2005. – С. 10.
5. Евгенов О. Анестезия для пожилых. // Освежающий курс лекций. – 1993. – С. 103.
6. Йен Смит, Пол Уайт. // Тотальная внутривенная анестезия. Пер. с англ. – М.: Бином - Пресс. – 2004. – 176 с.
7. Келли Ф., Малдер Р., Aнестезия у пожилых пациентов // Update in Anaesthesia. – 2004. – № 10. – Апрель. – С. 46 - 50.
8.Комисаренко И.А. // Consilium Medicum. – 2005. – Т.7 – №12 – С.1017.
9. Конев Ю.В. V Европейский конгресс по клинической геронтологии.
// Клиническая геронтология. – 2000. – Т.6. – № 7 – 8. – С.42 - 44.
10. Летенков В.Н. Прогнозирование риска операций « малых доступов» у больных желчнокаменной болезнью: Автореф. дис... канд. мед. наук. ММА им. И.М.Сеченова. – 1998. – С. 20.
11. Лихванцев В.В., Печерица В.В. // Современная ингаляционная анестезия. – М.: ГЭОТАР – МЕД. – 2003. – 200с.
12. Мизиков В.М., Бунятян А.А. Возможности и перспективы применения севофлурана в отечественной анестезиологической практике – // Тематический обзор – М.: Информ – Право. – 2005. – С. 5-7, С. 28.
13. Малышев В.Д., Свиридов С.В., Веденина И.В. и соавт.: Учебник // Анестезиология и реаниматология. – М.: Медицина. – 2003. – 528 с.
14. Малышев В.Д, Свиридов С.В., Веденина И.В. и соавт. // Интенсивная терапия. – М.:Медицина. – 2003. – 584 с.
15. Малышев Ю. П. Оптимизация анестезиологического обеспечения длительных операций в абдоминальной хирургии: // Автореф. дис. ... д-ра. мед. наук. – М. – 2001. – 43 с.
16. Савельев В.С. // Руководство по неотложной хирургии органов брюшной полости. – М.: – «Триада – Х». – 2005. – 640 с.
17. Скобелев Е.И., Бондаренко Е.Д. Перов О.И. Оптимизация анестезии на плановых операциях холецистэктомии у пожилых больных. // Новости анестезиологии и реаниматологии. – Москва. – 2006. – С. 81.
18. Скобелев Е.И., Перов О.И. Благовидов Д.Ф. и соавт. Выбор метода анестезии у пациентов пожилого возраста при хирургической патологии гепатобилиарной зоны. //– Москва. – 2007. – С. 55.
19. Скобелев Е.И., Мещеряков А.А., Перов О.И. // Вестник интенсивной терапии. Приложение к № 5. Материалы Третьей Всероссийской научно - методической конференции «Стандарты и индивидуальные подходы в анестезиологии, реанимации и интенсивной терапии». – 2006. – №1. – С. 81.
20. Слесаренко С.С., Федоров А.В., Коссович М.А. Эволюция операционного доступа в абдоминальной хирургии // Хирургия. – 1999. – №5. – С. 31 - 30.
21. Федоровский Н.М., Косаченко В.М., Кутина О.А. и соавт. Оптимизация анестезиологического обеспечения у лиц пожилого и старческого возраста при абдоминальных операциях. // Сборник материалов научно - практической конференции по актуальным проблемам регионарной анестезии. – 2001. – С.48.
22. Фетюков А.И., Гридина И.Б. Причины летальности и послеоперационных осложнений у больных пожилого и старческого возраста. // Тезисы докладов международного конгресса северных стран по проблемам старости. – Кондопога. – 1997. – С. 13 - 16.
23. Фрид М., Грайнс С. // Кардиология в таблицах и схемах. Пер. с англ. – М.: Практика. – 1996. – 736 c.
24. Cantillo J., Goldberg M.E., Larijani G.E. // Pharmacotherapy. – 1997. – Vol. 17. – P. 779 - 782.
25. Davison J.K., Eckhardt W.F., Perese D.A. Clinical Anesthesia Procedures of the Massachusetts General Hospital. // 4-th Edition. – 1993. – P. 711.
26. Goldberg M.E, Larijani G.E, Cantillo J, et al. Time-course of elimina
tion of serum inorganic fluoride ion following sevoflurane adminis
tration [abstract]. //Anesthesia Analgesia – 1995. – Feb. – Vol. 80 (2S) Suppl.: S. 152.
27. Nishiyama T., Hirasaki A., Effects of sevoflurane anaesthesia on renal
function - duration of administration and area under the curve and
rate of decrease of seruminorganic fluoride. Eur J. Anaesth.
1995. – №12. – P. 477 - 482.
28. Sanjay S. Patel et al: Drug Evaluation "Sevotlurane. A Review of its Pharmacodynamic and Pharmacokinetic Properties and its Clinical Use in General Anaesthesia". // Drugs. – 1996. – Apr. – Vol. 51. – №4. – Р. 658 - 700.
29. Yasuda N., Lockhart S.H., Eger E.l. et al. Kinetics of desflurane, isoflu-
rane, and halothane in humans. // Anesthesiology. – 1991. – №. 74. – P. 489 - 498.
30. Yasuda N., Toriumi K., Tanifuji Y., et al., liver and kidney function after
low flow sevoflurane anesthesia in surgical patients [abstract].
// Anesth, Analg. – 1994. – Feb. – V. 78. – (2S) – Suppl. – S. 494.

Рис. 1. Изменение АД ср. в подгруппах на этапах исследования.
Здесь и на рис. 2 – 5: 1–1- я группа; 2 – 2-я группа.

Рис.2. Изменения ОПСС в подгруппах на этапах исследования.

Рис.3. Изменения СИ в подгруппах на этапах исследования.
 Рис.4. Изменения УИ в подгруппах на этапах исследования.
Рис.4. Изменения УИ в подгруппах на этапах исследования.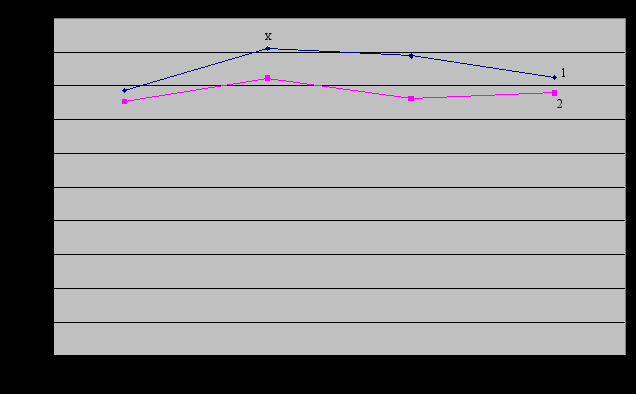 Рис. 5. Изменения ЧСС по группам на этапах исследования.
Рис. 5. Изменения ЧСС по группам на этапах исследования. хДостоверные различия в показателях в группах по сравнению с предыдущим этапом исследования (р < 0,05).
