Митченко Ольга Николаевна 2006 2007 учебный год Тема: «Соли азотной кислоты нитраты» урок
| Вид материала | Урок |
- План оглавление: Введение. Об азоте и нитратах. Азот в природе и его превращения. Основные, 317.79kb.
- Урок «Азотная кислота», 12.42kb.
- Анализ работы гоу гимназии №1590 сао за 2007/2008 учебный год, 1823.77kb.
- Анализ работы школы за 2005 2006 учебный год, 149.34kb.
- Урок: «Взаимодействие азотной кислоты с металлами». 9 класс Цель урока, 73.98kb.
- План работы мо начальных классов сош-№10 ст. Новомышастовской на 2007-2008 учебный, 76.8kb.
- Технология неконцентрированной, 287.45kb.
- Тема Ценные бумаги как инструмент финансового рынка, 1638.04kb.
- Кутанова Марина Николаевна Тема четверти : Музыка и изобразительное искусство Тема, 150.19kb.
- Алымова Ольга Никитична учитель математики 2010-2011 учебный год урок, 56.23kb.
Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа с.Прималкинского»
Прохладненский район КБР
Разработка урока химии
в 9 классе

Разработала и провела урок учитель химии
Митченко Ольга Николаевна
2006 - 2007 учебный год
Тема: «Соли азотной кислоты - нитраты»
Урок изучения нового материала.
Цели и задачи урока:
- На примере нитратов показать типичность и индивидуальность свойств веществ. Рассмотреть их физические и химические свойства, показать их значение в народном хозяйстве и действие на организм человека.
- Развивать умения сравнивать, проводить эксперимент, анализировать его результаты. Закреплять навык составления химических формул и уравнений.
- Воспитывать культуру обращения с веществами.
- Мотивировать на осознанное восприятие информации химического содержания.
Оборудование:
- штатив с пробирками,
- спиртовка,
- спички,
- пробиркодержатель,
- пипетки,
- планшетки,
- стеклянные трубочки,
- коллекция азотных удобрений,
- электронная презентация
- раздаточный материал для учащихся.
Реактивы:
Cu, уголь, H2SO4 (к), кристаллические NaNO3, KNO3, Ca(NO3)2, NH4NO3, , растворы: H2SO4, Ba(NO3)2, Cu(NO3)2, KOH, NaCl, AgNO3 ; раствор дифениламина, картофельный сок, морковный сок, огуречный сок, свекольный сок.
Девиз урока:
информирован – значит вооружен.
Ход урока
Приветствие учителя.
Как говорил Маколей, история делает человека мудрым, поэзия – разно-сторонним, математика – проницательным, естествознание – глубоким, логика – способным защищаться. Мы на нашем уроке заденем каждое из перечисленного, а значит … поднимемся в своем познании на новую ступеньку.
I. Актуализация прежних знаний учащихся.
1. работа с «Химическим тренажером».
Цель: включение учащихся в работу с химическим языком, повторение классов веществ, определение темы и задач урока.
Задание. 1. прочитать только формулы оксидов (работаем по цепочке)
2. выбрать и прочитать формулы солей.
Что объединяет названные соли?
Демонстрация слайда – определение темы занятия.
Целеполагание .
1. что мы знаем о нитратах?
Обостренный интерес к этим солям возник во второй половине XX в., когда развитые страны стали переносить принципы промышленных технологий на сельское производство, не учитывая его экологических особенностей. Внесение неумеренных доз азотных удобрений на поля с целью резкого увеличения их продуктивности приводило к различным отрицательным последствиям, и, прежде всего, к накоплению излишнего количества этих солей в сельскохозяйственной продукции. Это вызывало отравление людей, ухудшало их здоровье, что повлекло стойкую неприязнь к ним.
Между тем эти соединения – одно из важнейших звеньев природного круговорота азота. Основной строительный материал живых организмов – белок, а он в обязательном порядке включает химически связанный азот.
Ч
 то мы знаем о нитратах? Что можем узнать ?
то мы знаем о нитратах? Что можем узнать ? Из таблицы растворимости. Особенности.
По внешнему виду. Чем они опасны? Полезны?
Из жизненного опыта. Каковы правила безопасности
обращения и использования?
Записываем тему: «Соли азотной кислоты - нитраты»
II. Усвоение новых знаний и способов действия.
Фронтальная работа «Знакомство с нитратами»
1. Краткая характеристика данных солей на слайде презентации.
Натриевая селитра – мелкокристаллический порошок белого цвета, содержит до 16% азота. Дерево или бумага, пропитанные натриевой селитрой, легко воспламеняются. При попадании на кожу или слизистую оболочку глаз и носа вызывает раздражение.
Аммиачную селитру, содержит 15 – 16% азота. Из-за взрывоопасности селитру нельзя хранить вместе с нефтепродуктами, торфом, соломой, опилками, углем и другими органическими материалами. Аммиачная селитра раздражающе действует на слизистую оболочку носа и кожу.
Кальциевая селитра содержит 15, 5 -17% азота. Сильно гигроскопична, поэтому ее упаковывают в непромокаемые мешки и хранят в закрытых помещениях. Это удобрение нельзя смешивать с суперфосфатом.
2. Составить формулы нитратов калия, натрия, кальция. Нитраты натрия, калия, аммония и кальция называются селитрами.
Общими свойствами для всех нитратов будет их хорошая диссоциация в водных растворах и реакции ионного обмена.
Припоминаем совместно общие свойства солей.
Демонстрации опытов, иллюстрирующие общие свойства нитратов
1. взаимодействие нитрата бария с серной кислотой,
2. нитрата меди (II) со щелочью,
3. нитрата серебра с хлоридом натрия,
4. нитрата меди (II) с железом (вспоминаем правило: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений.
(Или алюминия с нитратом свинца)
Итак, нитраты участвуют во всех реакциях, свойственных солям.
Но всегда в общем есть что-то свое, особенное.
Особое свойство нитратов узнаем через анализ стихотворения, текст которого находится на столе.
Предлагаю закончить схему, которая представлена после текста стихотворения .
После самостоятельной работы с текстом сравнить свое мнение со схемой в слайде презентации.
Особые свойства нитратов.
Даром времени не тратя,
Разберемся, как нитраты
В «печке» разлагаются.
Что же получается?
Щелочной металл – такой активный,
Он командным тоном говорит:
«Быть нитратом – это так противно,
Из нитрата превращусь в нитрит!»
А металлы из компании от магния до меди,
Цинк, железо и другие их соседи –
Осторожно и спокойно, без обид,
Из нитрата извлекают свой оксид.
На соседей меди справа
Огонь влияет как облава,
Разлагая тот нитрат
На кислород и NО2.
При этом есть такой накал,
что выделяется металл.
Проанализируйте стихи. О чем идет речь? Какое свойство нитратов описано в стихотворении? Закончите схему:
термическое разложение:
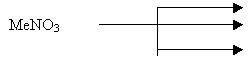
ДО термического разложения нитрата калия.
на раскаленном угольке в твердом состоянии нитрат вспыхивает (можно использовать на практике для определения нитрата).
Данная реакция является качественной на определение нитратов.
Выступления учащихся. Предлагается сказать самые важные мысли профессионалов.
С позиции агронома.
Нитраты – прекрасные азотные удобрения. Они необходимы для нормального питания растений. Долгое время на земле было известно только одно азотное удобрение – натриевая, или чилийская, селитра (на побережье Чили находятся природные залежи этого ценного удобрения).
Основатель отечественной агрохимии Д.Н. Прянишников писал, что главным условием, определяющим среднюю высоту урожая в разные эпохи, была степень обеспеченности сельскохозяйственных культур азотом.
При недостатке азота в почве у растений наступает азотное голодание. Оно характеризуется изменением зеленой окраски листьев, так как задерживается образование хлорофилла. Листья приобретают бледно-зеленую окраску.
Другой признак азотного голодания растений – это сильная задержка роста из-за ограниченного образования белков, необходимых для формирования молодых клеток. Азотные удобрения вносят под все культуры, они увеличивают урожай. Корневые системы всех без исключения растений хорошо усваивают нитраты. В растении происходит восстановление нитратов до аммиака:

С позиции эколога.
Из всех минеральных удобрений нитраты особенно сильно загрязняют окружающую среду, так как отличаются более высокой подвижностью в почве, чем калийные и фосфорные удобрения, и лучшей растворимостью.
Загрязнение почв и поверхностных вод в значительной мере связано с бесконтрольным и непродуманным использованием азотных удобрений (в основном нитратов).
Для предотвращения загрязнения окружающей среды удобрениями необходимо соблюдать основные правила их использования, хранения и транспортировки. Сроки внесения азотных удобрений должны быть приближены к периоду их максимального использования растениями. Кроме того, нельзя запахивать удобрения в почву.
С позиции биохимика.
При избытке нитратов в почве они полностью не перерабатываются, накаплива-ются в растительной продукции и попадают в организмы животных и человека. В желудочно-кишечном тракте нитраты превращаются в соли азотистой кисло-ты – нитриты, которые отравляют организм. Признаки отравления организма – слабость, головокружение, тошнота, расстройство желудка и т.д. Снижается ра-ботоспособность человека, возможна потеря сознания. В крови увеличивается содержание молочной кислоты, холестерина, лейкоцитов, снижается количество белков. Нитриты могут вступать во взаимодействие с гемоглобином, образуя метгемоглобин, в котором железо окислено до Fe(III). Это вещество, угнетаю-щее дыхательный центр, так как не способно переносить кислород. Многие растения способны накапливать большое количество нитратов, например капус-та, кабачки, петрушка, укроп, свекла столовая, тыква и др. Такие растения назы-вают нитратонакопителями.
С позиции врача.
При попадании в организм нитратов возникает острое кислородное голодание тканей из-за уменьшения содержания гемоглобина в крови. Это происходит потому, что нитраты (соли азотной кислоты) в организме восстанавливаются до нитритов:
| NO3- + 2Н+ + 2e—> NO2- + Н2О | |
| нитрат-ион | нитрит-ион |
Получающиеся нитриты проявляют сильные окислительные свойства и окисляют катионы железа Fe2+ гемоглобина в катион железа Fe3+. При этом образуется метгемоглобин, а нитриты восстанавливаются до монооксида азота.
Монооксид азота может взаимодействовать с гемоглобином, образуя нитрозогемоглобин. Метгемоглобин (гемиглобин), как и нитрозогемоглобин, не обладает способностью переносить кислород в организме, поэтому его появление в крови уменьшает ее кислородную емкость и опасно для жизни.
Таким образом,
Избыток в почве нитратов ухудшает качество выращиваемых овощей, фруктов, зерновых культур и др. Последствия употребления некачественных продуктов могут быть такие:
- развиваются раковые заболевания;
- появляется заболевание, при котором кровь не способна удерживать кислород, - метгемоглобинемия (кислородное голодание);
- нарушается деятельность щитовидной железы и др.
Комментарии учителя:
Текст на слайде:
С одной стороны нитраты хорошо усваиваются растениями, способствуют их росту и развитию.
С другой стороны человеку избыток нитратов опасен для жизни.
Предложите варианты решения в сложившейся проблемной ситуации.
Возможные варианты ответов:
1. избегание растительной продукции.
2. отказ от азотных удобрений.
3. информированность о растениях – накопителях нитратов.
4. знание правил безопасности при использовании растительной продукции…..
Какой (-ие) более приемлемы ?
Наличие избытка нитратов в растениях можно установить различными методами. Выпускается индикаторная бумага “Индам-2”, с помощью которой можно мгновенно определить избыток нитратов в растительной продукции. Однако ее не всегда встретишь в продаже. Можно использовать другую методику обнаружения нитратов.
Учащимся предлагается работа по обнаружению нитратов в овощах .
Практическая часть (проведение опытов).
Методика обнаружения нитратов в растительных объектах.
Реактивы и оборудование: раствор дифениламина в серной кислоте (0, 1 г дифениламина на 10 мл крепкой серной кислоты) в темной склянке, пипетка, ступка с пестиком, предметное стекло, стеклянная палочка, растительные объекты, лучше - заранее приготовленный растительный сок.
По изменению окраски судят о содержании нитратов: при отсутствии нитратов сок не изменяет цвет, при небольшом количестве нитратов появляется светло-голубая окраска, а при большом количестве нитратов – темно-синяя.
Сегодня на уроке мы научимся определять содержание нитратов в картофеле, моркови, луке, огурцах, свекле .
Обобщаем результаты эксперимента: на доске заполняем табличку:
| Растение | М  ного нитратов ного нитратов | Мало нитратов «+» | Нет нитратов «-» |
| | | | |
В разных странах приняты разные ПДК содержания нитратов в продукции растениеводства. Всемирная организация здравоохранения (ВОЗ) считает допустимым содержание нитратов в диетических продуктах до 300 мг на 1 кг сырого вещества. Знакомлю учащихся с таблицей, которая отражает способность различных культур накапливать нитраты.
ПДК нитратов в продукции растениеводства, мг NO3 - на 1 кг
| Томаты | 60 |
| Картофель | 80 |
| Морковь | 300 |
| Свекла столовая | 1400 |
| Лук (перо) | 400 |
| Огурцы (тепличные) | 150 |
| Капуста | 300 |
| Арбуз | 45 |
| Дыня | 45 |
Какой вывод можно сделать по этим данным? По нашим данным?
Предлагаю вам информацию в буклетах:
1. Как распределяются нитраты в овощах?
2. Как уменьшить содержание нитратов?
Итак, подведем итоги урока.
Что мы узнали?
1. У нитратов есть общие свойства и особенные.
2. У нитратов есть положительное и отрицательное значение.
3. Необходимо соблюдать правила безопасности при выращивании и употреб-лении растительной продукции.
Предлагается домашнее задание.
Приложение 1
В качестве Д/З
Для того, чтобы оценить, насколько реальна опасность отравления нитратами, предлагаю учащимся расчетную задачу :
1. В столовой свекле содержится в среднем 1200 мг нитрат-ионов на 1 кг. При очистке свеклы теряется 10% нитратов, а при варке – еще 40%. Будет ли превышена суточная норма потребления нитратов (325 мг), если ежедневно съедать по 200 г вареной свеклы?
Опасными загрязнителями продуктов питания нитраты становятся тогда, когда на каждый кг веса человек потребляет 5 мг нитратов в сутки.
2. Составьте для себя допустимую массу потребления нитратов.
3. В технической кальциевой селитре содержится примесь карбоната кальция. Поясните, как можно очистить кальциевую селитру от этой примеси. Составьте соответствующие уравнения реакций.
- Соли азотной кислоты растворимы в воде, тем не менее, предложите уравнение реакции HNO3 с солью, в результате которой образуется осадок. Напишите ионное уравнение реакции.
Приложение 2
Таблица . Накопление нитратов в различных частях продуктивных органов растений.
| Название растения | Рекомендации по применению |
 Патиссон Патиссон | Лучше срезать верхнюю часть, примыкающую к плодоножке |
 Огурец Огурец | Очистить огурец от кожицы и отрезать хвостик |
 Капуста Капуста | Снимать верхние кроющие листья и выбрасывать кочерыжку |
 Кабачки Кабачки | Срезать кожицу |
 Свёкла Свёкла | Отрезать верхнюю и нижнюю часть корнеплода |
 Картофель Картофель | Очищенный картофель залить на сутки 1%-ной поваренной соли или аскорбиновой кислоты |
| Морковь  | Отрезать верхнюю и нижнюю часть корнеплода |
Литература
1. Гаврусейко Н.П. Химические викторины Минск, 1972г.
2. О.С.Габриелян, И.С. остроумов Настольная книга учителя химии Дрофа М., 2002г.
3. Н.М. Кузьменок , Е.А. Стрельцов, А.И.Кумачев Экология на уроках химии Минск, 1992г.
4. О.С.Габриелян Учебник химии 9 класс М.2000г.
5. Л.Ю. Аликберова Занимательная химия. – М.: АСТ-ПРЕСС, 2002.
6. Т.И. Дорофеева Эти двуликие нитраты. //Химия в школе. – 2002. - №5. – С. 43- 45
7. М.В. Михалева, Б.В. Мартыненко , Э.М. Изилянова Экспресс-анализ овощей на содержание нитратов. //Химия в школе. – 2003. - №1. – С. 54- 56.
8. Г.В. Пичугина Химия и повседневная жизнь человека. – М.: Дрофа, 2004.
9. Интернет
Приложение 3
Рефлексия.
- Был ли данный урок интересен для тебя?
а) мне понравилась форма проведения урока (да/нет)
б) меня заинтересовало содержание урока (да/нет)
в) мне урок был неинтересен. (да/нет)
- Считаешь ли ты, что материал урока был полезным для тебя? (да/нет)
- Где ты сможешь применять полученную информацию?
- Будешь ли обсуждать ты информацию, полученную на уроке со своими близкими: (да/нет)
