Общая и
| Вид материала | Документы |
- Аннотация дисциплины «Общая и неорганическая химия» Общая трудоемкость дисциплины составляет, 19.38kb.
- Общая фармакология и общая рецептура, 67.83kb.
- «Физико-химические методы анализа» Общая трудоемкость изучения дисциплины составляет, 16.86kb.
- Общая часть, 692.76kb.
- Рабочая программа учебной дисциплины ф тпу 1 21/01 утверждаю, 218.97kb.
- Программа курса Iкурс Часть Вводные вопросы Предмет психологии; природа психического,, 17.27kb.
- Содержание лекций Модели местного самоуправления в России Местное самоуправление:, 786.51kb.
- Тематический план лекций и лабораторных занятий в 4 семестре по дисциплине «Общая гигиена», 34.25kb.
- Общая редакция В. В. Козловского В. И. Ильин драматургия качественного полевого исследования, 4631.85kb.
- Рабочая программа по курсу общая биология 9 класс, 576.48kb.
Определение содержания
фосфорной кислоты
Цель работы – определить содержание фосфорной кислоты в анализируемом растворе, г.
Сущность работы. Фосфорная кислота является трехосновной. Отношение констант Ka,1 / Ка,2 и Ка,2 / Ka,3 больше 104, поэтому теоретически ее можно оттитровать по первой и второй ступеням. Константа Ка,3 очень мала, вследствие чего по третьей ступени оттитровать фосфорную кислоту невозможно (отсутствует скачек на кривой титрования). С метиловым оранжевым фосфорная кислота оттитровывается щелочью как одноосновная:
H3PO4 + NaOH = NaH2PO4 + H2O fэкв.(H3PO4)=1,
а с фенолфталеином она оттитровывается до гидрофосфата натрия:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O fэкв.(H3PO4)=½.
Посуда: мерная колба, пипетка, бюретка, конические колбы.
Реактивы: стандартный раствор щелочи, индикаторы – метиловый оранжевый, фенолфталеин.
Выполнение работы.
В мерную колбу получают у лаборантов анализируемый раствор, доводят дистиллированной водой до метки и тщательно перемешивают. Пипеткой переносят аликвотную часть раствора в чистую коническую колбу. Добавляют 1–2 капли метилового оранжевого и титруют приготовленным раствором NaOH точно известной концентрации. Титрование проводят до момента резкого изменения окраски от розового к оранжевому (в присутствии свидетеля).
Определение фосфорной кислоты может быть выполнено с индикатором фенолфталеином. При этом титрование ведется до появления окраски.
Титрование повторяют не менее 3 раз при условии, что V≤0,1. По полученным результатам рассчитывают массу H3PO4 в анализируемом растворе (г) используя С(1/1 NaOH), титр Т(NaOH), титр NaOH по Н3РO4 Т(NaOH/Н3РO4).
5.4.1. Пример составления отчета.
15.10.2009
Лабораторная работа № 4
Определение содержания NaOH
Цель работы – определить массу NaOH в растворе.
Сущность работы. В основе определения лежит реакция:
NaOH + HNO3 = NaNO3 + H2O fэкв.(NaOH)=1.
Реагенты: 0,1041 н. HNO3; фенолфталеин.
Посуда: колба мерная (200,0 мл), бюретка, пипетка (20,0 мл), конические колбы.
Ход выполнения работы.
Анализируемый раствор получен в мерную колбу и доведен до метки дистиллированной водой. Из колбы отобраны 3 аликвоты по 20,0 мл и оттитрованы HNO3 с фенолфталеином.
Результаты титрования
| V(HNO3), мл | 12,1 | 12,3 | 12,6 | 12,2 |
Средний объем:
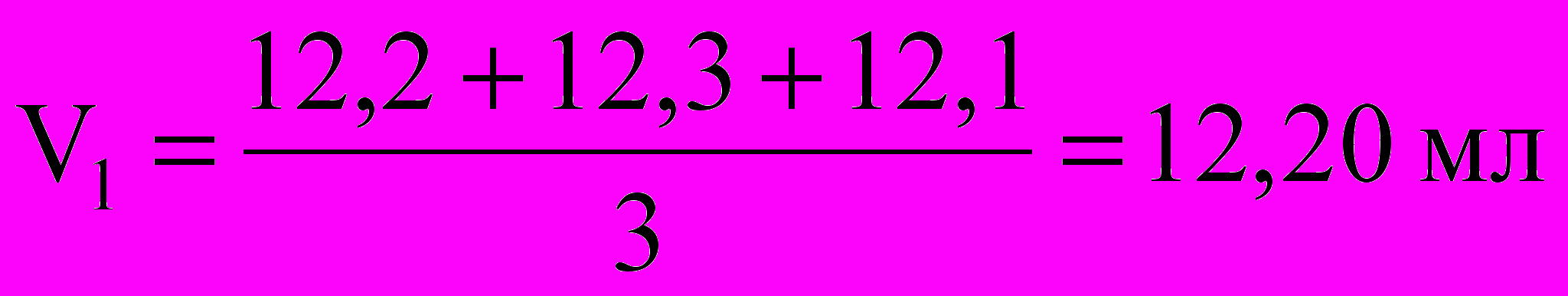 ;
;Расчет концентрации раствора:
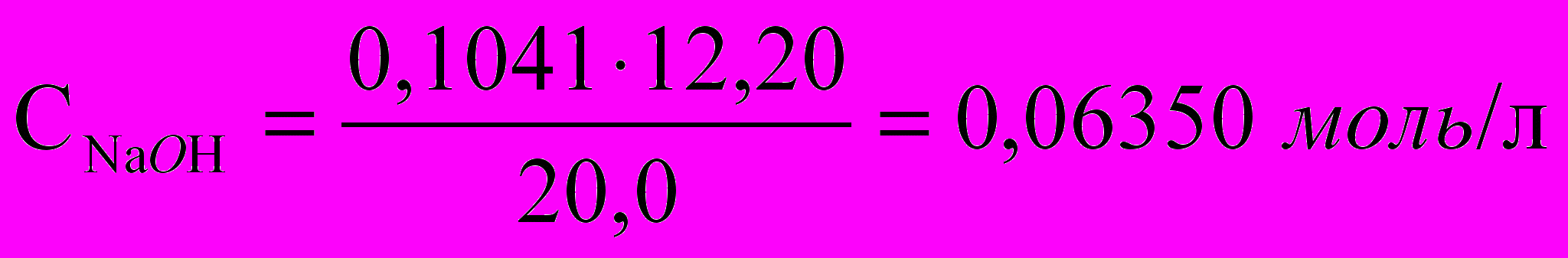 .
.Расчет масс веществ:
m(NaOH) = 0,0635039,9971×0,2 = 0,5080 г.
По полученным результатам самостоятельно рассчитать массу H3PO4 в анализируемом растворе (г) используя титр Т(NaOH) и титр NaOH по Н3РO4 Т(NaOH/Н3РO4) (см. табл. 2).
Истинные результаты:
m = 0,5091 г.
Погрешность определения.
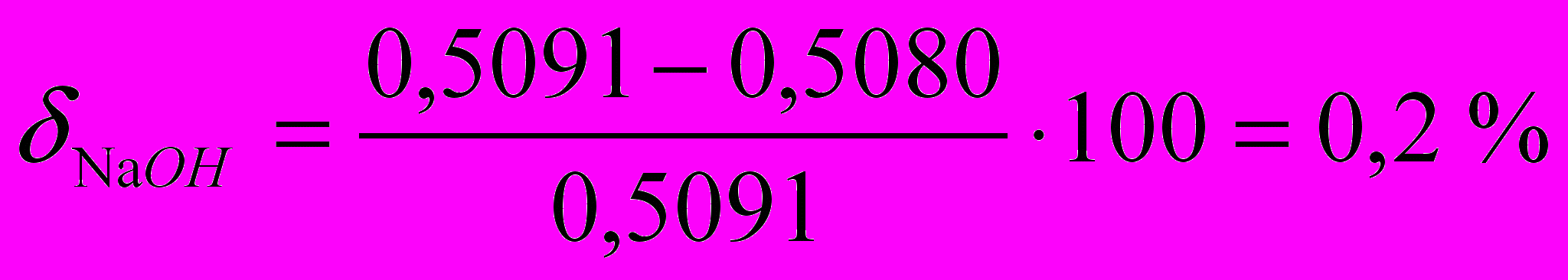 .
.Лабораторная работа № 5
Определение содержания слабой
органической кислоты (винной, щавелевой
или уксусной)
Органические кислоты (винная, лимонная, яблочная, щавелевая, янтарная, аскорбиновая) широко распростарены в растениях, они играют важную роль в их метаболизме. Винная, лимонная, яблочная, щавелевая, янтарная и др. находятся в растениях в свободном состоянии и в виде солей кали, натрия и кальция. Все кислоты и их соли, кроме щавелевой, встречаются в хорошо растворимой форме. Количественное определение и разделение органических кислот основано на физико-химических свойствах солей.
используются
Цель работы – определить массу слабой органической кислоты (винной, щавелевой или уксусной) в анализируемом растворе, г.
Сущность работы. Слабые органические кислоты (НА или Н2А) взаимодействуют со щелочью по уравнениям
НА + NaOH = NaА + Н2O;
Н2А + 2NaOH = Na2А + 2Н2O.
Фактор эквивалентности кислоты определяется по уравнению реакции.
Посуда: мерная колба, пипетка, бюретка, конические колбы.
Реактивы: стандартный раствор щелочи, индикатор – фенолфталеин.
Выполнение работы.
В мерную колбу получают у лаборантов анализируемый раствор, доводят дистиллированной водой до метки и тщательно перемешивают. Пипеткой переносят аликвотную часть раствора в чистую коническую колбу. Добавляют 1–2 капли фенолфталеина и титруют приготовленным раствором NaOH (или KOH) точно известной концентрации.
Титрование повторяют не менее трех раз. По полученным результатам рассчитывают массу кислоты в анализируемом растворе, г.
Лабораторная работа № 6
