Общая и
| Вид материала | Документы |
- Аннотация дисциплины «Общая и неорганическая химия» Общая трудоемкость дисциплины составляет, 19.38kb.
- Общая фармакология и общая рецептура, 67.83kb.
- «Физико-химические методы анализа» Общая трудоемкость изучения дисциплины составляет, 16.86kb.
- Общая часть, 692.76kb.
- Рабочая программа учебной дисциплины ф тпу 1 21/01 утверждаю, 218.97kb.
- Программа курса Iкурс Часть Вводные вопросы Предмет психологии; природа психического,, 17.27kb.
- Содержание лекций Модели местного самоуправления в России Местное самоуправление:, 786.51kb.
- Тематический план лекций и лабораторных занятий в 4 семестре по дисциплине «Общая гигиена», 34.25kb.
- Общая редакция В. В. Козловского В. И. Ильин драматургия качественного полевого исследования, 4631.85kb.
- Рабочая программа по курсу общая биология 9 класс, 576.48kb.
Лабораторная работа № 2
Приготовление и стандартизация рабочего
раствора HCl
Цель работы – приготовить 0,1 н. раствор HCl путем разбавления более концентрированного раствора и установить точную концентрацию приготовленного раствора (стандартизировать).
Сущность работы. Точную концентрацию раствора HCl устанавливают по результатам титрования стандарта – раствора тетрабората натрия Na2B4O7∙10H2O, который с соляной кислотой взаимодействует по уравнению реакции
Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4Н3BO3 f(Na2B4O7)= 1/2.
Приборы и посуда: технические и аналитические весы; электрическая плитка; мерные цилиндры (20–25 мл, 250 мл и 500 мл); денсиметр (ареометр); склянка с этикеткой для хранения рабочего раствора; мерная колба; пипетка; бюретка; колбы для титрования; тигель.
Реактивы: Na2B4O7×10H2O (х. ч.), концентрированный раствор HCl; индикатор – метиловый оранжевый.
Выполнение работы.
1. Приготовление рабочего раствора HCl путем разбавления более концентрированного раствора кислоты до концентрации 0,1 н.:
- с помощью денсиметра измеряют плотность концентрированного раствора кислоты (см. п. 4.3);
- по справочнику находят массовую долю (%) или молярную концентрацию (моль/л) HCl в растворе. Рассчитывают объем концентрированного раствора, необходимый для приготовления 500 мл (или 300 мл по указанию преподавателя) 0,1 н. раствора;
- цилиндром отмеряют рассчитанный объем, переносят его в мерный цилиндр или стакан вместимостью 500 мл и разбавляют дистиллированной водой до нужного объема (концентрированный раствор вливается в воду!, см. п. 4.4);
- приготовленный раствор переливают через воронку в склянку для хранения, закрывают притертой пробкой и тщательно перемешивают содержимое.
Приготовленный раствор имеют приблизительно известную концентрацию, поэтому его необходимо стандартизировать.
2. Установление точной концентрации приготовленного раствора (стандартизация):
- рассчитывают ориентировочную массу установочного вещества – Na2B4O7×10H2O, необходимую для приготовления 0,1 н. раствора заданного объема (см. вместимость мерной колбы, имеющейся на рабочем месте; раствор установочного вещества готовят такой же концентрации, как и концентрация рабочего раствора);
- тетраборат натрия взвешивают в тигле на технических (± 10 % от расчетного количества), а затем на аналитических весах (см. п. 3.1.4). Навеску аккуратно пересыпают через воронку в мерную колбу и струей горячей воды смывают ее в колбу (в холодной воде Na2B4O7×10H2O растворяется плохо). Тигель с оставшимися на стенках частицами Na2B4O7×10H2O снова взвешивают на аналитических весах. По разности двух взвешиваний находят массу вещества, перенесенного в колбу;
- заполняют колбу на 2/3 объема горячей дистиллированной водой. Снимают с колбы воронку и, перемешивая содержимое колбы плавными круговыми движениями, добиваются полного растворения тетрабората натрия. Охлаждают раствор до комнатной температуры, разбавляют его до метки дистиллированной водой и тщательно перемешивают содержимое колбы, многократно перевертывая и встряхивая ее. Вычисляют молярную концентрацию эквивалента тетрабората натрия С(1/2Na2B4O7) с точностью до 4 значащих цифр и приступают к титрованию;
- вымытую бюретку ополаскивают небольшим количеством приготовленного раствора кислоты и заполняют этим раствором;
- в чистую коническую колбу переносят пипеткой определенный объем (аликвоту) приготовленного раствора Na2B4O7, прибавляют 1–2 капли индикатора и начинают титровать, перемешивая жидкость плавным круговым движением колбы;
- титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые. Рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более, чем на 0,1 мл;
- по результатам титрования рассчитывают точную молярную концентрацию эквивалента приготовленного раствора кислоты С(1/1HCl), титр Т(HCl), титр HCl по Na2СO3 Т(HCl/Na2СO3) или титр HCl по К2СO3 Т(HCl/К2СO3) по указанию преподавателя (см. табл. 2).
В некоторых случаях по указанию преподавателя раствор HCl может быть приготовлен из фиксанала или установление концентрации HCl может быть проведено по стандартному раствору щелочи, Na2CO3 или NaHCO3.
Лабораторная работа № 3
Приготовление и стандартизация рабочего
раствора щелочи
Цель работы – приготовить 0,1 н. раствор NaOH (или KOH) путем разбавления более концентрированного раствора и установить его точную концентрацию.
Сущность работы. Точную концентрацию раствора NaOH устанавливают по результатам титрования стандарта – раствора щавелевой кислоты Н2С2O4×2H2O, которая со щелочью взаимодействует по уравнению
Н2С2O4 + 2NaOH = Na2С2O4 + 2Н2O f(Н2С2O4)=1/2.
Приборы и посуда: см. лаб. работу № 2.
Реактивы: Н2С2O4×2H2O (х. ч.), концентрированный раствор NaOH (или KOH); индикатор – фенолфталеин.
Выполнение работы.
1. Приготовление рабочего раствора NaOH (или KOH) путем разбавления более концентрированного раствора щелочи до концентрации 0,1 н.:
- с помощью денсиметра измеряют плотность концентрированного раствора щелочи (см. п. 4.3);
- по справочнику находят массовую долю (%) или молярную концентрацию NaOH (моль/л) в растворе. Рассчитывают объем концентрированного раствора, необходимый для приготовления 500 мл (или 300 мл по указанию преподавателя) 0,1 н. раствора;
- цилиндром отмеряют рассчитанный объем, переносят его в мерный цилиндр или стакан вместимостью 500 мл и разбавляют дистиллированной водой до нужного объема (концентрированный раствор вливается в воду!, см. п. 4.4);
- приготовленный раствор переливают через воронку в склянку для хранения, закрывают пробкой и тщательно перемешивают содержимое.
Приготовленный раствор имеют приблизительно известную концентрацию, поэтому его необходимо стандартизировать.
2. Установление точной концентрации приготовленного раствора:
- рассчитывают ориентировочную массу установочного вещества – Н2С2O4×2H2O, необходимую для приготовления 0,1 н. раствора заданного объема (см. вместимость мерной колбы, имеющейся на рабочем месте; раствор установочного вещества готовят такой же концентрации, как и концентрация рабочего раствора);
- щавелевую кислоту взвешивают в тигле на технических (± 10 % от расчетного количества), а затем на аналитических весах (см. п. 3.1.4). Навеску аккуратно пересыпают через воронку в мерную колбу и струей воды смывают ее в колбу. Тигель с оставшимися на стенках частицами Н2С2O4×2H2O снова взвешивают на аналитических весах. По разности двух взвешиваний находят массу вещества, перенесенного в колбу;
- заполняют колбу на 2/3 объема дистиллированной водой. Снимают с колбы воронку и, перемешивая ее содержимое плавными круговыми движениями, добиваются полного растворения щавелевой кислоты. Разбавляют раствор до метки дистиллированной водой и тщательно перемешивают содержимое колбы, многократно перевертывая и встряхивая ее. Вычисляют молярную концентрацию эквивалента щавелевой кислоты С(1/2Н2С2O4) с точностью до 4 значащих цифр и приступают к титрованию;
- вымытую бюретку ополаскивают небольшим количеством приготовленного раствора щелочи и заполняют этим раствором;
- в чистую коническую колбу переносят пипеткой определенный объем (аликвоту) приготовленного раствора Н2С2O4, прибавляют 1–2 капли индикатора и начинают титровать, перемешивая жидкость плавным круговым движением колбы;
- титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые. Рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1 мл;
- по результатам титрования рассчитывают точную молярную концентрацию эквивалента приготовленного раствора NaOH С(1/1 NaOH), титр Т(NaOH), титр NaOH по Н3РO4 Т(NaOH/Н3РO4) (см. табл. 2).
В некоторых случаях по указанию преподавателя раствор NaOH может быть приготовлен из фиксанала или установление концентрации его может быть проведено по стандартному раствору кислоты.
5.2. Справочные данные
1. Значения молярных масс
| Формула | ½H2C2O42H2O | ½Na2B4O7×10H2O | NaOH | HCl |
| М, г/моль | 63,033 | 190,68 | 39,9971 | 36,461 |
2. Плотности и концентрации растворов
| Плотность при 20 С, г/мл | NaOH | HCl | ||
| , масс. % | С, моль/л | , масс. % | С, моль/л | |
| 1,070 | 6,47 | 1,731 | 14,49 | 4,253 |
| 1,080 | 7,38 | 1,992 | 16,47 | 4,878 |
| 1,090 | 8,28 | 2,257 | 18,43 | 5,509 |
| 1,100 | 9,19 | 2,527 | 20,39 | 6,150 |
| 1,110 | 10,10 | 2,802 | 22,33 | 6,796 |
| 1,120 | 11,01 | 3,082 | 24,25 | 7,449 |
| 1,130 | 11,92 | 3,367 | 26,20 | 8,118 |
| 1,140 | 12,83 | 3,655 | 28,18 | 8,809 |
| 1,150 | 13,73 | 3,947 | 30,14 | 9,505 |
| 1,160 | 14,64 | 4,244 | 32,14 | 10,22 |
| 1,170 | 15,54 | 4,545 | 34,18 | 10,97 |
| 1,180 | 16,44 | 4,85 | 36,23 | 11,73 |
| 1,190 | 17,34 | 5,160 | 38,32 | 12,50 |
| 1,200 | 18,25 | 5,476 | – | – |
| 1,210 | 19,16 | 5,796 | – | – |
5.3. Пример составления отчета.
Метод кислотно-основного титрования
8.10.2004
Лабораторная работа № 2
Приготовление и стандартизация рабочего раствора
серной кислоты
Цель работы – приготовить 0,1 н. раствор HCl путем разбавления более концентрированного раствора и установить точную концентрацию приготовленного раствора (стандартизировать).
Приборы и посуда: технические и аналитические весы; электрическая плитка; мерные цилиндры (20–25 мл, 250 мл и 500 мл); денсиметр (ареометр); склянка с этикеткой для хранения рабочего раствора; мерная колба; пипетка; бюретка; колбы для титрования; тигель.
Реактивы: Na2B4O7×10H2O (х. ч.), концентрированный раствор HCl; индикатор – метиловый оранжевый.
Выполнение работы.
1. Приготовление рабочего раствора HCl
С помощью денсиметра измерили плотность концентрированного раствора кислоты. По справочным данным нашли массовую долю (%) и молярную концентрацию (моль/л) HCl в растворе:
| Плотность при 20 °С, г/мл | w, масс. % | С, моль/л |
| 1,110 | 28,18 | 8,809 |
Рассчитываем объем концентрированного раствора, необходимый для приготовления 500 мл 0,1 н. раствора:
I способ.
По закону эквивалентов С1·V1= С2·V2
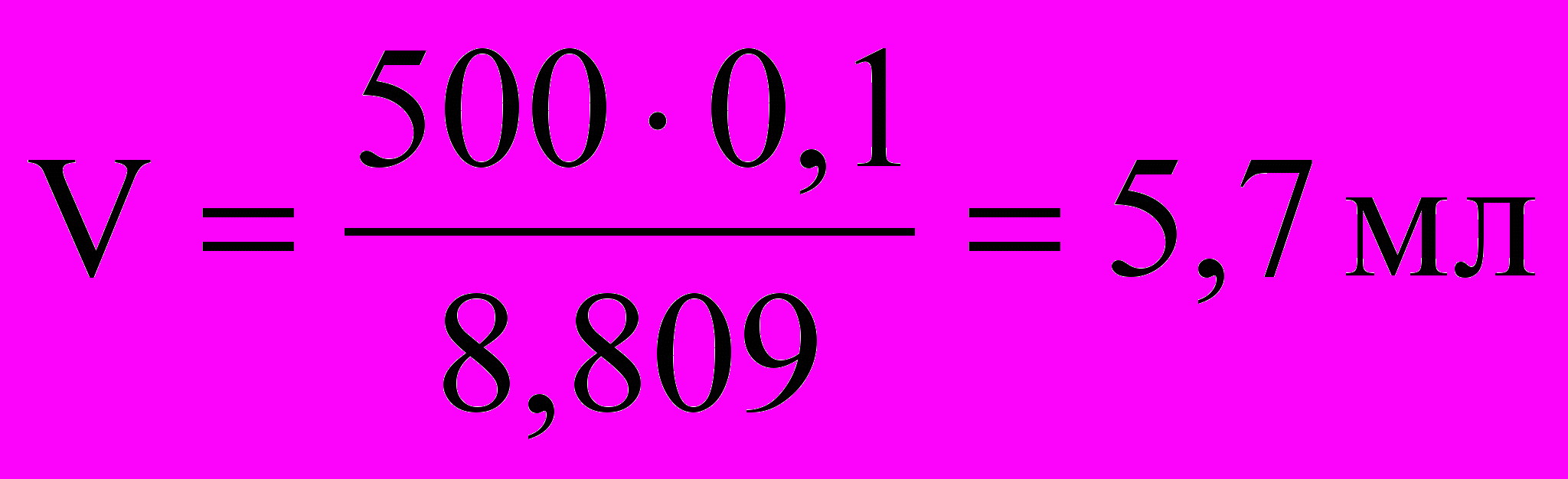
II способ.
1) Найдем массу вещества, содержащегося в 500 мл 0,1 н. раствора HCl, т.к. расчет ориентировочный, то используемые величины берем с меньшей точностью
m=C×M×V=0,1×36×0,5=1,8 г
2) Рассчитаем массу раствора
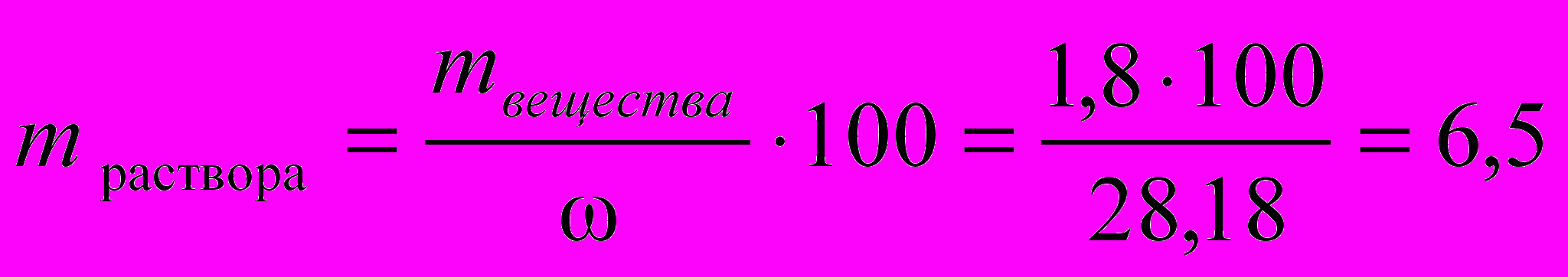 г
г3) Определим объем концентрированного раствора HCl
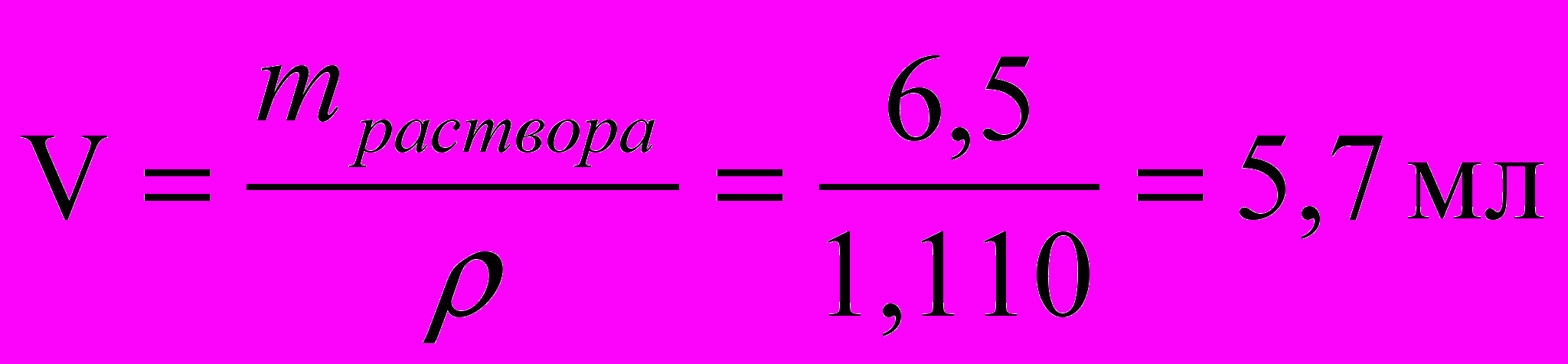
С помощью цилиндра отмерили 5,8 мл HCl и перелили в цилиндр (или мерный стакан) вместимостью 500 мл. Довели объем раствора дистиллированной водой до метки 500 мл.
2. Установление концентрации HCl.
Точную концентрацию раствора HCl устанавливаем по результатам титрования стандарта – раствора тетрабората натрия Na2B4O7∙10H2O:
Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4Н3BO3 f(Na2B4O7)=1/2.
Расчет навески Na2B4O7×10H2O:
m(Na2B4O7×10H2O)=C(1/2Na2B4O7)×V(Na2B4O7)×M(1/2Na2B4O7×10H2O);
m= 0,1∙0,1∙190,68 = 1,91 г.
Результаты взвешивания.
| Масса, г | на технических весах | на аналитических весах |
| пустого тигля | 32,0 | – |
| тигля с навеской | 33,8 | 33,8017 |
| тигля с остатками | – | 32,0713 |
Навеска перенесена в мерную колбу вместимостью 100,0 мл.
Расчет концентрации Na2B4O7:
m(Na2B4O7×10H2O) = 33,8017 32,0713 = 1,7304 г
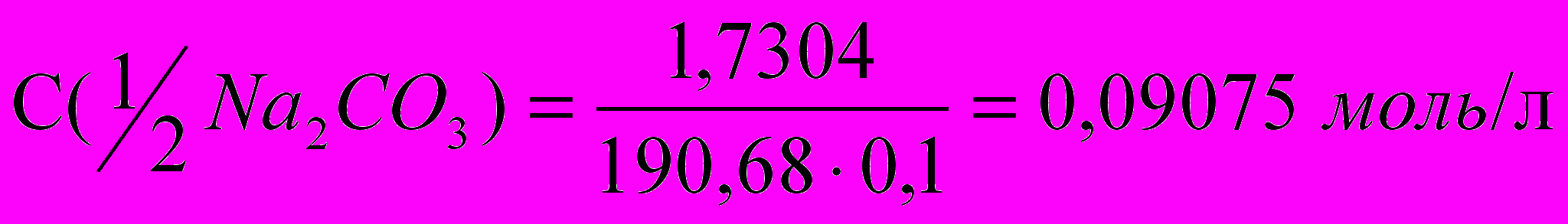 .
.Результаты титрования.
Отбираем аликвоту раствора тетрабората натрия объемом 10,0 мл. На ее титрование затрачиваются следующие объемы раствора HCl
| V, мл | 8,3 | 8,2 | 8,6 | 8,4 |
Средний объем раствора HCl:
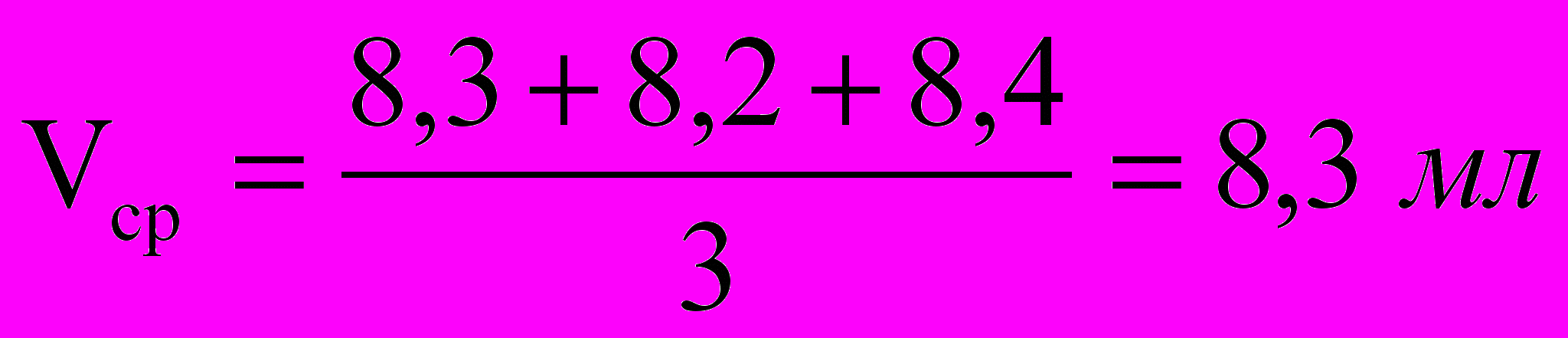 .
.Расчет концентрации HCl:
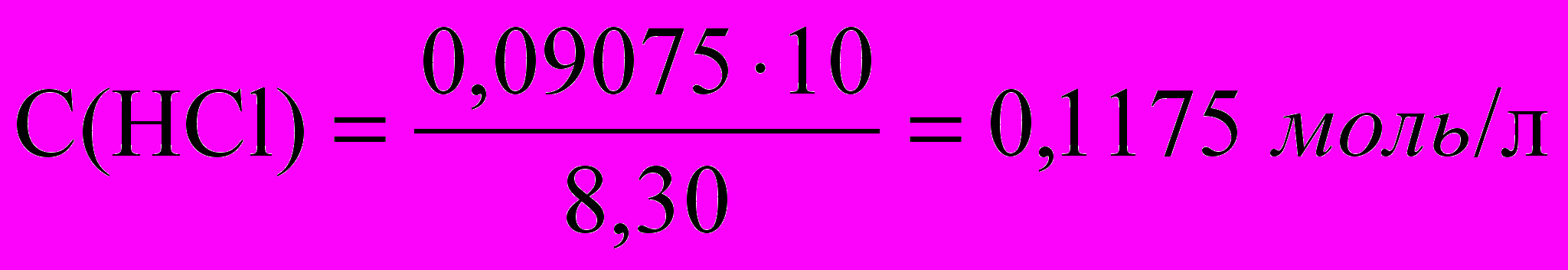 .
.Зная молярную концентрацию эквивалента приготовленного раствора кислоты С(1/1HCl) рассчитайте титр Т(HCl), титр HCl по Na2СO3 Т(HCl/Na2СO3) используя табл. 2.
5.4. Вопросы для самоподготовки к работам № 2, 3
Какие способы выражения концентрации используются в титриметрическом методе анализа?
- Почему первичные стандартные растворы HCl и NaOH можно приготовить только из фиксаналов? Как готовят вторичные стандартные растворы HCl и NaOH?
- Для чего используют установочные вещества? Как проводится расчет навески установочного вещества и расчет результатов титрования?
- Почему бюретки и пипетки перед употреблением необходимо ополаскивать тем же раствором, которым их будут наполнять? Можно ли так поступать при работе с мерными колбами?
- Рассчитайте молярную концентрацию и молярную концентрацию эквивалента раствора H2SO4, титр H2SO4, титр H2SO4 по Na2СO3 Т(HCl/Na2СO3), если на титрование 15,0 мл этой кислоты было затрачено 12,9 мл NaOH с концентрацией 0,1090 н.
- Определите факторы эквивалентности исходных веществ и продуктов данной реакции:
5.4. Контрольные анализы
Лабораторная работа № 4
Количественно фосфор определяют гравиметрическим илититриметрическим методами анализа. Определение фосфора в органических соединениях состоит из двух стадий: минерализации (изучается на профильных кафедрах) и аналитического окончания (изучаете на кафедре аналитической химии). После сжигания во всех случаях фосфор определяют в виде иона РО43-. Реакции нейтрализации используются для определения серы в виде H2SO4, бора,
