Ослин навчальний посібник до лабораторних занять з фізіології рослин для студентів біологічного факультету Видавництво поліграфічний центр "Київський університет" 2004
| Вид материала | Документы |
- Мусієнко М. М., Панюта О. О. Біотехнологія рослин. Навчальний посібник, 5445.72kb.
- Ділова іноземна мова" для студентів геологічного факультету (магістрів V-VI курсів), 329.16kb.
- Савицький В. М., Хільчевський В. К., Чунарьов О. В., Яцюк, 2100.06kb.
- Вченої ради біологічного факультету протокол №11 від 25 квітня 2005, 115.21kb.
- Тематичний план занять «Патофізіологія ендокринної та нервової систем» Для студентів, 1055.52kb.
- Київський університет туризму, економіки І права «Основи готельного менеджменту», 5077.65kb.
- Полтавський національний педагогічний університет імені В. Г. Короленка Історичний, 675.02kb.
- Практикум з педагогіки вищої школи: Навчальний посібник за модульно-рейтинговою системою, 411.72kb.
- Навчальний посібник для студентів філологічних спеціальностей вищих педагогічних навчальних, 3345.03kb.
- Практичний курс англійської мови навчальний посібник з практики усного та письмового, 5352.9kb.
Робота № 19. Спектрофотометричне визначення та
хроматографічне розділення пігментів
вищих водних рослин.
Теоретичне обгрунтування. Відомо, що фотосинтетичний апарат гідромакрофітів дуже чутливий до дії різних факторів довкілля і один з перших реагує на їх негативний вплив. У зв’язку з тим, що найважливішими компонентами фотосинтетичного апарата є фотосинтетично активні пігменти, вміст, стан і активність яких певною мірою визначають увесь комплекс процесів метаболізму організмів, безперечно, що зміни фотосинтетичної активності пігментного апарата можуть бути чутливим показником загального фізіологічного стану рослинного організму.
Пігментний комплекс рослин бере участь в утворенні багатьох специфічних речовин, які залежно від умов, можуть надавати ту чи іншу спрямованість процесам росту і розвитку рослин. Тому, можливість нормального існування водних рослин, збереження єдності цього комплексу з умовами водного середовища, здатність організму перебудовувати весь перебіг фізіолого-біохімічних процесів відповідно до змін цих умов найтісніше пов’язані з їх пігментним комплексом. У вищих водних рослин основну функцію фотоасиміляції виконують хлорофіли і каротиноїди.
Хлорофіл – добрий показник фізіологічного стану водної рослини. Відомо, що рослини, фотосинтез яких здійснюється в оптимальних умовах, містять більшу кількість хлорофілу а ніж хлорофілу в. Співвідношення цих пігментів у листках здорових рослин у нормі більше 1,0. Зміна співвідношення двох основних форм хлорофілу свідчить про зсув рівноваги у фотосинтетичній системі і значних порушеннях фізіологічного стану рослин, а зниження цього співвідношення до рівня менше одиниці вказує на переважання процесів деструкції органічної речовини над її продукцією.
Каротиноїди беруть участь у процесі фотосинтезу, росту, морфогенезу та розмноження і виконують ще багато різноманітних функцій в організмі. Так як відомо, що у гідрофітів порівняно з наземними рослинами підвищений вміст каротиноїдів – одна з адаптивних реакцій рослин, що забезпечує більш повне поглинання короткохвильової частини розсіяної у водній товщі променистої енергії, природно, що зменшення загальної кількості цих пігментів вплине на весь метаболізм рослини.
Для визначення концентрації фотосинтетичних пігментів водних рослин використовують різні методи: спектрофотометричний, флуориметричний та хроматографічний. Найпоширеніші з них –спектрофотометричний метод, який незважаючи на свою простоту, дає змогу в одній пробі визначити різні хлорофіли, продукти їхньої деградації, а також каротиноїди, та метод тонкошарової хроматографії.
Визначення концентрації фотосинтетичних пігментів водних рослин включає стандартні процедури : отримання наважки, подрібнення і нейтралізацію матеріалу, екстракцію пігментів розчинником та вимірювання оптичної густини екстрактів.
1. Отримання наважки. Коли беруть наважку рослинного матеріалу необхідно враховувати дві важливі умови: кількість наважки та швидкість зважування. Кількість наважки залежить від вмісту в дослідному матеріалі пігментів. Так, наприклад, при роботі з нормальними зеленими листками беруть наважку 0,4-0,5 г, а для дослідження вмісту пігментів в ліофільно висушених хлоропластах достатньо 20 мг.
В деяких випадках потрібно провести порівняльні розрахунки вмісту пігментів не лише на одиницю маси, а й на одиницю площі поверхні, тоді слід робити висічки свердлом відомого діаметра і зважувати певну кількість висічок.
Швидкість зважування залежить від матеріалу. Фіксований сирий або сухий матеріал можно зважувати на аналітичних терезах, оскільки за час зважування наважки з нею не відбувається суттєвих змін. Якщо зважуванню передує фіксація, або рослини є власно гдрофітами то наважку потрібно робити швидко, користуючись при цьому торзійними терезами.
2.Подрібнення та нейтралізація матеріалу. Для швидкої та повної екстракції пігментів необхідно добре подрібнити матеріал. Свіжий матеріал подрібнюють у ступці (невеликі наважки), або в гомогенізаторі (великі кількості) з додаванням як абразивного компонента кварцевого піску, товченого скла або синтетичного алмазного порошку. Для нейтралізації клітинного соку додають крейду або соду.
3.Екстракція пігментів. Екстракцію пігментів проводять різними способами залежно від поставленої мети, характера матеріалу та природи розчинника. Так як пігменти в листках зв`язані з ліпопротеїнами, їх повну екстракцію можна провести лише після порушення цього зв`язку. Неполярні розчинники не порушують зв`язок хлорофілу з білком, тому для повного вилучення пігментів із сирих листків треба застосовувати полярні розчинники. Найчастіше використовують 80 %-ий ацетон і 96о-ий спирт (етанол або метанол). Щоб отримати прозорий розчин пігментів слід відокремити рідку фазу від твердої, яка складається з осаду мезги, абразивного матеріалу та нейтралізуючих агентів. Це досягається шляхом фільтрування під вакуумом за допомогою електронасосу або насосу Камовського через фільтр Шотта із пористого скла або центрифугуванням. Отриманий фільтрат доводять до риски в мірному посуді.
4.Розділення пігментів за допомогою тонкошарової хроматографії на пластинках “Silufol”. На пластинку наносять екстракт пігментів. Для отримання одномірної хроматограми не має значення ні кількість, ні форма плями, яку наносять. Розчин пігментів наносять піпеткою на відстані 2 см від нижнього краю пластинки. Щоб прискорити випаровування розчинника на пластинку направляють потік повітря від вентилятора.
Використовуючи різні розчинники та їх поєднання, на хроматограмі отримують будь-яке розміщення плям. Для розгонки пластинку з нанесеною плямою вміщують у хроматографічну камеру, на дно якої наливають невеликим шаром (1-1,5 см) окремі розчинники, або їх комбінації. Розчинник, підіймаючись до верху по пластинці, тягне за собою пігменти, розподіляючи їх на різних рівнях пластинки.
1.Чистий петролейний ефір видаляє каротин, який рухається разом з фронтом розчинника.
1.Суміш петролейного ефіру з бензолом (1:3) видаляє із плями всі пігменти в такій послідовності: з самого верху – каротин з фронтом розчинника, нижче лютеїн, віолоксантин, суміш хлорофілів (хлорофіл а і в не розділяються один від одного – вище розміщений хлорофіл а, нижче хлорофіл в), під хлорофілом в розіщений ксантофіл –неоксантин, який трохи замаскований хлорофілом в.
2.Подібну універсальну дію має суміш гексан-ацетон-метанол (15:5:0,5).
3.Чистий петролейний ефір і суміш , яка складається з бензину-бензолу-ацетону (40:10:1) видаляють каротин, який рухається разом з фронтом розчинника.
4.Щоб виділити ксантофіли використовують суміш бензин-ацетон-хлороформ (5:5:4).
5.Застосовуючи суміш розчинників, яка складається із петролейного ефіру і етанолу (20:1) можна відокремити неоксантин від інших пігментів.
Після того, як пігменти чітко відокремили один від одного, отриману хроматограму виймають із хроматографічної камери, висушують і розрізають її на смужки відповідно до положення кожного пігменту. Далі смужки з відповідними пігментами нарізають дрібними шматочками, розміщують в маленьких склянках і заливають невеликою кількістю спирту з ацетоном (1:3). Забарвлений розчин зливають до мірної посудини і відмічають об’єм. Після отримання екстракту кожного пігменту визначають його оптичну густину на спектрофотометрі.
5. Вимірювання оптичної густини екстрактів спектрофотометричним методом. Спектрофотометричний метод визначення пігментів базується на вимірюванні оптичної густини розчинів (D) пігментів в області спектрального максимуму поглинання світла. Оптична густина характеризує послаблення випромінювання в шарах різноманітних речовин.
D = lg Io / I ,
де Io – інтенсивність випромінювання падаючого променя на поглинаючий розчин, I – інтенсивність випромінювання , що пройшло крізь розчин променя.
Мета роботи. Вивчення якісного складу та кількісного вмісту пластидних пігментів методами хроматографії та спектрофотометрії.
Матеріали і обладнання: дослідні водні рослини різних екологічних груп; спектрофотометр, хроматографічні камери, аналітичні і торсійні терези, пластинки “Silufol”, ступки, фільтр Шотта, колба Бунзена, електронасос, мікропіпетки, свердло; розчинники (петролейний ефір, бензол, етанол, метанол, ацетон, гексан, бензин, бензол, хлороформ).
Хід роботи. Наважку рослинного матеріалу (0,3- 0,5 г) гарно розтирають в ступці з невеликою кількістю розчинника (96% -етанолу або 80%- ацетону)до однорідної маси. Розтерту гомогенну масу кількісно переносять до фільтра Шотта, змиваючи ступку і пестик невеликими порціями розчинника. Фільтрують під вакуумом, доводячи фільтрат до певного об’єму (10 мл).
Отриманий екстракт суміші пластидних пігментів використовують для кількісного визначення деяких з них (хлорофілів а, в, суми каротиноїдів) за допомогою спектрофотометра і хроматографічного розділення на складові компоненти.
На спектрофотометрі визначають оптичну густину розчину (D) за певною довжиною хвилі що відповідає максимумам поглинання досліджуваних пігментів.
Макимуми поглинання для 80%-го ацетону і 96%-го етанолу дорівнюють:
Хлорофіл а –665 нм,
Хлорофіл в –649 нм,
Каротиноїди –440 нм.
Кількісний вміст пігментів (мг/мл) після спектрофотометрії розраховують за формулами:
Са = 11,63 Da – 2,39Dв,
Св = 20,11Dв –5,18 Dа,
Ca+в =6,45 Da + 17,72 Dв ,
С кар.= 4,695 Dкар. – 0,268 Са+в.
Далі розраховують вміст пігментів на грам сирої або сухої речовини.
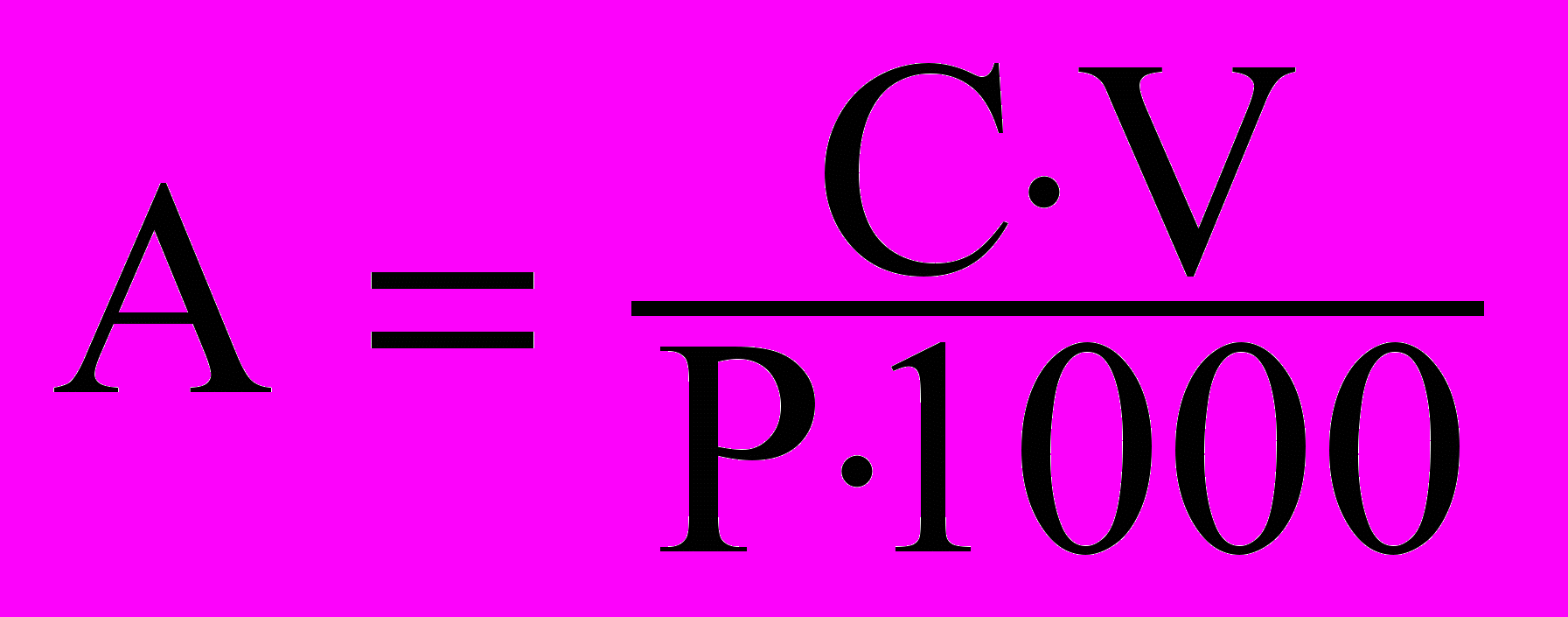
де А – вміст пігменту, мг/г;
С – концентрація пігменту, мг/л;
V –об’єм витяжки пігменту, мл;
Р –наважка рослинного матеріалу, мг.
Дані заносять до таблиці:
| Вид рослини | Наважка, мг | Об’єм витяжки, мл | Пігмент | Вміст пігменту, мг/мл | Вміст пігменту, мг/г сирої речовини |
| | | | Хлорофіл а Хлорофіл в Каротиноїди | | |
Роблять висновки.
Хроматографування проводять на пластинках “Silufol”, на які за допомогою мікропіпеток поступово (постійно підсушуючи теплим повітрям) наносять 0,05-0,2 мл екстракту у вигляді невеликих плям або смуг на відстані 2 см від нижнього краю. Для порівняння на одну пластинку наносять кілька екстрактів з різних видів водних рослин, але не більше п’яти. Роблять дві пластинки з однаковими варіантами.
Готують розчинники для хроматографії:
1.Чистий петролейний ефір.
2.Бензол з петролейним ефіром (1:3).
3.Петролейний ефір з етанолом (20:1).
Одну із двох пластинок вміщують в камеру на дно якої вже налитий розчинник №1 і накривають склом з метою герметизації. Петролейний ефір відділяє каротин. Коли жовта смуга фронту розчинника дійде до верхнього краю пластинки, її виймають, підсушують і вміщують в камеру з розчинником № 2.
Другу пластинку вміщують в банку з розчинником № 3.
Те саме роблять і з іншими розчинниками.
Коли фронт розчинника дійде до верхнього краю, пластинки виймають, підсушують і аналізують хроматограми, відмічаючи послідовність і колір плям.
Роблять висновки.
Робота № 20. Культивування водних рослин
з родини ряскових.
Теоретичні передумови. Підбір мінеральних поживних середовищ для культивування водних рослин з метою їх подальшого використання в токсикологічних експериментах є важливим як для отримання потрібної біомаси, так і для підтримання культури протягом певного періоду. Водні рослини переважно культивують в акваріумах на рідких поживних середовищах, але інколи використовують і тверді агарізовані середовища.
В останні десятиліття ряскові розглядають як надзвичайно цінний експериментальний об’єкт для лабораторних досліджень багатьох фізіологічних процесів завдяки малим розмірам, швидкому росту, відносно простій будові, переважанню вегетативного розмноження, невибагливості до середовища і, пов’язаною з цим, легкістю вирощування в стерильних і водних культурах.
Розмножують ряскові переважно вегетативним шляхом. В сприятливих умовах вегетативні пагони надзвичайно швидко утворюють нові листеці, причому як приріст площини, так і приріст кількості листеців відбувається типовим класичним способом. Як водні рослини, мають перевагу в тому, що їх можна вирощувати в лабораторних умовах на синтетичному поживному середовищі з використанням світла і тепла певної інтенсивності.
Забеспечення оптимальних умов для лабораторного вирощування рясок робить дослідження незалежними від вегетаційного сезону в природних умовах і дає змогу проводити дослідження протягом року.
Мета роботи: Ознайомитися з методами культивування рясок, приготувати мінеральні поживні середовища для вирощування цих рослин.
Матеріали і обладнання: рослини родини ряскових ( ряска мала, ряска триборозенчаста, вольфія безкоренева, багатокорінник); кристалізатори, автоклав, термостат, мікробіологічна петля ; дистилят, 0,1 %-ий розчин сулеми, 50 %-ий спирт етанол, 0,05 %-ий NaOCl, 1 %-ий розчин сахарози, 0,01 %-ий аспарагін, цитрат залізу, 1,5 %-ий агар, KNO3, KH2PO4, MgSO4, CaCl2, MnCl2, H3BO3, NH4NO3, K2HPO4, Fe2Cl6, FeCl3, CaNO3, KCl.
Хід роботи. Матеріал зібраний в природних умовах підлягає стерилізації з метою отримання чистих культур, вільних від мікроорганізмів. Стерилізацію проводять шляхом занурення рослин в 0,1 %-ий розчин сулеми і 50 %-ий розчин спирту протягом 30-60 сек , або в розчині 0,05 % NaOCl протягом 60 сек.
Потім рослини промивають стерильною дистильованою водою і переносять до судин із стерильним поживним середовищем з додаванням 1 % сахарози та 0,01 % аспарагіну. Ці операції виконують в асептичних умовах, в спеціальних камерах для щеплення. Через кілька днів вирощування в термостаті (освітлення –1200 Люкс, температура –28о С) із гинучих материнських листеців регенерують спадкові листеці, які дають початок стерильній культурі. Нові отримані рослини можна пересадити на свіже поживне середовище вже без додаткової стерилізації і, безпосередньо, використовувати в дослідженнях.
Приготування рідких мінеральних поживних середовищ. Різні види родини ряскових (ряска мала, ряска триборозенчаста, багатокорінник, вольфія безкоренева та ін.) можна виростити на різних мінеральних поживних середовищах з переважаючим вмістом вапняку. Стерильні культури гарно ростуть на чисто мінеральних сумішах, однак додавання сахарози значно прискорює ріст. Важливою складовою успішного культивування водних рослин є правильний підбір сольового складу середовища. Найчастіше використовують такі середовища:
Середовище Гапоненко-Стражецького:
KNO3 – 0,4 г/л ,
KH2PO4 – 0,2 г/л ,
MgSO4 7 H2O – 0,3 г/л ,
CaCl2 6H2O – 0,6 г/л ,
MnCl2 4H2O – 0,3 мг/л ,
H3BO3 – 0,5 мг/л ,
Цитрат залізу – 5мг/л.
Середовище Бенеке:
NH4NO3 – 0,2 г/л ,
CaCl2 – 0,1 г/л ,
K2HPO4 – 0,1 г/л ,
MgSO4 -0,1 г/л ,
Fe2Cl6 – 1 краплина 1% розчину.
Середовище Бейєринка:
NH4NO3 – 0,05 г/л ,
CaCl2 – 0,1 г/л ,
K2HPO4 – 0,2 г/л ,
MgSO4 -0,2 г/л ,
FeCl3 – 1 краплина 1% розчину.
Середовище Кнопа:
CaNO3 – 0,25 г/л ,
KH2PO4 – 0,06 г/л ,
MgSO4 -0,06 г/л ,
KCl – 0,08 г/л ,
Fe2Cl6 – 1 краплина 1% розчину.
Середовище автоклавують при 1,5 атм. протягом 20 хвилин.
Важливою умовою культивування ряскових є правильне підбирання освітлення. Оптимальний інтервал – 7-14 тис. лк. Бажано безперервне освітлення, винятком є ряска триборозенчаста, найкращий приріст якої спостерігається при 12-ти годинному освітленні з інтенсивнісю 1000 лк. Оптимальна температура вирощування дорівнює 22-37 оС, мінімальна 4-18 оС. Найтолерантнішим щодо температури є багатокорінник (може витримувати навіть температуру 50 оС протягом доби і 4 оС протягом двох тижнів). Росту ряскових сприяє нейтральна, або слабколужна реакція середовища. В природних водоймах ряска найкраще росте при рН 6,9-7,2, однак культивування в лабораторних умовах за цього рівня рН призводить до розвитку синьо-зелених водоростей. Попередня стерилізація листеців ряски 70о-м етиловим спиртом (протягом 2-3 сек.) з подальшим промиванням стерильною водою і культивування за рН 6,3 перешкоджають розвитку синьо-зелених водоростей.
Приготування твердого агаризованого середовища. Для приготування твердого середовища використовують 1,5%-й агар, який готують на мінеральному середовищі (1/20 від повного). Автоклавують протягом 30 хвилин при 1 атм. Потім агар розливають на косяки. Ряску садять звичайним способом за допомогою мікробіологічної петлі. Підтримання культури ряски на косяках не спричинює складностей, оскільки пересаджують її раз у 2-3 місяці. Косяки гарно зберігаються за кімнатної температури на розсіяному світлі. Метод вирощування рясок на агарізованому середовищі можна використовувати для отримання безбактеріальної культури, оскільки регулярне пересадження (через 2-3 тижні) сприяє звільненню ряски від супутніх бактерій і водоростей. Вирощування ряскових на твердому середовищі дає змогу зберігати зібрані зразки протягом довгого терміну.
