От лат evaporo испаряю и греч grapho пишу), метод получения изображений объектов в их собственном (обычно ик) тепловом излучении. Предложен нем
| Вид материала | Документы |
- Реферат по русскому языку на тему: «Типы словарей», 284.65kb.
- Метод распознавания изображений гистологических препаратов в задачах медицинской диагностики, 31.25kb.
- Конспект лекций для 16-и часового курса начертальная геометрия издание 2-ое, 578.52kb.
- Обработка и передача изображений, 243.48kb.
- Социоло́гия (от лат socius общественный; др греч. λόγος мысль, причина) наука о закономерностях, 85.75kb.
- Isbn 5-7262-0634 нейроинформатика 2006, 165.42kb.
- М. В. Лычагин Зав кафедрой д э. н., профессор, 986.65kb.
- Предложен метод неразрушающего акустического контроля многофазных макрооднородных композитных, 14.58kb.
- От греч autos -сам, bios жизнь, grapho пишу, лит прозаический жанр; как правило, последовательное, 2051.5kb.
- М. В. Корытова научный руководитель Р. Т. Файзуллин, д т. н., профессор Омский государственный, 26.14kb.
ЭМАН (от лат. emano — вытекаю, распространяюсь) (Е), редко применяемая внесистемная ед. концентрации (уд. активности) радиоакт. нуклидов в жидкостях или газах. 1 Э. равен концентрации радиоакт. нуклида, имеющего активность 10-10 кюри на 1 л р-ра или газовой смеси. 1 Э.=10-10 Ки/л=3,7•10-3 Бк/м3.
ЭМИССИОННАЯ СПЕКТРОСКОПИЯ, изучение структуры и св-в квантовых систем по их спектрам испускания. Спектры испускания атомов, молекул и тв. тел получают в спектральных приборах; их возбуждают разл. способами: облучая светом, помещая исследуемое в-во в пламя горелки, возбуждая атомы в-ва электрич. разрядом и т. д. Э. с. лежит в основе эмиссионного спектрального анализа. См. также Спектроскопия.
ЭМИССИОННАЯ ЭЛЕКТРОНИКА, область физики, охватывающая исследования и использование явлений, связанных с эмиссией эл-нов и ионов из тв. тела или жидкости в вакуум или др. среду, а также с др. процессами на поверхности тв. тел при бомбардировке её ч-цами.
ЭНАНТИОМОРФИЗМ (от греч.enantios — находящийся напротив, противоположный и morphe — форма), свойство нек-рых объектов образовывать зеркально равные друг другу по строению модификации. Один из таких объектов условно наз. «правым», а другой — «левым». Энантиоморфные объекты могут описываться только точечной группой симметрии, содержащей лишь оси симметрии, в частном случае могут быть асимметричными. Примеры энантиоморфных объектов — кристаллы винной кислоты, кварца, многие органич. молекулы, напр. аминокислоты. Др. термин, эквивалентный Э.,— хиральность. См. Симметрия кристаллов, Изомерия молекул.
В. К. Вайнштейн
ЭНЕРГЕТИЧЕСКАЯ ОСВЕЩЁННОСТЬ (облучённость), поверхностная плотность лучистого потока; равна отношению потока излучения к площади облучаемой поверхности. Единица измерения Э. о.— Вт/м2. В системе световых величин аналогом Э. о. явл. освещённость.
ЭНЕРГЕТИЧЕСКАЯ СИЛА СВЕТА, то же, что сила излучения.
ЭНЕРГЕТИЧЕСКАЯ ЭКСПОЗИЦИЯ (количество облучения, доза Не), отношение энергии dQe падающего на элемент поверхности излучения к площади dA этого элемента. Эквивалентное определение: Э. э. есть произведение энергетической освещённости Ее на длительность облучения dt.
He=dQe/dA=∫Eedt. Ед. измерения Э. э.— Дж•м-2. В системе световых величин аналогичная Э. э. величина наз. экспозицией. Понятием Э. э. широко пользуются также при работе с корпускулярным излучением.
Д. Н. Лазарев.
ЭНЕРГЕТИЧЕСКИЕ ФОТОМЕТРИЧЕСКИЕ ВЕЛИЧИНЫ, величины, характеризующие энергетич. параметры оптического излучения безотносительно к его действию на приёмники излучения. В таблице приведены наиб. употребительные Э. ф. в. и единицы

их измерения. Соотношения между Э. ф. в. те же, что и между соответствующими световыми величинами.
Д. Н. Лазарев.
ЭНЕРГИИ СОХРАНЕНИЯ ЗАКОН, один из наиб. фундам. законов природы, согласно к-рому важнейшая физ. величина — энергия сохраняется в изолиров. системе. В изолиров. системе энергия может переходить из одной формы в другую, но её кол-во остаётся постоянным. Если система не изолирована, то её энергия может изменяться либо при одноврем. изменении энергии окружающих тел на такую же величину, либо за счёт изменения энергии вз-ствия тела с
902
окружающими телами. При переходе системы из одного состояния в другое изменение энергии не зависит от того, каким способом (в результате каких вз-ствий) происходит переход, т. е. энергия — однозначная ф-ция состояния системы.
Э. с. з. явл. строгим законом природы, справедливым для всех известных вз-ствий, он связан с однородностью времени, т. е. с тем фактом, что все моменты времени эквивалентны и физ. законы не меняются со временем (см. Симметрия в физике). Э. с. з. для механич. процессов установлен Г. В. Лейбницем (1686), для немеханич. явлений — Ю. Р. Майером (1845), Дж. П. Джоулем (1843 — 1850) и Г. Л. Гельмгольцем (1847). В термодинамике Э. с. з. наз. первым началом термодинамики.
До создания А. Эйнштейном спец. теории относительности (1905) законы сохранения массы и энергии существовали как два независимых закона. В теории относительности они были слиты воедино (см. также Сохранения законы).
• Энгельс Ф., Диалектика природы, Маркс К. и Энгельс Ф., Соч., 2 изд., т. 20; Ленин В. И., Материализм и эмпириокритицизм, Полн. собр. соч., 5 изд., т. 18; М а й е р Р., Закон сохранения и превращения энергии. Четыре исследования. 1841—1851, М.—Л., 1933; Гельмгольц Г., О сохранении силы, пер. с нем., 2 изд., М.— Л., 1934; Планк М., Принцип сохранения энергии, пер. с нем., М.— Л., 1938; Л а у э М., История физики, пер. с нем., М., 1956; В и г н е р Е., Этюды о симметрии, пер. с англ., М., 1971.
Г. Я. Мякишев.
ЭНЕРГИЯ (от греч. energeia — действие, деятельность), общая количеств. мера движения и вз-ствия всех видов материи. Э. не возникает из ничего и не исчезает, она может только переходить из одной формы в другую (см. Энергии сохранения закон). Понятие Э. связывает воедино все явления природы.
В соответствии с разл. формами движения материи рассматривают разные формы Э.: механич., внутр., эл.-магн., хим., ядерную и др. Это деление до известной степени условно. Так, хим. Э. складывается из кинетич. Э. движения эл-нов и электрич. Э. вз-ствия эл-нов друг с другом и с ат. ядрами. Внутр. Э. равна сумме кинетич. Э. хаотич. движения молекул относительно центра масс тел и потенц. Э. вз-ствия молекул друг с другом. Э. системы однозначно зависит от параметров, характеризующих состояние системы. В случае непрерывной среды или поля вводятся понятия плотности Э., т. е. Э. в ед. объёма, и плотности потока Э., равной произведению плотности Э. на скорость её перемещения.
Относительности теория показала, что Э. тела неразрывно связана с его массой т соотношением ξ= mc2. Любое тело обладает Э.; если масса покоящегося тела m0, то его Э. покоя ξ0=m0c2', эта Э, может переходить в др. виды Э. при превращениях частиц (распадах, яд. реакциях и т. п.).
Согласно классич. физике, Э. любой системы меняется непрерывно и может принимать любые значения. Квант. теория утверждает, что Э. микрочастиц, движение к-рых происходит в огранич. объёме пр-ва (напр., эл-нов в атоме), принимает дискр. ряд значений. Так, атомы испускают эл.-магн. Э. в виде дискр. порций — световых квантов, или фотонов.
Э. измеряется в тех же ед., что и работа: в системе СГС — в эргах, в СИ — в джоулях; в ат. и яд. физике и физике элем. ч-ц обычно применяется внесистемная ед.— электрон-вольт.
• См. лит. при ст. Энергии сохранения закон.
Г. Я. Мякишев.
ЭНЕРГИЯ ИОНИЗАЦИИ, равна работе, затрачиваемой на удаление одного внеш. эл-на из атома (на ионизацию атома), находящегося в осн. энергетич. состоянии. Численно равна ионизационному потенциалу.
ЭНЕРГИЯ ПОКОЯ частицы (тела), энергия ч-цы в системе отсчёта, в к-рой она покоится: ξ0=m0c2, где m0 — масса покоя ч-цы.
ЭНЕРГИЯ СВЯЗИ, энергия связ. системы к.-л. ч-ц (напр., атома как системы из ядра и эл-нов), равная работе, к-рую необходимо затратить, чтобы разделить эту систему на составляющие её ч-цы и удалить их друг от друга на такое расстояние, на к-ром их вз-ствием можно пренебречь. Э. с. определяется вз-ствием ч-ц и явл. отрицат. величиной, т. к. при образовании связ. системы энергия выделяется. Абс. величина Э. с. характеризует прочность связи и устойчивость системы. Напр., для ат. ядра Э. с. определяется сильным взаимодействием нуклонов в ядре и, согласно соотношению Эйнштейна, пропорц. дефекту масс m:ξ=mc2. Для наиб. устойчивых ядер Э. с. составляет ок. 8•106 эВ/нуклон (удельная Э. с.). Эта энергия может выделиться при слиянии лёгких ядер в более тяжёлое ядро (см. Термоядерные реакции), a также при спонтанном делении тяжёлых ядер, объясняемом уменьшением уд. Э. с. с ростом ат. номера (см. Радиоактивность). Э. с. эл-нов в атоме или молекуле определяется электромагнитными взаимодействиями и для каждого эл-на пропорц. ионизац. потенциалу; напр., для атома Н в осн. состоянии она равна 13,6 эВ. Этим же вз-ствием обусловлена Э. с. атомов в молекуле и кристалле (см. Межатомное взаимодействие). Э. с., обусловленная гравитационным взаимодействием, обычно мала и имеет значение лишь для нек-рых косм. объектов (см., напр., Чёрная дыра).
ЭНЕРГИЯ ХИМИЧЕСКОЙ СВЯЗИ, для двухат. молекул — энергия удаления атомов на бесконечно большое расстояние друг от друга; для многоат. молекул, радикалов, ионов — энергия диссоциации. Суммарная энергия удаления всех атомов многоат. молекулы друг от друга на бесконечно большое расстояние, наз. энергией образования молекулы, равна приближённо сумме Э. х. с. Энергию образования молекулы обычно разбивают на вклады Э. х. с., оценивая их с помощью различных аддитивных схем. Экспериментально измеряют либо энергию образования молекул, сжигая соединения в калориметрич. бомбах, либо определяют энергию диссоциации молекул с помощью электронного удара и др. методов. Теор. расчёт Э. х. с.— одна из осн. задач квантовой химии.
ЭНТАЛЬПИЯ (от греч. enthalpo — нагреваю) (теплосодержание, тепловая функция Гиббса), потенциал термодинамический, характеризующий состояние макроскопич. системы в термодинамич. равновесии при выборе в кач-ве основных независимых переменных энтропии S и давления р. Обозначается H(S, p, N, хi), где N — число ч-ц системы, xi — др. макроскопич. параметры системы. Э.— аддитивная ф-ция (т. е. Э. всей системы равна сумме Э. составляющих её частей), с внутренней энергией U системы Э. связана соотношением:
H=U+pV, (1)
где V — объём системы. Полный дифференциал Э. (при неизменных N и xi) имеет вид:
dH = TdS + Vdp. (2)
Из ф-лы (2) можно определить темп-ру Т и объём V системы: Т=(дН/дS)р, V=(дН/др)S. При пост. давлении теплоёмкость системы ср= (дН!дТ)р. Эти св-ва Э. при пост. р аналогичны св-вам внутр. энергии при пост. V:
T=(дU/дS)v, р=-(дU/дV)S, cV =(дU/дT)V.
Равновесному состоянию системы при пост. S и p соответствует мин. значение Э. Изменение Э. (ЛЯ) равно кол-ву теплоты, к-рое сообщают системе или отводят от неё при пост. давлении, поэтому значения H характеризуют тепловые эффекты фазовых переходов (плавления, кипения и т. д.), хим. реакций и др. процессов, протекающих при пост. давлении. При тепловой изоляции тел (и пост. р) Э. сохраняется, поэтому её называют иногда теплосодержанием или тепловой ф-цией. Условие сохранения Э. лежит, в частности, в основе теории Джоуля — Томсона эффекта, нашедшего важное практич. применение при сжижении газов. Термин Э. был предложен голл. физиком X. Камерлинг-Оннесом.
Д. Н. Зубарев.
ЭНТРОПИЯ (от греч. entropia — поворот, превращение), понятие, впервые введённое в термодинамике для определения меры необратимого рас-
903
сеяния энергии. Э. широко применяется и в др. областях науки: в статистической физике как мера вероятности осуществления к.-л. макроскопич. состояния; в теории информации как мера неопределённости к.-л. опыта (испытания), к-рый может иметь разные исходы. Эти трактовки Э. имеют глубокую внутр. связь. Напр., на основе представлений об информац. Э. можно вывести все важнейшие положения статистич. физики.
В термодинамике понятие «Э.» было введено нем. физиком Р. Клаузиусом (1865), к-рый показал, что процесс превращения теплоты в работу подчиняется определ. физ. закономерности — второму началу термодинамики, к-рое можно сформулировать строго математически, если ввести особую ф-цию состояния —Э. Так, для термодинамич. системы, совершающей квазистатически (бесконечно медленно) циклич. процесс, в к-ром система последовательно получает малые кол-ва теплоты Q при соответствующих значениях абс. темп-ры Т, интеграл от «приведённого» кол-ва теплоты Q/T
по всему циклу равен нулю
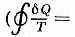
=0 — т. н. равенство Клаузиуса). Это равенство, эквивалентное второму началу термодинамики для равновесных процессов, Клаузиус получил, рассматривая произвольный циклич. процесс как сумму очень большого (в пределе бесконечно большого) числа элементарных Карно циклов. Математически равенство Клаузиуса необходимо и достаточно для того, чтобы выражение
dS=Q/T (1)
представляло собой полный дифференциал ф-ции состояния S, назв. «Э.» (дифф. определение Э.). Разность Э. системы в двух произвольных состояниях А и В (заданных, напр., значениями темп-р и объёмов) равна:SB-SA=∫BAQ/T (2)
(интегр. определение Э.). Интегрирование здесь ведётся вдоль пути любого квазистатич. процесса, связывающего состояния А и В, при этом, согласно равенству Клаузиуса, приращение Э. S=SB-SA не зависит от пути интегрирования. Т. о., из второго начала термодинамики следует, что существует однозначная ф-ция состояния S, к-рая при квазистатич. адиабатич. процессах (Q=0) остаётся постоянной. Процессы, в к-рых Э. остаётся постоянной, наз. изоэнтропийными. Примером может служить процесс, широко используемый для получения низких темп-р,— адиабатич. размагничивание (см. Магнитное охлаждение). При изотермич. процессах изменение Э. равно отношению сообщённой системе теплоты к абс. темп-
ре. Напр., изменение Э. при испарении жидкости равно отношению теплоты испарения к темп-ре испарения при условии равновесия жидкости с её насыщ. паром.
Согласно первому началу термодинамики, Q=dU+pdV, т. е. сообщаемое системе кол-во теплоты равно сумме приращения внутренней энергии dU и совершаемой системой элем. работы pdV, где р — давление, V -объём системы. С учётом первого начала термодинамики дифф. определение Э. принимает вид:
dS =1/T(dU+pdV), (3)
откуда следует, что Э. представляет собой потенциал термодинамический при выборе в кач-ве независимых переменных внутр. энергии U и объёма V. Частные производные Э. связаны с Т и р соотношениями:
1/T=(дS/дU (4) и p/T-=(дS/дV)U (5) к-рые определяют уравнения состояния системы (первое — калорическое, второе — термическое). Ур-ние (4) лежит в основе определения абсолютной температуры (см. также Температура, Температурные шкалы).
Ф-ла (2) определяет Э. лишь с точностью до аддитивной постоянной (т. е. оставляет начало отсчёта Э. произвольным). Абс. значение Э. можно установить с помощью третьего начала термодинамики, основываясь на к-ром, за нач. точку отсчёта Э. принимают S0=0 при Т=0.
Важность понятия Э. для анализа необратимых (неравновесных) процессов также была показана впервые Клаузиусом. Для необратимых процессов интеграл от приведённой теплоты Q/T по замкнутому пути всегда отрицателен
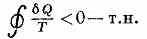
Клаузиуса неравенство. Это неравенство — следствие теоремы Карно: кпд частично или полностью необратимого циклич. процесса всегда меньше, чем кпд обратимого цикла. Из неравенства Клаузиуса вытекает, что
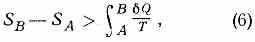
поэтому Э. адиабатически изолированной системы при необратимых процессах может только возрастать.
Т. о., О. определяет хар-р процессов в адиабатич. условиях: возможны только такие процессы, при к-рых Э. либо остаётся неизменной (обратимые процессы), либо возрастает (необратимые процессы). При этом не обязательно, чтобы возрастала Э. каждого из тел, участвующих в процессе. Увеличивается общая сумма Э. тел, в к-рых процесс вызвал изменения.
Термодинамич. равновесию адиабатич. системы соответствует состояние с максимумом Э. Энтропия может иметь не один, а неск. максимумов, при этом система будет иметь неск. состояний равновесия. Равновесие,
к-рому соответствует наибольший максимум Э., наз. абсолютно устойчивым (стабильным). Из условия максимальности Э. адиабатич. системы в состоянии равновесия вытекает важное следствие: темп-ра всех частей системы в состоянии равновесия одинакова.
Понятие Э. применимо и к термодинамически неравновесным состояниям, если отклонения от термодинамики равновесия невелики и можно ввести представление о локальном термодинамическом равновесии в малых, но ещё макроскопич. объёмах. В целом Э. неравновесной системы равна сумме Э. её частей, находящихся в локальном равновесии.
Термодинамика неравновесных процессов позволяет более детально исследовать процесс возрастания Э. и вычислить кол-во Э., образующейся в ед. объёма в ед. времени вследствие отклонения от термодинамич. равновесия,— производство энтропии.
Статистич. физика связывает Э. с вероятностью осуществления данного макроскопич. состояния системы. Э. определяется через логарифм статистического веса данного равновесного состояния:
S=kln(ξ, N), (7)
где (ξ, N)—число квантовомеханич. уровней в узком интервале энергии ξ вблизи значения энергии £ системы из N ч-ц, в классич. статистич. физике — величина объёма в фазовом пространстве системы при заданных ξ и N. Впервые связь Э. с вероятностью состояния системы была установлена австр. физиком Л. Больцманом в 1872: возрастание Э. системы обусловлено её переходом из менее вероятного состояния в более вероятное. Иными словами, эволюция замкнутой системы осуществляется в направлении наиболее вероятного распределения энергии по отд. подсистемам.
В отличие от термодинамики, статистич. физика рассматривает особый класс процессов — флуктуации, при к-рых система переходит из более вероятного состояния в менее вероятное, и её Э. уменьшается. Наличие флуктуации показывает, что закон возрастания Э. выполняется только в ср. для большого промежутка времени.
Э. в статистич. физике тесно связана с информац. Э., к-рая служит мерой неопределённости сообщений (сообщения описываются множеством величин x1, х2, . . ., хn и вероятностей Р1, Р2,. . .,Рn появления этих величин в сообщении). Для определённого (дискретного) статистич. распределения вероятностей Рk информац. Э. называют величину
Hи=-nk=1РkInPk при nk=1Pk=1.(8)
Ни=0, если к.-л. из Рk равно 1, а ост.— нулю, т. е. информация достоверна, неопределённость отсутствует. Э. принимает наибольшее значение, когда все Pk одинаковы (неопределённость в информации максимальна). Информац.
904
Э., как и термодинамическая, обладает св-вом аддитивности (Э. неск. сообщений равна сумме Э. отд. сообщений). Из вероятностной трактовки информац. Э. могут быть выведены осн. распределения статистич. физики: каноническое Гиббса распределение, к-рое соответствует макс. значению информац. Э. при заданной ср. энергии, и большое канонич. распределение Гиббса — при заданных ср. энергии и числе ч-ц в системе.
• См. лит. при ст. Термодинамика.
Д. Н. Зубарев.
ЭПИДИАСКОП (от греч. epi — на, dia — через и skopeo — смотрю) (эпидиапроектор), комбинированный проекционный аппарат, позволяющий получать на экране изображения как прозрачных, так и непрозрачных оригиналов. Совмещает в себе эпипроектор и диапроектор. Оптич. схема простейшего эпидиаскопа в двух режимах его работы представлена на рисунке: а) эпископическая проекция,
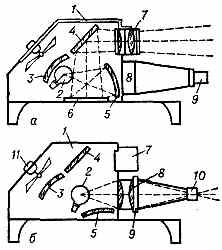
Оптич. схема эпидиаскопа.
б) диаскопическая проекция. В первом случае лучи от источника света 2 с помощью сферических зеркал 3 и 5 освещают непрозрачный объект 6, от которого диффузно рассеянные лучи попадают в светосильный проекц. объектив 7, отражаясь от зеркала 4; 1 — кожух, 11 — система охлаждения. При диаскопич. проекции зеркало 5 отклоняется, открывая доступ лучам от источника 2 в конденсор 8. Последний, равномерно освещая диапозитив, вставленный в рамку 9, направляет лучи в объектив 10, проецирующий изображение на экран.
• См. лит. при ст. Проекционный аппарат.
