Методические рекомендации по выполнению лабораторного и научно-исследовательского практикума для студентов всех форм обучения специальностей 240901 «Биотехнология» и260204 «Технология бродильных производств и виноделие»
| Вид материала | Методические рекомендации |
- «Технология бродильных производств и виноделие», 1195.96kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 981.77kb.
- Методические рекомендации по выполнению самостоятельной работы и изучению дисциплин, 855.43kb.
- Методические рекомендации по выполнению самостоятельной работы и изучению дисциплины, 846.76kb.
- Учебное пособие по дисциплине для студентов специальности 270500 «Технология бродильных, 1164.77kb.
- Учебно-методический комплекс для студентов дневной и заочной формы обучения по специальности, 1588.96kb.
- Методические рекомендации к лабораторным работам по курсу «Основы проектирования, 616.07kb.
- Учебное пособие по дисциплине для студентов специальностей 270500 «Технология бродильных, 2133.55kb.
- Методические рекомендации по выполнению лабораторных работ для студентов специальностей, 200.14kb.
- Методические указания, 361.46kb.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение
высшего профессионального образования
«Алтайский государственный технический университет
имени И.И. Ползунова»
Бийский технологический институт (филиал)
М.Э. Ламберова, Ю.А. Кошелев, Т.И. Войнаровская
ОЦЕНКА ЭФФЕКТИВНОСТИ КУЛЬТИВИРОВАНИЯ
ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE
Методические рекомендации по выполнению лабораторного
и научно-исследовательского практикума для студентов всех форм
обучения специальностей 240901 «Биотехнология»
и 260204 «Технология бродильных производств и виноделие»
Бийск 2007
УДК 576.8.(075.8)
Ламберова, М.Э. Оценка эффективности культивирования дрожжей Saccharomyces cerevisiae: методические рекомендации по выполнению лабораторного и научно-исследовательского практикума для студентов всех форм обучения специальностей 240901 «Биотехнология» и 260204 «Технология бродильных производств и виноделие» / М.Э. Ламберова, Ю.А. Кошелев, Т.И. Войнаровская.
Алт. гос. тех. ун-т, БТИ. Бийск.
Изд-во Алт. гос. тех. ун-та, 2007. 69 с.
Настоящие методические рекомендации содержат общие сведения о классификации, морфологических, физиологических свойствах дрожжей; методики проведения аэробного и анаэробного культивирования дрожжей Saccharomyces cerevisiae на синтетической питательной среде, содержащей минеральные соли и сахарозу; методики приготовления реактивов и проведения анализа сахаров и этилового спирта в питательной среде и культуральной жидкости. Приведены методы подбора оптимальных условий оживления и культивирования, подсчета числа жизнеспособных клеток дрожжей и посторонней микрофлоры в исходных дрожжах и в конечной суспензии, оценки стерильности и состава питательной среды и эффективности аэробного и анаэробного культивирования в соответствии с производственными нормативными документами.
Рассмотрены и утверждены на
заседании кафедры «Биотехнология».
Протокол № 81 от 16 ноября 2006 г.
Рецензент: к.т.н. зав. кафедрой перерабатывающей
промышленности лицея 22 Е.Н. Широкова (г. Бийск)
Ламберова М.Э., Кошелев Ю.А., Войнаровская Т.И., 2007
БТИ АлтГТУ, 2007
Введение
Дрожжи различных таксономических групп играют положительную и отрицательную роль в подавляющем числе пищевых и бродильных производств. Особенно широкое применение имеют хлебопекарные дрожжи Saccharomyces cerevisiae.
Лабораторный и научно-исследовательский практикумы по специальности 240901 «Биотехнология» по курсам: общая биология и микробиология; особенности микроорганизмов в производственных процессах; биохимия; химия и технология пищевых производств; теоретические основы биотехнологии; общая биотехнология; технология продуктов брожения, а также по специальности 260204 «Технология бродильных производств и виноделие» по курсам: микробиология; биохимия; пищевая химия; введение в технологию пищевых производств; особенности микроорганизмов в производственных процессах; общая технология отрасли; технология органических кислот; технология дрожжей; технология отрасли (спирт, пиво, вино) и другим предполагают реактивацию и культивирование дрожжей в аэробных и анаэробных условиях на питательных средах с углеводами и оценку эффективности прироста дрожжевой биомассы и продуктов жизнедеятельности дрожжей, имеющих практическую значимость (этиловый спирт, органические кислоты, углекислый газ и др.), оценку качества посевного материала дрожжей, его специфическую стерильность, количественный подсчет клеток дрожжей и посторонней микрофлоры на поверхности агаризованной питательной среды, определение в питательной среде содержания сахарозы, этанола и углекислого газа, а также характеристику эргостерина, биосинтез его в клетке продуцентов, промышленный и лабораторный методы получения эргостерина из биомассы дрожжей.
В данных методических рекомендациях суммированы все необходимые методики и приведен алгоритм действий, предусмотренных производственной нормативной документацией.
1 ПРАКТИЧЕСКАЯ ЧАСТЬ
1.1 Задание
Культивирование дрожжей Saccharomyces cerevisiae провести в аэробных и анаэробных условиях на питательной среде: сахароза + минеральные соли.
В результате определить следующие показатели:
- убыль субстрата сахарозы из питательной среды в результате их утилизации дрожжами;
- прирост биомассы дрожжей;
- количество выделившегося этанола в питательной среде;
- количество выделившегося углекислого газа;
- эффективность образования биомассы по субстрату;
- эффективность образования этанола по субстрату;
- эффективность образования углекислого газа по субстрату;
- наличие эргостерина в биомассе дрожжей.
1.2 Оценка жизнеспособных клеток дрожжей в сравнении
с количеством посторонней микрофлоры
Перед началом эксперимента необходимо проверить жизнеспособность и чистоту культуры дрожжей.
1.2.1 Приготовление агара питательного
3,8 г готового сухого препарата агара питательного размешиваем в 100 мл дистиллированной воды и нагреваем до полного растворения агара на водяной бане. Фильтруем в колбу на 250 мл, закрываем ватно-марлевой пробкой и бумажным колпачком, стерилизуем автоклавированием в течение 20 минут при температуре 120 С. Среду охлаждаем до температуры 4550 С и разливаем, помещаем в термостат на 48 часов при температуре 37 С для проверки стерильности.
1.2.2 Приготовление стерильных разведений клеточной
суспензии
Берем 0,1 г сухих дрожжей и заливаем 2 мл стерильной дистиллированной воды и выдерживаем 1 час при комнатной температуре.
В другом случае берем 1 г прессованных хлебопекарных дрожжей 75%-ной влажности, добавляем 5 мл стерильной дистиллированной воды. Затем (в любом из двух случаев) стерильной пипеткой отбираем 1 мл дрожжевой суспензии, переносим в пробирку, куда доливаем 9 мл стерильной воды. Тщательно перемешиваем содержимое пробирки продуванием воздуха через пипетку. Отбираем из этой пробирки 1 мл суспензии и переносим в пустую стерильную чашку Петри. Еще 1 мл из этой же пробирки переносим в следующую пробирку с 9 мл стерильной воды и т.д. Таким образом засеваем три чашки Петри, получая разведения анализируемой суспензии дрожжей в соотношениях: 1:10; 1:100; 1:1000. Помещаем чашки вверх дном в термостат при 37 С на 48 часов и проводим подсчет выросших колоний, описываем их цвет, форму, профиль, размеры и микроскопируем.
Проводим микроскопирование каждого вида выросших колоний. Для этого готовим мазки, взяв 23 изолированные колонии каждого вида, вносим на обезжиренное этиловым спиртом предметное стекло в каплю дистиллированной воды, подсушиваем, фиксируем их в пламени спиртовки и окрашиваем по Граму:
- на фиксируемый мазок накладываем фильтровальную бумагу, пропитанную карболовым раствором генциана фиолетового, и выдерживаем 23 минуты;
- не промывая водой, на мазок наносим на 23 минуты раствор Люголя;
- последний, также не промывая водой, сливаем, мазок обрабатываем 96%-ным этиловым спиртом в течение 3040 секунд;
- хорошо промываем дистиллированной водой;
- дополнительно окрашиваем раствором фуксина (4050 секунд);
- промываем водой, высушиваем, микроскопируем под иммерсией, зарисовывая и описывая результаты.
Число жизнеспособных клеток дрожжей считаем по формуле:
Х = N/P, (1)
где N число колоний дрожжей, шт.;
Р выбранное разведение.
Отношение количества клеток посторонней микрофлоры к числу жизнеспособных клеток дрожжей вычисляем по формуле:
Y=X'/X100%, (2)
где Х' число клеток посторонней микрофлоры (определяется аналогично Х).
Процент содержания посторонней микрофлоры не должен превышать 10 %, тогда посевной материал можно использовать в дальнейшем процессе.
Если результаты сравнительного подсчета посторонней микрофлоры по отношению к жизнеспособным клеткам дрожжей в посевном материале неудовлетворительные, проводим его дополнительную обработку. Для этого берем 0,1 г сухих дрожжей (или 1 г прессованных дрожжей 75%-ной влажности), заливаем 5 мл стерильной дистиллированной воды и выдерживаем при комнатной температуре в течение 1 ч. Затем подкисляем суспензию серной кислотой до рН = 2,0, выдерживаем в течение 10 мин и устанавливаем рН = 4,0. Делаем три разведения (1:10, 1:100 и 1:1000), засеваем в три чашки Петри с агаром питательным, которые ставим вверх дном в термостат на 48 часов при температуре 37 С. Затем подсчитываем, описываем и микроскопируем выросшие колонии (см. раздел 2).
1.2.3 Приготовление питательной среды
Солевой состав:
K2HРО4·3Н2О 0,06550 г;
NH4Cl 0,10000 г;
MgSO4·7H2O 0,02000 г;
FeSO4·7H2O 0,00100 г;
СаСl2 0,00075 г;
Вода дистиллированная 100 мл;
Сахароза 5 г.
В колбу на 250 мл вносим навески всех солей и 50 мл дистиллированной воды, закрываем ватно-марлевой пробкой и бумажным колпачком и автоклавируем при температуре 120 С в течение 20 минут.
В другую колбу на 100 мл вносим навеску сахарозы 5 г и 50 мл дистиллированной воды. Закрываем колбу ватно-марлевой пробкой и бумажным колпачком и автоклавируем при температуре 112 С в течение 20 минут. Затем оба раствора выдерживаем 48 часов в термостате для проверки стерильности, затем стерильно сливаем вместе перед спиртовкой и снова выдерживаем 48 часов в термостате для проверки стерильности готовой жидкой синтетической питательной среды с целью культивирования дрожжей в аэробных или анаэробных условиях.
1.3 Количественное определение сахаров в питательной среде после автоклавирования и культивирования
1.3.1 Приготовление растворов для анализа
1. Раствор сернокислой меди (СuSО4·5H2O) 8%-ный. После приготовления раствор фильтруем.
2. Щелочной раствор сегнетовой соли (С4Н4О6КNa·5Н2О). Едкого натра NaOH 15 г растворяем в мерной колбе на 50 мл дистиллированной водой, все время смешивая до полного растворения, сюда же добавляем 20 г сегнетовой соли, смешиваем до растворения и добавляем воду до метки. Фильтруем в склянку из темного стекла. Храним раствор в темноте.
3. Фелингова жидкость является смесью равных объемов растворов 1 и 2. Готовим непосредственно перед использованием.
4. Раствор марганцевокислого калия. 5 г КМnО4 растворяем в одном литре кипяченой дистиллированной воды, фильтруем в склянку из темного стекла. Через пять дней устанавливаем титр раствора.
Для этого в стеклянном бюксе высушиваем в сушильном шкафу при температуре 120 С щавелевокислый натрий в течение 2 часов. После остывания бюкса из него в химические стаканы или колбы для титрования берем три навески щавелевокислого натрия по 0,200,25 г, приливаем туда же по 50 мл дистиллированной воды и 12 мл конценитрированной Н2SO4. Смесь нагреваем до 70 С, и горячую смесь титруем из бюретки 0,5%-ным раствором КМnО4 до слабо-розового окрашивания. Количество миллилитров, соответствующее 1 мл КМnО4, вычисляем по формуле:
C = B·K/M, (3)
где В навеска щавелевокислого натрия, мг;
М количество раствора КМnО4, пошедшего на титрование, мл;
К коэффициент пересчета (К=0,9483).
Подставив полученные при титровании данные, находим С, затем вычисляем Сср.
0,5%-ный раствор КМnО4 перед титрованием пробы питательной среды разводим в пять раз и получаем 0,1%-ный раствор.
5. Раствор сернокислого окисного железа. 5 г сернокислой окисной соли железа Fe2(SO4)3 растворяем в мерной колбе на 100 мл дистиллированной водой, сюда же добавляем 11 мл концентрированной Н2SО4 (1,84 г/см3). Раствор не должен обладать восстанавливающими свойствами, поэтому к нему по каплям добавляем раствор КМnО4 до появления чуть слабо-розового оттенка. Затем объем раствора доводим до метки.
1.3.2 Ход анализа
В центифужные пробирки вносим по 4 мл питательной среды. Добавляем 4 мл жидкости Фелинга и содержимое перемешиваем. Жидкость должна быть голубой. Если ее цвет стал бурым, это означает, что не хватило жидкости Фелинга и нужно взять меньше питательной среды. Пробирки ставим на 10 мин на кипящую водяную баню до выпадения красно-бурого осадка закиси меди. Затем пробирки охлаждаем в воде, содержимое их центрифугируем при 2000 об/мин в течение пяти минут. Надосадочную жидкость декантируем и край пробирки подсушиваем фильтровальной бумагой. Следить, чтобы осадок не сливался!
Сразу после сливания жидкости к осадку добавляем 2 мл горячей дистиллированной воды, осадок встряхиваем, постукивая пальцами по дну пробирки. Затем приливаем 57 мл горячей воды, обмывая ею стенки пробирки, и снова центифугируем, а затем сливаем жидкость. Промывание водой производим 34 раза. После промывания осадка в пробирке немедленно приливают 2 мл горячей дистиллированной воды. К взмученному палочкой осадку приливают 3 мл раствора сернокислого оксида железа, продолжая помешивать палочкой до полного растворения осадка закиси меди (палочку оставляем в пробирке).
В результате раствор в пробирке становится зеленоватым. Не вынимая палочки, раствор титруем до бледно-розового окрашивания, не исчезающего в течение 1 минуты, 0,1%-ным раствором КМnО4, который готовим из 0,5%-ного раствора перед титрованием. Параллельно ставим контроль. Для этого вместо питательной среды берем 4 мл дистиллированной воды. Ход дальнейшей работы тот же, что и с питательной средой. Содержание общего количества сахаров (в процентах) рассчитываем по следующей формуле:
S = (a – b)·(c/5) V 100/(KBV1), (4)
где а количество раствора КМnО4, пошедшего на титрование питательной среды, мл;
b количество раствора КМnО4, пошедшего на титрование контрольной пробы, мл;
с/5=10; 13/5=2,026 (определение описано выше);
К коэффициент пересчета, равный 1,9;
В масса сахарозы, мг;
V общий объем питательной среды, мл;
V1 объем среды, взятый на анализ, мл;
100 коэффициент для пересчета в проценты.
1.4 Культивирование дрожжей в аэробных условиях
1.4.1 Подготовка посевного материала дрожжей
В пробирку помещаем 0,5 г сухих дрожжей, туда же заливаем
5 мл стерильной дистиллированной воды, оставляем на 1 час при комнатной температуре (или 5 г прессованных дрожжей заливаем 5 мл стерильной дистиллированной воды), затем подкисляем концентрированной серной кислотой до рН = 2,0 и выдерживаем 10 минут; после этого доводим рН до 4,0, добавив несколько капель раствора NаОН. Центрифугируем суспензию дрожжей при 2000 об/мин в течение
10 минут. Взвешиваем осадок, который представляет собой оживленные дрожжи.
1.4.2 Посев клеток на проверенную стерильную
питательную среду
В стерильных условиях помещаем подготовленный посевной материал дрожжей (инокулят) в проверенную в термостате жидкую питательную среду, колбу закрываем ватно-марлевой пробкой и закрепляем на термостатированной качалке, установив следующий режим: cкорость 130 об/мин, амплитуда 2, температура 37 С. Ежедневно колбу взвешиваем. Результаты взвешивания записываем. Культивирование прекращают, когда вес колбы стабилизируется и перестанет меняться.
1.4.3 Оценка прироста биомассы дрожжей
Культуральную жидкость разделяем на центрифуге (10 минут, 2000 об/мин) на жидкую часть и осадок биомассы дрожжей, который затем взвешиваем. По разнице начальной и конечной массы дрожжей 100%-ной влажности (если исходная влажность дрожжей отличалась от 100 %, предварительно сделать пересчет массы) определяем прирост биомассы дрожжей в процессе их аэробного культивирования (X).
1.4.4 Определение убыли сахаров в питательной среде
Содержание сахаров в культуральной жидкости определяем по методике, описанной ранее (см. п. 1.3). Затем убыль сахаров находим по разнице между начальной и конечной величиной (S).
1.4.5 Определение экономического коэффициента
по приросту биомассы дрожжей
Расчет экономического коэффициента по приросту биомассы дрожжей провести по формуле:
YX/S = X/S, (5)
где X – прирост биомассы дрожжей после культивирования, г;
S – убыль сахаров в культуральной жидкости в результате культивирования дрожжей, г.
1.5 Культивирование дрожжей в анаэробных условиях
1.5.1 Подготовка посевного материала
Подготовка посевного материала дрожжей осуществляется по 1.4.1.
1.5.2 Посев клеток на проверенную среду
В колбу помещаем дрожжи, закрываем герметично корковой пробкой, в центр которой с помощью иголки для шприца вставлена пластиковая трубочка, другой конец последней опускаем в стакан, куда через трубочку выходит образующийся СО2. Заполненную установку ставим в термостат с температурой 37 С. Ежедневно колба взвешивается до тех пор, пока вес не перестанет меняться.
Затем проводим оценку прироста биомассы дрожжей по 1.4.3 и убыль сахаров в культуральной жидкости по 1.4.4 и рассчитываем экономический коэффициент YX/S по 1.4.5.
1.5.3 Определение количества выделившегося СО2
Диоксид углерода, образующийся при брожении, определяем по разности масс колбы до брожения и после него с учетом прибыли биомассы и убыли сахаров.
1.5.4 Качественное определение образовавшегося спирта
Установка для перегонки спирта приведена на рисунке 1.
В колбу 3 наливаем 6070 мл культуральной жидкости. Перегоняем две трети содержимого колбы в приемник.
Качественное определение спирта основано на окислении этанола до уксусной кислоты и воды смесью бихромата калия с серной кислотой:
3СН3СН2ОН+2К2Сr2О7+8Н2SO4=3СН3СООН+2Сr(SO4)2+Н2SО4+11Н2О.
Отбираем 510 мл перегнанной жидкости, капаем несколько капель концентрированной Н2SО4 и помещаем туда же несколько кристаллов бихромата калия. Смесь ставим на плитку, нагреваем.
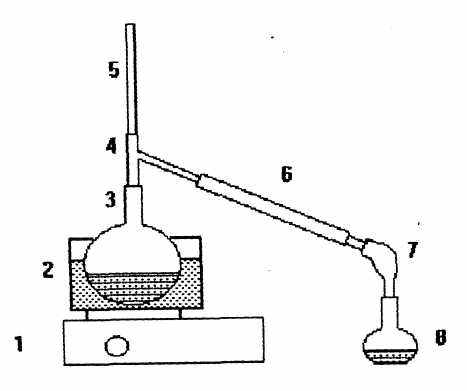
1 плитка; 2 водяная баня; 3 круглодонная колба;
4 насадка Вюрца; 5 термометр; 6 холодильник Либиха;
7 алонж; 8 приемник
Рисунок 1 Установка для перегонки спирта
Через некоторое время смесь меняет цвет с желто-коричневого на зеленый и ощущается запах яблочного уксуса. Это указывает на наличие спирта. Весовым или массовым способом определяем количество образовавшегося этанола (Р).
1.5.5 Определение экономического коэффициента
образования этанола
Расчет экономических коэффициентов образования этанола провести по формулам:
YР/S = Р/S, (6)
где Р – прирост этанола после анаэробного культивирования, г;
S – убыль сахаров в культуральной жидкости в результате анаэробного культивирования дрожжей, г;
YР/Х = Р/Х, (7)
где Р – прирост этанола после анаэробного культивирования, г;
Х – прирост биомассы дрожжей в результате анаэробного культивирования, г.
Аналогично рассчитывают экономические коэффициенты по образовавшемуся углекислому газу.
1.6 Получение эргостерина из биомассы дрожжей
1.6.1 Характеристика эргостерина
Эргостерин [ мол. масса 396,66].
Эргостерин является провитамином витамина D.
1.6.2 Лабораторное получение эргостерина
1.6.2.1 Сырье и материалы
Дрожжи 20 г;
Едкий калий 3 г;
Спирт этиловый 33 мл;
1.6.2.2 Ход работы
В колбу, вместимостью 250 мл, загрузить 10 г дрожжей, 1,5 г едкого калия, 15 мл спирта.
Смесь постоянно перемешивать в течение 6 часов при температуре 7884 С на термостатированной качалке с водяной баней. После этого смесь отфильтровать. Далее этот концентрат упарить до содержания сухих веществ 3639 %.
Во время упаривания из-за содержания большого количества белка концентрат вспенивается. Пену убирать путем прекращения на несколько секунд подачи воздуха в аппарат. Эту операцию повторять многократно в течение примерно 78 часов. После того как белок гидролизовался, пена в растворе исчезает. Дальше упаривание продолжать в течение пяти часов до густого, тягучего состояния, содержание сухих веществ в котором примерно 3639 %. Цвет концентрата после упаривания темно-коричневый.
После упаривания практически твердый концентрат растворить в 10 мл этилового спирта и выдержать в термостатированной качалке при 78 С до получения однородного коричневого раствора. Затем колбу охладить и поставить в холодильник при 0 С до выпадения кристаллов эргостерина. Выпавшие кристаллы отфильтровать на фильтре Шота. Провести очистку кристаллов путем перекристаллизации последовательным промыванием 70%-ным этиловым спиртом, смесью спирта с бензолом (80:20) и повторной перекристаллизацией. Полученные кристаллы эргостерина высушить и измерить температуру плавления.
