Методические рекомендации по выполнению лабораторного и научно-исследовательского практикума для студентов всех форм обучения специальностей 240901 «Биотехнология» и260204 «Технология бродильных производств и виноделие»
| Вид материала | Методические рекомендации |
- «Технология бродильных производств и виноделие», 1195.96kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 981.77kb.
- Методические рекомендации по выполнению самостоятельной работы и изучению дисциплин, 855.43kb.
- Методические рекомендации по выполнению самостоятельной работы и изучению дисциплины, 846.76kb.
- Учебное пособие по дисциплине для студентов специальности 270500 «Технология бродильных, 1164.77kb.
- Учебно-методический комплекс для студентов дневной и заочной формы обучения по специальности, 1588.96kb.
- Методические рекомендации к лабораторным работам по курсу «Основы проектирования, 616.07kb.
- Учебное пособие по дисциплине для студентов специальностей 270500 «Технология бродильных, 2133.55kb.
- Методические рекомендации по выполнению лабораторных работ для студентов специальностей, 200.14kb.
- Методические указания, 361.46kb.
3.6 Дрожжи как источник белка
Биомасса дрожжей в современной биотехнологии считается источником белка, сбалансированного по незаменимым аминокислотам. Использование микробной биомассы для обогащения кормов белком и незаменимыми аминокислотами в условиях интенсивного животноводства одна из важных проблем будущего, так как человечество развивается таким образом, что оно вряд ли сможет обеспечить себя пищей традиционными методами. Выращивание микроорганизмов не зависит от климатических и погодных условий, не требует посевных площадей, поддается автоматизации. Дрожжи одна из наиболее перспективных групп микроорганизмов для получения белковых кормовых добавок. Содержание белка в клетках некоторых штаммов дрожжей составляет от половины до 2/3 сухой массы, на долю незаменимых аминокислот приходится до 10 % (в белках сои, богатых лизином, его содержится приблизительно 6 %).
Впервые дрожжи стали рассматривать как источник питания в годы первой мировой войны в Германии, где их использовали в качестве добавки при изготовлении колбас. В первой половине XX века возникла новая отрасль промышленности производство белка одноклеточных организмов. В нашей стране производство кормовых дрожжей было начато в 1930-х гг. Отходы сельского хозяйства, такие как солома, кукурузные кочерыжки, опилки, подвергали гидролизу серной кислотой, полученные гидролизаты нейтрализовали и использовали для выращивания дрожжей. Наиболее привлекательным в этом производстве является использование возобновляемого сырья, особенно древесины, запасы которой в нашей стране пока достаточно велики. В большинстве этих отходов основным компонентом является целлюлоза, и в гидролизатах будет преобладать глюкоза, усваиваемая всеми без исключения видами дрожжей. Поэтому на гидролизатах можно выращивать самые разнообразные дрожжи, удовлетворяющие технологическим требованиям. В гидролизатах древесины присутствует также большое количество ксилозы, поэтому здесь желательно использование видов, утилизирующих пентозы. В то же время транспортировка сырья на гидролизные заводы оказывается дорогостоящей, поэтому в большинстве стран существуют только локальные мелкие производства кормовых дрожжей, что экологически и экономически более выгодно.
Первый в мире крупный завод кормовых дрожжей мощностью 70000 т в год был пущен в 1973 г. в СССР. В качестве сырья на нем использовали выделенные из нефти н-алканы, а продуцентами стали несколько видов дрожжей, способных к быстрому росту на углеводородах: Candida maltosa, Candida guilliermondii, Candida lipolytica.
В дальнейшем именно отходы от переработки нефти служили главным сырьем для производства дрожжевого белка, которое быстро росло и к середине 1980-х гг. превысило 1 млн т в год, причем в СССР кормового белка получали вдвое больше, чем во всех остальных странах мира вместе взятых. Этому способствовала организация научно-исследо-вательской работы. Были подробно изучены специфические особенности окисления и ассимиляции углеводородов, кинетические параметры роста, разработана технология их культивирования в крупных ферментерах объемом в сотни кубических метров. Однако в последующем масштабы производства дрожжевого белка на углеводородах нефти резко сократились. Это произошло как в результате экономического кризиса 1990-х гг., так и из-за целого ряда специфических проблем, с которыми связано это производство. Одна из них необходимость очистки готового кормового продукта от остатков нефти, имеющих канцерогенные свойства.
Другим пригодным видом сырья для производства микробного белка является метанол. На метаноле как на единственном источнике углерода и энергии способны расти около 25 видов дрожжей, в том числе Pichia polymorpha, Pichia anomala, Yarrowia lipolytica. Однако более выгодным считается выращивание на метаноле метилотрофных бактерий, таких как Methylophilus methylotrophus, так как они используют одноуглеродные соединения более эффективно. Поэтому при росте на метаноле бактерии дают больше биомассы, чем дрожжи. Первая реакция окисления метанола у дрожжей катализируется оксидазой, а у метилотрофных прокариот дегидрогеназой. Ведутся генноинженерные работы по переносу гена метанолдегидрогеназы из бактерий в дрожжи. Это позволит объединить технологические преимущества дрожжей с эффективностью роста бактерий.
В последнее время интенсивно изучаются дрожжи, обладающие гидролитическими ферментами и способные расти на полисахаридах без их предварительного гидролиза. Использование таких дрожжей позволит избежать дорогостоящую стадию гидролиза полисахаридсодержащих отходов. Известно более 100 видов дрожжей, которые хорошо растут на крахмале как на единственном источнике углерода. Среди них особенно выделяются два вида, которые образуют как глюкоамилазы, так и -амилазы, растут на крахмале с высоким экономическим коэффициентом и могут не только ассимилировать, но и сбраживать крахмал: Schwanniomyces occidentalis и Saccharomycopsis fibuliger. Оба вида перспективные продуценты белка и амилолитических ферментов на крахмалсодержащих отходах. Ведутся поиски и таких дрожжей, которые могли бы расщеплять нативную целлюлозу. Целлюлазы обнаружены у нескольких видов, например, у Trichosporon pullulans, однако активность этих ферментов низкая, и о промышленном использовании таких дрожжей говорить пока не приходится. Дрожжи из рода Kluyveromyces хорошо растут на инулине, основном запасном веществе в клубнях топинамбура важной кормовой культуры, которая также может быть использована для получения дрожжевого белка.
Еще один субстрат, пригодный для получения кормового белка, молочная сыворотка, побочный продукт сыроварения. Молочная сыворотка содержит до 4 % лактозы. Способность к ассимиляции лактозы имеется примерно у 20 % всех известных видов дрожжей. Гораздо реже встречаются дрожжи, сбраживающие лактозу. Активный катаболизм лактозы особенно характерен для дрожжей из рода Kluyveromyces. Эти дрожжи можно использовать для получения на молочной сыворотке кормового белка, этанола, препаратов
-глюкозидазы.
3.7 Производство этанола
Этанол широко применяется в химической промышленности как исходное соединение для синтеза многих веществ, как растворитель, экстрагент, антифриз и т.п. Вероятно, у этанола большое будущее и как топлива в двигателях внутреннего сгорания: этанол гораздо более экологически чистое топливо, чем бензин.
В принципе этанол можно получать из любого источника углеводов, которые сбраживаются дрожжами. Разнообразие потенциальных продуцентов тоже велико: более 200 видов дрожжей способны сбраживать глюкозу.
Крупномасштабное получение этанола в качестве топлива осуществляется в основном в Бразилии и других странах Южной Америки.
В качестве источника углеводов используется сахарный тростник и маниока, в качестве продуцента этанола Saccharomyces cerevisiae.
Сырьем для производства спирта служат разнообразные растительные материалы, содержащие в достаточном количестве сбраживаемые сахара или другие углеводы, которые можно осахарить. Наиболее широко используются крахмалосодержащие материалы зерно (рожь, пшеница, кукуруза, ячмень, овес, просо) и картофель, сахаросодержащие материалы меласса (отход сахарного и крахмало-паточного производства), дефектная сахарная свекла, а также древесина и отходы сельскохозяйственных растений. Дальнейшее увеличение производства спирта будет идти по пути увеличения мощностей предприятий, использующих непищевое сырье.
Процесс производства спирта из крахмалистого сырья включает ряд стадий. Вначале сырье измельчают и разваривают с целью извлечения и растворения крахмала. Поскольку крахмал не подвержен действию ферментов дрожжей, способных сбраживать только дисахариды и моносахариды, охлажденную разваренную массу обрабатывают амилолитическими ферментами солода (пророщенного зерна) или грибов (Aspergillus oryzae, Asp. niger и др.). Осахаренная масса (затор) содержит смесь углеводов, состоящую из мальтозы, глюкозы и декстринов. Кроме того, в нем имеются пептиды, аминокислоты, фосфорорганические соединения, минеральные соли и микроэлементы.
Следующая стадия сбраживание осахаренной массы. На спиртовых заводах России применяют периодический и непрерывно-поточный способы брожения. Для этого используют естественно-чистые культуры дрожжей; последние систематически ведут на производственных заторах в специальном дрожжевом отделении. Для подавления в них размножения бактерий пастеризованный и охлажденный до 30 °С затор подкисляют серной кислотой до рН 3,84,0. Такие значения рН менее благоприятны для развития дрожжей, чем рН 4,55,0, но медленное размножение дрожжей компенсируется возможностью получения практически чистой культуры в нестерильных условиях.
Спиртовые дрожжи, применяемые при переработке крахмалистого сырья, должны обладать высокой бродильной активностью; быстро и полностью сбраживать сахара, а также использовать другие компоненты питательной среды в анаэробных условиях, быть устойчивыми к продуктам своего обмена (особенно к спирту), хорошо противостоять развитию инфекции. Уже около 80 лет применяют Sacch. cerevisiae, раса XII. Эти дрожжи хорошо сбраживают глюкозу, фруктозу, сахарозу, мальтозу, на 1/3 раффинозу, несколько слабее галактозу. В среде накапливают до 1011 об. % спирта. Раса XII верхнебродящая, хорошо распределяется во всем объеме затора, пылевидная, не образует хлопьев. Оптимальная температура ее развития 3038 °С, максимальная 38 °С, минимальная температура 5 °С. Значение рН во время брожения поддерживают в пределах 3,84,0. Используют также другие расы дрожжей, но не так широко. После сбраживания заторов в них остаются неиспользованными около 0,1 % галактозы, 0,4 % декстринов и 0,5 % пентоз.
Проводится селекционная работа по получению рас дрожжей с более высокими производственно ценными свойствами, в частности способных интенсивно использовать галактозу и декстрины. В последние годы большое внимание уделяется селекции термотолерантных рас, дающих в промышленном производстве ряд преимуществ (ускорение микробиологических процессов, уменьшение расхода хладоагента и др.). Разрабатываются методы получения этанола на различных субстратах с использованием иммобилизованных клеток микроорганизмов.
Меласса побочный продукт сахарного производства (содержит около 80 % сухих веществ и 20 % воды). Сухие вещества представлены сахарами, безазотистыми органическими, азотсодержащими и минеральными веществами. Основной сахар мелассы сахароза. В сухих веществах ее 4550 %. Содержится также 0,10,5 % инвертного сахара (смесь глюкозы и фруктозы) и 0,52 % раффинозы. Все остальные сухие вещества мелассы объединяют общим названием несахара. Они определяют свойства мелассы как сырья для спиртового производства. Азотсодержащие вещества мелассы представлены в основном продуктами распада белковых веществ аминокислотами и бетаином органическим основанием, дающим при разложении амины. Содержит она витамины группы В и биотин, необходимые для роста дрожжей. Нормальная доброкачественная меласса имеет слабощелочную или нейтральную реакцию (рН 7,28,9).
К дрожжам, используемым для сбраживания мелассных растворов, предъявляются в основном те же требования, что и к расам для производства спирта на крахмалистых средах. Кроме того, они должны обладать способностью переносить высокие концентрации сухих веществ, содержащихся в мелассе, и, возможно, более полно сбраживать рафинозу. Технологические схемы предусматривают использование выделенных после брожения дрожжей в качестве хлебопекарных, поэтому они должны отвечать требованиям, предъявляемым к последним.
В производстве широкое применение нашла раса Я Sacch. cerevisiae, а при использовании дрожжей в качестве хлебопекарных раса В (венгерская). Дрожжи этих рас хорошо сбраживают сахарозу, глюкозу и фруктозу, рафинозу только на 1/3. При большом содержании раффинозы в мелассе недобор спирта может быть значительным.
Для селекции рас дрожжей с требуемыми свойствами был применен метод гибридизации. В результате скрещивания расы Я с дрожжами, использующимися в пивоваренном производстве и способными образовывать -галактозидазу, были получены диплоидные гибриды (67 и 73). Они сбраживают раффинозу на 6070 %, тогда как дрожжи рас Я и В только на 30 %. В последние годы для сбраживания сусла из свеклосахарной и тростниковой мелассы используют расу V-30. Она сбраживает раффинозу на 2/3, обладает высокой генеративной способностью, а получаемые прессованные хлебопекарные дрожжи лучшего качества, чем дрожжи расы В.
Сырьем для получения технического спирта могут служить гидролизаты древесины и других растительных отходов. Древесина хвойных и лиственных пород содержит 4075 % полисахаридов. Различают легко- и трудногидролизуемые полисахариды. Легкогидролизуемые полисахариды состоят из гемицеллюлоз и пектиновых веществ. Трудногидролизуемые полисахариды содержат целлюлозу с небольшой примесью гемицеллюлоз.
Растительное сырье под давлением подвергают кислотному гидролизу. Полученный гидролизат содержит 3,23,5 % редуцирующих сахаров, преимущественно глюкозу, в небольших количествах галактозу и маннозу, а также пентозы ксилозу, арабинозу, рамнозу.
Для сбраживания древесных гидролизатов используют ряд рас Sacch. cerevisiae и Schizosaccharomyces. Последние более полно сбраживают галактозу, чем сахаромицеты, и поэтому дают более высокий выход спирта. Брожение проводят по непрерывно-поточному способу при высокой концентрации биомассы (1725 г/л).
Присутствующие в гидролизате вредные примеси играют роль антисептиков подавляют развитие посторонних микроорганизмов. Поэтому на гидролизных спиртовых заводах отсутствуют установки для размножения чистых и производственных культур дрожжей, а одни и те же дрожжи используют на протяжении многих месяцев.
Зрелая бражка по окончании брожения, содержит 1,01,5 % этанола и побочные продукты брожения, несброженные сахара и другие органические вещества. При перегонке бражки и ректификации гидролизного спирта не удается полностью избавиться от этих примесей; гидролизный спирт (ректификат) содержит до 0,050,1 % метанола и несколько большее количество кислот, сложных эфиров и альдегидов, чем ректификат из пищевого сырья.
При традиционном способе получения этанола из гидролизатов древесины и отходов сельскохозяйственных растений значительная часть моносахаридов, в основном ксилозы, остается неиспользованной. В последние годы выявлены дрожжи Pachysolen tannophilus, Candida shehatae (син. Pichia stipitis) и другие, способные сбраживать ксилозу с образованием этанола. Использование таких дрожжей может обеспечить утилизацию до 90 % сахаров, образующихся при гидролизе растительной массы. Разрабатываются промышленные методы производства этанола с применением ксилозосбраживающих дрожжей.
Сульфитные щелока являются отходами целлюлозного производства. Для извлечения целлюлозы древесину обрабатывают при повышенной температуре варочным раствором, обычно представляющим смесь сернистой кислоты с водными растворами бисульфитов и моносульфитов Ca(HSO3)2, Mg(HSO3)2, NH4HSO3 и NaHSO3. При этом целлюлоза извлекается в неповрежденном виде, а гидролизуются только гемицеллюлозы. Лигнин, входящий в состав древесины, образует с сернистой кислотой водорастворимые лигносульфокислоты. Суммарная концентрация сахаров достигает 3,03,5 %, из них 6268 % сбраживаемые, рН 1,51,0.
Сульфитные щелока сбраживают расами Sacch. cerevisiae, которые хорошо используют галактозу, обладают флокулирующими свойствами и сорбируются волокнами целлюлозы. Благодаря наличию в щелоках ряда антисептических веществ нет необходимости в процессе производства размножать дрожжи в специальных аппаратах. Отбродившие дрожжи вновь идут в производство.
Зрелая бражка содержит 0,51,0 % этилового спирта и много летучих примесей (альдегиды, эфиры, высшие спирты, метанол, фурфурол, сернистый ангидрид, сероводород). В сульфитном спирте остаются трудноотделяемые сернистые соединения, значительное количество альдегидов и эфиров, а также 2,08,0 % метанола. Сульфитный спирт является самым дешевым.
3.8 Различные продукты, получаемые из дрожжей
В последние десятилетия разнообразие биотехнологических процессов, в которых используются дрожжи, резко увеличилось. Еще более разнообразны перспективы использования дрожжей: в различных разработках, патентах и т.п. упоминается более 200 видов. Сейчас дрожжи используются для получения различных ферментных препаратов, органических кислот, полисахаридов, многоатомных спиртов, витаминов и витаминных добавок, а также во множестве других мелкомасштабных процессах.
Промышленно важные органические кислоты, продуцируемые микроорганизмами, являются либо конечными продуктами (молочная, масляная, пропионовая кислоты у анаэробных бактерий), либо интермедиатами метаболизма, которые можно получать с помощью дрожжей. В больших масштабах производится лимонная кислота, в основном с помощью Aspergillus niger, с использованием в качестве субстрата мелассы. Однако ее можно получать и с помощью дрожжей Yarrowia lipolytica на более дешевых субстратах, таких как парафины нефти. Сейчас разработаны технологии получения и многих других кислот, например, изолимонной из Candida catenulata, фумаровой из Candida hydrocarbofumarica, яблочной из Pichia membranaefaciens и др.
Из дрожжевых полисахаридов наиболее популярен пуллулан, который получают из дрожжеподобного гриба Aureobasidium pullulans. Он представляет собой -глюкан, в котором мальтотриозные остатки соединены между собой (16)-гликозидными связями. Пуллулан используется в основном в пищевой промышленности в качестве пленочного покрытия. Возможно получение разнообразных по строению и свойствам полисахаридов и из других видов дрожжей. Особенно много внеклеточных полисахаридов образуют дрожжи Cryptococcus, Rhodotorula, Lipomyces.
Многоатомные спирты (глицерин, ксилит, эритрит, арабит) широко применяются в химической и пищевой промышленности. Перспективным считается способ получения сахароспиртов, таких как глицерин, эритрит и ксилит, с использованием ксеротолерантных дрожжей Zygosaccharomyces rouxii и Zygosaccharomyces bailii. Эти дрожжи способны расти в средах с высоким осмотическим давлением, синтезируя при этом большое количество внутриклеточных полиолов, которые служат осмопротекторами. Другой способ касается получения ксилита важного полиола для пищевой промышленности. Ксилит накапливается как побочный продукт при сбраживании ксилозы дрожжами Pachysolen tannophilus. Многие дрожжи служат источниками для получения ферментных препаратов, которые используются в современной пищевой и химической промышленности. Из дрожжевого осадка, образующегося как отход пивоварения, получают фермент
-фруктофуранозидазу (инвертазу), расщепляющий сахарозу на глюкозу и фруктозу. Препараты инвертазы широко применяются в кондитерской промышленности для предотвращения кристаллизации сахарозы, для приготовления инвертных сиропов. С помощью культур Kluyveromyces marxianus получают -галактозидазу, которая применяется в молочной промышленности. Дрожжи Yarrowia lipolytica используются для получения лииолитических ферментов, представляющих большой интерес для многих отраслей хозяйства. Липазы используются в сыроварении, в косметической промышленности, при выделке мехов и кож, в моющих средствах. В последние годы разработано множество способов получения самых различных ферментов из дрожжей: пектиназ из Saccharomycopsis fibidiger, амилаз из Schwanniomyces occidentalis, ксиланаз из Cryptococcus laurentii, гидролаз L--амино--капролактама из криптококков, алкогольоксидазы из Hyphopichia burtonii, оксидазы
D-аминокислот из Trigonopsis variabilis, фенилаланинаммиаклиазы из Rhodotorula glutinis.
Применение дрожжей как источников витаминов началось в 1930-е гг. Одним из первых промышленных процессов получения витаминов было выделение эргостерина из Saccharomyces cerevisiae с последующим облучением ультрафиолетом для перевода в витамин D. Затем у дрожжей была открыта способность к сверхсинтезу некоторых витаминов группы В, в частности рибофлавина. Разработаны промышленные способы получения -каротина из красных дрожжей. Кроме производства индивидуальных витаминов уже много лет в мире практикуется получение автолизатов и гидролизатов дрожжей, которые используются как источник витаминов и как вкусовые добавки.
3.9 Эргостерин
3.9.1 Общая характеристика эргостерина
Эргостерин является провитамином витамина D. В 19301932 гг. Ф. Аскью и А. Виндаусу получили в своих лабораториях сначала неочищенный витамин D1, а затем индивидуальный витамин D2 (эргокальциферол) из облученного провитамина эргостерина. В 1936 г.
Г. Брокман выделил более универсальный природный витамин D3 (холекальциферол) из жира печени тунца. В том же году А. Виндаус получил его фотоизомеризацией провитамина – 7-дегидрохолестерина.
В 19361937 гг. строение витаминов D2 и D3 было установлено
А. Виндаусом и Дж. Хейлброном и подтверждено в 1957 г. Д. Ходжкином методом рентгеноструктурного анализа. В настоящее время известно еще четыре витамина группы D: D4D7, но их активность различна.
Эргостерин – эргоста-5,7,22-триен-3-ол – исходный продукт производства жирорастворимого витамина D2 и кормовых препаратов, обогащенных витамином D2. В группу витаминов D объединяют родственные соединения, важнейшими из которых являются витамины D2 и D3, обладающие антирахитичным действием. Витамин D2 (эргокальциферол) образуется при УФ-облучении эргостерина, витамин D3 (холекальциферол) образуется из 7-дегидрохолестерина. В организме человека и животных эти соединения регулируют усвоение кальция и фосфора из пищи и отложение их в костной ткани.
В основе структуры эргостерина и витамина D лежат четыре углеродных цикла (А, В, С, D). В случае витамина D кольцо В разомкнуто. Углеводородная структура эргостерина и витамина D определяет их липофильные свойства.
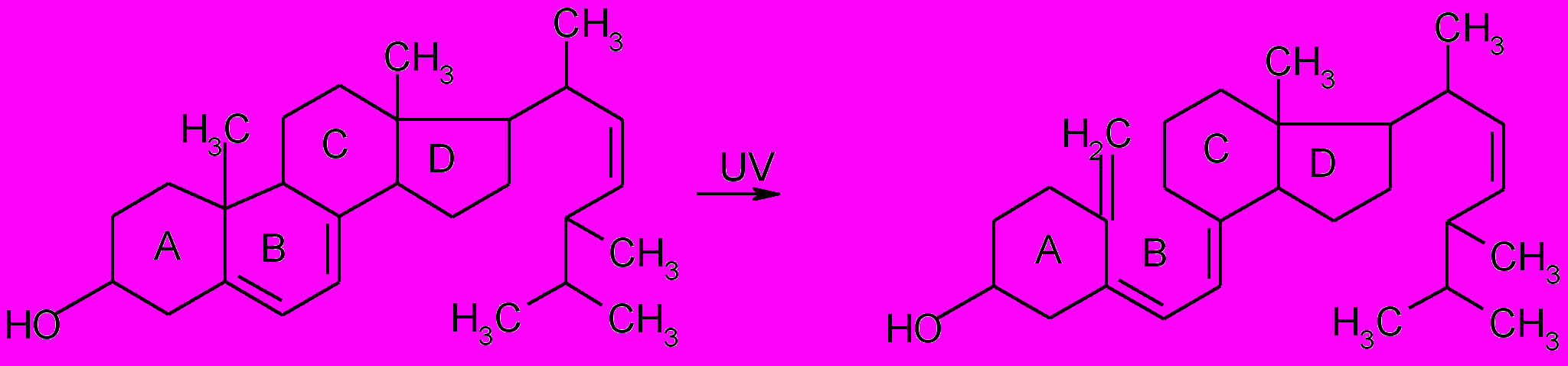
Эргостерин Витамин D2
Затем под действием ферментов витамин D2 превращается в
25-гидроксикальциферол:
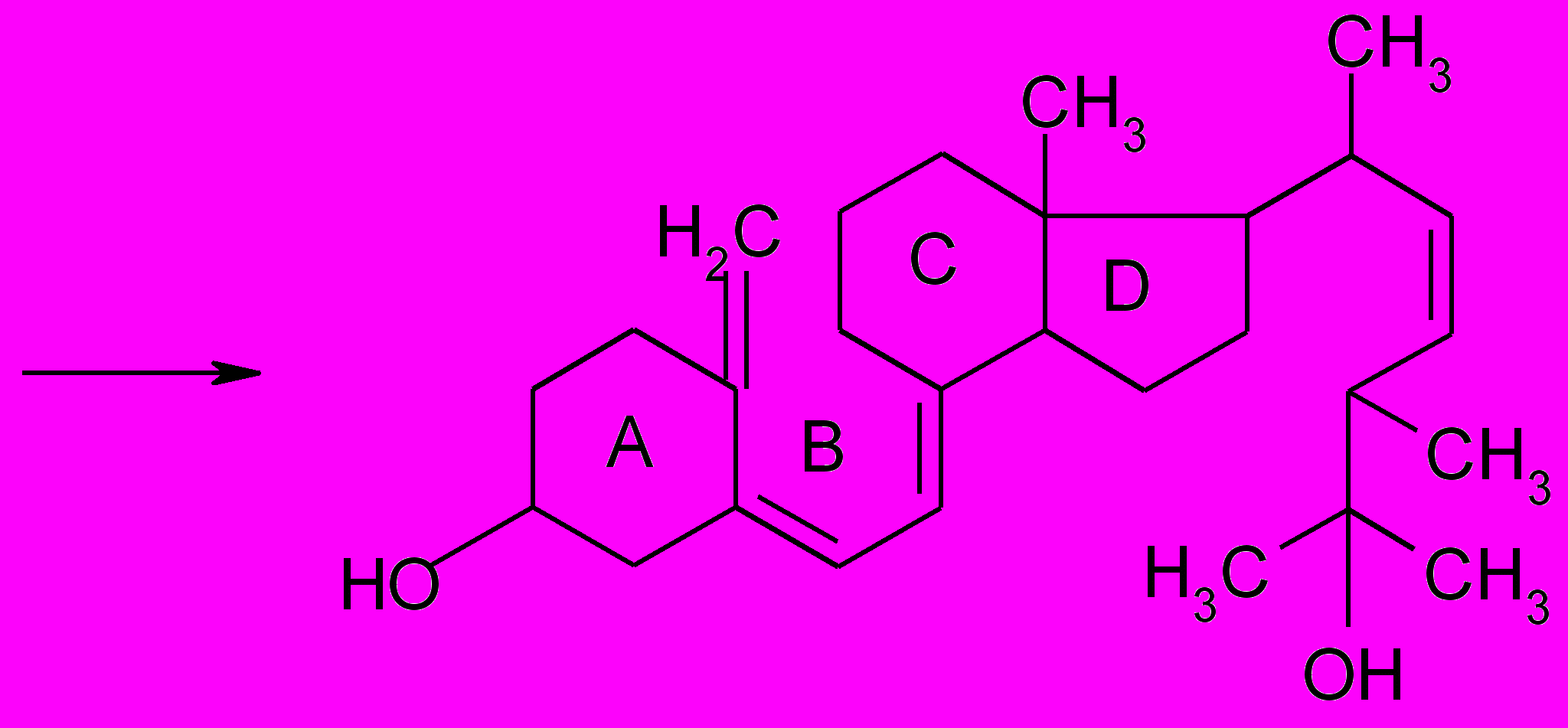
25-Гидроксикальциферол
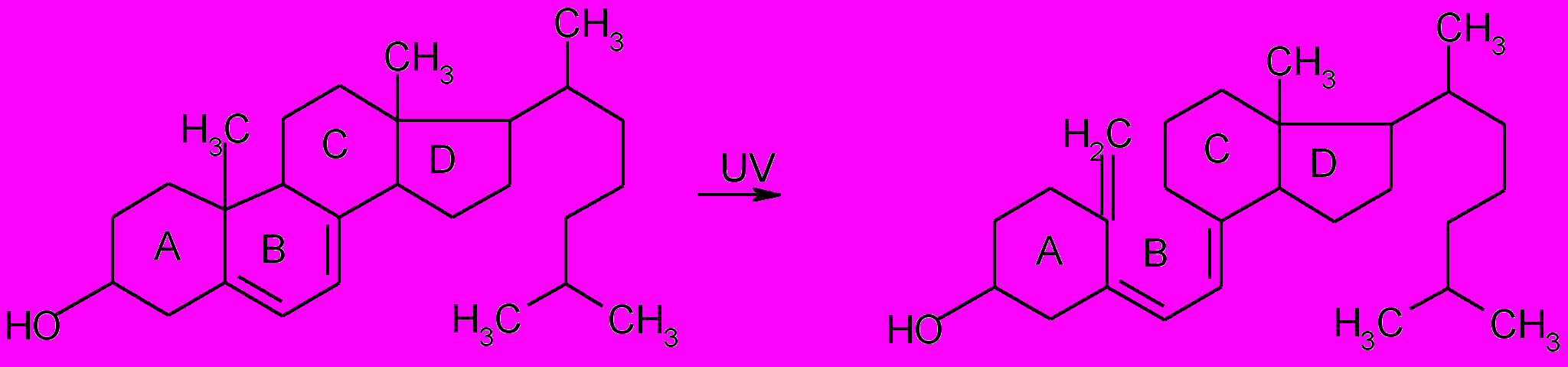
7-Дегидрохолестерин Витамин D3
Также витамин D3 под действием соответствующих ферментов может превращаться в различные свои формы:
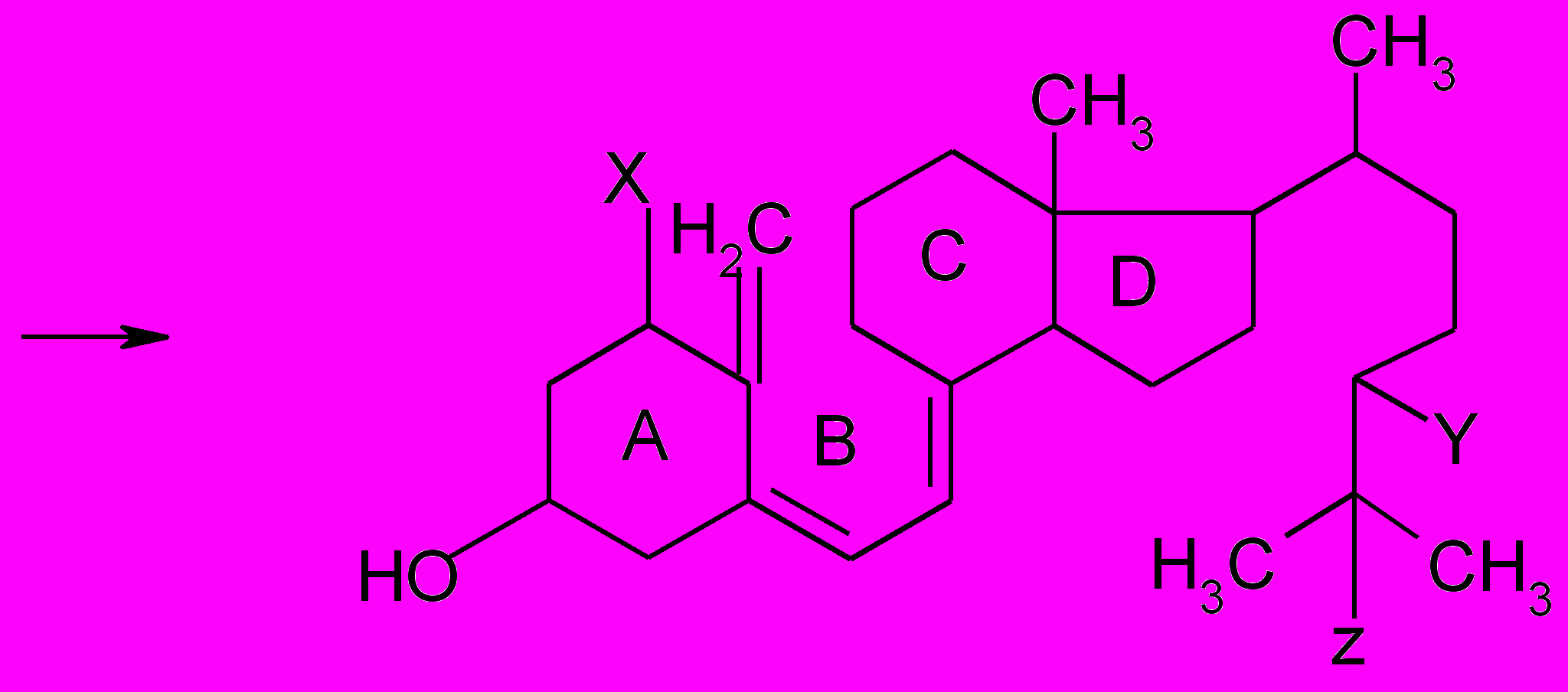
X Y Z
1-Гидроксихолекальциферол ОН Н Н
1,25-Дигидроксихолекальциферол ОН Н ОН
1,24,25-Тригидроксихолекальциферол ОН ОН ОН
Провитамин D3 7-дегидрохолестерин присутствует в кожных покровах людей, и для его превращения в холекальциферол достаточно солнечного облучения, так что суточная потребность взрослого человека (712 мкг) легко удовлетворяется. У детей суточная доза витамина D3 составляет 1225 мкг. При гипо- или авитаминозе развивается рахит, поэтому необходимо поступление этого витамина со сливочным маслом, молоком, яйцами, жиром печени рыб, где его содержание наиболее велико. В лечебных целях возможно также использование витамина D2, синтезированного из эргостерина, получаемого из дрожжей, либо как побочный продукт производства антибиотиков.
Витамины D широко применяются в животноводстве, но для некоторых животных и птиц витамин D2 малоактивен и непригоден как пищевая добавка.
В организме человека витамины D вместе с ферментами, гормонами, АТФ, Na+ и другими веществами регулируют всасывание Ca2+ в кишечнике, содержание Ca2+ в крови, метаболизм Сa2+ и фосфатов, приводящий к построению нормальной костной и мышечной ткани. Большинство функций витамины D выполняют не сами, а их окисленные метаболиты: 25-гидроксикальциферол, 1-гидроксихолекальци-ферол, 1,25-дигидроксихолекальциферол. Эти метаболиты, открытые Г. де Лука в 19691971 гг., обладают значительно более высокой биологической активностью, чем исходные витамины. Они проявляют все свойства истинных стероидных гормонов.
