Методические рекомендации по выполнению лабораторного и научно-исследовательского практикума для студентов всех форм обучения специальностей 240901 «Биотехнология» и260204 «Технология бродильных производств и виноделие»
| Вид материала | Методические рекомендации |
- «Технология бродильных производств и виноделие», 1195.96kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 981.77kb.
- Методические рекомендации по выполнению самостоятельной работы и изучению дисциплин, 855.43kb.
- Методические рекомендации по выполнению самостоятельной работы и изучению дисциплины, 846.76kb.
- Учебное пособие по дисциплине для студентов специальности 270500 «Технология бродильных, 1164.77kb.
- Учебно-методический комплекс для студентов дневной и заочной формы обучения по специальности, 1588.96kb.
- Методические рекомендации к лабораторным работам по курсу «Основы проектирования, 616.07kb.
- Учебное пособие по дисциплине для студентов специальностей 270500 «Технология бродильных, 2133.55kb.
- Методические рекомендации по выполнению лабораторных работ для студентов специальностей, 200.14kb.
- Методические указания, 361.46kb.
1.6.3 Качественные реакции на витамины группы D
1.6.3.1 Оборудование и реактивы
Пипетки с одной меткой на 1 мл (4 шт.); штатив лабораторный с пробирками; баня водяная; рыбий жир; анилин; раствор брома в хлороформе (1:60); соляная кислота (конц.).
1.6.3.2 Реакция с анилином
В сухую пробирку наливают 1 мл рыбьего жира и 1 мл смеси анилина с концентрированной соляной кислотой (15:1), перемешивают, осторожно нагревают при постоянном помешивании до кипения и кипятят 0,5 минут. При наличии витамина D желтая окраска эмульсии переходит сначала в зеленую, а затем в красную. Через 12 минуты эмульсия делится на два слоя, из которых нижний окрашен в интенсивный красный цвет.
1.6.3.3 Бромхлороформная проба
В сухую пробирку наливают 1 мл рыбьего жира и 1 мл раствора брома в хлороформе (1:60). В присутствии витамина D возникает зеленовато-голубое окрашивание при нагревании на водяной бане в течение 12 минут.
1.6.4 Количественное определение витамина D
1.6.4.1 Оборудование и реактивы
Фотоэлектроколориметр; баня водяная; воронка делительная на 300 мл (2 шт.); коническая колба с притертой пробкой на 200 мл; набор пипеток градуированных на 1, 5 и 10 мл; молочный жир; этиловый спирт (96%-ный); гидроксид калия (50%-ный); диэтиловый эфир; сульфат натрия свежепрокаленный; хлороформ (промытый водой, высушенный над безводным сульфатом натрия и перегнанный); хлорид сурьмы (III) (2123%-ный) в хлороформе (безводный; рекомендуется хранить в темной склянке в эксикаторе над серной кислотой); ацетилхлорид; основной раствор кальциферола (в 100 мл этилового спирта растворяют 10 мг кальциферола, что соответствует 400 000 ИЕ витамина D2; раствор устойчив в течение года при хранении в холодильнике).
1.6.4.2 Ход анализа
В коническую колбу с воздушным обратным холодильником длиной 80 см вносят 10 г молочного жира, 40 мл 96%-ного этилового спирта и 8 мл 50%-ного раствора гидроксида калия. Колбу помещают в водяную баню, нагретую до температуры 8590 С, на 4050 минут. По окончании омыления содержимое колбы количественно переносят в делительную воронку и трижды экстрагируют диэтиловым эфиром (порциями 50, 25 и 25 мл). Эфирный слой переносят в другую делительную воронку, где промывают его многократно водой до полного удаления щелочи (проба на фенолфталеин). К полученному эфирному экстракту добавляют 7 г свежепрокаленного сульфата натрия и высушивают его до полной прозрачности (1520 мин), после чего фильтруют через бумажный фильтр. Эфир отгоняют на предварительно нагретой водяной бане до получения сухого остатка, который растворяют в 5 мл хлороформа. Из полученного раствора отбирают 1 мл, добавляют 3 капли ацетилхлорида и 6 мл раствора хлорида сурьмы (III). Через
4 минуты интенсивность окраски измеряют в фотоэлектроколориметре при 500 нм. Фотометрирование ведут против смеси из 1 мл хлороформа, 6 мл раствора хлорида сурьмы (III) и трех капель ацетилхлорида. Содержание витамина D рассчитывают по калибровочному графику. Для получения калибровочного графика готовят серию растворов кальциферола в хлороформе, содержащих в 1 мл от 200 до 1000 ИЕ витамина D, используя для этого основной раствор кальциферола и проводя цветную реакцию, как указано выше. Расчет ведут по формуле:
С = х·V·/a, (8)
где С содержание витамина D в 1 г жира, ИЕ;
х найденное по калибровочному графику количество витамина D в 1 мл раствора, ИЕ;
V масса жира, г;
плотность жира, г/см3.
2 ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
2.1 Общая характеристика дрожжей
Термином «дрожжи» обозначают одноклеточные эукариотные микроорганизмы. В группу дрожжей объединяются грибы, которые существуют преимущественно в виде отдельных клеток. Клетки разных видов дрожжей морфологически довольно разнообразны: круглые, яйцевидные, лимоновидные, овальные. Длина их составляет 220 мкм, а ширина 1,510 мкм. Размножаются дрожжи вегетативно и половым путем. Клетки дрожжей грамположительны. На плотных питательных средах дрожжи растут в виде врастающих в субстрат колоний, имеющих мягкую консистенцию и разнообразных по форме: выпуклых, круглых, лопастных. Колонии могут быть бесцветными или окрашенными в желтый, оранжевый, розовый цвета (рисунок 2).

Рисунок 2 Гигантские колонии дрожжей разных видов на сусло-агаре
В зависимости от наличия и типа полового процесса дрожжи относят к трем классам грибов: Ascomycetes, Basidiomycetes и Deuteromycetes. Термин «дрожжи» в строгом смысле не имеет таксономического значения.
К классу Ascomycetes относят дрожжи, образующие при половом размножении сумки (аски) с эндогенными спорами. К нему принадлежат представители родов дрожжей, используемых в бродильных производствах, Saccharomyces и Shizosaccharomyces.
Класс Basidiomycetes включает дрожжи, формирующие телиоспоры (телейтоспоры) и базидиоподобные спорофоры с экзогенными половыми спорами (споридиями).
К Deuteromycetes, или несовершенным грибам, относят дрожжи, у которых не обнаружен половой цикл. Считают, что организмы, принадлежащие к этой группе, произошли от высших грибов в результате утраты ими половых функций.
В процессе эволюции дрожжи хорошо приспособились к обитанию в различных местах, содержащих чаще всего углеводы.
Они растут на поверхности сладких плодов, в нектаре цветков, в сокотечениях деревьев, на поверхности листьев, в лесной подстилке и почве. Встречаются дрожжи и в водоемах. Содержатся они в пищеварительном тракте человека и животных. Большинство дрожжей сапрофиты, но среди видов, находящихся и во внутренних органах и на кожных покровах человека, имеются патогенные, или условно патогенные, формы, например, возбудитель кандидомикозов Candida albicans. Некоторые дрожжи вызывают болезни растений.
Многие дрожжи осуществляют спиртовое брожение и используются для производства пива, вина, хлеба, спирта. Биомасса кормовых дрожжей рода Саndida используется в качестве питательных добавок к рационам сельскохозяйственных животных.
2.2 Систематика дрожжей
Одноклеточная организация дрожжей накладывает столь существенный отпечаток на их внешний облик и на методы работы с ними, что систематика дрожжей долгое время развивалась вполне независимо от систематики мицелиальных грибов. Одно из важных отличий широкое использование для классификации и идентификации дрожжей физиологических и биохимических признаков. До середины XX века все одноклеточные грибы рассматривались в качестве достаточно обособленной таксономической группы аскомицетов. Последней точки зрения придерживался, например, В.И. Кудрявцев, автор отечественного определителя дрожжей, который предлагал объединять все дрожжи в самостоятельный порядок Unicellomycetales. В середине XX века произошло принципиальное событие в систематике дрожжей, когда японскому микологу Исао Банно удалось индуцировать половой цикл размножения у гетероталличных красных дрожжей Rhodotorula glutinis. Полученные им характеристики жизненного цикла однозначно свидетельствовали о принадлежности этих дрожжей к гетеробазидиомицетам. Стало очевидным, что среди дрожжей имеются представители совершенно различных таксономических групп грибов как аскомицетовых, так и базидиомицетовых. После этого большое внимание в систематике дрожжей стало уделяться поиску признаков, позволяющих разделить аскомицетовые и базидиомицетовые виды, даже без наблюдения полного жизненного цикла (так называемых признаков аффинитета). В систематике дрожжей стали активно использоваться биохимические и цитологические признаки.
Современный период изучения биологического разнообразия характеризуется интенсивным развитием филогенетической систематики, которая направлена на реконструкцию конкретных путей исторического развития организмов. В микробиологии филогенетическая систематика получила мощный импульс развития лишь в самом конце XX века в связи со сравнительным изучением консервативных нуклеотидных последовательностей в рРНК. У дрожжей такая систематика строится главным образом на изучении двух участков рДНК длиной около 600 нуклеотидных пар: D1/D2 домена на 5'-конце гена, кодирующего 26S рРНК и внутреннего транскрибируемого спейсерного региона (ITS), включающего ген 5.8S рРНК. Считается, что вследствие консервативности этих участков различия между ними прямо пропорциональны филогенетическому расстоянию, степени эволюционного родства. Сек-венирование неклеотидных последовательностей рДНК оказалось мощным инструментом для построения филогенетической классификации дрожжей, определения их места в общей системе грибов. К настоящему времени расшифрованы и помещены в компьютерные банки данных, доступные по сети Интернет, нуклеотидные последовательности рРНК у представителей всех известных видов дрожжей. Это позволило построить филогенетические деревья, отражающие эволюцию их рибосомальных генов. Оказалось, что группирование дрожжей на основе сходства нуклеотидных последовательностей рРНК во многих случаях не совпадает с группированием по фенотипическим признакам. Многие традиционные признаки, используемые в классификации дрожжей, такие как характеристики вегетативного размножения, форма аскоспор, способность к сбраживанию и ассимиляции сахаров, стали считаться ненадежными, не пригодными для определения филогенетического родства. Секвенирование рРНК (рДНК) сейчас считается необходимым при описании новых видов дрожжей.
Один из главных вопросов, который активно дискутировался до последнего времени, положение дрожжей в общей системе грибов. Являются ли они предковыми примитивными формами аско- и базидиомицетов, давшими начало более продвинутым и сложно организованным мицелиальным грибам, или вторично упростившимися, возникшими независимо в разных филогенетических линиях грибов в результате конвергенции? Окончательный ответ на этот вопрос был получен лишь недавно в результате развития молекулярно-филогене-тической систематики. Сейчас считается окончательно доказанным полифилетическое происхождение дрожжей, их независимое возникновение среди аскомицетовых и базидиомицетовых грибов. После обнаружения базидиомицетовых дрожжей в зимологии возникло представление о дрожжах, как о чисто морфологической, или экоморфологической группе грибов (жизненной форме), лишенной таксономического содержания. В то же время дрожжи встречаются лишь в некоторых филогенетических линиях грибов, в которых имеются также близкородственные виды, существующие в основном в мицелиальной форме. Примерами могут служить аскомицеты Endomyces, Blastobotrys, базидиомицеты Tilletiopsis, Trichosporonoides, не образующие почкующиеся одиночные клетки. Несмотря на отсутствие одноклеточных ассимилятивных стадий, такие виды также включают в определители дрожжей, так как филогенетически они очень близки к «настоящим» одноклеточным дрожжам. Поэтому, с точки зрения филогенетической систематики, целиком сводить понятие «дрожжи» только к одноклеточной жизненной форме грибов не представляется целесообразным.
Систематика дрожжей, поиск их места в общей системе грибов продолжают активно развиваться, и в этой области еще не выработано устоявшихся, стабильных представлений. Тем не менее со времени первых описаний сахаромицетов зимологами пройден очень большой путь в исследовании разнообразия дрожжевых грибов. Основные этапы этого пути отражены в серии определителей голландской зимологической школы, которые выходили с интервалом в 1020 лет.
2.3 Классификация дрожжей
Классификация дрожжей на уровне семейств и порядков разработана очень слабо. За основу приводимой ниже классификации взято последнее издание определителя дрожжей (Kurtzman C.P., Fell J.W. (eds.) The Yeasts, a taxonomic study. Fourth revised and enlarged edition. Amsterdam: Elsevier Science B.V., 1998).
2.3.1 Аскомицетовые дрожжи
Традиционно все аскомицетовые грибы разделяли на два таксономических класса: Hemiascomycetes, или голосумчатые грибы, и Euascomycetes (настоящие аскомицеты). Первые не образуют плодовых тел, и аски у них располагаются непосредственно на мицелии или в виде одиночных клеток, тогда как эуаскомицеты, за немногими исключениями (например, род Eremascus), обычно формируют аски внутри или на поверхности специальных плодовых тел (аскокарпов), образованных грибной тканью густым скоплением мицелия. Ранее все аскомицетовые дрожжи помещали в группу гемиаскомицетовых в качестве самостоятельного порядка Endomycetales. Кроме настоящих дрожжей к эндомицетовым относили и некоторые голосумчатые грибы, не образующие одноклеточных вегетативных форм, а также диморфные дрожжеподобные грибы, иногда с очень слабо выраженной дрожжевой фазой, например, Ascoidea, Cephaloascus, Dipodascus. Дальнейшее разделение эндомицетовых дрожжей на семейства и роды проводилось прежде всего на основании таких признаков, как способ вегетативного размножения, тип полового процесса и форма аскоспор. Например, дрожжи рода Schizosaccharomyces выделяются на основании вегетативного размножения делением, а не почкованием, роды Hanseniaspora, Nadsonia, Saccharomycodes на основании размножения биполярным почкованием на широком основании, роды Saccharomyces, Pichia, Metschnikowia, Williopsis характеризуются шаровидной, шляповидной, игловидной и сатурновидной формой аскоспор соответственно.
Кроме эндомицетовых к гемиаскомицетам формально относили еще одну группу грибов, составляющую отдельный порядок Taphrinales. Все представители этого порядка облигатные паразиты растений, образующие аски не в плодовых телах, а плотным слоем под кутикулой растения-хозяина. Аскоспоры некоторых видов тафриновых способны почковаться, формируя сапротрофную дрожжевую фазу. Однако тафриновые существенно отличаются от остальных гемиаскомицетов тем, что в цикле их развития преобладает дикариотическая фаза так же, как у базидиомицетовых грибов. К тафриновым очень близки представители рода Protomyces, все члены которого тоже являются фитопатогенными грибами, но способны образовывать сапротрофные дрожжевые стадии.
Среди эуаскомицетов способность к вегетативному размножению в одноклеточной форме встречается очень редко. Наиболее известны так называемые «черные дрожжи», характеризующиеся накоплением меланоидных пигментов, которые придают их колониям черный цвет.
Внедрение в таксономическую практику биохимических и молекулярно-биологических методов (особенно проведенный в последнее время анализ нуклеотидных последовательностей рРНК) существенно изменило представления о филогенетической классификации аскомицетовых дрожжей. Эти исследования подтвердили разделение аскомицетов на две главные филетические линии: гемиаскомицетовые и эуаскомицетовые.
Наряду с этим обнаружилось, что дрожжи рода Schizosac-charomyces по нуклеотидным последовательностям рРНК наиболее близки к тафриновым и вместе с ними образуют группу дрожжевых грибов, предковую по отношению к остальным аскомицетам. Эта группа грибов была названа архиаскомицетами (древними аскомицетами). Таким образом, все аскомицетовые дрожжи в настоящее время распределяются по трем классам Archiascomycetes, Hemiascomycetes, Euascomycetes (рисунок 3).
2.3.1.1 Saccharomyces
Клетки овальные или круглые, иногда удлиненные, размером (5…7)(8…11) мкм. Размножаются многосторонним почкованием. Почкование истинное (рисунок 4). Может формироваться примитивный псевдомицелий, но истинного мицелия не образуют.
Диплоидизация происходит в результате слияния двух гаплоидных клеток (хологамия). Вегетативно размножаются в основном диплоидные клетки. В неблагоприятных условиях образуются аски с одной или четырьмя спорами. При созревании спор сумки-аски не вскрываются и сохраняются. Аскоспоры имеют круглую, слегка овальную форму, гладкие, бесцветные. Аски образуются преимущественно из вегетативных диплоидных клеток (рисунок 5).
Дрожжи рода Saccharomyces активно сбраживают сахара, нитраты не ассимилируют, так как не имеют ферментов, способных восстанавливать их до ионов аммония. На поверхности агара питательного они обычно формируют гладкие тускло блестящие белые с желтым оттенком колонии.
Дрожжи вида Saccharomyces cerevisiaе способны сбраживать глюкозу, сахарозу, частично раффинозу, мальтозу и декстрины. На гидролизных средах выход спирта составляет 5557 литров из 100 кг сбраживаемых сахаров. Поэтому дрожжи вида Saccharomyces cerevisiaе являются одним из основных продуцентов этанола на углеводных средах. Дрожжи этого рода с давних времен распространены в кустарном виноделии и широко используются в разных отраслях бродильной промышленности, в связи с чем они более всех других дрожжей изучены в разных аспектах. Их систематика, однако, многократно пересматривалась. Центральный вид S. cerevisiae известен в десятках синонимов, которые в настоящее время рассматриваются как производственные расы, но не самостоятельные виды.
Класс Archiascomycetes Семейство Saccharomycetaceae
Arxiozyma
Порядок Schizosaccharomycetales Citeromyces
Schizosaccharomyces Cyniclomyces
Порядки Taphrinales и Debaryomyces
Protomycetales Dekkera
Taphrina (анаморфа Issatchenkia
Lalaria) Kluyveromyces
Protomyces Lodderomyces
Pachysolen
Класс Hemiascomycetes Pichia (=Hansenula)
Порядок Saccharomycetales Saccharomyces
Семейство Ascoideaceae Saturnispora
Ascoidea Torulaspora
Williopsis
Семейство Cephaloascaceae Zygosaccharomyces
Cephaloascus
Семейство Saccharomycodaceae
Семейство Dipodascaceae Hanseniaspora
Dipodascus Nadsonia
Galactomyces Saccharomycodes
Sporopachydermia Wickerhamia
Stephanoascus
Wickerhamiella Семейство Saccharomycopsidaceae
Yarrowia Ambrosiozyma
Zygoascus Saccharomycopsis
Семейство Endomycetaceae
Endomyces Класс Euascomycetes
Семейство Eremotheciaceae Oosporidium
Eremothecium «Черные дрожжи»
Coccidiascus Анаморфные роды
Семейство Lipomycetaceae Aciculoconidium
Babjevia Arxula
Dipodascopsis Blastobotrys
Lipomyces Botryozyma
Zygozyma Brettanomyces
Семейство Metschnikowiaceae Candida
Clavispora Geotrichum
Metschnikowia Kloeckera
Myxozyma
Schizoblastosporion
Sympodiomyces
Trigonopsis
Рисунок 3 Классификация аскомицетовых дрожжей

Рисунок 4 – Многостороннее почкование у Saccharomyces cerevisiae
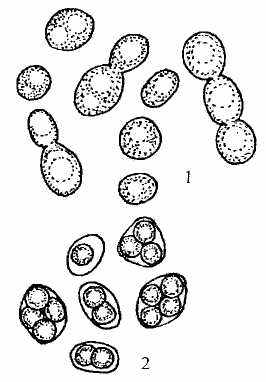
1 почкующиеся клетки; 2 аски со спорами
Рисунок 5 – Saccharomyces cerevisiae
В последнем руководстве по дрожжам (N. Kreger-van-Rij, 1984) к роду Saccharomyces отнесено семь видов, размножающихся вегетативно преимущественно в диплоидной фазе: Sacch. cerevisiae, Sacch. kluyveri, Sacch. exiguus, Sacch. dairensis, Sacch. servazzii, Sacch. tellustris, Sacch. unisporus. Как синонимы Sacch, cerevisiae рассматриваются Sacch. bayanus, Sacch. carlsbergensis и ряд других промышленно важных доожжей.
Наибольшее значение имеет Sacch. cerevisiae. К этому виду относятся расы дрожжей, используемые в хлебопечении, спиртовом производстве, пивоварении, виноделии, производстве кваса (см. раздел 3). Поэтому приводим характеристику вида Saccharomyces cerevisiae Hansen.
На солодовом сусле в трехсуточной культуре при 28 °С клетки имеют сферическую, эллипсоидальную или несколько удлиненную формы; располагаются единично или парами, иногда образуют короткие цепочки или мелкие грозди (см. рисунок 5). В зависимости от размера клеток штаммы этого вида можно разделить на три морфологические группы.
К первой группе относятся штаммы, имеющие самые крупные клетки (3,5…10,55,0…21,0 мкм), ко второй наименьшие (2,5…7,011,0…19,0 мкм), к третьей промежуточные (3,5…8,05,0…11,5 до 18,0 мкм) клетки. Некоторые штаммы образуют удлиненные клетки, достигающие 30 мкм и более.
Колонии у этих дрожжей пастообразные, кремовые или коричневато-кремовые, обычно с довольно ровной, гладкой, иногда слегка пузырчатой или покрытой точками поверхностью, с блестящими или тусклыми секторами. Край колоний цельный, иногда лопастный, изредка образуется примитивный псевдомицелий.
Аскообразование легко вызвать при высеве дрожжей на агар с ацетатом. Аски обычно содержат от одной до четырех спор шаровидной или эллипсоидальной формы. Сбраживают глюкозу, галактозу, сахарозу, мальтозу и на 1/3 раффинозу. В аэробных условиях используют глюкозу, галактозу, сахарозу, мальтозу, на 1/3 раффинозу. Способность к использованию L-сорбозы, трегалозы, мелецитозы, инулина, L-арабинозы, D-рибозы, глицерина, D-маннита, D-сорбита,
-метил-6-глюкозида и молочной кислоты варьирует. Не ассимилируют целлобиозу, лактозу, мелибиозу, крахмал, ксилозу, D-арабинозу,
L-рамнозу, эритрит, рибит, дульцит, салицин, янтарную и лимонную кислоты, инозит. Не используют в качестве источника азота NО3. Штаммы имеют различную способность расти на средах в отсутствие витаминов.
Штаммы Sacch. cerevisiae подразделяют на расы низового и верхового брожения. К расам низового брожения относится большинство винных и пивных дрожжей, к расам верхового спиртовые, хлебопекарные и некоторые пивные. Дрожжи низового брожения функционируют в производстве при температуре от 6 до 10 °С и ниже (до 0 °С), а верхового обычно температуре от 14 до 25 °С.
В конце брожения низовые дрожжи оседают на дно, формируя плотный осадок, верховые всплывают на поверхность и образуют «шапку». Способность последних подниматься на поверхность обусловлена тем, что клетки после почкования остаются соединенными в небольшой цепочке; пузырьки углекислого газа поднимают их на поверхность. Оба свойства, однако, не абсолютны.
По поведению в бродящей среде дрожжи разделяют также на хлопьевидные и пылевидные. В основе этого разделения лежит различие в их флоккуляционных свойствах (флоккуляция обратимая агрегация, или агглютинация, клеток).
Хлопьевидные дрожжи в конце брожения слипаются в комки («флоккулы») и либо оседают на дно, либо поднимаются на поверхность. Пылевидные дрожжи в течение всего процесса брожения находятся во взвешенном состоянии. Флоккулируют дрожжи как низового, так и верхового брожения. Клетки хлопьевидных дрожжей крупнее и тяжелее, чем пылевидных; последние особенно подвержены автолизу. Пылевидные дрожжи дают меньший прирост биомассы, но обладают более высокой бродильной активностью и полнее сбраживают сусло, образуют больше диацетила и высших спиртов. Хлопьевидные дрожжи лучше создают аромат напитков. Способность дрожжей к хлопьеобразованию не является стойким признаком, и штаммы могут ее постепенно утрачивать.
