Методические рекомендации по выполнению лабораторного и научно-исследовательского практикума для студентов всех форм обучения специальностей 240901 «Биотехнология» и260204 «Технология бродильных производств и виноделие»
| Вид материала | Методические рекомендации |
- «Технология бродильных производств и виноделие», 1195.96kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 981.77kb.
- Методические рекомендации по выполнению самостоятельной работы и изучению дисциплин, 855.43kb.
- Методические рекомендации по выполнению самостоятельной работы и изучению дисциплины, 846.76kb.
- Учебное пособие по дисциплине для студентов специальности 270500 «Технология бродильных, 1164.77kb.
- Учебно-методический комплекс для студентов дневной и заочной формы обучения по специальности, 1588.96kb.
- Методические рекомендации к лабораторным работам по курсу «Основы проектирования, 616.07kb.
- Учебное пособие по дисциплине для студентов специальностей 270500 «Технология бродильных, 2133.55kb.
- Методические рекомендации по выполнению лабораторных работ для студентов специальностей, 200.14kb.
- Методические указания, 361.46kb.
3.9.2 Биосинтез эргостерина
Стерины, каротиноиды, соединения групп Q-коферментов относятся к терпенам, синтезирующимся по «изопреновому правилу», по которому каротиноиды (политерпены), стерины (тритерпены), а также убихиноны и гиббереллиновая кислота синтезируются из изопреновых единиц в четыре стадии:
- образование мевалоната из ацетил-КоА или лейцина;
- дегидратирование и декарбоксилирование мевалонилпирофосфата с образованием «активного изопрена» изопентенилпирофосфата и конденсация изопреновых звеньев с образованием ациклических терпенов разной длины;
- циклизация ациклических структур;
- дальнейшая модификация циклической структуры.
Интермедиатами синтеза стеринов являются ацетат, мевалоновая кислота, сквален, ланостерин. Сквален – общий предшественник стеринов растительного, животного происхождения и дрожжей, накапливается и при аэрации превращается в стерин. Первые две стадии синтеза стеринов схожи с синтезом каротиноидов, расхождение на уровне фарнезилпирофосфата, который в случае стеринов димеризуется с образованием сквалена.
(
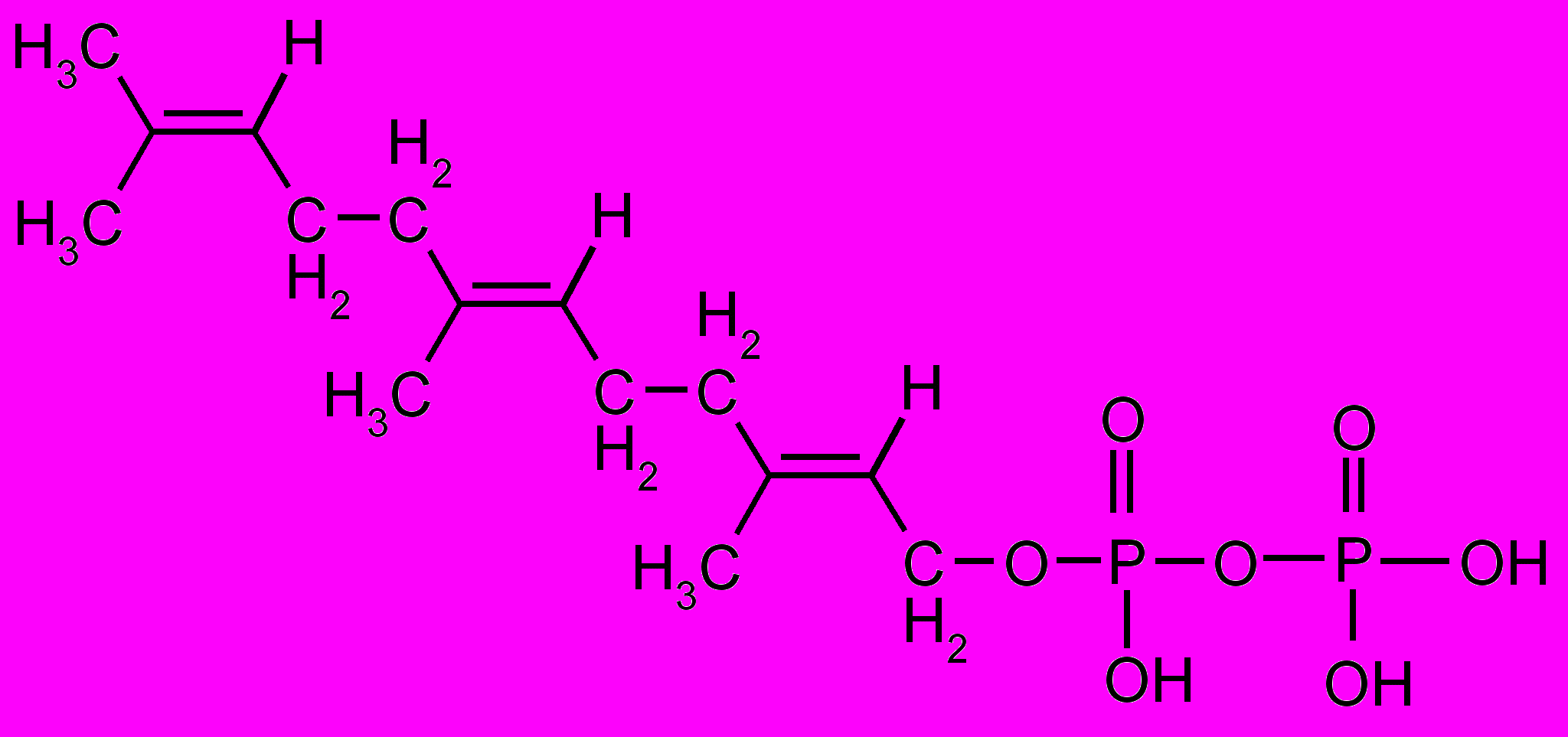
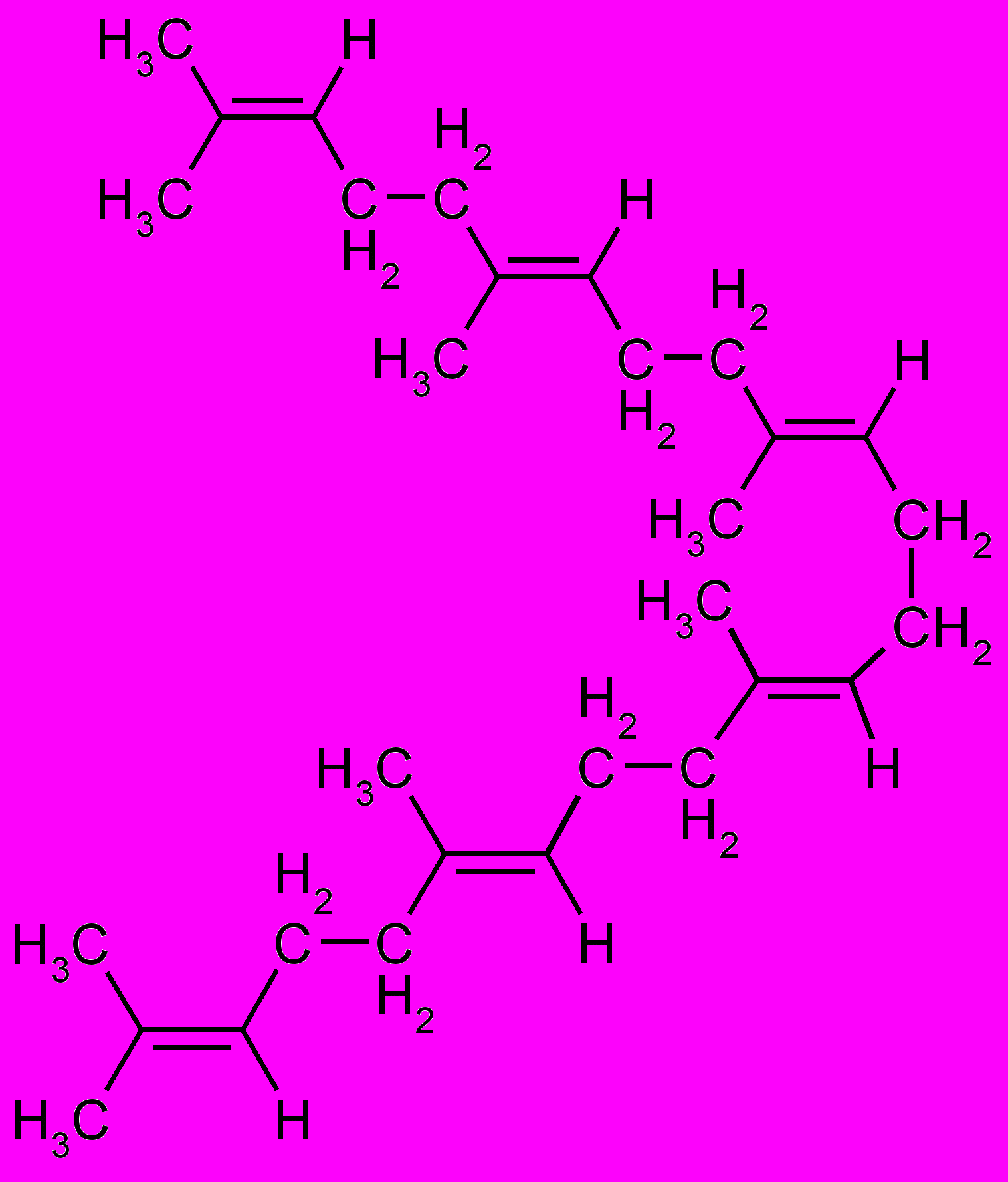
) Фарнезилпирофосфат Сквален ()
Затем при циклизации и отщеплении протона образуется ланостерин, предшественник холестерина и эргостерина:
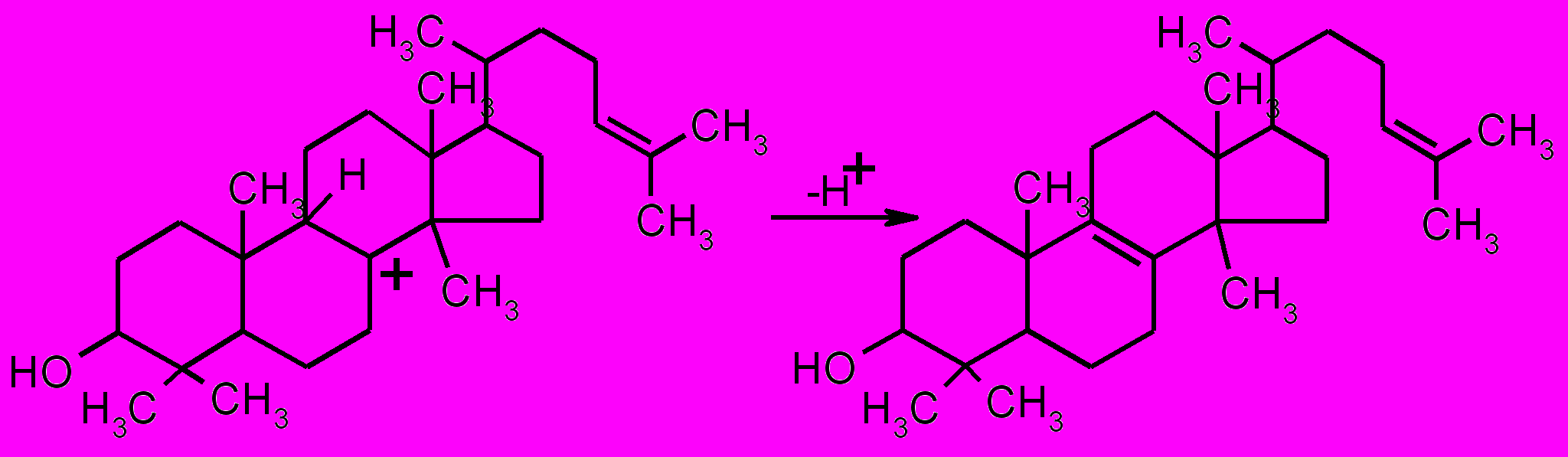
Сквален Ланостерин
Превращение ланостерина в эргостерин происходит в результате следующих стадий:
- деметилирования ланостерина;
- трансалкилирования с образованием 24(28)-метиленовой группы и одновременным восстановлением С-24(25)двойной связи;
- десатурации боковой цепи с образованием С-22(23) двойной связи (предполагается участие монооксигеназной системы, содержащей цитохром Р-450);
- изомеризации 8 7;
- дегидрогенирования с образованием 5;
- восстановления 24(28)-метиленовой группы до метильной.
Последовательность реакций точно не установлена, но выделен ряд веществ, которые рассматривают как интермедиаты на пути от ланостерина к эргостерину. Предполагают, что ферменты, участвующие в поздних стадиях синтеза эргостерина, локализуются в микросомах дрожжей.
3.9.3 Продуценты эргостерина
Источниками эргостерина в природе являются фитопланктон, бурые и зеленые водоросли, особенно богаты эргостерином дрожжи и плесневые грибы, которые служат сырьем для его промышленного получения. Эргостерин – основной стерин дрожжей, на который приходится 60–90 % от других стеринов: содержание эргостерина составляет 0,20,5 % сухой биомассы дрожжей, иногда достигает 10 %. Культурные расы дрожжей всегда богаче стеринами, чем дикие; наибольшее количество стеринов содержат пивные и пекарские дрожжи. По эргостеролсинтезирующей способности при поверхностном культивировании дрожжи располагаются в следующий ряд (исходя из процентов эргостерола в абсолютно сухих дрожжах): Saccharomyces carlsbergensis (0,494,30); Saccharomyces ellipsoideus (1,21,5); Rhodotorula glutinis (0,70,9); Candida utilis (0,40,6); Candida tropicalis (0,20,3). В мицелии грибов Aspergillus и Penicillium содержание стеринов 1,21,4 % в расчете на сухой мицелий. Penicillium westlingtii содержат 2,20 %.
Бактерии синтезируют ничтожные количества стеринов. Содержание в их клетках стеринов и сквалена составляет 0,0010,1 мг/г сухой биомассы. Стерины обнаружены у Lactobacillus arabinosus, Lactobacillus pentosus, Escherichia coli, Azotobacter chroococcum, Micromonospora sp., Streptomyces griseus, Sphaerotillis natans, Rhodospirillum rubrum.
Большие количества сквалена синтезируют Halobacterium cutirubrum (1,0 мг/г сухих клеток) и Methylococcus capsulatus (5,5 мг/г сухих клеток). Сквален и его четыре гидроформы выделены из метанообра-зующей бактерии Methanobacillus kuzneceovii. В клетках Mycobacterium rubrum обнаружено холестерина 7,08,0 % от общего количества липидов.
3.9.4 Условия образования эргостерина дрожжами
Наиболее высокие количества стеринов синтезируют штаммы Saccharomyces carlsbergensis ИНМИ-101 и Saccharomyces carlsbergensis. Биомасса Saccharomyces carlsbergensis может содержать более 10 % эргостерина при условии хорошей аэрации в процессе культивирова-ния. В анаэробных условиях в клетках дрожжей накапливается предшественник эргостерина – сквален. Показано, что кислород индуцирует синтез стеринов, активируя эпоксидазу сквалена – превого фермента биосинтетического пути. Индукция синтеза эргостерина начинается при 0,03%-ном содержании О2 в газовой фазе и достигает максимума при 2%-ной концентрации.
Для биосинтеза стеринов дрожжами важно, чтобы среда содержала большой избыток углеводов и мало азота. Пекарские дрожжи, богатые белком, содержат мало стеринов. В дрожжах рода Candida высокое соотношение C:N в среде приводит к накоплению липидов, а не эргостерина.
Для дрожжей, усваивающих н-алканы, они являются лучшим источником углерода для синтеза эргостерина, чем углеводы. Это может быть связано с образованием из н-алканов ацетата (предшественника эргостерина) в результате -окисления парафинов. Для пекарских дрожжей ацетат является хорошим источником углерода в биосинтезе стеринов.
Стимулирующее действие на образование стеринов дрожжами оказывают ингибиторы гликолиза и разобщители окислительного фосфорилирования и дыхания. Важно также присутствие в среде достаточного количества витаминов, главным образом пантотеновой кислоты, которая в составе КоА участвует в построении молекулы эргостерина.
При действии на дрожжи рентгеновского излучения содержание эргостерина увеличивается в 2-3 раза, что объясняется угнетением процесса аминирования, сопровождающегося повышением синтеза липидов. Подобно ионизирующим облучениям действуют радиомиметические вещества, нарушающие метаболизм клетки и стимулирующие липидный обмен. Например, при комбинированном воздействии на клетки дрожжей эмбихина и рентгеновского излучения выход стеринов Saccharomyces cerevisiae увеличивается на 109 % по сравнению с контролем.
Полиеновые антибиотики нистатин и филипин, взаимодействующие с мембранами дрожжей, повышают уровень стеринов в клетках на 5060 % по сравнению с контролем.
Синтез стеринов не связан с ростом дрожжей. Содержание стеринов повышается по мере старения культуры и стеринообразование продолжается после остановки роста клеток.
Роль стеринов в метаболизме продуцентов не до конца ясна. Наблюдается связь между дыхательной активностью дрожжей и образованием эргостерина. В анаэробных условиях дрожжи содержат много сквалена и мало эргостерина. Роль эргостерина как структурного компонента мембран связывают с проницаемостью клеточных мембран.
Наиболее богата стеринами у дрожжей фракция митохондрий. Предполагается, что митохондрии принимают участие в биосинтезе стеринов, которые затем участвуют в образовании митохондриальных структур и оказывают влияние на их функциональную активность.
Стерины содержат в молекуле ОН-группу и в клетке находятся в виде эфиров жирной кислоты. Поэтому существует предположение, что образование стеринов – это реакция детоксикации, защищающая организм от избыточного синтеза жирных кислот. Стерины используются для транспорта непредельных кислот и других соединений в клетке. Микоплазмы включают стерины в клеточные мембраны. Дрожжи Saccharomyces cerevisiae в условиях пониженного содержания растворенного О2 в среде поглощают экзогенные стерины, часть из которых подвергают трансформации с образованием ценных стероидов. Например, демостерин клетки дрожжей превращают в
24-метилхолестерин, а 24,25-дигидроланостерин преобразуют в
7-дегидрохолестерин, который служит интермедиатом в биосинтезе витамина D3.
3.9.5 Промышленное получение и применение эргостерина
В промышленности эргостерин получают из дрожжей Saccharomyces cerevisiae, Saccharomyces carlsbergensis и мицелиальных грибов. Засев производят большим количеством инокулята. Культивирование ведут при высокой температуре и сильной аэрации в среде, содержащей большой избыток источников углерода по отношению к источникам азота.
Дрожжи и грибы Aspergillus и Penicillium используют для получения кристаллического витамина D2 или концентрата. В качестве концентрата в животноводстве применяют облученные сухие дрожжи.
Максимум поглощения эргостерина наблюдается при 280 нм. Это излучение возбуждает отдельные связи колец А и В в молекуле эргостерина и вызывает его превращение в витамин D2. Облучение производят ультрафиолетовыми лампами с длиной волны 280300 нм (сухие дрожжи) или в тонком слое 5 %-ной суспензии дрожжей. При более коротковолновом или длинноволновом излучении повышается выход других соединений стериновой природы.
На выход витамина D2 и образование других соединений влияют длительность облучения, температура, наличие примесей.
Промышленность выпускает препарат «Кормовые гидролизные дрожжи, обогащенные витамином D2». В 1 г абсолютно сухих дрожжей содержится 5000 ИЕ витамина D2, не менее 46 % сырого протеина и незаменимые аминокислоты, в том числе лизин, метионин, триптофан.
Для получения кристаллического витамина D2 дрожжи или мицелий грибов подвергают гидролизу соляной кислотой при 110 С. Гидролизованную массу обрабатывают спиртом при 7578 С и после охлаждения до 1015 С фильтруют. Фильтрат упаривают до содержания в нем 50 % сухих веществ и используют как концентрат витаминов группы В.
Витамин D2 получают из массы, оставшейся после фильтрации. Массу промывают, сушат, измельчают и дважды обрабатывают при температуре 78 С трехкратным объемом спирта.
Спиртовые экстракты сгущают до 70%-ного содержания сухих веществ. Таким образом получают липидный концентрат. Его омыляют раствором NaOH, а стерины остаются в неомыленной фракции. Кристаллы эргостерина выпадают из раствора при 0 С. Очистку кристаллов проводят путем перекристаллизации, последовательным промыванием 69%-ным спиртом, смесью спирта и бензола (80:20) и повторной перекристаллизацией. Полученные кристаллы эргостерина сушат, растворяют в эфире, облучают, после чего эфир отгоняют, а раствор витамина концентрируют и кристаллизуют.
Для получения масляного концентрата раствор витамина после фильтрации разбавляют маслом до стандартного уровня.
Источником получения эргостерина может быть мицелий грибов, остающийся как отход антибиотической промышленности и производства лимонной кислоты.
Промышленное получение эргостерина возможно также из липидной фракции Candida quilliermondii, использующей н-алканы.
Сухую массу дрожжей для извлечения остаточных углеводородов экстрагируют петролейным эфиром. Получаемая при этом липидная фракция (микробный жир) является побочным продуктом. Из нее выделяют эргостерин, убихинон-9 и другие жирорастворимые соединения.
Обогащенные эргостерином, облученные ультрафиолетовым излучением дрожжи используют в животноводстве как кормовую добавку.
Эргостерин – исходный продукт для получения некоторых стероидных гормонов, лечебных и пищевых препаратов.
3.9.6 Сырье и реактивы для промышленного получения
эргостерина
При промышленном получении эргостерина по технологической инструкции требуется:
- пекарских дрожжей 600 кг;
- едкого калия 100 кг;
- спирта этилового 975 мл.
В реактор вместимостью 2 м3 загружают 600 кг дрожжей, 100 кг чешуйчатого едкого калия, 975 л этилового спирта, при перемешивании нагревают до кипения и выдерживают до шести часов при температуре 7884 С. Массу сливают на нутч-фильтр, при этом получают твердые остатки дрожжевых клеток и частично гидролизованных белков (белковые отходы), которые преимущественно оседают на стенках и мешалке реактора. После слива экстракта их промывают водой.
Экстракт после фильтрования упаривают до содержания сухих веществ 3639 %, из концентрата после кристаллизации, осуществляемой при температуре 1520 С в течение 68 ч, осаждают эргостерин-сырец, содержащий около 30 % эргостерина, а также другие дрожжевые стерины и щелочь, получают 45 кг сырца. Его, не высушивая, подвергают двух-, трехкратному кипячению с 65%-ным этиловым спиртом в соотношении 15, 20 и 16 л на 1 л сырца, растворяя при этом щелочь и стерины (операция аффинации). После сушки при 5060 С получают 1,21,4 кг аффинированного эргостерина, содержащего не менее 88 % основного вещества и до 3 % влаги. Тпл = 157159 С.
ЛИТЕРАТУРА
- Промышленная микробиология / под. ред. Н.С. Егорова. М.: Высшая школа, 1989. – 503 с.
- Березовский, В.М. Химия витаминов / В.М. Березовский. М.: Наука, 1973. – 489 с.
- Теппер, Е.З. Практикум по микробиологии / Е.З. Теппер, В.К. Шильников, Г.И. Переверзева. М.: Колос, 1993. – 321 с.
- Нетрусов, А.И. Практикум по микробиологии / А.И. Нетрусов [и др.]. – М.: Академия, 2005. – 608 с.
- Драк, А.И. Получение эргостерина без коагуляции дрожжевой массы / А.И. Драк, Г.И. Аксенович, В.В. Высоцкий, Я.С. Мелляр // Химико-фармацевтический журнал. – 1989. № 6. – С. 4143.
- Бабьева, И.П. Биология дрожжей / И.П. Бабьева, И.Ю. Чернов. – М.: Товарищество научных изданий КМК, 2004. – 221 с.
Содержание
| ВВЕДЕНИЕ______________________________________________ | 3 |
| 1 ПРАКТИЧЕСКАЯ ЧАСТЬ_________________________________ | 4 |
| 1.1 Задание_____________________________________________ | 4 |
| 1.2 Оценка жизнеспособных клеток дрожжей в сравнении с количеством посторонней микрофлоры______________________ | 4 |
| 1.3 Количественное определение сахаров в питательной среде после автоклавирования и культивирования___________________ | 6 |
| 1.4 Культивирование дрожжей в аэробных условиях__________ | 8 |
| 1.5 Культивирование дрожжей в анаэробных условиях________ | 10 |
| 1.6 Получение эргостерина из биомассы дрожжей_____________ | 12 |
| 2 ТЕОРЕТИЧЕСКАЯ ЧАСТЬ________________________________ | 15 |
| 2.1 Общая характеристика дрожжей________________________ | 15 |
| 2.2 Систематика дрожжей_________________________________ | 16 |
| 2.3 Классификация дрожжей_______________________________ | 18 |
| 2.4 Распространение дрожжевых грибов в природе____________ | 24 |
| 2.5 Особенности метаболизма дрожжей_____________________ | 26 |
| 2.6 Продукты метаболизма________________________________ | 33 |
| 2.7 Лимитирующие факторы_______________________________ | 34 |
| 3 ПРОМЫШЛЕННОЕ ИСПОЛЬЗОВАНИЕ ДРОЖЖЕЙ_________ | 40 |
| 3.1 История использования________________________________ | 40 |
| 3.2 Традиционные процессы_______________________________ | 40 |
| 3.3 Виноделие___________________________________________ | 42 |
| 3.4 Пивоварение_________________________________________ | 43 |
| 3.5 Хлебопечение________________________________________ | 45 |
| 3.6 Дрожжи как источник белка____________________________ | 48 |
| 3.7 Производство этанола_________________________________ | 50 |
| 3.8 Различные продукты, получаемые из дрожжей____________ | 54 |
| 3.9 Эргостерин__________________________________________ | 56 |
| ЛИТЕРАТУРА____________________________________________ | 65 |
Ламберова Марина Эдуардовна
Кошелев Юрий Антонович
Войнаровская Тамара Иосифовна
ОЦЕНКА ЭФФЕКТИВНОСТИ КУЛЬТИВИРОВАНИЯ
ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE
Учебное пособие
Редактор Соловьева С.В.
Подписано в печать 21.08.2007. Формат 6084 1/16
Усл. п. л. 4,1. Уч.-изд. л. 4,4
Печать ризография, множительно-копировальный
аппарат «RISO TR-1510»
Тираж 100 экз. Заказ 2007-49
Издательство Алтайского государственного
технического университета
656038, г. Барнаул, пр. Ленина, 46
Оригинал-макет подготовлен ИИО БТИ АлтГТУ
Отпечатано в ИИО БТИ АлтГТУ
659305, г. Бийск, ул. Трофимова, 29
