Проведения недели химии
| Вид материала | Конкурс |
- План проведения недели химии и биологии Мероприятия Участники Место проведения Час, 23.48kb.
- План проведения мероприятий: Понедельник открытие Недели химии Вторник, 191.23kb.
- План проведения Недели предметов естественно математического цикла в мбоу сош с. Посёлки, 33.13kb.
- Отчёт о проведении недели естественных наук. Время проведения, 26.04kb.
- План проведения недели русского языка и литературы. Дни недели, 376.24kb.
- Примерный план проведения тематической недели, посвященной 300-летию юбилея М. В. Ломоносова, 34.17kb.
- Рекомендации к проведению Недели «Итальянские каникулы» в библиотеках «цбс», 161.36kb.
- Как лучше составить план проведения предметной недели по английскому языку? Во время, 29.73kb.
- План лекций по токсикологической химии для студентов заочного обучения (V курс 9семестр), 23.62kb.
- О проведении областной недели «Музей и дети», 31.08kb.
Д/З: 10.8 выучить строение ПСХЭ /в тетради/ построить энергетические диаграммы атомов кислорода и серы.
Карточка-задание №1. /Слава/
В следующих предложениях вставьте пропущенные слова.
“Атом углерода содержит в ядре __________протонов и _______ электронов. Число электронов, находящихся вокруг ядра, как число протонов, равно_________________ элемента.
Число нейтронов равно __________________________________.
Карточка-задание №2. /Альбина/
Определите число протонов, нейтронов и электронов для атома:
- Калия
- Фосфора
1. Химический элемент VII группы 4-го периода ПСХЭ Д.И.Менделеева.
2. Химический элемент, который имеет 34 электрона.
3. Химический элемент, который имеет 49 протонов.
4. Первый элемент ПСХЭ Д.И.Менделеева.
5. Химический элемент, получивший свое название в честь континента. /лантаноид/
6. Химический элемент, внешний энергетический уровень которого имеет строение 3s23p5.
7. Газ, дающий красное свечение газосветных ламп и утверждающий, что он – это не он.
8. Металл, занимающий в ПСХЭ место в 4 периоде, 1 группе.
9. Элемент, названный в знак признания заслуг выдающегося русского ученого, создателя Периодической системы химических элементов.

1. Химический элемент VII группы 4-го периода ПСХЭ Д.И.Менделеева.
2. Химический элемент, который имеет 34 электрона.
3. Химический элемент, который имеет 49 протонов.
4. Первый элемент ПСХЭ Д.И.Менделеева.
5. Химический элемент, получивший свое название в честь континента. /лантаноид/
6. Химический элемент, внешний энергетический уровень которого имеет строение 3s23p5.
7. Газ, дающий красное свечение газосветных ламп и утверждающий, что он – это не он.
8. Металл, занимающий в ПСХЭ место в 4 периоде, 1 группе.
9. Элемент, названный в знак признания заслуг выдающегося русского ученого, создателя Периодической системы химических элементов.
Тема урока: “Белки.”
Цели урока:
- Познакомить учащихся с новым классом органических соединений.
- Дать представление о строении, свойствах белков, о роли белков в организме.
- Показать зависимость функций белка от его химического строения и пространственной структуры.
- Рассмотреть биологическую роль белков;
Образовательные задачи: дать знания учащимся о составе, строении и свойствах белка
Познавательные задачи: совершенствовать умения учащихся анализировать, сравнивать, устанавливать взаимосвязь между строением и свойствами
Воспитательные задачи: с помощью опыта “изменение структуры и свойств белков при воздействии на них алкоголя” убедить учащихся, что спирт губительно воздействует на организм человек
Методическая цель: показать формы и методы самостоятельных работ на уроке изучения новых знаний, опираясь на химический эксперимент
Тип урока: интегрированный урок - лекция.
Метод урока: изложение с постановкой проблемных вопросов, демонстрация.
Оборудование:
- Плакаты:
- Формулы аминокислот.
- Типы структур белка.
- Превращение белка в организме.
- Классификация белков.
- Формулы аминокислот.
- Опыт:
- спиртовка.
- Пробирка.
- Держатель.
- Куриное яйцо.
- Химический стакан.
- спиртовка.
План урока:
- Организационный момент.
- Постановка проблемного вопроса.
- Изложение основного материала урока с демонстрацией опыта.
- Закрепление изученного.
- Задание на дом.
… Жизнь – есть способ существования
белковых тел.
(Ф.Энгельс)
Учитель химии. «Жизнь есть способ существования белковых тел» – этими словами Ф.Энгельса можно начать наш урок, тема которого «Белки». Основные учебные цели урока – проследить взаимосвязь строения белка с его свойствами и функциями, а также связь белкового питания человека с его здоровьем. Т. е. доказать, что жизнь – это способ существования белковых тел. Эта тема изучается в курсе химии и биологии, поэтому сегодня мы будем говорить не только о химических свойствах и строении молекулы, но и о значении белков в организме человека.
Белки – это природные полимеры, состоящие из остатков a-аминокислот. Ну а с аминокислотами мы познакомились с вами на прошлом уроке. И прежде чем приступать к изучению новой темы проверим, как вы усвоили аминокислоты.
Так как вас очень много и всех я опросить не смогу, мы поступим следующим образом:
Вам ребята я дам выполнить задания на каточках, а с остальными мы побеседуем.
Карточка №1
Напишите реакцию взаимодействия аминоуксусной кислоты с гидроксидом калия.
Карточка№2
Составьте уравнение реакции аминопропионовой кислоты с соляной кислотой.
Карточка№3
Докажите, что аминокислоты проявляют амфотерные свойства.
Карточка №4
Перечислите «незаменимые» аминокислоты.
Карточка №5
Изобразите структурные формулы изомерных аминокислот состава С3Н7О2N и назовите их.
Фронтальный опрос:
- Какие соединения называются аминокислотами?
- Какие химические свойства проявляют аминокислоты?
- Напишите реакцию взаимодействия аминоуксусной кислоты с гидроксидом натрия.
- Какое значение играют аминокислоты в организме человека?
- Какова общая формула аминокислот?
Так вот ребята всего двадцатью различными аминокислотами, формулу которых мы только что записали, образованы все белки. Аминокислоты могут соединятся между собой, происходит образование пептидной связи, в которой участвуют карбоксильная группа одной молекулы и аминогруппа другой. Например:
-
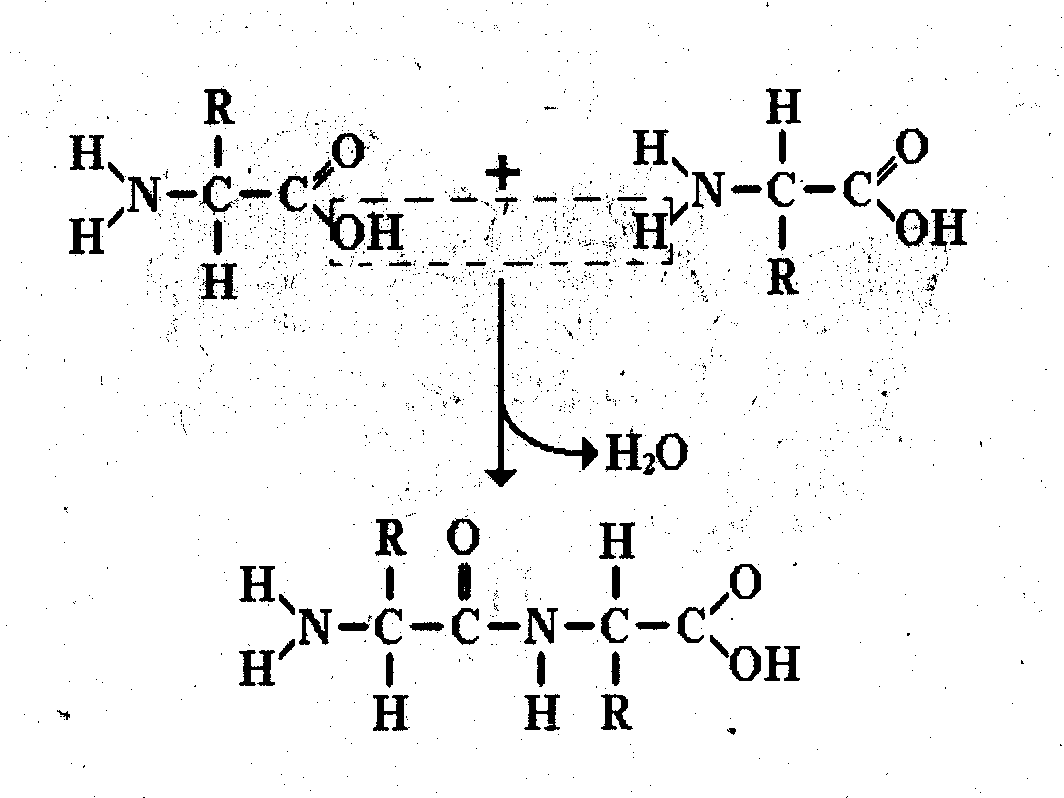
дипептид (из двух аминокислот)

СО – NH - пептидная связь.
Белки представляют собой полимерные цепи, образующиеся по реакции поликонденсации, состоящие из десятков, тысяч, миллионов и больше остатков аминокислот, связанных между собой пептидными связями.
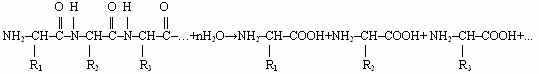
Фрагменты белков, состоящие из ограниченного числа аминокислотных остатков, называются пептидами: ди-, три-, ит.д. пептиды. Если остатков много, но их число не превышает 10 000, то это полипептиды. При большей длине цепи – белки. Это различие полипептидов и белков имеет физический смысл: белки подвергаются денатурации, а полипептиды нет. А что такое денатурация мы с вами узнаем, когда будем говорить о химических свойствах белков.
Вы наверное, слышали о проблеме совместимости тканей при пересадке органов от одного организма к другому. Несовместимость – следствие того, что каждый организм имеет собственный набор белков. Индивидуальность белковой молекулы определяют радикалы аминокислот и взаимное расположение в молекуле белка, называют первичной структурой.
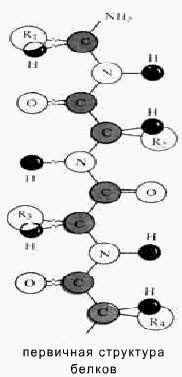
И возможности образования разных первичных структур неисчислимы. Только двадцатизвенных пептидов может существовать 2 108 . А это очень короткие цепи, которые ещё белками не назовешь. Для белковых тел характерны огромные молекулярные массы значения, которых достигает в некоторых случаях почти миллиарда. Например, молекула коллагена его масса = 350 000 и имеет длину около 0,3 мкм. На стр. 141 рис. 40.1
Эта форма часто определяет растворимость белков в воде:
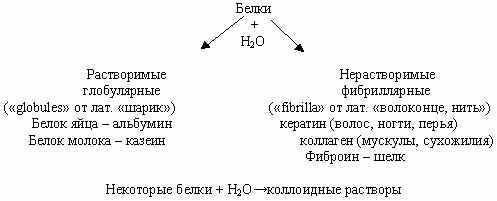
Естественно, что длинная молекула не может быть строго линейной. В результате её изгибания и сворачивания возможно взаимодействие между её отдельными участками. Это взаимодействие приводит к образованию водородных связей с участием атомов и кислорода, которые регулярно чередуются вдоль цепи. Поэтому эти связи способствуют образованию регулярной спиралевидной структуры, которая и называется вторичной структурой белковой молекулы.
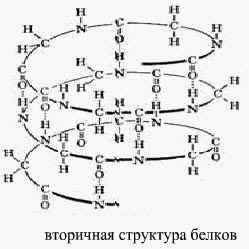
. В пространстве закрученная спираль ППЦ образует третичную структуру белка, которая поддерживается взаимодействием разных функциональных групп ППЦ.
- –S–S– (дисульфидный мостик)
- –СООН и –ОН (сложноэфирный мостик)
- –СООН и –NH2 (солевой мостик)

Некоторые белковые макромолекулами могут соединяться друг с другом и образовывать крупные молекулы. Полимерные образования белков называются четвертичными структурами (гемоглобин только при такой структуре способен присоединять и транспортировать О2 в организм)
Химические свойства белков.
1. Наличие в белке двух функциональных групп (-NH2-аминогруппа, -СООН-карбоксильная группа) обуславливает свойство амфотерности – возможности реагировать как с кислотами, так и с щелочами.
2. Гидролиз. В зависимости от условий разделяют:
- щелочной,
- кислотный,
- температурный гидролиз.
Схема гидролиза: Белок + вода
 Аминокислоты.
Аминокислоты.3. Качественные реакции на белки – цветные реакции. Например, окрашивание кератина кожи под действием азотной кислоты в желтый цвет.
С солями меди в присутствии щелочи белки дают фиолетовую окраску. Это качественная реакция на пептидную группу.
4. Денатурация – потеря белком четвертичной, третичной и вторичной структуры без нарушения первичной.
Демонстрация опыта. В пробирку помещаем раствор куриного белка в воде. Пробирку нагреваем над пламенем спиртовки, соблюдая все правила безопасности.
В

пробирке происходит процесс денатурации белка – из прозрачного альбумин становится белым. С латинского alba – белый.
После остывания пробирки белок, выпавший хлопьями, не растворяется – необратимая денатурация.
Денатурацию могут вызывать различные факторы: температура, рентгеновское излучение, концентрированные растворы кислот и щелочей и др. К чему может привести денатурация?
- нарушение антигенной чувствительности белка
- блокирование ряда иммунологических реакций
- нарушение обмена веществ
- воспаление слизистой оболочки ряда органов пищеварения (гастриты, колит)
- камнеобразование (камни имеют белковую основу)
Процесс, обратный денатурации называется ренатурацией.
Процесс денатурации белка может происходить и в человеческом организме при повышении температуры. Так при
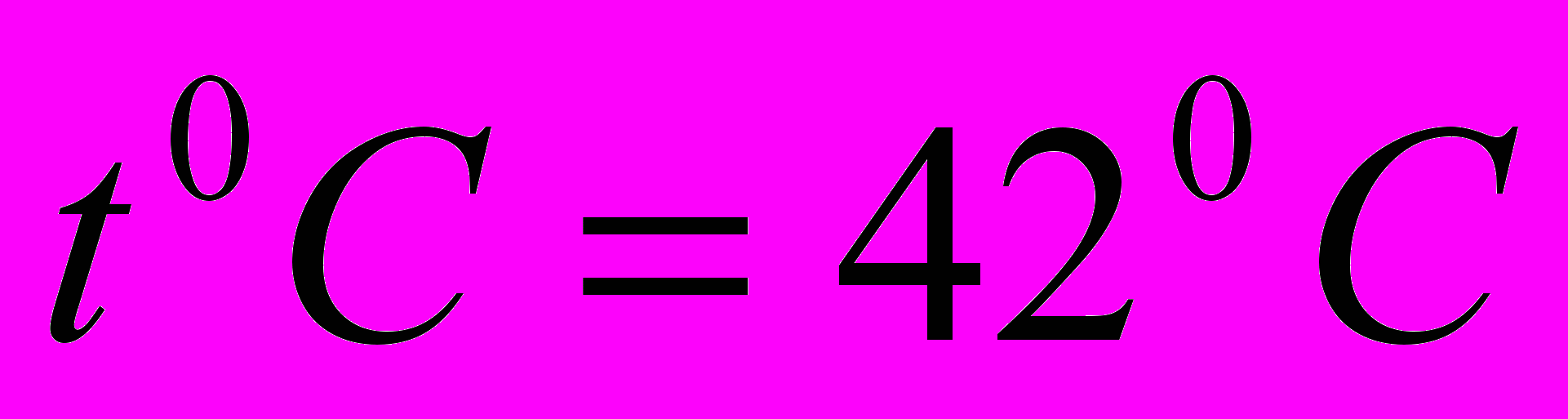 начинается денатурация белков клеток.
начинается денатурация белков клеток.Белки многих вирусов и м/о денатурируют при меньших значениях температуры. Поэтому при различных инфекционных заболеваниях врачи не всегда рекомендуют снижать температуру лекарственными препаратами.
. Функции белков в организме.
Итак, состав и структура белка обуславливают его химические свойства, а они в свою очередь определяют функции белка в клетке.
Какие функции играет белок в организме человека?
Закрепление изученного материала.
Занятия проводятся в форме брифинга.
Вопросы к брифингу:
- Белок иначе называют…
- Что является мономерами белка?
- Сколько незаменимых АК известно?
- Какие вещества называются белками?
- Каков атомарный состав белков?
- Какая связь поддерживает вторичную структуру?
- Как называется связь, образующая ППЦ?
- Вторичная структура белковой молекулы в пространстве напоминает…
- За счет каких взаимодействий образуются третичная структура?
- Почему белки относят ВМС?
- Что в переводе с греческого означает “протеин”?
- На какие две группы делят белки по их отношению к Н2О?
- Что такое “денатурация”?
- Как называется процесс взаимодействия белков с Н2О?
VI. Рефлексия
- Что заинтересовало вас сегодня на уроке более всего?
- Как вы усвоили пройденный материал?
- Какие были трудности? Удалось ли их преодолеть?
- Пригодятся ли вам знания, полученные сегодня на уроке?
Вывод: Понятие “белок” и “жизнь” неразрывно связаны друг с другом. Что такое жизнь? откуда она появилась на Земле? Эти вопросы волновали людей всегда. Белок – вот самая высшая ступень развития вещества, обусловившая появление человека и жизни вообще на Земле.
“Жизнь есть способ существования белковых тел…”
VII. Итоги урока. Оценки за урок.
VIII. Домашнее задание.
40.4 задание 4 -5 стр. 145.
Карточка №1
Напишите реакцию взаимодействия аминоуксусной кислоты с гидроксидом калия.
Карточка№2
Составьте уравнение реакции аминопропионовой кислоты с соляной кислотой.
Карточка№3
Докажите, что аминокислоты проявляют амфотерные свойства.
Карточка №4
Перечислите «незаменимые» аминокислоты.
Карточка №5
Изобразите структурные формулы изомерных аминокислот состава С3Н7О2N и назовите их.
