Д. И. Менделеева прогнозирование свойств элементов и их соединений методические указания
| Вид материала | Методические указания |
- Химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых, 461.43kb.
- Модуль Теория строения атома. Периодический закон и периодическая система Д. И. Менделеева, 401.18kb.
- Химических элементов Д. И. Менделеева, 32.78kb.
- Программа, контрольные вопросы и упражнения по неорганической химии под редакцией проф.,, 600.91kb.
- Таблицы Д. И. Менделеева. Атомы в свою очередь состоят из более мелких частиц: протонов,, 951.76kb.
- Тема №1 «Общая химия», 73.57kb.
- Задачи изучения дисциплины, 16.34kb.
- Материалы для подготовки к экзамену по химии, 462.84kb.
- Характеристика химических элементов малых периодов по их положению в периодической, 97.2kb.
- Закон и периодическая система д. И. Менделеева, 334.53kb.
Электроотрицательность ЭО характеризует способность атомов в соединениях притягивать к себе электроны и рассчитывается по формуле
ЭО =
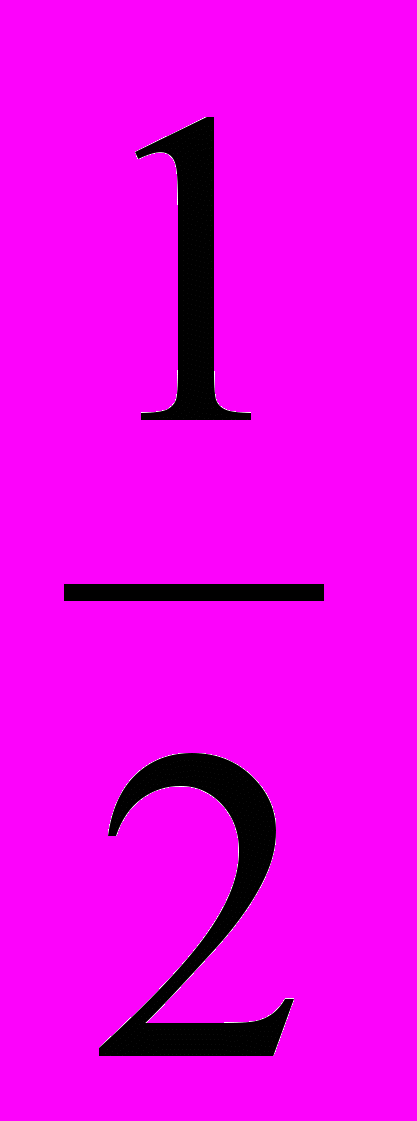 (Еи + Еср).
(Еи + Еср).Относительная электроотрицательность ОЭО – предложена Полингом, который составил таблицу ОЭО почти всех химических элементов периодической системы (табл. 1). ОЭО рассчитывается по формуле
ОЭО =
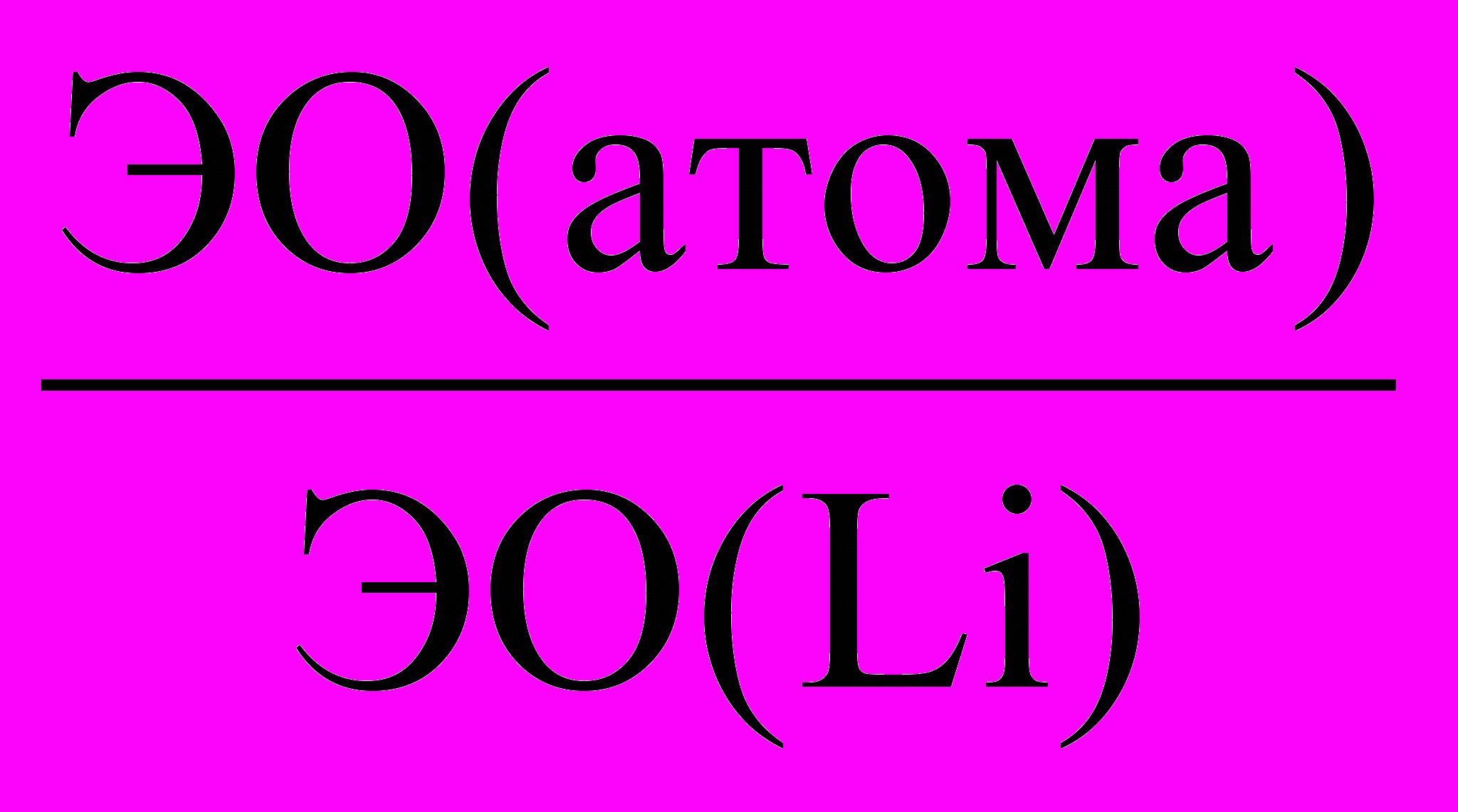 > 1, или < 1, или = 1.
> 1, или < 1, или = 1.ОЭО выражена небольшими числами, позволяющими легко сравнивать способность атомов отдавать или принимать электроны, оценивать длину и полярность химической связи во многих соединениях элементов. ОЭО также изменяется периодически, т.е. растет в периодах от начала к концу и в группах снизу вверх.
Наиболее электроотрицательные элементы: фтор, кислород, хлор, азот.
Таблица 1
Относительные электроотрицательности элементов
| Периоды | Группы элементов | ||||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||
| 1 | (Н) 2,16 | | | | | | Н 2,16 | | | | Не — |
| 2 | Li 1,00 | Ве 1,51 | В 2,07 | С 2,57 | N 3,16 | O 3,60 | F 4,20 | | | | Ne — |
| 3 | Na 1,04 | Mg 1,26 | Al 1,50 | Si 1,79 | P 2,16 | S 2,50 | Cl 2,90 | | | | Ar — |
| 4 | K 0,93 Cu 1,80 | Ca 1,07 Zn 1,70 | Sc 1,22 Ga 2,87 | Ti 1,34 Ge 2,07 | V 1,48 As 2,25 | Cr 1,60 Se 2,51 | Mn 1,64 Br 2,82 | Fe 1,68 | Co 1,75 | Ni 1,80 | Kr ─ |
| 5 | Rb 0,91 Ag 1,46 | Sr 1,02 Cd 1,51 | Y 1,14 In 1,54 | Zr 1,25 Sn 1,77 | Nb 1,26 Sb 1,87 | Mo 1,33 Te 2,07 | Tc 1,40 I 2,28 | Ru 1,46 | Rh 1,50 | Pd 1,39 | Xe |
| 6 | Cs 0,88 Au 1,45 | Ba 1,00 Hg 1,47 | La 1,11 Tl 1,47 | Hf 1,26 Pb 1,60 | Ta 1,38 Bi 1,72 | W 1,46 Po 1,82 | Re 1,51 At 1,96 | Os 1,56 | Ir 1,60 | Pt 1,47 | Rn |
| 7 | Fr 0,88 | Ra 1,00 | Aс 1,02 | | | | | | | | |
Лантаноиды: 1,11 – 1,20
Актиноиды: 1,02 – 1,30
5. Периодическое изменение свойств простых веществ
По положению химического элемента в периодической системе и электронной конфигурации его атомов можно прогнозировать многие физические и химические свойства простых веществ, в том числе агрегатное состояние, кристаллическую структуру.
5.1. Физические свойства простых веществ
Элементы начала периодов с большими атомными радиусами, низкими энергиями ионизации и малыми величинами ОЭО образуют простые твердые вещества с металлической кристаллической решеткой, в объеме которой распределены «полусвободные» электроны, называемые электронным газом. Эти элементы – металлы с металлическим блеском, высокой электро- и теплопроводностью.
Элементы конца периодов с меньшими атомными радиусами и большими величинами ОЭО образуют газообразные соединения (если элемент находится в верхней части групп и в конце периодов) или твердые простые вещества, проявляющие неметаллические свойства. Молекулы инертных газов, завершающих период, одноатомны (Ar, Kr, Ne, He …), других газообразных веществ – двухатомны (О2, Cl2, N2 …).
Простые вещества принято делить на металлы и неметаллы, обнаруживающие периодическое изменение многих физических свойств: пластичность, температуры плавления, твердости и коэффициента линейного расширения кристаллического тела, плотности и растворимости в воде и т.д.
5.2. Периодичность химических свойств простых веществ
Металлы – s, d, f-элементы и некоторые р-элементы (III группы главной подгруппы А, кроме бора B, и элементы Sn, Pb, Bi, Sb, Po из главных подгрупп 4, 5, 6, 7 групп). Атомы металлов имеют больший, чем у неметаллов, радиус, низкую электроотрицательность (ОЭО < 2) и 1, 2 или 3 валентных электрона на последнем энергетическом уровне, которые они легко отдают при химическом взаимодействии:
Ме − nē → Меn+
-
Восстановитель
Отдача
электронов
Процесс окисления
Окисли-тель
Металлы легко окисляются, т.е. они проявляют восстановительные свойства, образуют при окислении положительно заряженные ионы. Металлы называют электроположительными элементами. Величина степени окисления металлов, находящихся в IV, V, VI, VII группах, переменная: от +2 до высшей положительной степени окисления, равной номеру группы.
Неметаллы – это р-элементы, находящиеся в конце периодов в IV, V, VI, VII, VIII группах, и бор в III группе. Атомы неметаллов имеют более 3 валентных электронов на последнем энергетическом уровне, высокую электроотрицательность (ОЭО > 2), малые радиусы; они способны как отдавать валентные электроны, так и принимать на последний уровень электроны до 8, т.е. до образования электронной оболочки инертного газа.


 неМе –х хē + неМе ─ nē неМе +n
неМе –х хē + неМе ─ nē неМе +n  Прием ē окислитель или Отдача ē
Прием ē окислитель или Отдача ēВосстановление восстановитель Окисление
Неметаллы обладают окислительными и восстановительными свойствами, могут взаимодействовать как с металлами, так и с другими неметаллами.
Периодическое изменение металлических и неметаллических, восстановительных и окислительных свойств простых веществ определяется периодичностью электронного строения соответствующих атомов (рис. 1).

 Изменения в периодах
Изменения в периодахZя ↑, Nē ↑, Bē ↑, ОЭО ↑ усиливаются неметаллические
r (атома) ↓ и окислительные
N (энерг. ур.) = const свойства простых веществ
И
 зменения Zя ↑
зменения Zя ↑в главных Nē ↑ усиливаются металлические
подгруппах N (энерг. ур.) ↑ и восстановительные
ОЭО ↓ свойства простых веществ
Вē = const
Рис. 1. Схема изменения основных характеристик атомов и свойств простых веществ в периодах и группах
Пример 7
| Характеристика атома элемента | Химический элемент | ||
| Цинк Zn | Мышьяк As | Висмут Bi | |
| N ZЯ Nē N (периода) N (группы) Вē Подгруппа Электронное семейство ОЭО | 30 30 30 4 II 2 Побочная Б d-элемент 1,70 | 33 33 33 4 V 5 Главная А р-элемент 2,25 | 83 83 83 6 V 5 Главная А р-элемент 1,72 |
| С   войства войства простых веществ | В периоде Усиливаются:
| | |
| | В главной подгруппе А Усиливаются:
| ||
| Металл Восстановитель | Неметалл Окислитель и восстановитель | Металл Восстановитель |
6. Периодичность форм и свойств соединений
химических элементов
Периодичность форм и свойств сложных веществ можно проследить при условии, что их молекулы однотипны, а формулы аналогичны, т.е. отличаются только одним из химических элементов одного периода или одной главной подгруппы: ряды оксидов, гидроксидов, хлоридов, гидридов, сульфатов и т.д.
Пример 8:
Оксиды элементов III периода:
Na2O, CaO, Al2O3, SiO2, P2O5, SO3, Cl2O7;
Галогеноводороды (галогены – элементы VII группы, главной подгруппы А): HF, HCl, HBr, HI, HАt.
6.1. Кислотно-основные свойства соединений элементов
Периодичность кислотно-основных свойств химических соединений наиболее наглядно прослеживается на примере оксидов и гидроксидов элементов в одинаковых степенях окисления, характерных для элементов одной группы (табл. 2). Общие формулы оксидов и гидроксидов элементов одной группы аналогичны.
Таблица 2
Изменение форм и кислотно-основных свойств оксидов и
гидроксидов элементов в высших степенях окисления в периоде
| Г Р У П П А | ||||||
| I | II | III | IV | V | VI | VII |
| Высшая положительная степень окисления элемента | ||||||
| +1 | +2 | +3 | +4 | +5 | +6 | +7 |
| Общая формула оксида | ||||||
| Э2О | ЭО | Э2О3 | ЭО2 | Э2О5 | ЭО3 | Э2О7 |
| Кислотно-основной характер оксида | ||||||
| основной | основной или амфотерный | амфотерный | кислотный или амфотерный | кислотный | кислотный | кислотный |
| Общая формула гидроксида | ||||||
| ЭОН | Н2ЭО2 Э(ОН)2 | Э(ОН)3 ↨ Н3ЭО3 или НЭО2 | Э(ОН)4 Н2ЭО3 или Н4ЭО4 | НЭО3 или Н3ЭО4 | Н2ЭО4 | НЭО4 |
| Кислотно-основной характер гидроксида | ||||||
| Основание | Основание или амфолит | Амфолит | Амфолит или кислота | Кислота | Кислота | Кислота |
Примечание: Э – обозначение химического элемента;
амфолит, или амфотерный гидроксид.
Пример 9:
Формулы кислот элементов VI группы подобны формуле серной кислоты H2SO4, хромовая кислота H2СrO4, теллуровая кислота H2TeO4 и т.д.
Оксиды и гидроксиды металлов могут быть основными, амфотерными (амфолитами) или кислотными в зависимости от степени окисления металла.
Степени окисления металла
0
 +1 +2 +3 +4 +5 +6 +7 +8
+1 +2 +3 +4 +5 +6 +7 +8-
О К С И Д Ы
Ме2О МеО Ме2О3 МеО4 Ме2О5 МеО3 Ме2О7 МеО4
О
 сновные
сновные
Амфотерные
Кислотные
Г И Д Р О К С И Д Ы
О
 снования
снования
Ме(ОН) или Ме(ОН)2
Ме(ОН)n
амфолиты
HnMeOn
Кислоты
HxMeOy
Рис. 2. Схема влияния степени окисления металла на кислотно-основной характер его оксидов и гидроксидов
Положение металла в периодической системе элементов Д. И. Менделеева также влияет на кислотно-основной характер оксидов и гидроксидов: сверху вниз в главных подгруппах и от конца периода к его началу усиливаются металлические свойства элемента и основные свойства оксидов и гидроксидов металла.
Пример 10:
1. Zn+2O – амфотерный оксид, так как степень окисления цинка +2, цинк находится ближе к концу периода.
2. Ti+2O – основной оксид, так как степень окисления титана +2, титан находится ближе к началу периода.
3. Ti+4O2 – амфотерный оксид, так как степень окисления титана +4.
4. Cr+6O3 – кислотный оксид, так как степень окисления хрома +6.
Оксиды неметаллов, положительная степень окисления (ст.ок) которых больше двух, проявляют только кислотные свойства, а при ст.ок = 2 называются несолеобразующими, т.е. не обладающими кислотными свойствами.
Пример 11:

 S+6O3 S+4O2 S+2O
S+6O3 S+4O2 S+2O| кислотные оксиды, т.к. ст.ок. (S) > 2 | несолеобразующий оксид, т.к. ст.ок. (S) = 2 |
Кислотным оксидам неметаллов (ЭxOy) соответствуют кислородсодержащие кислоты (НхЭОу). Например, оксиду S+4O2 соответствует кислота H2S+4O3.
Водородные соединения неметаллов VI и VII групп, главных подгрупп А – это газообразные вещества, которые при растворении в воде проявляют кислотные свойства, их относят к бескислородным кислотам.
Характер изменения кислотно-основных свойств соединений элементов в периодах и группах схематично представлен на рис. 3.
Пример 12:
HCl – газ, хлороводород,
водный раствор HCl – хлороводородная кислота, бескислородная.
| Изменения | | в периодах Высшая ст.ок. ОЭО |
  | | |
| В  главных подгруппах главных подгруппах | | - усиливаются кислотные свойства оксидов и - уменьшаются основные свойства гидроксидов |
| Высшая ст.ок. = const | |
|
| ОЭО | |
|
Рис. 3. Схема изменения свойств оксидов и гидроксидов химических элементов и гидридов неметаллов в периодах и главных подгруппах
6.2. Окислительно-восстановительные свойства
соединений элементов
Окислительно-восстановительные свойства соединений элементов связаны с передачей электронов: восстановитель отдает электроны, окислитель их принимает. Возможность отдачи или приема электронов можно определить по степени окисления элемента, входящего в состав молекулы вещества (табл. 3)
Таблица 3
Влияние степени окисления элемента на его окислительно-восстановительные свойства
| Степень окисления элемента | ||
| Положительная | Отрицательная (низшая) | |
| Высшая | Промежуточная | |
| Получена из нейтрального атома | ||
| При отдаче всех Вē | При отдаче части Вē | При приеме электронов до 8 |
| Численно равна | ||
| Ст.ок. = Вē = = Nгруппы | Ст.ок. < Вē | Ст.ок. = 8 – Вē |
| Возможность отдачи электронов элементом | ||
| Нет | Есть | Есть |
| Возможность приема электронов элементом | ||
| Есть | Есть | Нет |
| Тип свойств по ст. ок. | ||
| Окислительные | Окислительно-восстановительные | Восстановительные |
| Роль соединения элемента в реакции | ||
| Окислитель | Окислитель или восстановитель | Восстановитель |
Пример 13:
Определите окислительно-восстановительные свойства веществ H2SO4, H2SO3, H2S, S по ст. ок. элемента серы S, находящейся в VI группе.
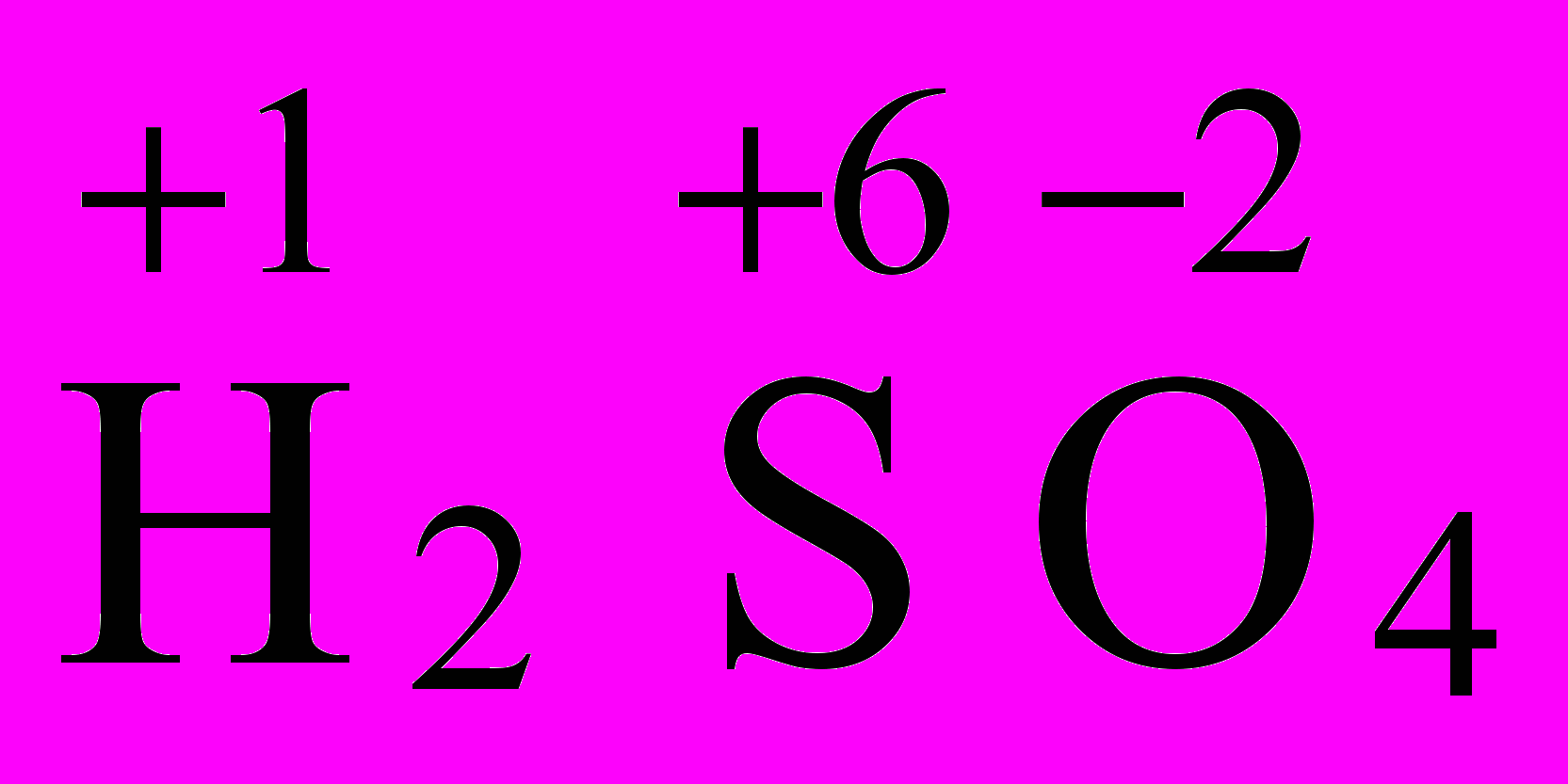 | сера в высшей положительной степени окисления, так как ст.ок. S = +6 = N (группы) = Вē = 6. Следовательно, H2SO4 – окислитель. |
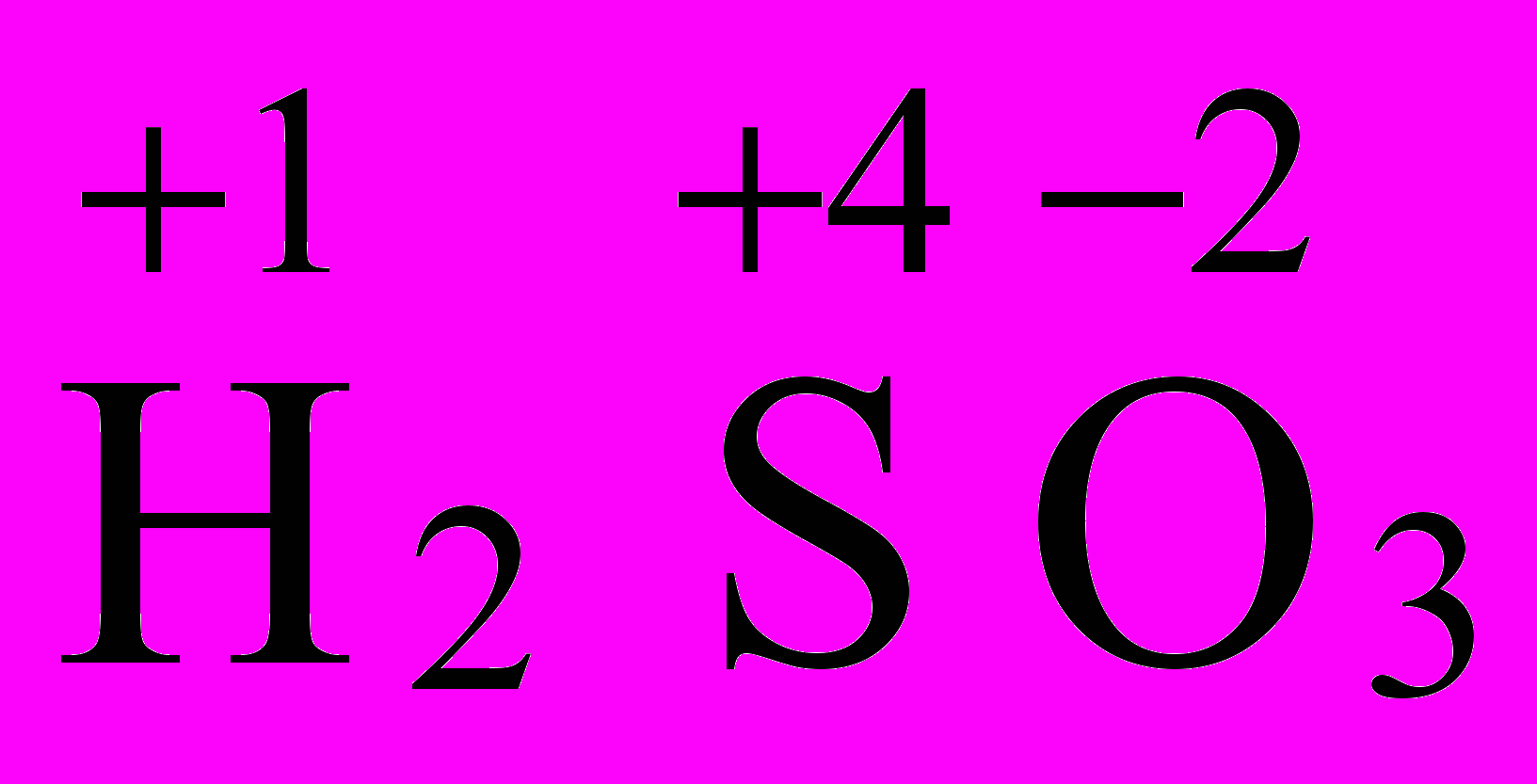 | ст.ок. S = +4 < Вē = 6. Следовательно, H2SO3 может быть и окислителем и восстановителем. |
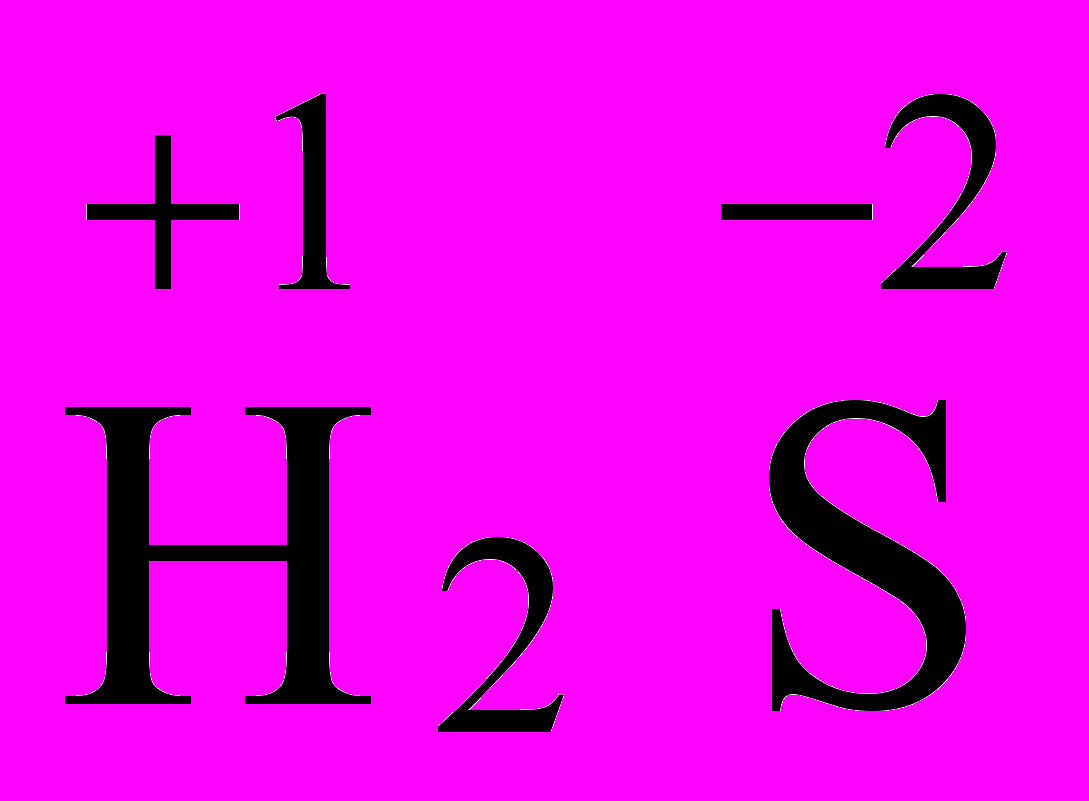 | ст.ок S = -2, равная по модулю 8 – Вē = 2, т.е. низшая ст.ок. Следовательно, H2S – только восстановитель. |
| S0 | - 2 < Ст.ок S0 < 6, следовательно, S0 способна как принимать, так и отдавать электроны S0 может быть и окислителем и восстановителем. |
Химические элементы с числом валентных электронов больше трех могут иметь переменные степени окисления.
Пример 14:
Сера ─ р-элемент VI группы, главной подгруппы А: имеет шесть валентных электронов (Вē = 6) на третьем последнем энергетическом уровне. Конфигурация валентных электронов: 3s2 3p4 (рис. 4):

-
3s 3p 3d
Рис. 4. Распределение валентных электронов по энергетическим ячейкам в нормальном состоянии атома серы и при сообщении ему энергии.
В атоме серы два неспаренных электрона, которые могут быть отданы (S+2) или к которым для спаривания могут быть приняты два электрона (S-2).
При сообщении энергии атому серы один из двух спаренных электронов перейдет с 3р-подуровня в пустую ячейку 3d-подуровня, произойдет расспаривание электронов. Тогда в атоме появится 4 неспаренных электрона, ст. ок. S будет равна +4.
При сообщении атому серы большей энергии произойдет аналогичное расспаривание двух электронов с 3s-подуровня, в атоме серы появятся 6 неспаренных электронов, при отдаче которых ст. ок. S повысится до +6.
Таким образом, переменная степень окисления связана с последовательной отдачей валентных электронов. Причем расспаривание электронов, как видно, приводит к изменению степени окисления на две единицы.
Периодичность окислительно-восстановительных свойств однотипных соединений определяется периодическим изменением числа валентных электронов в атомах, относительных электроотрицательностей атомов, степеней окисления элементов, стандартных потенциалов окислительно-восстановительных процессов.
7. Прогнозирование свойств веществ
Прогнозирование свойств веществ следует начинать с определения места химического элемента, входящего в состав молекулы вещества, в периодической системе Д. И. Менделеева, установления строения атома этого элемента и конфигурации его валентных электронов (п. 2).
Для понимания принципа периодичности свойств элемента по мере увеличения заряда ядра атома важно знать распределение электронов по уровням и подуровням, заполнение которых периодически повторяется (п. 3). Элементы с одинаковой конфигурацией валентных электронов принято называть аналогами.
По энергетической диаграмме распределения электронов по уровням, подуровням и энергетическим ячейкам находят число неспаренных электронов и оценивают возможность расспаривания электронов, что позволяет определить возможные степени окисления элементов, а по степени окисления прогнозировать формы и свойства его соединений (пп. 4, 5, 6).
Прогнозирование строения атома и свойств целесообразно представить в виде табл. 4 или в соответствии с планом прогноза (табл. 4) записать в произвольной форме.
Таблица 4
Прогнозирование строения и свойств химического элемента,
форм и свойств его соединений
| №  п/п п/п | Химический План элемент прогноза | Символ ______________, название _______________ Ar(элемента) = | |||||
| 1 | Положение элемента в периодической системе | N (элемента) | N (периода) | N (группы) | Подгруппа | ||
| | | | | ||||
| 2 | Основные характеристики атома | Zя Ne Np Nn | N (энер. ур.) | Вē | ns | np | (n-1)d |
| | | | | | | ||
| 3 | Электронная формула атома | | |||||
| 4 | Энергетическая диаграмма расположения электронов по уровням, подуровням, ячейкам | | |||||
| 5 | Электронное сем-во | | |||||
| 6 | Возможные ст. ок. | | |||||
| 7 | ОЭО (табл. 1) | | |||||
| 8 | Свойства простого вещества | Металлические или неметаллические | | ||||
| Окислительные или восстановительные | | ||||||
| 9 | Кислотно-основные свойства оксидов | Формулы | | ||||
| Кислотно-основной характер | | ||||||
| 10 | Свойства гидроксидов | Формулы | | ||||
| Кислотно–основной характер | | ||||||
| Окислительно-восстан. св-ва | |
8. Многовариантные задания
Для успешного выполнения многовариантных заданий следует ознакомиться с содержанием настоящих методических указаний, внимательно изучить предлагаемые схемы, таблицы и примеры.
Задание 1. В соответствии с вариантом задания (табл. 5):
- охарактеризуйте каждый элемент по плану прогноза, представленному в табл. 4;
- дайте сравнительную характеристику свойств атомов химических элементов (п. 4), свойств простых веществ (п. 5), а также кислотно-основных и окислительно-восстановительных свойств соединений элементов (п. 6).
Таблица 5
Варианты задания 1
| Вариант | Химический элемент | Вариант | Химический элемент | ||
| 1 | 2 | 1 | 2 | ||
| 1 | Bi | Zn | 16 | Sc | Ga |
| 2 | W | P | 17 | Mg | Fe |
| 3 | Ti | Ge | 18 | V | As |
| 4 | Al | Мо | 19 | Hg | Si |
| 5 | Mn | Br | 20 | Te | Ag |
| 6 | Cs | Ta | 21 | Re | Rb |
| 7 | Zr | Sn | 22 | Nb | Sb |
| 8 | Cd | I | 23 | Cu | Se |
| 9 | Hf | Pb | 24 | Fr | Ni |
| 10 | Cl | Au | 25 | U | Be |
| 11 | Na | Po | 26 | Ca | At |
| 12 | B | Ac | 27 | Ra | Ru |
| 13 | Sr | Tc | 28 | Ku | K |
| 14 | Os | Ba | 29 | Cr | S |
| 15 | La | Tl | 30 | Y | In |
Задание 2. В соответствии с вариантом задания (табл. 6) для каждого элемента:
- определите место элемента в периодической системе Д. И. Менделеева и назовите элемент;
- запишите полную электронную формулу атома и определите электронное семейство элемента;
- изобразите энергетическую диаграмму расположения электронов по уровням и подуровням и определите все возможные степени окисления элемента;
- напишите формулы оксидов и гидроксидов элемента и охарактеризуйте их кислотно-основные свойства;
- дайте сравнительную характеристику физических и химических свойств простых веществ.
Таблица 6
Варианты задания 2
| Вариант | Конфигурация валентных электронов элемента | Вариант | Конфигурация валентных электронов элемента | ||
| 1 | 2 | 1 | 2 | ||
| 1 | 4d25s2 | 6s26p3 | 16 | 4d55s2 | 4s24p3 |
| 2 | 6s26p4 | 3s23p4 | 17 | 4d45s2 | 4s24p2 |
| 3 | 5d106s2 | 5s25p3 | 18 | 3d104s2 | 6s26p6 |
| 4 | 4s24p1 | 3d74s2 | 19 | 5s25p4 | 5d86s2 |
| 5 | 4d45s1 | 5d46s2 | 20 | 5d26s2 | 6s26p2 |
| 6 | 3d24s2 | 4s24p6 | 21 | 4d105s2 | 4d105s2 |
| 7 | 5s25p2 | 5d66s2 | 22 | 6s26p5 | 4s24p5 |
| 8 | 5d56s2 | 6s26p2 | 23 | 5d106s1 | 4s24p4 |
| 9 | 5d76s2 | 6s26p1 | 24 | 5d36s2 | 5d26s2 |
| 10 | 3s23p1 | 2s22p6 | 25 | 3d54s2 | 5s25p1 |
| 11 | 3d94s2 | 3s23p2 | 26 | 3d14s2 | 3d104s2 |
| 12 | 3d44s2 | 4d15s2 | 27 | 5s25p5 | 2s22p4 |
| 13 | 3s23p3 | 5s25p6 | 28 | 3d24s2 | 2s22p5 |
| 14 | 4d85s2 | 2s22p2 | 29 | 3s23p5 | 3d64s2 |
| 15 | 3s23p6 | 3d84s2 | 30 | 2s22p3 | 4d105s2 |
Задание 3. Укажите, как в заданном ряду элементов в соответствии с вариантом задания (табл. 7) изменяются (увеличиваются, уменьшаются или не изменяются):
- заряд ядра атома;
- число валентных электронов, в том числе неспаренных электронов;
- число энергетических уровней;
- радиус атома;
- энергия ионизации и энергия сродства к электрону;
- ОЭО (относительная электроотрицательность) и способность принимать электроны;
- металлические и неметаллические свойства;
- окислительно-восстановительные свойства;
- высшая положительная степень окисления;
- формулы оксидов и их кислотно-основной характер;
- формулы соответствующих гидроксидов и их кислотно-основной характер.
Таблица 7
Варианты задания 3
| Вариант | Ряд химических элементов | Вариант | Ряд химических элементов |
| 1 | Рубидий – цезий – франций | 16 | Мышьяк – селен – бром |
| 2 | Углерод – кремний – германий | 17 | Таллий – свинец – висмут |
| 3 | Галлий – индий – таллий | 18 | Бериллий – магний – кальций |
| 4 | Литий – бериллий – бор | 19 | Мышьяк – сурьма – висмут |
| 5 | Калий – кальций – галлий | 20 | Фтор – хлор – бром |
| 6 | Сурьма – теллур – йод | 21 | Алюминий – кремний – фосфор |
| 7 | Литий – натрий – калий | 22 | Рубидий – стронций – индий |
| 8 | Германий – олово – свинец | 23 | Висмут – полоний – астат |
| 9 | Сера – селен – теллур | 24 | Стронций – барий – радий |
| 10 | Бор – углерод – азот | 25 | Бор – алюминий – галлий |
| 11 | Галлий – германий – мышьяк | 26 | Бром – йод – астат |
| 12 | Цезий – барий – таллий | 27 | Фосфор – сера – хлор |
| 13 | Калий – рубидий – цезий | 28 | Индий – олово – сурьма |
| 14 | Азот – фосфор – мышьяк | 29 | Франций – радий – лантан |
| 15 | Селен – теллур – полоний | 30 | Натрий – магний – алюминий |
Библиографический список
- Общая химия / Н. В. Коровин – М. : Высшая школа, 2002. – 558 с.
- Теоретические основы общей химии / А. И. Горбунов [и др.]– М. : Изд-во МГТУ им. Н. Э. Баумана, 2003. – 720 с.
- Краткая химическая энциклопедия. Т 3. – М. : Советская энциклопедия, 1964. – 1112 с.
- Справочное руководство по химии / А. И. Артеменко, В. А. Малеванный, И. В.Тикунова – М. : Высшая школа, 1990. – 340 с.
- Общая химия. Направление и скорость химических процессов. Строение вещества / О. С.Зайцев – М. : Высшая школа, 1983. – 248 с.
- Задачи и упражнения по общей химии/ Н. Л.Глинка – М. : Интеглал-пресс, 2002. – 240 с.
- Краткий химический справочник / В. А. Рабинович, З. Я. Хавин – С-Пб.: Химия, 1994. – 432 с.
Оглавление | |
| Введение -------------------------------------------------------------------------------- | 3 |
| 1. Периодический закон Д. И. Менделеева--------------------------------------- | 4 |
| 2. Структура периодической системы элементов Д. И. Менделеева (короткая форма таблицы)-------------------- -------------------------------------- | 5 |
| 3. Электронное строение атома----------------------------------------------------- | 7 |
| 4. Периодичность свойств атомов химических элементов-------------------- | 9 |
| 5. Периодическое изменение свойств простых веществ---------------------- | 11 |
| 6. Периодичность форм и свойств соединений химических элементов---- | 14 |
| 7. Прогнозирование свойств веществ--------------------------------------------- | 18 |
| 8. Многовариантные задания-------------------------------------------------------- | 19 |
| Библиографический список--------------------------------------------------------- | 22 |
