Д. И. Менделеева прогнозирование свойств элементов и их соединений методические указания
| Вид материала | Методические указания |
- Химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых, 461.43kb.
- Модуль Теория строения атома. Периодический закон и периодическая система Д. И. Менделеева, 401.18kb.
- Химических элементов Д. И. Менделеева, 32.78kb.
- Программа, контрольные вопросы и упражнения по неорганической химии под редакцией проф.,, 600.91kb.
- Таблицы Д. И. Менделеева. Атомы в свою очередь состоят из более мелких частиц: протонов,, 951.76kb.
- Тема №1 «Общая химия», 73.57kb.
- Задачи изучения дисциплины, 16.34kb.
- Материалы для подготовки к экзамену по химии, 462.84kb.
- Характеристика химических элементов малых периодов по их положению в периодической, 97.2kb.
- Закон и периодическая система д. И. Менделеева, 334.53kb.
2.4. Подгруппа – часть группы, в состав которой входят химические элементы с одинаковым распределением валентных электронов в атоме.
В результате смещения химических элементов влево и вправо каждая группа делится на две подгруппы: главную А и побочную Б.
Главная подгруппа АВē находятся: - на последнем n–м энергетическом уровне; - ns- и np- подуровнях. Включает: s-элементы: ns1 или ns2; р-элементы: ns2npх, где х = 1, 2…6. | Побочная подгруппа БВē находятся: - на последнем n-м и предпоследнем (n – 1)-м энергетических уровнях; - ns- и (n – 1)d-подуровнях. Включает: d–элементы: (n – 1)dх ns2, где х = 1,2…10. На ns-подуровне некоторых d-элементов может быть один электрон или не одного. |
2.5. Лантаноиды и актиноиды – два семейства f-элементов, которые в виде двух отдельных рядов вынесены за пределы таблицы. В последние годы в эти ряды часто включают лантан и актиний.
ЛантаноидыПорядковые номера от 57 до 71.N (периода) = 6 N (группы) = IIIПодгруппа – побочная БВē находятся: на трех последних энергетических уровнях; подуровнях 4f x5dy6s2, где х = 1,2…14 y = 0, 1, 2; Включает: f-элементы | АктиноидыПорядковые номера от 89 до 103 N (периода) = 7 N (группы) = IIIПодгруппа – побочная БВē находятся: на трех последних энергетических уровнях; подуровнях 5f x6dу7s2, где х = 0, 1,2…14 y = 0, 1, 2; Включает: f-элементы |
Число валентных электронов у атомов этих химических элементов может быть больше или меньше трех за счет провала электронов с
f-подуровня на d-подуровень или наоборот.
Пример 3
| Химический элемент | |||
| Полоний Ро | Лантан Lа | ||
| Положение в периодической системе | Строение атома | Положение в периодической системе | Строение атома |
| N = 84 А r = 208,98. N (периода) = 6 N (группы) = VI Подгруппа Электронное семейство | ZЯ = 84; Nр = 84; N ē = 84 N n = 209 – 84 = 125 N (энер.ур.) = 6 n = 6 Bē = 6 Главная А 6s26p4 р-элемент | N = 57 А r = 138,9. N (периода) = 6 N (группы) = III Подгруппа Электронное семейство | ZЯ = 57; Nр = 57; N ē = 57 N n = 139 – 57 = 82 N (энер.ур.) = 6 n = 6 Bē = 3 Побочная Б 5d16s2 d-элемент |
3. Электронное строение атома
Электроны в атоме располагаются по энергетическим уровням и подуровням, что изображается чаще всего двумя способами: в виде электронной конфигурации атома или энергетической диаграммой расположения электронов по уровням и подуровням в атоме.
3.1. Электронная конфигурация атома отображает расположение электронов в атоме по уровням и подуровням.
При этом следует помнить, что в соответствии с принципом Паули максимально может быть на s-подуровне любого уровня 2 электрона, на
p-подуровне – 6 электронов, на d-подуровне – 10 электронов, на f-подуровне – 14 электронов.
В соответствии с правилом наименьшей энергии (правилом Клечковского) уровни и подуровни заполняются в следующей последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Электронную конфигурацию атома принято изображать в виде электронной формулы, которая записывается в порядке возрастания номера энергетического уровня, т.е. без учета последовательности заполнения подуровней электронами.
Пример 4. Электронная формула химического элемента 5-го периода, IV группы, подгруппы Б циркония Zr с порядковым номером 40 имеет вид
40Zr 1s2 2s2 2p6 3s2 3p6 3d104s2 4p64d25s2.
Тогда как электронная конфигурация атома 40Zr с учетом последовательности заполнения подуровней записывается следующим образом:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2.
3.2. Энергетическая диаграмма уровней и подуровней – это наглядная схема электронной структуры атома, которая в общепринятом, сжатом по вертикали изображении в отсутствие электронов имеет вид
| э 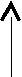 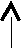 нергетические нергетическиеуровни | 123456 7 | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | ||
| | | | | | | | | | | | | | | | | ||
| | | | | | | | | | | | | | | | | ||
| | | | | | | | | | | | | f | | | | ||
| | | | | | | d | | | | | | | | | | ||
| | | p | | | | | | | | | | | | | |
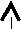 s
s

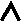 п о д у р о в н и
п о д у р о в н иНа диаграмме обозначаются:
-
 атомная орбиталь или энергетическая ячейка ;
атомная орбиталь или энергетическая ячейка ;- электроны в ячейке или ;
-
- спаренные электроны
;
- неспаренные электроны
или
.
Согласно принципу Паули, на одной атомной орбитали (в одной энергетической ячейке) не может находиться больше двух электронов. Следовательно, на s-подуровне (одна атомная орбиталь) может находиться 2 электрона, на p-подуровне (три орбитали) – 6 электронов, на d-подуровне (5 атомных орбителей) ─ 10 электронов, на f-подуровне (7 атомных орбиталей) – 14 электронов.
Согласно правилу Гунда, электроны стремятся занять наибольшее число ячеек в подуровне.
Пример 5.
Электронная структура атома углерода 6С 1s22s22p2 изображается на энергетической диаграмме только так:
-
1s2 2s2 2p
Пример 6
| Химический элемент | Сурьма Sb | Марганец Mn | |||||||||||||||||||
| Основные характеристики атома | Nē = 51; N (энер.ур.) = 5; Вē = 5; р-элемент | Nē = 25; N (энер.ур.) = 4; Вē = 7; d-элемент | |||||||||||||||||||
| Электронная формула атома | 1s22s22p63s23p63d104s24p64d10 5s25p3 Вē | 1s22s22p63s23p63d54s2 Вē | |||||||||||||||||||
| Энергетическая диаграмма распределения электронов по уровням и подуровням в атоме | | | |||||||||||||||||||
| 5 | ⇅ | ↧ | ↧ | ↧ | | | | | | | 4 | ⇅ | | | | | | | | | |
| 4 | ⇅ | ⇅ | ⇅ | ⇅ | ⇅ | ⇅ | ⇅ | ⇅ | ⇅ | 3 | ⇅ | ⇅ | ⇅ | ⇅ | ↧ | ↧ | ↧ | ↧ | ↧ | | |
| 3 | ⇅ | ⇅ | ⇅ | ⇅ | ⇅ | ⇅ | ⇅ | ⇅ | ⇅ | 2 | ⇅ | ⇅ | ⇅ | ⇅ | d | ||||||
| 2 | ⇅ | ⇅ | ⇅ | ⇅ | d | 1 | ⇅ | p | | | | | | | |||||||
| 1 | ⇅ | p | | | | | | | s | | | | | | | | | ||||
| | s | | | | | | | | | | |||||||||||
| Электронная конфигурация валентных электронов | 5s2 – спаренные электроны 5p3 – неспаренные электроны | 4s2 – спаренные электроны 3d5 – неспаренные электроны |
4. Периодичность свойств атомов химических элементов
Периодическая система элементов Д. И. Менделеева отражает периодичность конфигураций валентных электронов и позволяет на их основе объяснить закономерное изменение физических и химических свойств элементов.
4.1. Электронное строение последних энергетических уровней
На последних энергетических уровнях атомов распределяются валентные электроны Вē, которые при протекании химических реакций переходят от атома к атому. Если атом отдает все Вē, то элемент приобретает высшую положительную степень окисления (в. ст. ок.). Число валентных электронов, их электронные конфигурации и положительные степени окисления элементов периодически повторяются при непрерывном увеличении заряда ядра атома.
В больших периодах (4, 5, 6, 7) наблюдается периодическое изменение числа валентных электронов и высших положительных степеней окисления дважды: в одном и другом рядах.
Некоторые d-элементы (Cu, Ag, Au) и f-элементы имеют аномально высокие положительные степени окисления за счет d-электронов предпоследнего и f-электронов третьего от конца уровней.
4.2. Размеры атомов
Радиусы атомов с увеличением заряда ядра в группах сверху вниз увеличиваются в связи с ростом числа энергетических уровней, в периодах от начала к концу – уменьшаются, так как при одинаковом числе энергетических уровней усиливается притяжение валентных электронов к ядру атома.
В атомах d- и f-элементов действие возрастающего заряда ядра на радиус атома более слабое, потому в периодах и группах радиусы изменяются в меньшей степени, а у актиноидов они почти постоянны.
4.3. Энергетическая характеристика атома
Способность атома удерживать электроны количественно оценивается энергиями ионизации и сродства к электрону или их суммарной величиной, называемой электроотрицательностью.
Энергия ионизации Еи – это энергия, необходимая для отрыва от одного моля атомов одного или более молей валентных электронов
(Еи(1) < Eи(2) < Eи(3) < …). Энергия ионизации атомов химических элементов периодически изменяется: повышается от начала периода к его концу, а в главных подгруппах ─ снизу вверх.
Энергия сродства к электрону Еср – это энергия присоединения молей электронов к одному молю нейтральных атомов. Энергия сродства атома к электрону также повышается в периоде от начала к концу, в группе − снизу вверх.
