Глицеральдегид-3-фосфатдегидрогеназа: роль в регуляции энергетического обмена, индукции апоптоза и агрегации белков 03. 00. 04-Биохимия
| Вид материала | Автореферат |
- Темы рефератов по витаминам и гормонам для студентов 2 курса факультета всэ витамины,, 10.06kb.
- Метаболизм белков у растущих бычков и свиней и факторы его регуляции 03. 00. 04 биохимия, 703.33kb.
- Задачи: Проверить и углубить знания в биосинтезе белков, фотосинтезе и этапах энергетического, 32.48kb.
- Рабочая программа дисциплины «биология клетки» (молекулярная биология) Код дисциплины, 225.32kb.
- План лекций для студентов 3-го курса факультета, 31.63kb.
- Тема строение белков и ферментативный катализ вопросы лекции, 137.02kb.
- Е в регуляции биосинтеза белка и нуклеиновых кислот в культуре нормальных и опухолевых, 203.51kb.
- Роль β-адренорецепторов в регуляции водно-солевого обмена у белых крыс, 748.01kb.
- Никитина любовь Сергеевна механизмы влияния сигнальных белков апоптоза на функциональное, 322.15kb.
- «Молекулярные механизмы гормональной регуляции» Общая трудоемкость изучения дисциплины, 11.18kb.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
МЕТОДЫ ИССЛЕДОВАНИЯ
Глицеральдегид-3-фосфатдегидрогеназу Bacillus stearothermophilus выделяли из штамма-суперпродуцента Escherichia coli GM-109. Данный штамм был трансформирован мультикопийной плазмидой pskBstII, содержащий ген ГАФД из B.st. Плазмида была любезно предоставлена проф. Ги Бранлантом из Университета Пуанкаре (г. Нанси, Франция). Выделение проводили согласно методике Ройтел и соавторов (Roitel O. et al., 1999). Мутантные формы ГАФД B.stearothermophilus из клеток E. coli штамма GM-109, трансформированных плазмидой psk II B. stearothermophilus, выделяли по той же методике.
Глицеральдегид-3-фосфатдегидрогеназу из скелетных мышц кролика выделяли по методике Хилла (Hill C.M. et al., 1975).
Нефосфорилирующую глицеральдегид-3-фосфатдегидрогеназу (ГАПН) Streptococcus mutans из штамма E.coli DH5, трансформированного мультикопийной плазмидой pskBstII, несущей ген ГАПН S. mutans, проводили по методу Кроу и Виттенбергера (Crow and Wittenberger, 1979).
Шаперонин GroEL из клеток E.coli штамма W3110, трансформированной плазмидой рОF39, содержащей ген GroEL проводили по методике Корралеса и Фершта с некоторыми модификациями (Corrales, Fersht, 1996). Плазмида, содержащая ген GroEL, была любезно предоставлена проф. В.В. Месянжиновым (ИБОХ РАН).
Моноклональные антитела клона 6С5 против ненативных форм ГАФД были получены нами ранее совместно с А. Г. Катрухой.
3-фосфоглицераткиназу, 3-фосфоглицератмутазу и енолазу выделяли из мышц кролика по методу Скоупса (Scopes, Stoter, 1982).
Ренин из почек выделяли по описанной нами методике с применением ионообменной и аффинной хроматографии на иммобилизованном пепстатине (Плетень и др., 1979).
Выделение протаминов, а также их дополнительная очистка до электрофоретически гомогенного состояния, определение аминокислотного состава и др. физико-химических свойств были проведены по описанной нами ранее методике (Исаева и др., 1989). В этой работе был использован только один из препаратов – протамин из лососевых рыб («сальмин»), представляющий собой монопротамин, содержащий в своем составе только одну основную аминокислоту – аргинин.
Концентрацию белка определяли методом Бредфорд (Bradford M., 1976) и спектрофотометрически по поглощению при длине волны 280 нм (А0,1%280 холоГАФД B.st.=0,92, апоГАФД B.st.=0,83, холоГАФДк =1,0, апоГАФДк =0,83, IgG =1,5).
Концентрацию иммобилизованных белков определяли по модифицированному методу Бредфорд (Asryants R. et al., 1985).
Определение дегидрогеназной активности ГАФД проводили спектрофотометрически по увеличению поглощения NADH.
Ацилфосфатазную активность окисленной ГАФД определяли спектрофотометрически по накоплению NADH в сопряженной системе с восстановленной ГАФД по методике Шмальгаузен и др. (Schmalhausen E.V., 1999).
Иммобилизацию белков проводили по методике, разработанной ранее в нашей лаборатории (Cherednikova T. et al., 1980). Степень активации носителя составляла 5-10 мг BrCN/г влажной сефарозы для иммобилизации ГАФД за одну субъединицу, 30 мг BrCN/г сефарозы для иммобилизации ГАФД за две субъединицы или для иммобилизации GroEL.
Получение иммобилизованных форм ГАФД различной нативности и степени олигомерности проводили в соответствии с описанными ранее подходами (Муронец и др., 1980, Cherednikova T. et al., 1980). Иммобилизованные на Cефарозе активные димеры ГАФД из мышц кролика и B. Stearothermophilus получали после диссоциации иммобилизованного активного тетрамера на свободный и связанный с матрицей димеры. Неактивный тетрамер получали обработкой иммобилизованного тетрамера глутаровым альдегидом. Для получения иммобилизованной денатурированной ГАФД тетрамеры, связанные с матрицей через одну субъединицу, денатурировали до полной инактивации фермента в 8 М мочевине или в буфере c рН 2,3.
Иммунизацию кроликов проводили согласно стандартной процедуре (Green J. and Manson M., 1998), используя для иммунизации 2 мл эмульсии, содержащей 1т мл полного адъюванта Фрейнда, 0,5-0,8 мг ГАФД B. stearothermophilus и 0,8 мг GroEL. Это позволило выделить из сыворотки крови одного животного антитела против двух антигенов.
Выделение антител на иммобилизованных антигенах. Фракцию иммуноглобулинов G, полученную из поликлональной сыворотки, наносили на сорбенты с различными иммобилизованными антигенами и инкубировали в течение 30-40 минут. Не связавшиеся с иммуносорбентом антитела собирали, а сефарозу промывали буферным раствором. Низкоспецифичные антитела элюировали буферным раствором с рН 4,3. Высокоаффинные антитела элюировали буферным раствором с рН 2,3. Полученные антитела немедленно нейтрализовали двукратным объемом фосфатного буферного раствора (рН 7,7), замораживали и хранили при температуре -20С.
Титр антител на ГАФД и GroEL в сыворотке определяли с помощью твердофазного иммуноферментного анализа ELISA по классической процедуре непрямого иммуноферментного анализа (Barh G.M. et al., 1980). Степень перекрестной реакции между антителами определяли с помощью метода иммунопреципитации с Protein G. ГАФД инкубировали с эквимолярным количеством антител в течение 20 мин, а затем добавляли иммобилизованный Protein G. После 40 мин инкубации сефарозу промывали и состав проб анализировали ДСН-электрофорезом. Анализ интенсивности белковых полос проводили с помощью компьютерной программы PCBAS 2.08.
Электрофорез в денатурирующих условиях в полиакриламидном геле в присутствии ДСН, а также нативный электрофорез и иммуноблоттинг проводили с соответствии со стандартными процедурами.
Введение [32P]dATP в ДНК с помощью фрагмента Кленова ДНК-полимеразы I. ДНК метили с помощью фрагмента Кленова ДНК-полимеразы I с добавлением случайных гексануклеотидов и [32P]dAТФ согласно стандартной методике (Маниатис Т. и др., 1984).
Связывание ГАФД с мечеными ДНК и РНК. Апоформу ГАФД кролика получали с помощью аффинной хроматографии на колонке с Affi-blue сефарозой. АпоГАФД подвергали окислению Н2О2. Окисленный и восстановленный апоферменты затем инкубировали с ДНК или РНК в присутствии кофакторов (NAD или NADH) или без них. Затем проводили фильтрацию смеси через нитроцеллюлозные фильтры (0,45 m, Millipore HA), промывку фильтров и измерение радиоактивности во всех пробах (Wong I. and Lohman T.M., 1993)
Изучение субклеточной локализации ГАФД в клетках HeLa в процессе апоптоза. Клетки HeLa и HeLa-Bcl-2 выращивали на среде Eagle (Rovensky Y.A. et al., 1999). В апоптоз клетки вводили одновременным добавлением TNF- и ингибитора синтеза белка (эметина) в количестве 1 мкг/мл среды. Перекисный апоптоз индуцировали добавлением в культуральную среду раствора перекиси водорода до конечной концентрации 10 мкМ. Культуру клеток HeLa и HeLa-Bcl-2 выращивали в течение двух дней и фиксировали 4% раствором формальдегида. Актиновые микрофиламенты окрашивали флуоресцентным красителем родамин-фаллоидином. ГАФД окрашивали с помощью моноклональных антител клона 6С5. Клетки исследовали и фотографировали с помощью микроскопа Axiophot (Carl Zeiss, Germany) и объективов (Apochromat, Germany) с 40 – и 60 – кратным увеличением, а также конфокального лазерного микроскопа LSM-510 (Carl Zeiss, Germany) со 100 – кратным увеличением.
Анализ методом дифференциальной сканирующей калориметрии(ДСК) проводили на дифференциальном адиабатическом сканирующем микрокалориметре "ДАСМ-4" ("Биоприбор", Россия). Измерения проводили при скорости нагрева 1,0оС/мин в диапазоне температур от 20 до 100оС при избыточном давлении 2 атм.
Регистрацию спектров кругового дихроизма проводили на дихрографе MARK V “Jobin Ivon” (Франция), управляемом компьютером IBM-PS 1-6, в кювете с длиной оптического пути 1 см. Данные обрабатывали с использованием программы RDA.
Определение коэффициента седиментации. Седиментационный анализ проводили на аналитической ультрацентрифуге Beckman E с использованием фотоэлектрической сканирующей приставки.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
- РАЗОБЩЕНИЕ ГЛИКОЛИЗА ПРИ ИНДУКЦИИ АЦИЛФОСФАТАЗНОЙ АКТИВНОСТИ ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТДЕГИДРОГЕНАЗЫ
Одной из основных целей работы являлась проверка гипотезы, согласно которой, появление ацилфосфатазной активности у частично окисленной перекисью водорода глицеральдегид-3-фосфатдегидрогеназы (ГАФД), может приводить к разобщению окисления и фосфорилирования в гликолизе (Schmalhausen, Muronetz, 1997). Для проверки этого предположения мы изучили влияние Н2О2 на гликолиз, используя смесь очищенных ферментов гликолиза или цитоплазматическую фракцию из мышц крысы. Было показано, что окисление ГАФД Н2О2 действительно приводит к ускорению гликолиза на участке 3-ФГА – лактат как в смеси ферментов (рис. 1), так и в цитоплазматической фракции мышц.
Р
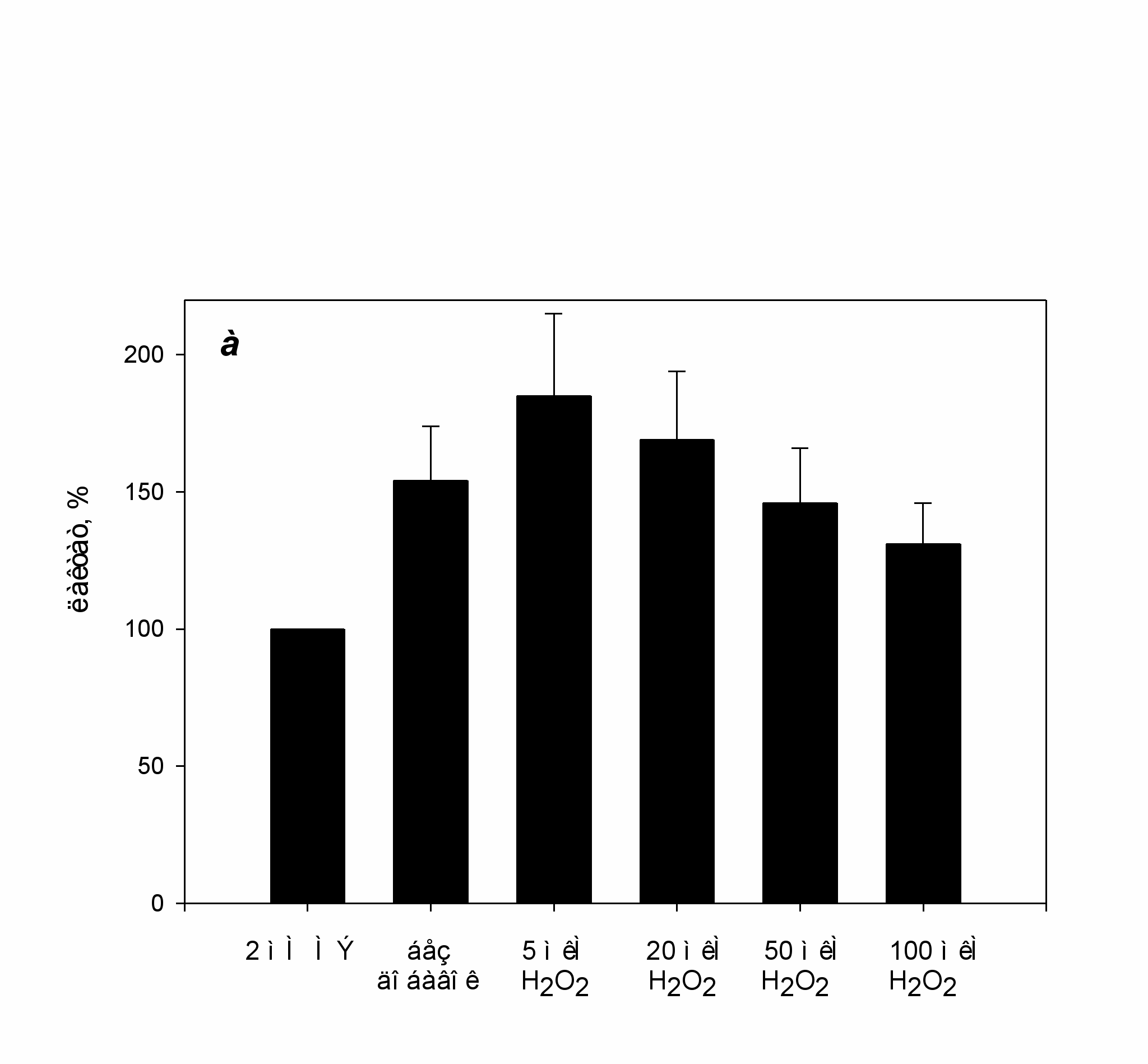
ис. 1. Зависимость накопления лактата от концентрации H2O2 при инкубации смеси ферментов в присутствии 3-ФГА и ADP. Концентрация 3-ФГА в среде 3мМ, концентрация ADP 1мМ. Накопление лактата в пробах, содержащих МЭ, принимали за 100% активности.
Концентрация перекиси водорода, вызывающая максимальный прирост лактата (на 100-150 %), в смеси ферментов и в мышечном экстракте составляет 5-10 и 100 мкМ, соответственно. Дальнейшее увеличение концентрации перекиси водорода приводит к снижению концентрации лактата в пробах, что объясняется ингибированием как дегидрогеназной, так и ацилфосфатазной активностей вследствие окисления Cys-149 до более высокой степени окисления, чем сульфеновая кислота.
Известно, что в аэробных условиях, при интенсивном функционировании митохондрий, протекание гликолиза должно затормозиться из-за недостатка ADP.
Мы предположили, что может произойти не замедление, а блокирование гликолиза из-за особенности сопряженной реакции, катализируемой ГАФД и 3-ФГкиназой. Так, после образования 1,3-ДФГ он может или связываться с 3-ФГкиназой или ацилировать ГАФД. В обоих случаях промежуточный комплекс является стабильным, причем превращения 1,3-ДФГ в 3-ФГ без добавления ADP не происходит. Окисление ГАФД может вызывать увеличение скорости гликолиза, за счет расщепления 1,3-дифосфоглицерата до 3-фосфоглицерата даже при очень низких концентрациях цитоплазматической ADP. При этом стадия, на которой происходит синтез АТP, исключается (и, следовательно, нет необходимости в использовании ADP), а реакция образования NADH становится независимой от киназной реакции и присутствия ADP.
Было показано, что в присутствии окисленной ГАФД гликолиз эффективно протекает даже при низких концентрациях ADP (Рис.2). Наибольшая разница в накоплении лактата между опытными пробами, содержащими 10 мкМ H2O2 и контрольными, содержащими 2 мм МЭ, наблюдается при низких концентрациях ADP (менее 0,5 мМ), когда скорость 3-ФГкиназной реакции падает из-за недостатка ADP. В этом случае наличие дополнительного ADP- независимого пути расщепления 1,3-ДФГ приводит к ускорению гликолиза. Сходные результаты были получены в эксперименте с цитоплазматической фракцией мышц.
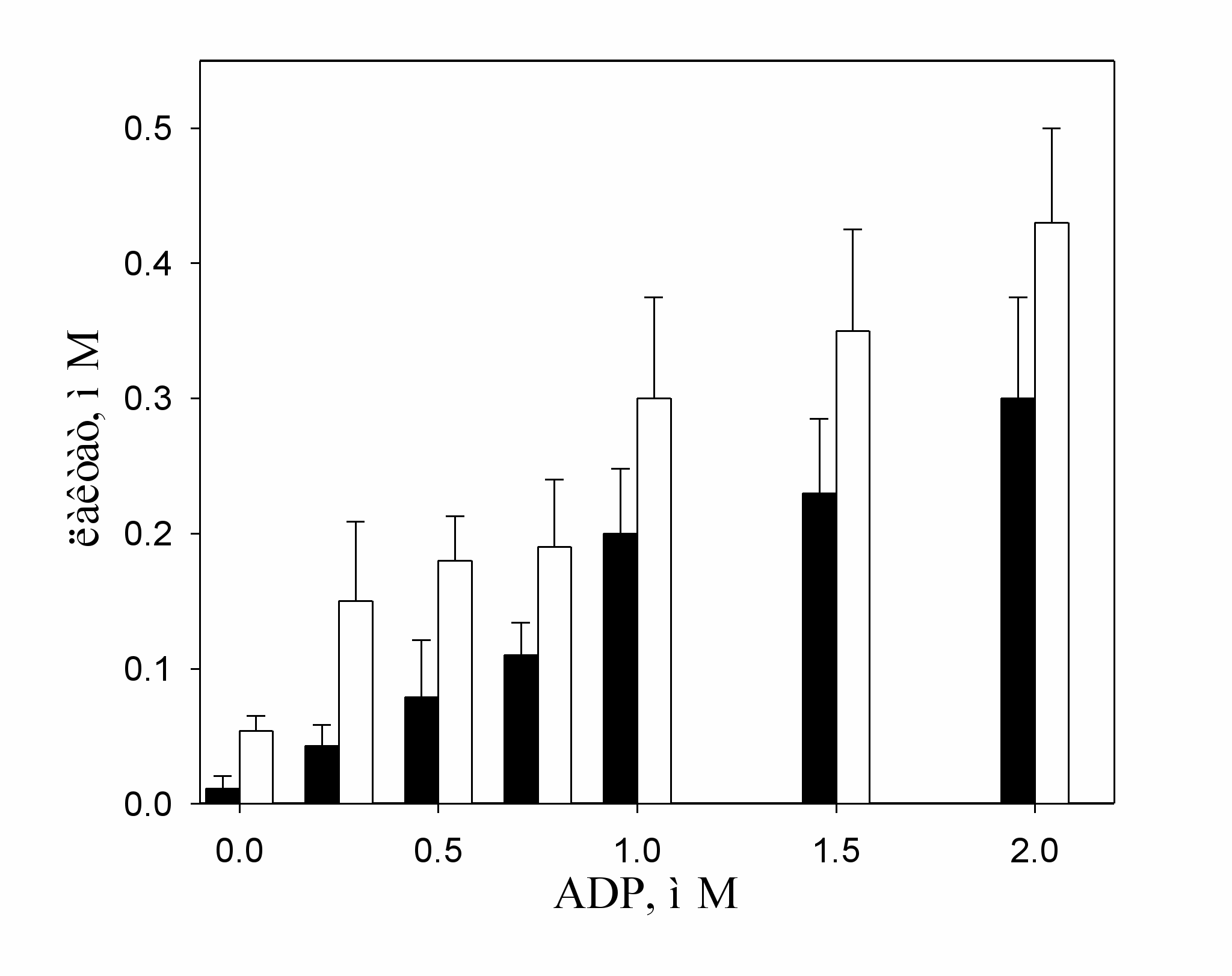
Рис. 2. Зависимость накопления лактата от концентрации ADP при инкубации смеси ферментов в присутствии 3-ФГА. Концентрация H2O2 в опыте 10 мкМ, концентрация 3-ФГА 3 мМ, концентрации ADP указаны на рисунке, светлые столбики - пробы, содержащие H2O2; темные столбики - пробы, содержащие МЭ.
За протеканием гликолиза мы следили не только по накоплению лактата, но и по изменению концентрации АТP в среде.
В таблице 1 представлено соотношение образования лактата и ATP в мышечном экстракте в зависимости от наличия окислителя или восстановителя в среде.
Таблица 1.
| | Лактат, мM | ATP, мМ | ATP/ 3-ФГА наблюдаемое | ATP/ 3-ФГА теоретическое |
| В присутствии 100 мкM Н2О2 | 0,62 0,038 | 0,65 0,01 | 1,04 0,08 | 1 полное разобщение |
| В присутствии 1 мМ MЭ | 0,186 0,022 | 0,31 0,032 | 1,61 0,14 | 2 полное сопряжение |

акопление АТP в цитоплазматической фракции мышц в присутствии 3 мМ 3-ФГА и 1мМ АDP.
Из таблицы 1 видно, что хотя в присутствии H2O2 количество образовавшегося АТP выше в 2 раза, а лактата - в 3 раза, чем в присутствии МЭ, однако эффективность гликолиза существенно возрастает в присутствии меркаптоэтанола, о чем свидетельствует отношение АТP/3-ФГА. Если в пробе с МЭ на каждую молекулу 3-ФГА образуется около 2 молекул АТP, что соответствует состоянию полного сопряжения в гликолизе, то в пробе, предварительно окисленной Н2О2 , соотношение АТP/ФГА составляет 1,04, то есть только 1 молекула АТP синтезируется на моль 3-ФГА. Это позволяет предположить, что в последнем случае АТP синтезируется только в ходе пируваткиназной реакции. Это свидетельствует о разобщении окисления и фосфорилирования в гликолизе на стадии, катализируемой ГАФД-3-ФГ-киназой. Таким образом, окисление ГАФД приводит к ускорению гликолиза, но к уменьшению синтеза АТP.
Эти наблюдения подтверждают наше предположение, что окисленная ГАФД, необратимо расщепляя 1,3-ДФГ, направляет гликолиз в обход 3-ФГкиназной реакции, обеспечивая тем самым накопление NADH и пирувата независимо от наличия ADP.
Накопление лактата в пробах, содержащих окисленную ГАФД, возможно и при наличии в среде одной лишь АТР. Как следует из таблицы 2, эффективное накопление лактата в присутствии 1мМ АТP наблюдалось только в пробах, окисленных перекисью водорода. В присутствии МЭ прирост лактата был крайне низким - в 10-12 раз ниже, чем в окисленных Н2О2 пробах. Сходные эффекты наблюдались как в смеси гликолитических ферментов, так и в цитоплазматической фракции мышц.
Таблица 2.
Накопление лактата в присутствии 3мМ 3-ФГА и 1 мМ ATP.
| | Концентрация лактата, мM | |
| в присутствии МЭ | в присутствии H2O2 | |
| смесь ферментов | 0,024 0,006 | 0,27 0,008 |
| цитоплазматическая фракция мышц | 0,015 0,005 | 0,18 0,006 |
Окисление проводили в присутствии H2O2 в концентрации: 10 мкМ (смесь гликолитических ферментов );100мкМ (цитоплазматическая фракция).
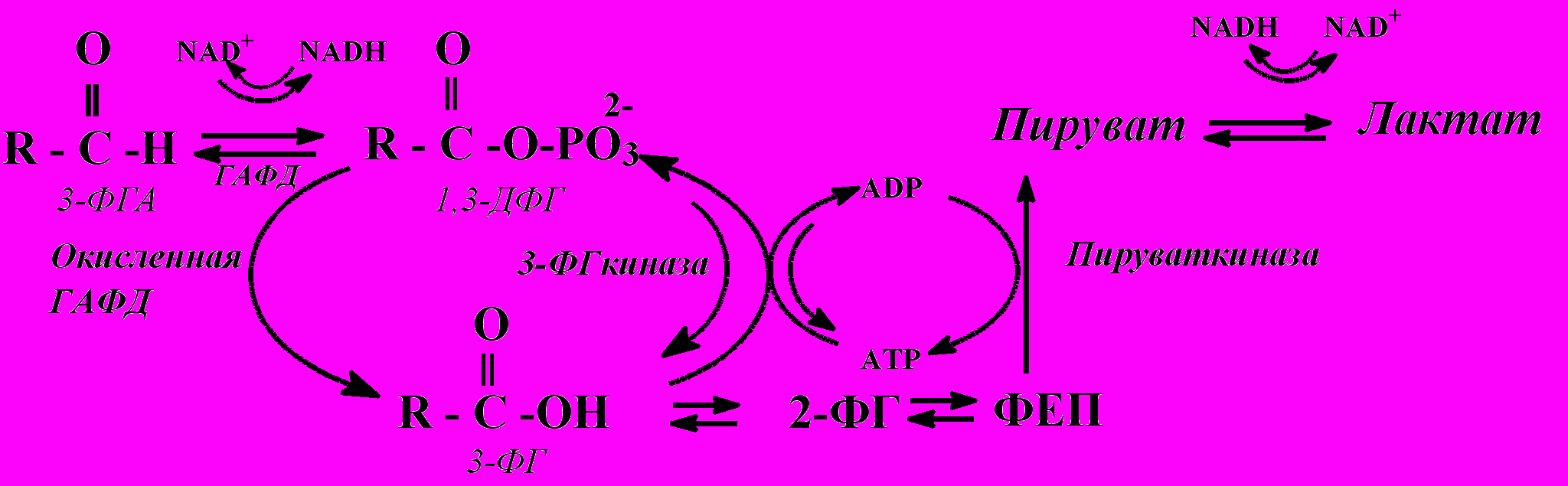
Рис. 3. Схема “футильного цикла гликолиза”.
По всей видимости, в опытах с использованием АТР мы видим явное доказательство работы “футильного цикла” с участием 3-ФГкиназы и окисленной ГАФД (схема на рис.3).
В ходе такого цикла ATP и 3-ФГ, образующиеся в системе, превращаются в ADP и 1,3-ДФГ при участии 3-ФГкиназы, а окисленная форма ГАФД вновь гидролизует 1,3-ДФГ до 3-ФГ, который снова поступает в цикл.
Таким образом, комбинация окисленной ГАФД и 3-ФГкиназы в присутствии 3-ФГА, приводит к гидролизу АТP с образованием АDP, который используется в пируваткиназной реакции. Благодаря такому «футильному циклу» гликолиз может функционировать даже в тех условиях, когда его протекание по обычному пути заблокировано из-за отсутствия АDP.
Дополнительное подтверждение предложенной нами гипотезы о разобщении окисления и фосфорилирования в ходе гликолиза было получено в опытах с нефосфорилирующей глицеральдегид-3-фосфатдегидрогеназой. Этот фермент, отсутствующий в тканях животных, катализирует NADP-зависимое превращение 3-фосфоглицеринового альдегида сразу в 3-фосфоглицерат без образования макроэргических соединений. Мышечный экстракт инкубировали в присутствии ADP, ФГА, NADP (кофактор ГАПН) и NADH (кофактор ЛДГ) и различных концентраций ГАПН. Было показано, что в присутствии 1 и 3,5 мкМ ГАПН накопление лактата возрастает в 5 и 8 раз, соответственно, по сравнению с пробами без добавления этого фермента. ГАПН способна эффективно заменять собой окисленную ГАФД и при добавлении в мышечный экстракт АТP вместо ADP. Таким образом, показана возможность существования футильного цикла, благодаря наличию в системе фермента-разобщителя. Таким образом, введение независимой глицеральдегид-3-фосфатдегидрогеназной системы с гидро-, а не с фосфоролитическим расщеплением ацил-фермента дает те же эффекты, что и наличие ацил-фосфатазной системы, расщепляющей 1,3-дифосфоглицерат. Обсуждаемые процессы могут иметь особое значение в условиях дефицита ADP в цитоплазме клетки, особенно при интенсивном дыхании, происходящем в митохондриях. Такие реакции позволяют поставлять субстраты в митохондрии (NADH и пируват) независимо от уровня ADP в цитоплазме, что может быть важным при работе митохондрий в режиме разобщения, а также обеспечивать приток субстратов для реакций биосинтеза.
- Влияние H2O2 НА ВЗАИМОДЕЙСТВИЕ ГАФД С
НУКЛЕИНОВЫМИ КИСЛОТАМИ
Существует обширная информация об участии ГАФД в индукции апоптоза и в развитии ряда патологических состояний, которое опосредовано осуществляется через взаимодействие фермента с нуклеиновыми кислотами. Однако конкретные механизмы этих процессов не изучены. По этим причинам мы исследовали влияние окисления перекисью водорода на особенности связывания ГАФД с нуклеиновыми кислотами, предполагая, что такое окисление может быть одним из механизмов вовлечения фермента в индукцию апоптоза.
Мы предположили, что в зависимости от степени окисления ГАФД и наличия кофактора в ее активном центре, фермент должен по-разному связываться с нуклеиновыми кислотами. Прежде всего, окисление SH- групп Cys-149 ГАФД должно понижать прочность связывания NAD в активном центре фермента, вследствие невозможности образования комплекса с переносом заряда между модифицированным Cys-149 фермента и кофактором. Способность такого окисленного фермента связываться с нуклеиновыми кислотами может изменяться как за счет изменения эффективности конкуренции кофактора и нуклеиновых кислот за активный центр ГАФД, так и благодаря изменению его сродства к НК.
Для проверки данной гипотезы мы определили параметры связывания полностью окисленной (100 мкм перекисью водорода) и полностью восстановленной (2 мМ МЭ) ГАФД с кофакторами NAD и NADH. Параметры связывания NAD или NADH с ГАФД определяли по тушению белковой флуоресценции по мере увеличения концентрации кофакторов. Было показано, что у восстановленной формы фермента присутствуют 4 центра связывания NAD на тетрамер ГАФД: два участка прочного (стехиометрического) связывания (КД менее 100 нМ), а также и 3 и 4 участки с КД 0,9 мкМ и 12 мкМ, соответственно. После окисления ГАФД до полного исчезновения всех видов активности фермента, сродство ГАФД к коферменту NAD значительно снижается – исчезают участки прочного стехиометрического связывания, а для участков непрочного связывания Кд снижается до 64 мкМ. Это происходит из-за невозможности образования комплекса с переносом заряда между модифицированным остатком Cys-149 и NAD. Так как NADH не способен образовывать комплекс с переносом заряда с Cys-149, то окисление фермента должно в меньшей степени влиять на его сродство к NADH. Действительно, окисленная форма фермента обладает двумя участками прочного стехиометрического связывания NADH и двумя участками связывания с КД 0,03 и 7мкМ. Таким образом, полученный результат подтверждает наше предположение о более высоком сродстве окисленного фермента к NADH, чем к NAD.
Для изучения взаимодействия нуклеиновых кислот с окисленной ГАФД был использован метод связывания белков с нуклеиновыми кислотами на нитроцеллюлозных фильтрах. В работе использовалась [32P] меченная суммарная тРНК, [32P] меченная тотальная ДНК и апофермент. Фермент окисляли 70 мкМ раствором перекиси водорода, а в восстановленном состоянии поддерживали 2 мМ МЭ. Результаты связывания ГАФД с [32P] меченной суммарной тРНК представлены на рис. 4. тРНК связывается и с
окисленной апоГАФД и с восстановленной апоГАФД (кривые 7 и 5).
Р
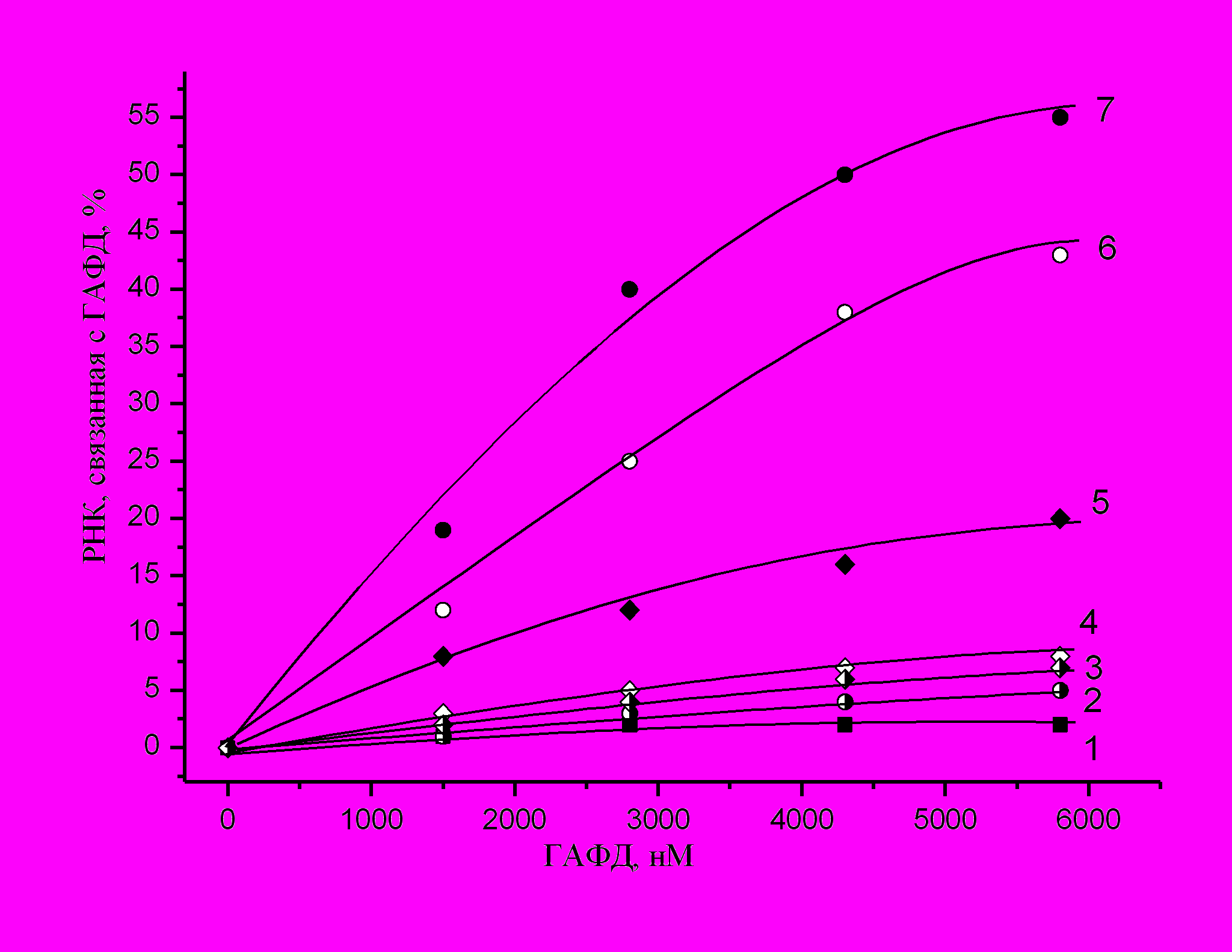
ис. 4. Взаимодействие [32P] меченной тРНК с окисленной и восстановленной ГАФД. Апофермент ГАФД в 10мМ Трис-HCl, рН 7,6, содержащем 7мМ MgCl2 и 10мМ KCl, окисляли 70 мкM раствором перекиси водорода или инкубировали в присутствии 2мМ раствора МЭ, а затем инкубировали с [32P] меченной суммарной тРНК в различных молярных соотношениях в течение 30 минут при 37оС. Кофакторы NAD и NADH в концентрации 100мкM добавляли за 10 минут до внесения в пробы тРНК. Комплексы адсорбировали на нитроцеллюлозных фильтрах, счет осуществляли по Черенкову. 1 – связывание тРНК с БСА в качестве контроля; 2 – окисленная ГАФД в присутствии NADH; 3 – восстановленная ГАФД в присутствии NADH; 4 – восстановленная ГАФД в присутствии NAD; 5 – восстановленная ГАФД без кофакторов; 6 – окисленная ГАФД в присутствии NAD; 7 – окисленная ГАФД в отсутствие кофакторов. Молярную концентрацию ГАФД определяли из расчета на мономер фермента.
Однако, связывание с окисленной формой происходит гораздо лучше, чем с восстановленной, т.е. окисление само по себе повышает сродство
ГАФД к тРНК. Присутствие же кофактора практически предотвращает связывание тРНК с восстановленной формой фермента (кривая 4) и незначительно уменьшает связывание ее с окисленной (кривая 6). NADH обладает более выраженной способностью предотвращать связывание ГАФД с
РНК, чем NAD (кривые 2 и 3).
Из-за более высокой прочности связывания кофактора NADH в активном центре окисленной ГАФД, концентрация NADH, способная воспрепятствовать связыванию тРНК с окисленным ферментом, ниже, чем соответствующая концентрация NAD.
Таким образом, можно прийти к заключению, что комплекс с РНК может образовываться только в тех случаях, когда кофактор NAD в активном центре ГАФД либо отсутствует, либо связан непрочно, из-за неспособности образовывать комплекс с переносом заряда.
Далее мы исследовали взаимодействие ГАФД с тотальной [32P] меченой ДНК. Как видно из приведенных на рисунке 5 данных - наилучшее связывание ДНК наблюдается с окисленной апоГАФД (кривая 1). Присутствие кофактора NAD ослабляет взаимодействие ДНК с окисленным ферментом (кривые 2, 3) и практически предотвращает его взаимодействие с восстановленным (кривые 5 и 6). Эти результаты аналогичны данным, полученным при изучении взаимодействия ГАФД с тРНК.
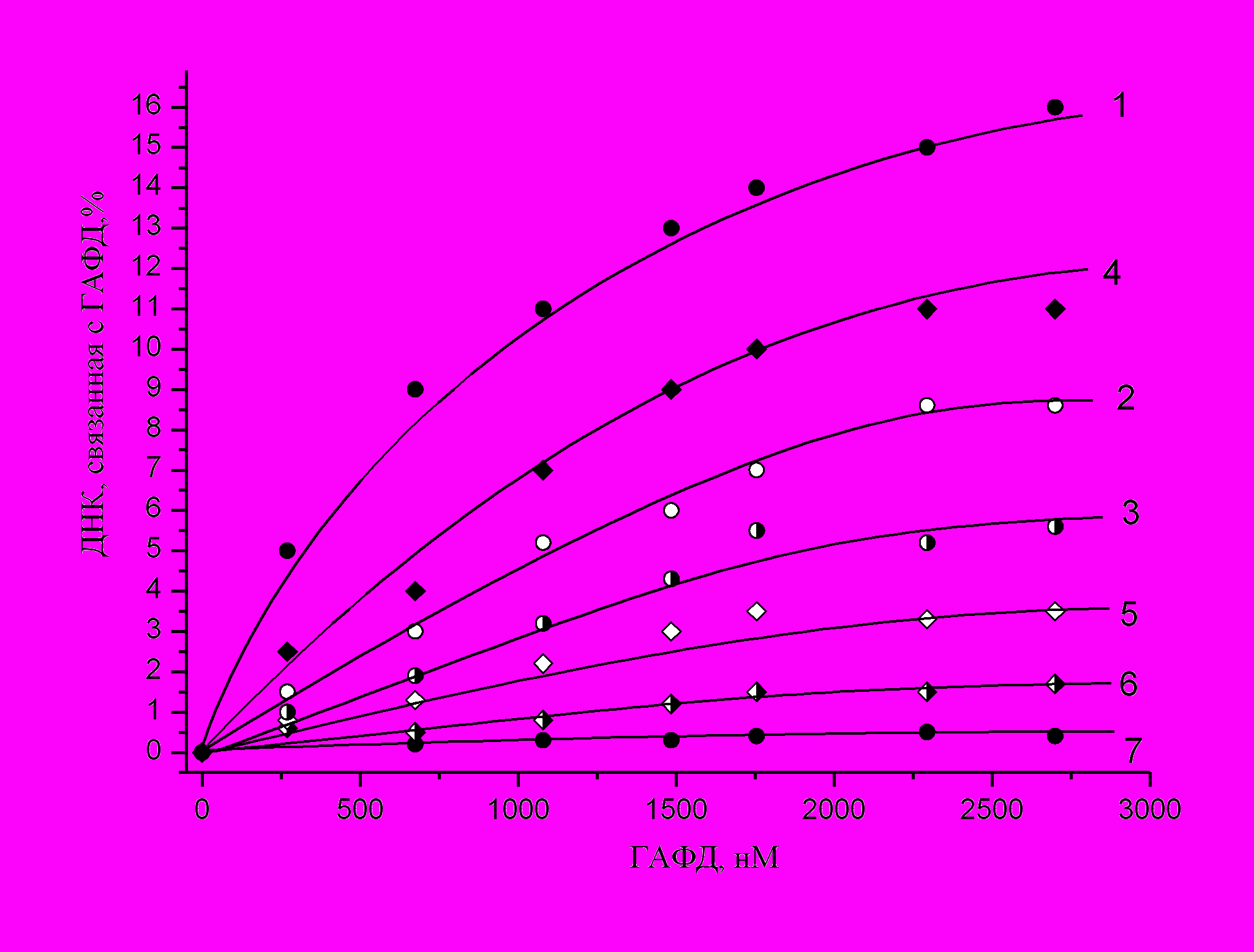
Рис. 5 Взаимодействие [32P]меченной тотальной ДНК с окисленной и восстановленной ГАФД.
Апофермент ГАФД в 10мМ Трис-HCl, рН 7,6, содержащем 7мМ MgCl2 и 10мМ KCl, окисляли 70 мкM раствором перекиси водорода или инкубировали в присутствии 2мМ раствора МЭ, а затем инкубировали с [32P] меченной тотальной ДНК в различных молярных соотношениях в течение 30 минут при 37оС. Кофактор NAD в концентрации 100мкM или 3мМ добавляли за 10 минут до внесения в пробы ДНК. Комплексы адсорбировали на нитроцеллюлозных фильтрах, счет осуществляли по Черенкову. 1 – окисленная апоГАФД в отсутствии кофактора; 2 – окисленная ГАФД в присутствии 100мкM NAD; 3 – окисленная ГАФД в присутствии 3мМ NAD; 4 – восстановленная апоГАФД без кофактора; 5 – восстановленная ГАФД в присутствии 100мкM NAD; 6 – восстановленная ГАФД в присутствии 3мМ NAD. Смесь [32P] меченной ДНК с БСА использовали в качестве контроля (7). Молярные концентрации ГАФД определяли на мономер белка.
Было показано, что окисление ГАФД увеличивает ее сродство к нуклеиновым кислотам. Эти данные подтверждают важную роль модификации ГАФД в ее способности взаимодействовать с нуклеиновыми кислотами.
Мы впервые показали, что такой модификацией может быть окисление цистеиновых остатков в активных центрах фермента, причем даже присутствие кофактора NAD не могло воспрепятствовать этому взаимодействию.
Как было показано выше, окисление фермента может ослаблять связывание с ним кофактора NAD. В то же время известно, что четвертичная структура апофермента гораздо менее стабильна, чем холофермента (Lakatos S. and Zavodsky P., 1976), и, таким образом, окисление ГАФД может приводить к диссоциации апофермента на димеры и мономеры. Таким образом, окисление вызывает появление в клетке ненативных форм ГАФД, способных перемещаться из цитоплазмы в ядро. Следовательно, с помощью антител к ненативным формам ГАФД можно попытаться визуализовать такие формы in vivo методом иммунного окрашивания, показав, таким образом, их субклеточную локализацию. Этим исследованиям был посвящен следующий раздел нашей работы.
3. ИЗМЕНЕНИЕ ВНУТРИКЛЕТОЧНОЙ ЛОКАЛИЗАЦИИ ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТДЕГИДРОГЕНАЗ ПРИ ИНДУКЦИИ АПОПТОЗА.
На основании собственных и литературных данных мы предположили, что именно ненативные формы ГАФД, которые неспособны участвовать в катализе гликолитической реакции, могут быть вовлечены в патологические процессы. В связи с этим было решено изучить внутриклеточную локализацию нететрамерных, то есть ненативных форм ГАФД. Для иммунной окраски ненативной ГАФД в клетке были использованы моноклональные антитела клона 6С5, которые с высокой аффинностью связывались с димерной, мономерной и денатурированной формами ГАФД, но не с нативными тетрамерами. (Grigorieva J. et al., 1999). На рисунке 6, А представлены результаты такого окрашивания. Видно ярко светящееся ядро, цитоплазма же остается практически темной. Лишь по краям заметно окрашивание, напоминающее стресс фибриллы. Видно, что окрашивание ГАФД по краям цитоплазмы полностью совпадает с окраской актина, то есть можно говорить о взаимодействии в клетке ненативной формы ГАФД и актина. Для подтверждения выявленной нами колокализации ГАФД и актина, мы использовали конфокальную микроскопию.
Р
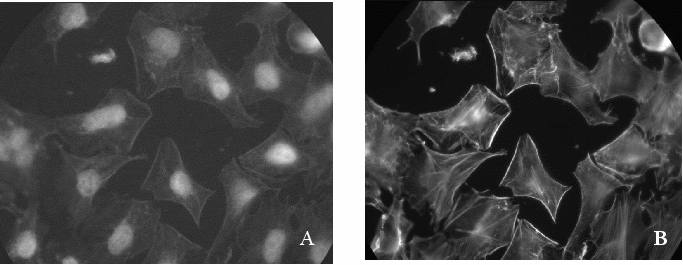 ис. 6. Внутриклеточная локализация ненативной ГАФД (А) и актина (В) в клетках HeLa
ис. 6. Внутриклеточная локализация ненативной ГАФД (А) и актина (В) в клетках HeLaН
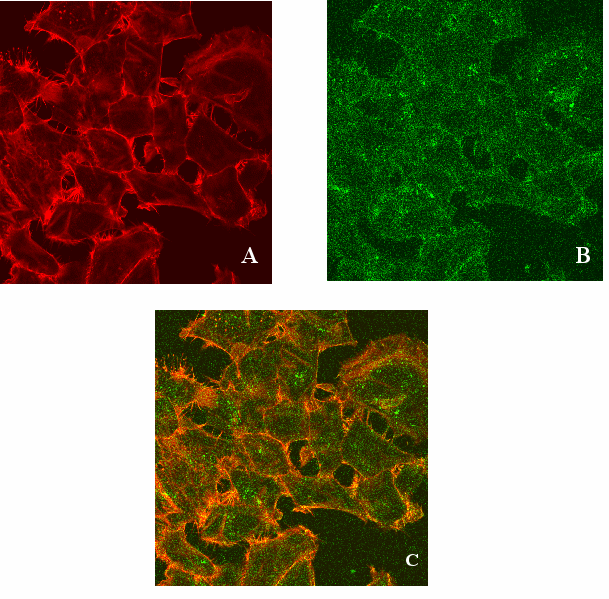
а рисунке 7 представлены результаты одновременного окрашивания клеток на ГАФД и актин.
Рис.7 Одновременное окрашивание клеток HeLa на ненативную форму ГАФД и актин. Клетки HeLa выращивали и окрашивали так же, как и в предыдущем эксперименте mAbs 6C5 и фаллоидином. Зеленое свечение – окраска ненативной формы ГАФД в клетках; красное – окраска актина. А – локализация актина в клетках HeLa; B – локализация ГАФД в клетках HeLa; C – колокализация ГАФД и актина в клетках HeLa
Видно, что окраска на ненативную ГАФД полностью совпадает с окраской на актин, что подтверждает оранжевое свечение комплекса (С) (окраска на ГАФД – зеленое свечение (В), на актин – красное (А)).
Таким образом, нами была продемонстрирована колокализация ненативной ГАФД и актина в нормальных клетках HeLa.
Для клетки известны состояния, когда в процессе апоптоза цитоплазматическая ГАФД транслоцируется в ядро. Для того чтобы оценить, что происходит при этом с ненативной формой фермента, мы изучили его субклеточную локализацию в процессе апоптоза. Апоптоз в клетках HeLa вызывали их инкубацией с TNF. На рисунке 8 показано окрашивание клеток HeLa mAbs 6C5 после 4 часов инкубации с TNF. На рисунке мы можем выделить 3 типа клеток, отличающихся по окраске. 1 – большие клетки, в которых четкая окраска ядра исчезла, вся клетка окрашена равномерно неярко, хотя осталось более четкое окрашивание краев клетки. По своей морфологии клетки еще близки к контрольным; 2 – клетки, окраска которых напоминает "солнечное затмение". Морфологически клетки уже заметно округлены; 3 – клетки, в которых яркая окраска наблюдается во всей клетке. Морфологически клетки также округлены. Второй тип клеток здесь составляет большинство популяции. После 6 часов инкубации с TNF. большую часть популяции составляет уже третий тип клеток, где ярко окрашена вся цитоплазма, а сами клетки круглые, заметно отличающиеся от морфологически нормальных. Мы полагаем, что эти три типа окрашивания ненативной ГАФД в процессе апоптоза представляют собой различные стадии, которые проходит данная форма фермента при апоптозе.

Рис. 8. Локализация ненативных форм ГАФД в клетках HeLa в процессе апоптоза после 4 часов инкубации с TNF.
