Е в регуляции биосинтеза белка и нуклеиновых кислот в культуре нормальных и опухолевых гепатоцитов 03. 00. 04 биохимия автореферат
| Вид материала | Автореферат |
- Спецкурс «Химия нуклеиновых кислот и основы генной инженерии» для студентов 4 курса, 23.84kb.
- Функции в организме, 166.53kb.
- Рабочая программа дисциплины «биология клетки» (молекулярная биология) Код дисциплины, 225.32kb.
- План состав нуклеиновых кислот Состав ДНК, 232.1kb.
- Урок №94 тема. Основные этапы биосинтеза белка, 33.42kb.
- «Нуклеиновые кислоты», 177.07kb.
- Механические и математические модели пространственных структур нуклеиновых кислот, 19.3kb.
- Вирусные и невирусные методы введения в организм рекомбинантных нуклеиновых кислот, 997.26kb.
- План: Введение (рассказ о биоорганической химии). Открытие нуклеиновых кислот, 38.77kb.
- Рабочей программы учебной дисциплины молекулярная биология уровень основной образовательной, 42.15kb.
На правах рукописи
КНЯЗЕВ
РОМАН АЛЕКСАНДРОВИЧ
РОЛЬ АПОЛИПОПРОТЕИНА А-I И АПОЛИПОПРОТЕИНА Е В РЕГУЛЯЦИИ БИОСИНТЕЗА БЕЛКА И НУКЛЕИНОВЫХ КИСЛОТ В КУЛЬТУРЕ НОРМАЛЬНЫХ И ОПУХОЛЕВЫХ ГЕПАТОЦИТОВ
03.00.04 - биохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Новосибирск – 2007
Работа выполнена в Государственном учреждении Научно-исследовательском институте биохимии Сибирского отделения Российской академии медицинских наук
Научный руководитель:
академик РАМН Панин Лев Евгеньевич
Научный консультант:
доктор медицинских наук, профессор Поляков Лев Михайлович
Официальные оппоненты:
доктор медицинских наук, профессор Колпаков Аркадий Ростиславович
доктор биологический наук, профессор Гуляева Людмила Федоровна
Ведущая организация: Государственное учреждение Научный центр клинической и экспериментальной медицины Сибирского отделения Российской академии медицинских наук (Новосибирск)
Защита состоится « 17» апреля 2007 г. в 10 часов на заседании диссертационного совета Д 001.034.01 в Государственном учреждении Научно-исследовательском институте биохимии СО РАМН по адресу: 630117, Новосибирск, ул. Академика Тимакова, 2; тел.: 8-3832-33-54-81).
С диссертацией можно ознакомиться в библиотеке Государственного учреждения Научно-исследовательского института биохимии Сибирского отделения Российской академии медицинских наук
Автореферат разослан «___» ___________ 2007г.
Ученый секретарь
диссертационного совета Русских Г. С.

ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Известно, что липопротеины и их белковые компоненты участвуют в регуляции многих метаболических процессов. Среди которых можно выделить следующие. Аполипопротеины апоА-I и апоЕ осуществляют регуляцию обмена холестерина не только в плазме крови, но и посредством рецепторов внутри клетки за счет активного его выведения с помощью встроенных в мембрану специфических транспортных белков: АТР-связывающего кассетного транспортера (АВСА1) и мембранного рецептора для ЛПВП - скевенджер-рецептора класса В1 (Borst P., Elfehnk R.O., 2002; Wei C. e.a.,2005). Аполипопротеины оказывают влияние на функцию эндокринной системы, в частности, на стероидогенез; апоЕ является одним из регуляторов клеточного иммунитета; аполипопротеины способны связывать и транспортировать в клетку различные по структуре соединения (Поляков Л.М., Панин Л.Е., 2000).
Имеются сообщения о регуляции аполипопротеинами генетического аппарата клетки. Это подтверждается в серии работ Института биохимии СО РАМН под руководством академика РАМН Л.Е. Панина. Действительно, в ядрах гепатоцитов крыс были обнаружены аполипопротеины А-I и Е. Оба белка присутствовали во фракции кислых негистоновых белков, принимающих участие в регуляции экспрессии генов. Оказалось, что аполипопротеин А-I способствует повышению транскрипционной активности хроматина. Были вскрыты и молекулярные механизмы этого процесса. Показано, что аполипопротеин А-I в комплексе с восстановленными формами стероидных гормонов взаимодействует с GC-богатыми участками ДНК. При этом восстановленная 4–3-кетогруппа А-кольца стероидных гормонов инициирует разрыв в GC-парах водородных связей. В дальнейшем разрыв увеличивается за счет гидрофобного взаимодействия между азотистыми основаниями и гидрофобными участками аполипопротеина А-I. С образовавшимися одноцепочечными участками ДНК взаимодействует РНК-полимераза, которая и запускает экспрессию генов с последующей активацией биосинтеза белка (Panin L.E. e.a., 1998; 2000).
Другим регуляторным белком является аполипопротеин Е. Он известен, как ингибитор пролиферации некоторых типов клеток, включая опухолевые (Vogel T. e.a., 1994). Показано, что аполипопротеин Е повышает экспрессию мРНК перлекана, основного протеогликана в семействе гепарансульфатов, который и опосредует антипролиферативный эффект аполипопротеина Е в культуре крысиных и человеческих гладкомышечных клеток аорты (Paka L. e.a., 1999). По данным Хоу и соавторов (2001), аполипопротеин Е ингибировал стимулированную сывороткой пролиферацию эмбриональных фибробластов крыс, при этом в бессывороточной среде аполипопротеин Е увеличивал рост клеток, продлевая G1-фазу клеточного цикла. Аполипопротеин Е усиливал рост первичных нейронов через сигнальную функцию ЛПНП-подобного рецептора (LRP, lipoprotein receptor-related protein) (Qui Z. e.a., 2004). Отмечена способность аполипопротеина Е ингибировать сосудистую гиперплазию при воспалении, вызванном денудацией эпителия сонных артерий у мышей (Moore, Z.W., Hui D.Y., 2005). Результаты исследования эффекта аполипопротеина Е на клетки человеческой аденокарциномы НТ29 и распределение -катенина позволяют предположить, что данный белок участвует в сохранении межклеточных взаимодействий, ингибируя рост опухолевых клеток (Niemi M. e.a. 2002). В дополнение к этому, показано, что аполипопротеин Е снижает экспрессию генов канонического, или зависимого от -катенина Wnt-сигнального пути (Caruso A. e.a. 2006), конститутивная активация которого играет важную роль в канцерогенезе (Taipale J. e.a., 2001).
Перечисленные работы о регуляторных эффектах аполипопротеинов А и Е позволили высказать предположение о существовании у этих белков конкурентных взаимоотношений в регуляции процессов внутриклеточной регенерации и пролиферации. В связи с этим, целью настоящего исследования являлось изучение роли аполипопротеинов А-I и Е в регуляции биосинтеза белка и нуклеиновых кислот в культуре нормальных и опухолевых гепатоцитов.
Задачи исследования:
- Изучить процессы комплексообразования липопротеинов со стероидными гормонами и их метаболитами.
- Изучить влияние комплексов стероидных гормонов и их метаболитов с аполипопротеином А-I на биосинтез белка в культуре гепатоцитов крыс.
- Изучить роль аполипопротеина Е в регуляции биосинтеза белка и нуклеиновых кислот в культуре нормальных гепатоцитов и в клетках асцитной гепатомы Эрлиха.
Научная новизна. Методами ультрацентрифугирования, гель-фильтрации и тушения флуоресценции показано, что при образовании комплексов липопротеинов со стероидными гормонами и их метаболитами принимает участие белковый компонент. Основным аполипопротеином, участвующим в процессе комплексообразования является аполипопротеин А-I. Полученные константы ассоциации комплексов белок-лиганд свидетельствуют о достаточно высоком сродстве.
На культуре гепатоцитов крыс показано, что комплексы аполипопротеина А-I с тетрагидрокортизолом и прегненолоном обладают высокой биологической активностью, усиливая скорость биосинтеза белка. Принципиально важную роль в этом процессе играет восстановленная 4–3-кетогруппа кольца А стероидных гормонов.
На культуре гепатоцитов крыс показано, что аполипопротеин Е проявляет конкурентный эффект по отношению к комплексу аполипопротеин А-I-тетрагидрокортизол и снижает увеличение скорости биосинтеза ДНК, РНК и белка, определяемую по включению радиоактивной метки.
Впервые на модели асцитной гепатомы Эрлиха показано, что опухолевые макрофаги играют ключевую роль в образовании биологическиактивных комплексов аполипопротеина А-I со стероидными гормонами, которые в свою очередь увеличивают скорость биосинтеза белка в клетках асцитной гепатомы. Аполипопротеин Е подавлял биологическую активность комплекса, что отражалось в снижении скорости биосинтеза белка.
Теоретическая и практическая значимость.
Решение поставленных в диссертации задач является важным этапом в исследовании молекулярных механизмов межклеточных взаимодействий связанных с регуляцией экспрессии генов. Установление характера и степени связывания (аффинитета) липопротеинов со стероидными гормонами и их метаболитами важны для оценки роли изучаемых комплексов в регуляции важнейших внутриклеточных процессов. В результате проведенных исследований, описан неизвестный ранее механизм регуляции биосинтеза ДНК, РНК и белка – процесс, основанный на конкурентных взаимоотношениях между аполипопротеином Е и комплексом аполипопротеином А-I-стероид.
Результаты работы свидетельствуют о том, что макрофаги занимают ключевые позиции в регуляции процессов регенерации и клеточной пролиферации. Эти межклеточные взаимодействия проявляют себя не только в нормальных тканях, но и в системе –макрофаг-опухолевая клетка. Показано, что в основе этих взаимоотношений также лежит способность макрофагов образовывать биологически активные комплексы восстановленных форм стероидных гомонов с аполипопротеином А-I. Однако способность к синтезу и секреции аполипопротеина Е у них снижена, что имеет принципиальное значение в противоопухолевой защите организма. Понимание тонких механизмов взаимоотношений макрофаг-опухолевая клетка может служить основой для повышения эффективности методов коррекции у онкологических больных.
Положения, выносимые на защиту:
- Фракции липопротеинов плазмы крови образуют комплексы со стероидными гормонами и их метаболитами за счет белкового компонента. Одним из главных таких белков является аполипопротеин А-I.
- Скорость биосинтеза белка в гепатоцитах крыс повышается под влиянием комплексов аполипопротеина А-I с тетрагидрокортизолом и с прегненолоном.
- Аполипопротеин Е подавляет эффекты комплексов аполипопротеина А-I с тетрагидрокортизолом и с прегненолоном в нормальных гепатоцитах и опухолевых клетках асцитной гепатомы Эрлиха.
Апробация материалов диссертации. Материалы диссертационного исследования доложены на I Съезде физиологов СНГ (Сочи, 2005).
Публикации. По материалам диссертации опубликованы 3 работы, из них 2 статьи.
Объем и структура диссертации. Диссертация состоит из введения, 4-х глав, включающих обзор литературы, материалов и методов, результатов исследований, обсуждения, выводов и списка литературы, включающих 30 отечественных и 172 зарубежных источников. Материалы диссертации изложены на 132 страницах машинописного текста. Работа иллюстрирована 9 таблицами и 16 рисунками. Диссертация выполнена в соответствии с планом научно-исследовательских работ Института биохимии СО РАМН.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Исследования были проведены на крысах линии Вистар массой 180-200 г, мышах линии СВА массой 15-20 г, полученных из вивария СО РАМН (Новосибирск). Содержание, питание, уход за животными и выведение их из эксперимента осуществляли в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных» (Приложение к приказу МЗ СССР от 12.08.1977 г № 755).
В работе использовались следующие методы:
- Выделение липопротеинов сыворотки крови методом ультрацентрифугирования в растворах KBr (Hatch, Lees, 1968).
- Делипидирование липопротеинов (Herbert P., e.a.,1973). Делипидирование проводили охлажденной смесью хлороформ-метанол (1:1) с последующей многократной отмывкой эфиром.
- Хроматографические методы. Смесь аполипопротеинов наносили на колонку (1,6 х 100 см) с Сефарозой CL-4В "Pharmacia" (Швеция) и элюировали 0,01 М трис-НСl буфером, рН 8,6, содержащим 6 М мочевину, 0,01% азид натрия и 1 мМ фенилметансульфонилфторид (Herbert P., e.a., 1973).
- Электрофорез в полиакриламидном геле с додецилсульфатом натрия (Laemmli, 1970).
- Гепатоциты выделяли методом рециркуляторной ферментативной перфузии с использованием 0,03% раствора коллагеназы (Seglen Р.О., 1976).
- В качестве модели опухолевого роста использовалась гепатома Эрлиха (Институт цитологии и генетики СО РАН, Новосибирск).
- Анализ взаимодействия триптофансодержащих белков ЛП-фракций со стероидами их метаболитами проводили на спектрофлуориметре MPF-4 «Хитачи» (Япония) при длине волны возбуждения 285 нм и эмиссии в диапазоне от 300 до 600 нм (Лакович Дж., 1986.)
- Изучение образования комплекса апоА-I-прегненолон проводили методом гель-фильтрации (колонка: 40 0,8 см, Сефадекс G-25 («Pharmacia», Швеция), элюент: 0,05 М калий-фосфатный буфер, рН 7,4, содержащий 0,15 М NaCl).
- Константы ассоциации (Касс.) были рассчитаны на основании кривых тушения флуоресценции (Attala, Lata 1968).
- Скорость биосинтеза белка в культуре клеток оценивали по включению 14С-лейцина и выражали в имп/мин на 1 мг белка (Weigand K. e.a., 1974).
- Скорость биосинтеза РНК в культуре клеток оценивали по включению 3Н-уридина и выражали в имп/мин на 1 мг белка (Шаткин А., 1972).
- Скорость биосинтеза ДНК в культуре клеток оценивали по включению 3Н-тимидина и выражали в имп/мин на 1 мг белка (Шаткин А., 1972).
Результаты экспериментов обработаны методами вариационной статистики с использованием t-критерия Стьюдента. При обработке экспериментальных данных использовали пакет прикладных программ Microsoft office (США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Связывание стероидных гормонов и их метаболитов отдельными классами ЛП и их белковыми компонентами, мы изучали с использованием методов ультрацентрифугирования, гель-фильтрации и флуоресцентной спектроскопии.
Полученные методом ультрацентрифугирования данные показали, что связывание меченых стероидов с липопротеиновыми фракциями в целом оказалось на уровне 34-42%. Основная часть метки находилась во фракции белков инфранатанта. Однако нельзя не учитывать и тот факт, что в инфранатанте находится значительная часть аполипопротеинов, не связанных с липидами. Это, так называемый, "свободный пул" аполипопротеинов, который также может вносить свой вклад в связывание стероидов.
Высокая специфичность и чувствительность флуоресцентных методов позволяет их широко применять для анализа взаимодействий типа "рецептор-лиганд". Метод белковой флуоресценции позволяет обнаружить зависимость спектральных характеристик хромофорных групп (триптофанилов) от конформационного состояния молекул белка. Считается, что триптофан является естественной "меткой-репортером", поэтому исследование параметров его флуоресценции дает представление о характере взаимодействий, в частности, при образовании комплексов белок-стероид.
Анализ взаимодействия ЛП со стероидными гормонами показал, что наибольшее снижение флуоресценции было для частиц ЛПВП (55-65%). Менее выраженным данный эффект был для ЛПОНП (30-35%) и для ЛПНП (15-20%). При этом форма спектров, их полуширина практически не изменялись.
В частицах ЛПВП основным структурно-функциональным белком является апоА-I. В связи с этим, изучали связывание стероидов хроматографически очищенным апоА-I. На рис. 1. приведены кривые тушения триптофановой флуоресценции апоА-I при образовании комплексов с тетрагидрокортизолом. Тушение составило 29%. На рис. 2. приведены кривые тушения триптофановой флуоресценции апоА-I при образовании комплексов с прегненолоном. Тушение составило 20%.
Изучение временной зависимости тушения флуоресценции при одномоментном добавлении насыщающих количеств стероидов показало, что полное насыщение связывающих областей ЛП-частиц гормонами происходит уже через 30 мин от начала опыта.

Рис. 1. Спектры триптофановой флуоресценции апоА-I при комплексообразовании с тетрагидрокортизолом.
(
 ) – апоА-I (исходный спектр);
) – апоА-I (исходный спектр); (
 ) – апоА-I + тетрагидрокортизол (через 60 мин);
) – апоА-I + тетрагидрокортизол (через 60 мин);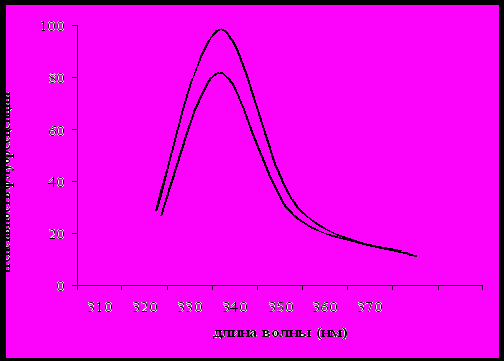
Рис. 2. Спектры триптофановой флуоресценции апоА-I при комплексообразовании с прегненолоном.
(
 ) – апоА-I (исходный спектр);
) – апоА-I (исходный спектр); (
 ) – апоА-I + прегненолон (через 60 мин).
) – апоА-I + прегненолон (через 60 мин).В таблице 1. представлены константы связывания различных стероидов с ЛП фракциями и изолированного апоА-I, полученные на основе кривых тушения триптофановой флуоресценции. Константы ассоциации комплексов белок-лиганд (106 М-1) свидетельствуют о достаточно высоком сродстве, поэтому связывание можно назвать специфическим.
Таблица 1.
Константы ассоциации для комплексов липопротеин-стероид на основании кривых тушения флуоресценции триптофана.
| Стероид | ЛПОНП | ЛПНП | ЛПВП | АпоА-I |
| Кортикостерон | 0,6х106М-1 | 0,67х106М-1 | 3,6х106М-1 | 0,8х106М-1 |
| Дезокси- кортикостерон | 1,02х106М-1 | 0,14х106М-1 | 4,0х106М-1 | 0,3х106М-1 |
| Тестостерон | 1,2х106М-1 | 0,27х106М-1 | 4,8х106М-1 | 0,7х106М-1 |
| Прогестерон | 0,6х106М-1 | 0,64х106М-1 | 4,4х106М-1 | 0,5х106М-1 |
Для изучения комплексообразования апоА-I c прегненолоном мы исполоьзовали также метод гель-фильтрации. Хроматографию проводили на сефадексе G-25. На колонку одновременно нанесли хроматографически чистый апоА-I и 14С-прегненолон, при этом белок выходил отдельным пиком без регистрации радиоактивности. Затем инкубация апоА-I с 14С-прегненолоном на выходе показала присутствие метки во фракции белка. Что подтверждает данные по тушению триптофановой флуоресценции о процессе комплексообразования апоА-I-гормон. Присутствие 1000-кратного избытка немеченого прегненолона практически вытесняло меченый, что также позволяет говорить о специфичности связывания гормон-белок.
Для выяснения закономерностей в регуляции экспрессии генов, связанных с усилением биосинтеза белка, были проведены исследования в двух независимых парах стероидных гормонов. Первая пара представляет гормоны пучковой зоны коры надпочечников. Это кортизол и его восстановленная форма – тетрагидрокортизол. Разница между ними заключается в том, что у последнего гормона 4–3-кетогруппа А-кольца восстановлена. Гидроксил в 3-м положении ТГК находится в транс-позиции. Вторая пара гормонов – прогестерон и прегненолон. По структуре А-кольца первый гормон полностью соответствует кортизолу, а второй - тетрагидрокортизолу, только оксигруппа в 3-м положении у прегненолона находится в цис-позиции.
Проведены нами исследования показали, что в паре кортизол – тетрагидрокортизол только комплекс апоА-I-ТГК значительно усиливал скорость биосинтеза белка в гепатоцитах по сравнению с контролем (табл. 2). Кортизол, комплекс апоА-I-кортизол и ТГК не вызывали достоверных изменений по сравнению с контролем.
Таблица 2.
Изменение скорости биосинтеза белка в гепатоцитах крыс (M±m)
| Условия инкубации | Скорость биосинтеза белка, имп/мин на 1 мг белка, (n=5) |
| Контроль | 18016 ± 554 |
| АпоА-I | 15763 ± 452 # |
| Кортизол | 16395 ± 398 # |
| ТГК | 15559 ± 433 # |
| АпоА-I - кортизол | 15854 ± 317 # |
| АпоА-I - ТГК | 32802 ± 1175 * |
* - достоверное различие по сравнению с контролем (р < 0,001)
# - достоверное различие по сравнению с комплексом апоА-I-ТГК (р < 0,05)
Результаты в паре прогестерон – прегненолон оказались схожими, биологической активностью обладал комплекс апоА-I-прегненолон, который имеет восстановленную окси группу в А кольце, он значительно усиливал биосинтез белка, тогда как комплекс апоА-I-прогестерон не изменял скорость включения 14С-лейцина по сравнению с контролем (табл. 3).
Таблица 3.
Изменение скорости биосинтеза белка в гепатоцитах крыс (M±m)
| Условия инкубации | Скорость биосинтеза белка, имп/мин на 1 мг белка, (n=6) |
| Контроль | 57606 ± 2762 |
| АпоА-I | 50405 ± 1446 # |
| Прогестерон | 64815 ± 968 # |
| Прегненолон | 57730 ± 1267 # |
| АпоА-I - прогестерон | 64055 ± 1415 # |
| АпоА-I - прегненолон | 112089 ± 1560 * |
* - достоверное различие по сравнению с контролем (р < 0,001)
# - достоверное различие по сравнению с комплексом
апоА-I– прегненолон (р < 0,001)
Сами прогестерон и прегненолон также не вызывали достоверных изменений по сравнению с контролем.
Проведенные исследования говорят о том, что в комплексе с апоА-I биологической активностью обладает не только восстановленная форма кортизола - тетрагидрокортизол, но и соответствующий ему по структуре А-кольца прегненолон. Считаем, что в повышении скорости биосинтеза белка в гепатоцитах принципиально важную роль играет восстановленная 4–3-кетогруппа стероидных гормонов.
Ранее уже было показано, что комплекс апоА-I с тетрагидрокортизолм обладает биологической активностью, которая заключается в усилении экспрессии генов и увеличении скорости биосинтеза ДНК, РНК и белка. Исходя из литературных данных о регуляторных эффектах апоЕ, мы предположили, что этот белок может играть роль отрицательной обратной связи в данном механизме усиления биосинтеза белка и нуклеиновых кислот. Проведенные нами исследования показали, что апоЕ полностью подавлял повышение биосинтеза ДНК, РНК и белка, вызванное действием комплекса апоА-I– ТГК (табл. 4).
Таблица 4.
Изменение скорости биосинтеза ДНК, РНК и белка в гепатоцитах
(M±m)
| Условия икубации | Скорость биосинтеза имп/мин на мг белка (n=6) | ||
| ДНК | РНК | Белка | |
| Контроль | 1343 ± 74 | 1155 ± 52 | 18016 ± 554 |
| АпоА-I - ТГК | 1985± 104 * | 2275 ± 173 * | 32802 ± 1175 * |
| АпоЕ | 862 ± 70 *# | 1134 ± 131 # | 19942 ± 2463 # |
| АпоА-I - ТГК + апоЕ | 803 ± 48 *# | 1132 ± 191 # | 21823 ± 2292 # |
* - достоверное различие по сравнению с контролем (р < 0,01)
# - достоверное различие по сравнению с комплексом
апоА-I – ТГК (р < 0,01)
В отсутствии комплекса апоА-I-ТГК в среде инкубации апоЕ не оказывал влияния на биосинтез белка и РНК, но снижал скорость включения меченого тимидина в ДНК в 1,6 раза по сравнению с контролем.
Таким образом, между комплексом апоА-I–ТГК и апоЕ существуют конкурентные взаимоотношения. Они проявляются в том, что комплекс апоА-I–ТГК усиливает синтез ДНК, РНК и белка в гепатоцитах, в то время как апоЕ полностью снимает эффект комплекса.
В НИИ биохимии СО РАМН было показано, что клетки Купфера фагоцитируя продукты клеточной деградации, кооперативно с помощью рецептор-опосредованного эндоцитоза захватывают ЛПВП3 и стероидные гормоны. ЛПВП3 во вторичных лизосомах подвергаются дезинтеграции с образованием апоА-I, а стероидные гормоны восстанавливаются при участии - и -редуктаз с образованием тетрагидросоединений. Полученные продукты образуют биологически активный комплекс, который сначала попадает в интерстициальное пространство, а затем в ядра гепатоцитов, где и усиливает экспрессию генов.
Мы изучали этот процесс на культуре клеток асцитной гепатомы Эрлиха. Полученные данные показали, что добавление ЛПВП и кортизола увеличивала скорость биосинтеза белка в сокультуре клеток асцитной гепатомы и опухолевых макрофагов (табл.5). Добавление ЛПВП и кортизола в культуру без прилипающих клеток не вызывало достоверных изменений по сравнению с контролем. Что подтверждает данные, полученные ранее на нормальных клетках Купфера (Усынин И.Ф. 1996). У нас была задача изучить роль апоЕ в данном механизме, предположительно, он должен играть роль отрицательной обратной связи, снимая биологический эффект комплекса апоА-I-тетрагидрокортизол образованного в макрофагах. Полученные данные показали – апоЕ действительно ингибировал эффект комплекса апоА-I-ТГК (табл. 5).
Таблица 5.
Изменение скорости биосинтеза белка в клетках асцитной гепатомы Эрлиха (M±m)
| Условия инкубации | Скорость биосинтеза белка, имп/мин х 103 на 1 мг белка, (n=6) |
| 1. Контроль (сокультура) | 816 ± 14,3 |
| 2. Сокультура + ЛПВП + кортизол | 937 ± 35,4 * |
| 3. Сокультура + апоЕ + ЛПВП + кортизол | 733 ± 28,3* # |
| 4. Клетки асцитной гепатомы + ЛПВП + кортизол | 728 ± 20,5 * # |
* - достоверное различие по сравнению с группой 1 (р < 0,05)
# - достоверное различие по сравнению с группой 2 (р < 0,05)
Мы провели аналогичное исследование еще на одном стероиде-прогестероне. Предположительно в макрофагах окси группа в А кольце прогестерона может восстанавливаться с образованием предшественника прогестерона – прегненолона, который в свою очередь образует комплекс с основным компонентом ЛПВП – апоА-I. Этот комплекс и должен усиливать экспрессию генов в клетках гепатомы. Полученные данные показали увеличение скорости биосинтеза белка в сокультуре под действием ЛПВП и прогестерона (табл. 6). Добавление ЛПВП и прогестерона в культуру клеток гепатомы Эрлиха без прилипающих клеток не вызывало эффекта. Инкубация клеток в присутствии ЛПВП, кортизола и апоЕ также не оказывало эффекта на изменение биосинтеза белка.
Таблица 6.
Изменение скорости биосинтеза белка в клетках асцитной гепатомы Эрлиха (M±m)
| Условия инкубации | Скорость биосинтеза белка, имп/мин х 103 на 1 мг белка, (n=6) |
| 1. Контроль (сокультура) | 762 ± 34,2 |
| 2. Сокультура + ЛПВП + прогестерон | 877 ± 47,9 * |
| 3. Сокультура + апоЕ + ЛПВП + прогестерон | 760 ± 64 # |
| 4. Клетки асцитной гепатомы + ЛПВП + прогестерон | 712 ± 48,9 |
* - достоверное различие по сравнению с группой 1 (р < 0,05)
# - достоверное различие по сравнению с группой 2 (р < 0,05)
Таким образом, на культуре асцитной гепатомы Эрлиха было показано, что в процессе образования биологически активного комплекса ключевая роль принадлежит макрофагам, что подтверждается серией работ выполненных в Институте биохимии под руководством академика РАМН Панина Льва Евгеньевича (Панин Л.Е., 1998). Аполипопротеин Е принимает участие в подавлении биологических эффектов комплекса аполипопротеина А-I с тетрагидрокортизолом и, предположительно, комплекса аполипопротеина А-I с прегненолоном в культуре клеток асцитной гепатомы Эрлиха.
ВЫВОДЫ
- Липопротеиновые фракции плазмы крови образуют комплексы со стероидными гормонами и их метаболитами за счет белковых компонентов. Одним из главных таких белков является аполипопротеин А-I.
- Комплексы аполипопротеина А-I с тетрагидрокортизолом и с прегненолоном обладают высокой биологической активностью, усиливая скорость биосинтеза белка в гепатоцитах крыс.
- Аполипопротеин Е принимает участие в подавлении эффектов комплексов аполипопротеина А-I с тетрагидрокортизолом и аполипопротеина А-I с прегненолоном в гепатоцитах крыс.
- На модели асцитной гепатомы Эрлиха показано, что опухолевые макрофаги играют ключевую роль в образовании биологически-активных комплексов аполипопротеина А-I со стероидными гормонами, которые в свою очередь увеличивали скорость биосинтеза белка в клетках асцитной гепатомы.
- Аполипопротеин Е подавляет биологическую активность комплекса апоА-I, что отражалось в снижении скорости биосинтеза белка в культуре клеток асцитной гепатомы Эрлиха.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ.
- Суменкова Д.В., Князев Р.А., Гуща Р.С., Поляков Л.М., Панин Л.Е. Влияние комплекса тетрагидрокортизола и аполипопротеина А-I на метаболические характеристики изолированных гепатоцитов// Тез.докл. I Съезда физиологов СНГ. Сочи -2005.-с.216.
- Л.М.Поляков, Р.А.Князев, Д.В.Суменкова, Л.Е.Панин Анализ взаимодействия липопротеинов и стероидных гормонов// Сибирский Консилиум.-2006.-№7(54).-с.20-24.
- Л.Е.Панин, Р.А.Князев, Д.В.Суменкова, Р.С.Гуща, Л.М.Поляков Роль аполипопротеина Е в регуляции биосинтеза белка и нуклеиновых кислот в культуре гепатоцитов крыс// Бюллетень Сибирского отделения РАМН.-2007.-123.-№1.-с.63-66.
