Разработка биотехнологий получения иммобилизованных дрожжей и их применения в бродильных производствах 05. 18. 07 Биотехнология пищевых продуктов (пивобезалкогольная, спиртовая и винодельческая промышленности) 05.
| Вид материала | Автореферат |
СодержаниеРис. 1. Принципиальная схема получения биокатализатора на основе криогеля ПВС 1.2. Оптимизация процесса формирования биокатализатора |
- Интенсификация процесса брожения методом электронно-ионной обработки (эио) пивных дрожжей, 547.73kb.
- Методические рекомендации по выполнению лабораторного и научно-исследовательского практикума, 952.7kb.
- Учебно-методический комплекс дисциплины Молекулярная и промышленная биотехнология Специальность, 49.3kb.
- Учебное пособие по курсу "Биотехнология" для студентов фармацевтического факультета, 1364.67kb.
- Потребительское поведение на рынке функциональных пищевых продуктов приморского края, 71.92kb.
- Совершенствование биотехнологий высокоочищенной α-циклодекстринглюканотрансферазы, 372.26kb.
- Санкт-Петербургский Государственный университет низкотемпературных и пищевых технологий, 55.14kb.
- Особенности использования иммобилизованных ферментов в пищевой промышленности, 89.87kb.
- Совершенствование технологии производства природно-полусладких вин в условиях российской, 313.28kb.
- Микробиология пищевых продуктов специальность 111201 «Ветеринария» Пояснительная записка, 312.22kb.
Рис. 1. Принципиальная схема получения биокатализатора на основе криогеля ПВС:
А) по ранее известному методу (Мартыненко, 2004),
Б) по разработанному в работе методу.

Разработка биокатализатора на основе клеток дрожжей, иммобилизованных в криогель ПВС
Состав среды
Оптимизация условий получения биомассы клеток для иммобилизации
Оптимизация условий получения биокатализатора
Применение разработанного биокатализатора
рН
Температура
культивирования
Концентрация раствора ПВС
Условия формирования гранул
Для шампанизации вина
Классическим способом
(в бутылках)
Резервуарнымспособом
Для получения вина
Белого
Красного
Для кислотопонижения вина
Для устранения недобродов
Для получения биоэтанола
Концентрация биомассы клеток в гранулах




- Анализ кинетики роста дрожжей
- Анализ бродильной активности полученной биомассы свободных клеток
- Биохимический анализ клеток (концентрация АТФ, жирнокислотный состав, содержание трегалозы)
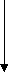
- Анализ бродильной активности полученного биокатализатора
- Исследование жизнеспособности иммобилизованных клеток
- Микроскопирование поверхности гранул биокатализатора
- Исследование характеристик готового продукта
Исследование свойств иммобилизованного биокатализатора
Рис. 2. Общая схема проведения экспериментальных исследований в диссертационной работе.
Было установлено, что максимальные удельная скорость роста и уровень накопления биомассы дрожжей были получены на питательной полусинтетической среде (Рис. 1Б).
Далее проверялось влияние примененных условий культивирования дрожжей (состава среды, температуры и длительности процесса) на сбраживание свободными клетками виноматериала при 15оС в течение 4 недель (Рис. 3). Было показано, что бродильная активность дрожжей, выращенных на полусинтетической среде, практически не отличается от активности дрожжей, выращенных на виноматериале (Рис. 3). Однако, анализ биохимических характеристик этих клеток выявил существующие между ними различия. Было установлено, что удельная концентрация трегалозы в дрожжевых клетках, выращенных на полусинтетической среде почти на 120% и 30% выше, чем в клетках, культивирование которых проводили на виноматериале и солодовом сусле, соответственно (Табл. 2). А это значит, что клетки, выращенные на полусинтетической среде лучше были подготовлены к преодолению стрессовой ситуации, возникающей при их криоиммобилизации, так как известно, что трегалоза в дрожжах выполняет роль протектора целостности клеток при неблагоприятных условиях культивирования.
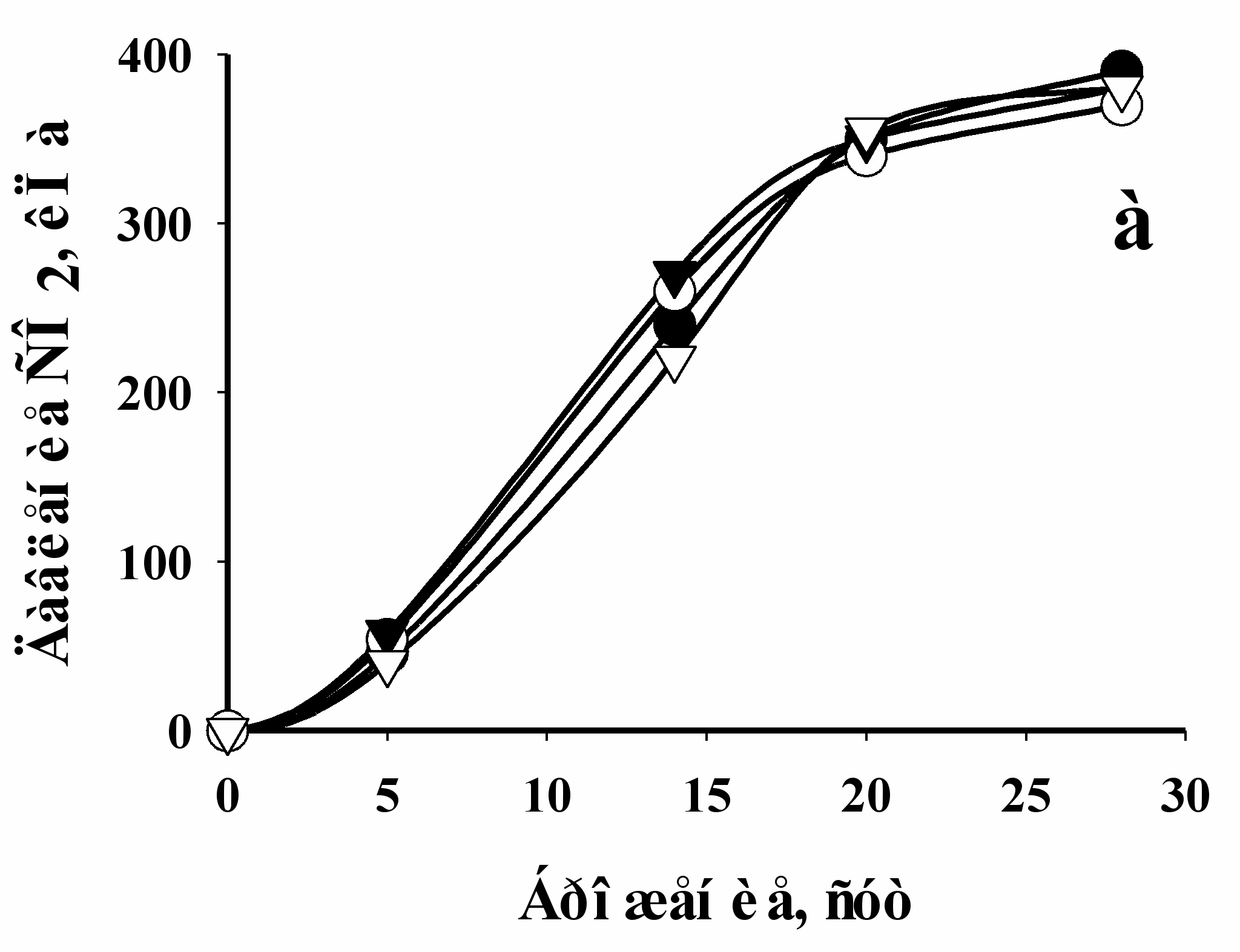
Рис. 3. Динамика накопления СО2 в процессе сбраживания виноматериала дрожжевыми клетками, предварительно выращенными при 30оС (а) и 20оС (б). Символы , и ▼ – обозначают дрожжевые клетки, культивировавшиеся на виноматериале с рН 5,0; рН 7,0 и рН 3,0, соответственно; символ обозначает клетки, выращенные на полусинтетической среде (рН 5,6).
Высокий уровень внутриклеточного АТФ в дрожжевых клетках, выращенных на полусинтетической среде (Табл. 2), также свидетельствовал о более благоприятном энергетическом статусе этих клеток, с точки зрения их последующей иммобилизации, в сравнении с клетками, выращенными на виноматериале. Также было установлено, что величина удельной концентрации внутриклеточного АТФ имеет максимум в конце логарифмической фазы роста. Эту фазу сочли оптимальной для иммобилизации клеток.
Таблица 2. Содержание трегалозы и удельная концентрация внутриклеточного АТФ в дрожжах, выращенных на различных питательных средах в аэробных условиях
| Среда для культивирования дрожжей | Время культивирования, ч | Трегалоза, мг/г сух биомассы | [АТФ] х 10-10 моль/мг клеток |
| Виноматериал pH 3,0 | 24 72 | 0,116 0,119 | 7,8 1,7 |
| Полусинтетическая среда рН 5,6 | 24 | 0,259 | 16,2 |
| Солодовое сусло рН 5,2 | 24 | 0,197 | 15,7 |
Анализ жирнокислотного состава липидов биомассы дрожжей показал, что уровень ненасыщенности жирных кислот в клетках, выращенных при 20оC в 2 раза выше, чем в клетках, выросших при 30оC (Табл. 3).
Таблица 3. Жирнокислотный состав дрожжевой биомассы, полученной при культивировании в различных условиях
| Жирные кислоты (длина углеродной цепи и количество двойных связей) | Содержание в % | ||||||||
| 20оC | | 30оC | |||||||
| аА | Б | В | Г | А | Б | В | Г | ||
| ∑ C 10:0÷14:0 | 3,99 | 0,63 | 3,99 | 0,88 | 1,22 | 1,17 | 14,69 | 12,87 | |
| C 14:1 | 0,30 | 0,18 | 0,30 | 0,42 | 0,08 | н/о | 0,42 | н/о | |
| C 15:0 | 0,64 | 0,34 | 0,65 | 0,23 | 0.30 | 0,44 | н/о | 4,92 | |
| C 16:0 | 9,32 | 7,68 | 9,47 | 6,39 | 26,66 | 28,48 | 27,16 | 24,80 | |
| C 16:1 | 41,91 | 36,74 | 42,56 | 55,00 | 26,11 | 22,97 | 8,72 | 10,89 | |
| C 17:0 | 0,20 | 0,07 | н/о | 0,18 | 0,11 | н/о | н/о | 1,16 | |
| C 18:0 | 3,20 | 4,22 | 3,46 | 2,53 | 25,12 | 25,34 | 19,02 | 6,51 | |
| C 18:1 | 38,74 | 48,8 | 37,98 | 33,51 | 19,51 | 21,20 | 16,30 | 19,19 | |
| ∑ C 18:2÷18:3 | 0,44 | 0,36 | 0,37 | 0,11 | 0,26 | 0,30 | 9,35 | 6,16 | |
| ∑ C 20÷23 | 1,26 | 0,98 | 1,22 | 0,75 | 0,63 | 0,1 | 4,34 | 13,5 | |
| Сумма ненасыщенных кислот | 82,65 | 86,67 | 82,43 | 89,71 | 46,47 | 44,52 | 37,96 | 42,32 | |
а) Виноматериал pH 3,0 (A), 5,0 (Б) и 7,0 (В); полусинтетическая среда pH 5,6 (Г);
н/о – не обнаружено.
Известно, что высокий общий уровень ненасыщенности мембранных липидов гарантирует поддержание проницаемости и текучести мембран, что, в свою очередь, обеспечивает хорошую адаптацию микроорганизмов к воздействию низких температур. Последний факт крайне важен для последующей криоиммобилизации клеток и, поэтому температура 20оC была принята как оптимальная для культивирования дрожжей перед иммобилизацией в криогель ПВС.
1.2. Оптимизация процесса формирования биокатализатора
Следующая стадия разработки технологии получения биокатализатора состояла в оптимизации состава биокатализатора и условий проведения иммобилизации (Рис. 2). Ранее известный метод включения клеток дрожжей в криогель ПВС (Рис. 1А) предполагал формирование гранул биокатализатора в среде гидрофобной жидкости (петролейного эфира), нежелательной для применения на производстве из-за своей пожароопасности, а также токсичности для клеток. В связи с этим было решено изменить условия иммобилизации и проводить ее на воздухе. Такой подход был апробирован впервые.
С помощью электронной микроскопии было проведено сравнительное исследование образцов иммобилизованных биокатализаторов, сформированных двумя разными способами (Рис. 4). Было показано, что макропоры носителя, полученного формированием на воздухе, имели существенно больший размер (до 50 мкм), чем поры носителя, сформированного по ранее известной методике (до 20 мкм) в среде гидрофобного растворителя. Такое изменение в структуре нового биокатализатора должно было способствовать улучшению массообменных процессов внутри гранул.
| А  | Б 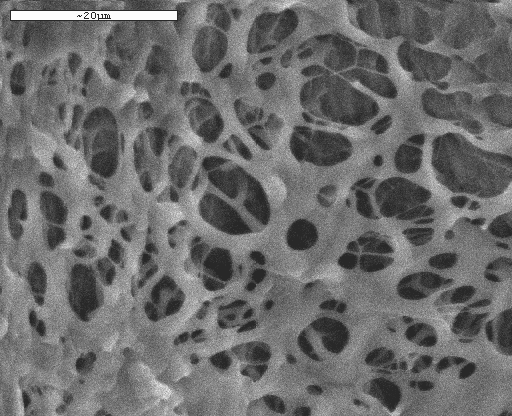 |
Рис. 4. Микрофотографии поверхности криогеля ПВС, формирование которого проводилось в среде гидрофобной жидкости (А) и в воздушной среде (Б).
В предварительных экспериментах было установлено, что введение ПВС в гранулы в концентрации менее 10% приводит к формированию криогеля с пониженной механической прочностью, в результате чего происходит его деформация и, как следствие этого, наблюдается выход клеток из матрицы носителя.
В работе была проварьирована концентрация полимера в составе получаемого биокатализатора в интервале от 10 до 17% с целью получения механически прочной матрицы с хорошими массообменными характеристиками.
Ранее было показано, что при снижении концентрации клеток в биокатализаторе до 2% наблюдается снижение числа свободных клеток, накапливающихся в вине к концу брожения (Мартыненко, 2001). Однако, известно, что большая концентрация клеток обеспечивает более высокие скорости процесса брожения, при этом органолептические показатели готовой продукции существенно зависят от концентрации клеток, участвующих в процессе брожения (Liger-Belair, 2004). В связи с этим, концентрацию клеток в биокатализаторе варьировали от 2 до 10% (масс.). Оптимизацию состава биокатализатора проводили с помощью математического аппарата, соответствующего аддитивно-решетчатому методу описания объекта.
В качестве основных оптимизируемых функций при выборе соотношений компонентов биокатализатора были выбраны давление углекислого газа (Рис. 5А) и концентрация свободных клеток (Рис. 5Б), которые накапливались при шампанизации вина классическим методом. Исходя из составленного ортогонально-решетчатого плана, были рассчитаны оценки эффектов уровней каждого фактора данного процесса. Полученные зависимости целевых функций от исследуемых факторов на варьируемых уровнях графически представлены на Рис. 5.
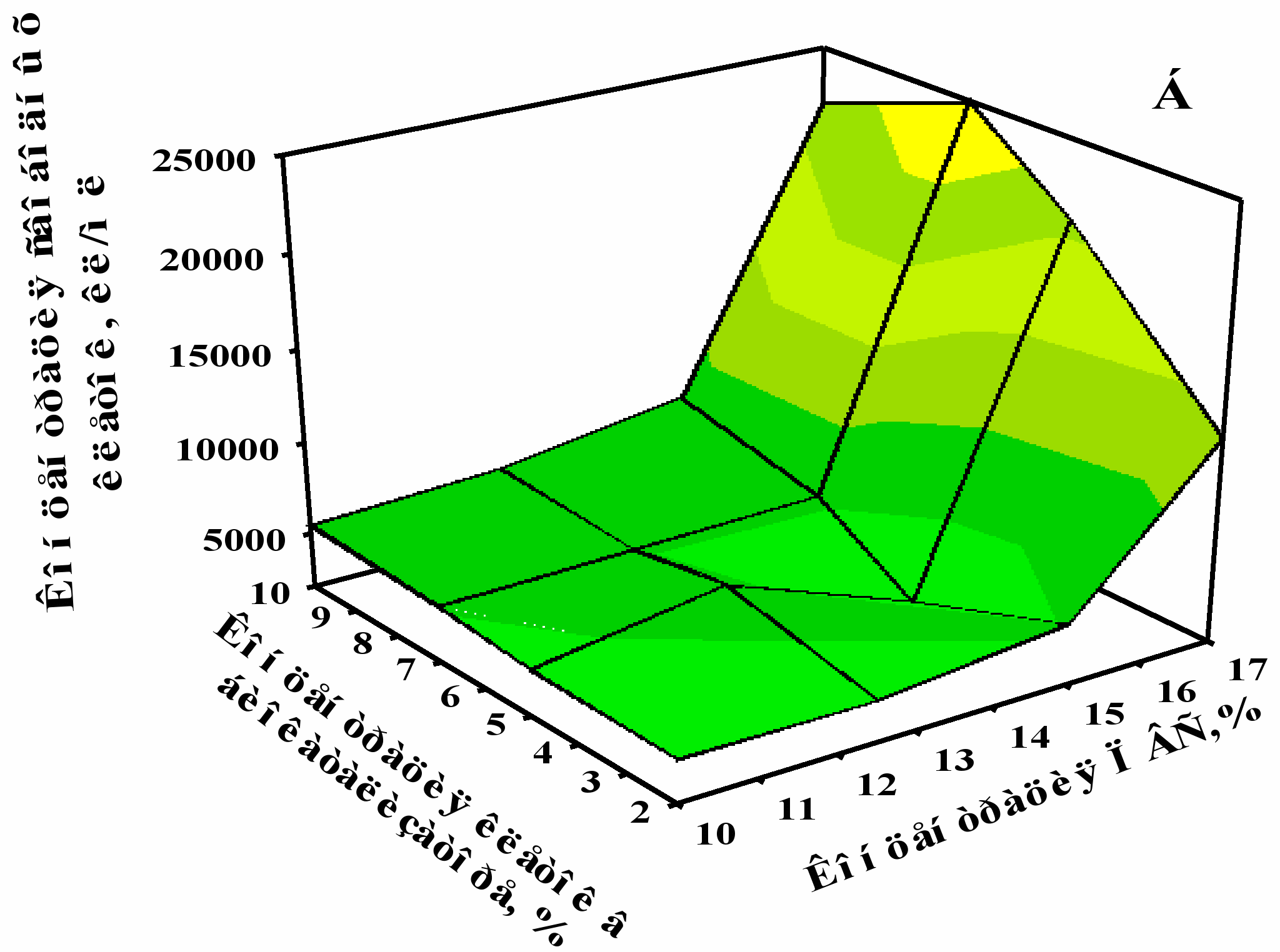
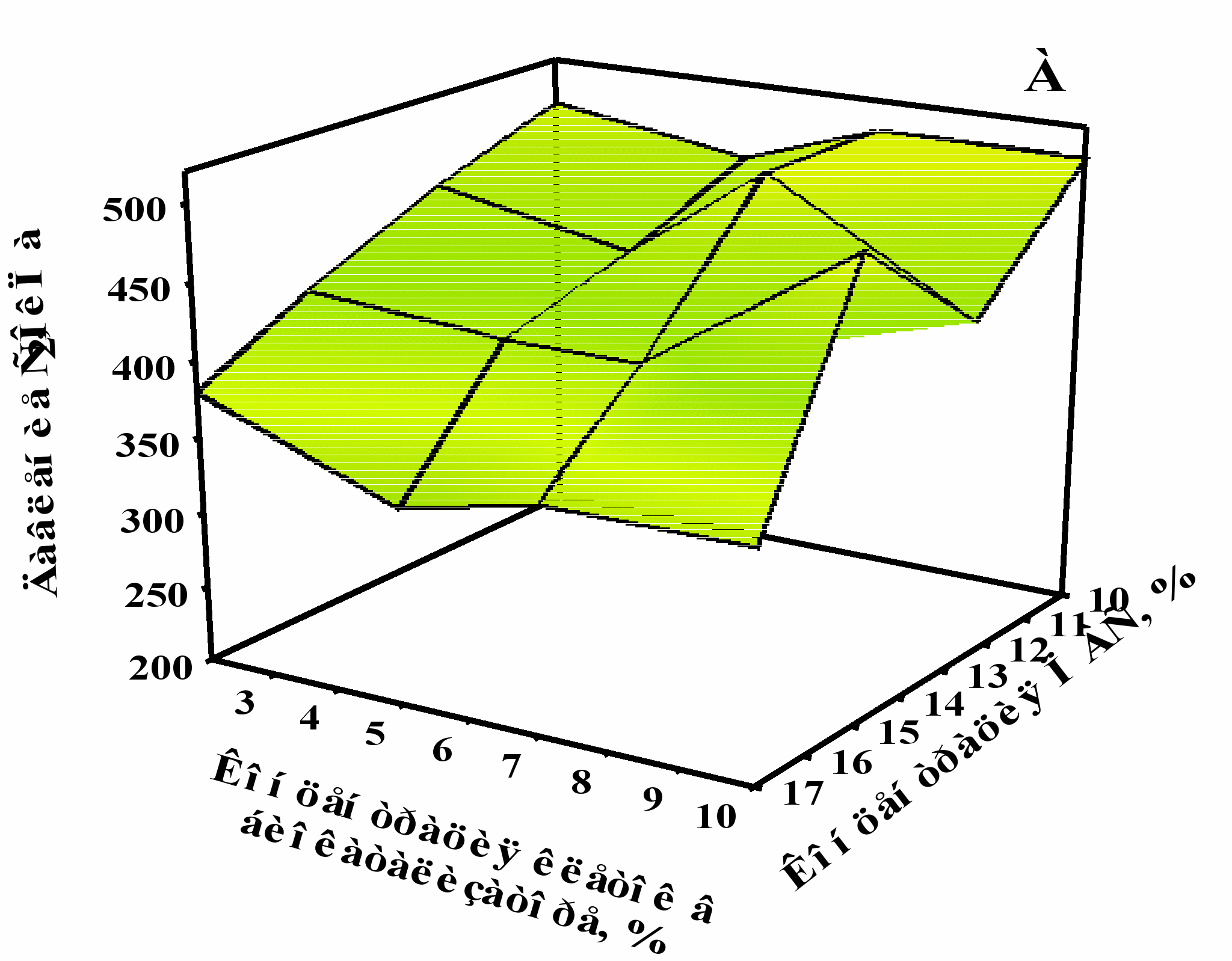
Рис. 5. Зависимость давления СО2 (А) и концентрации свободных клеток (Б), накапливающихся в шампанском, от исходных концентраций дрожжевых клеток и полимера в составе биокатализатора при его использовании в процессе сбраживания виноматериала в бутылках.
Было установлено, что оптимальной для формирования биокатализатора, применяемого для шампанизации вина, однозначно, является 10%-ная концентрация ПВС. Окончательный вывод о том, что 10% концентрация клеток дрожжей в составе иммобилизованного препарата является лучшей, был сделан после дополнительных исследований характеристик получаемого шампанского (Табл. 4).
Таблица 4. Характеристики шампанского, приготовленного в бутылках, с применением дрожжей, иммобилизованных в криогель ПВС
| Исходная концентра-ция клеток в биокатали-заторе, % | Давление CO2, кПa | Свободные клетки, кл/мл вина | Сахароза, г/л | Спирт, об % | Титруемая кислот-ность, г/л | Дегустаци-онная оценка |
| 2а 2б 10б | 450 500 540 | (3,5 ± 0,3)´105 (3,1 ± 0,3)´103 (3,4 ± 0,4)´103 | 1,6 1,4 1,1 | 11,30 11,60 11,85 | 7,4 7,3 7,2 | н/и 8,70 8,75 |
| Свободные клетки | 430 | (1,0 ± 0,1)´107 | 1,8 | 11,0 | 7,4 | 8,60 |
