Кудрявцев дмитрий Владимирович факторы прогноза и отдаленные результаты комбинированного и комплексного лечения меланомы кожи
| Вид материала | Автореферат диссертации |
- План реферата. Актуальность темы. Определение меланомы. Эпидемиология меланомы. Классификация, 240.33kb.
- Реферат на тему : Меланома кожи, 870.72kb.
- Пути улучшения диагностики и лечения меланомы кожи 14. 00. 14 Онкология, 659.38kb.
- От науки к практике, 179.82kb.
- Меланома, 231.45kb.
- Аннотации статей 3 номера «Московский хирургический журнал» за 2009 год, 1235.15kb.
- Щегельский Дмитрий Владимирович программа, 392.59kb.
- Загрудинный зоб хирургическое лечение, 55.58kb.
- Грибковые заболевания кожи, 31.78kb.
- Отдаленные результаты хирургического лечения и качество жизни больных, оперированных, 305.19kb.
Рис. 3. Распределение больных в исследуемой группе комбинированного и комплексного лечения в зависимости от состояния регионарных лимфатических коллекторов.
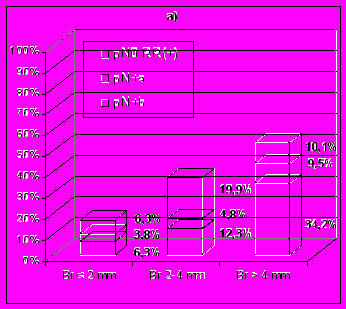
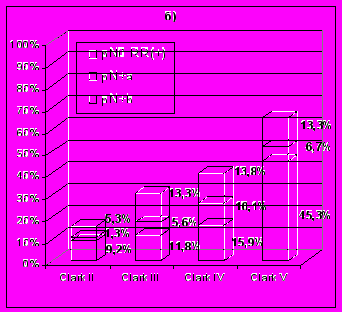
Рис. 4. Общий риск вовлечения регионарных коллекторов у больных меланомой кожи в зависимости от – а) толщины опухоли, б) уровня инвазии.
Наличие метастазов меланомы кожи в регионарные лимфатические узлы, не зависимо от их размеров, оказывало самостоятельное и значимое влияние на риск развития отдаленных метастазов. В группе больных меланомой кожи со свободными от заболевания лимфатическими коллекторами частота отдаленных метастазов была наименьшей в сравнении с группой региональных рецидивов (р<0,001), субклинических (р<0,01) и клинически определяемых региональных метастазов (р<0,001) (рис. 5).
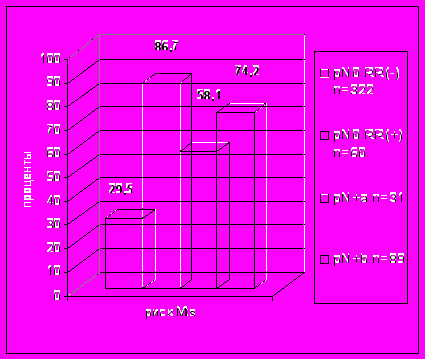
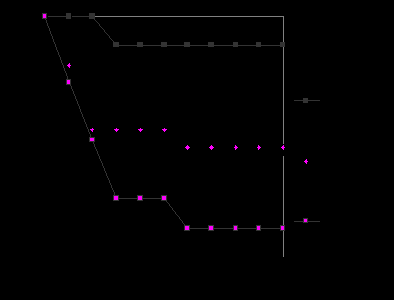
Рис. 5. Риск развития отдаленных метастазов в последующий период наблюдения в зависимости от состояния регионарных лимфатических коллекторов.

Рис. 6. Десятилетняя актуриальная специфическая выживаемость больных меланомой кожи после комбинированного и комплексного лечения в зависимости от состояния регионарных лимфатических узлов.
Пятилетняя выживаемость больных без метастазов в регионарные лимфатические узлы, независимо от характеристик первичной опухоли, составила 77,7±2,6%, что было значимо выше, чем в группе регионарных рецидивов– 49,8±6,6% (р<0,01) и клинически определяемых регионарных метастазов – 36,4±4,7% (р<0,001) (рис. 6). Различия в выживаемости больных в группах регионарных рецидивов и регионарных метастазов, диагностированных на момент лечения, не были значимы (р>0,2). В отношении десятилетней выживаемости наличие метастазов в регионарные лимфатические узлы было еще более значимым. Так, не было различий в уровне восьми-, девяти- и десятилетней выживаемости между группами регионарных рецидивов, субклинических и клинически определяемых регионарных метастазов. В группе больных без регионарных метастазов показатель десятилетней выживаемости составил 74,2±4,2% против 24,1±6,2% у пациентов с регионарными рецидивами, 24,4±5,2 и 27,7±4,6% у пациентов с метастазами, диагностированными клинически (р<0,001).
Единственной из исследованных характеристик регионарных метастазов, статистически достоверно ассоциированной с отдаленными результатами лечения и риском развития отдаленных метастазов, было число регионарных лимфатических узлов, содержащих метастазы меланомы. Так, десятилетняя выживаемость больных меланомой кожи с метастазами в один лимфатический узел составила 43,2±7,6% против 14,7±5,7% у пациентов с большим числом пораженных лимфатических узлов (р<0,05), а риск развития отдаленных метастазов – 57,4% и 82,0%, соответственно (р<0,01).
Представленные данные свидетельствуют, что существует необходимость прогнозирования вероятности поражения регионального лимфатического коллектора уже на предоперационном этапе. Это требуется для того, чтобы определить объем хирургического и комбинированного этапов лечения, так как, несмотря на высокий риск отдаленных метастазов у таких больных, каждый третий больной с субклиническими и каждый четвертый с клинически определяемыми регионарными метастазами имеет шанс пережить десятилетний срок наблюдения при условии выполнения одномоментной лимфаденэктомии.
Результаты исследования показали, что оценить вероятность поражения регионарных лимфатических узлов и выделить группу больных с высоким риском региональных, в том числе и субклинических метастазов, которым показано выполнение одномоментной лимфаденэктомии, возможно на основании изучения клинической картины заболевания. Были выделены десять клинических характеристик, ассоциированных с частотой региональных метастазов (табл. 2). Обобщая значение клинических факторов прогноза в оценке частоты поражения лимфатических коллекторов, можно сказать, что в случае наличия одной из десяти клинических характеристик первичной опухоли, которые были статистически достоверно ассоциированы с высоким риском регионарных метастазов, последние присутствуют более чем в 40% случаев в диагностируемой или скрытой форме. При сочетании первых пяти из этих клинических факторов прогноза, таких как инфильтрация, кровоточивость, быстрый рост, узловая форма и воспаление, риск регионарного метастазирования составил 55% против 15,2% в группе больных без них (t=5,7).
Таблица 2
Клинические факторы прогноза, достоверно ассоциированные с высоким риском регионарного метастазирования
-
Клинико-анамнестический фактор прогноза
pN+ или RR(+)
при отсутствии признака
pN+или RR(+)
при наличии признака
t
Инфильтрация основания
23,4%
46,9%
5,7
Мокнутие и кровоточивость
19,3%
42,9%
5,4
Быстрый рост
26,5%
46,1%
4,6
Форма роста (узловая)
26,7%
45,5%
4,2
Воспаление
29,8%
47,7%
4,0
Изъязвление
26,6%
40,8%
3,3
На фоне врожденного невуса
28,6%
42,2%
3,2
Боль
34,3%
50,0%
2,9
Коркообразование
24,5%
39,0%
2,7
Травма (повышенная травматизация)
26,1%
38,0%
2,3
Изучение зависимости частоты регионарных метастазов от морфологических характеристик опухоли показало, что у больных меланомами толщиной до 2 мм метастатическое поражение регионарных лимфатических узлов наблюдали в 10,1% случаев, от 2 до 4 мм – в 17,1% и более 4 мм – в 43,7% случаев. В то же время частота регионарных метастазов от уровня инвазии по Clark составила при II уровне – 10,5%, III – 17,4%, IV – 26,1% и V уровне – 52,0%. В случае наличия морфологически определяемого изъязвления меланомы кожи частота регионарных метастазов составила 28,9% против 12,6% у больных с неизъязвленными новообразованиями (t=4,4). Свою значимость изъязвление сохраняло и в стратификационном анализе в группе больных с опухолями III и IV уровней инвазии, у которых в случае наличия изъязвления регионарные метастазы наблюдали в 23,9% случаев против 11,7% у пациентов с неизъязвленными меланомами (t=2,7).
Еще одной морфологической характеристикой первичной меланомы кожи, значимо ассоциированной с частотой регионарных метастазов, была лимфоидная инфильтрация, определяемая на границе первичной опухоли и здоровых тканей. Так, в группе слабовыраженной лимфоидной инфильтрации или в случае ее отсутствия регионарные метастазы наблюдали в 34,1% случаев против 7,3% в группе с выраженной и умеренной степенью лимфоидной инфильтрации (t=6,1). Свое влияние на частоту регионарных метастазов лимфоидная инфильтрация сохраняла и в стратификационном анализе в группах больных меланомами кожи III-IV уровней инвазии, у которых частота поражения регионарных лимфатических узлов составила 22,9% против 8,1%, соответственно (t=2,2).
Профилактическая лимфаденэктомия или профилактическое облучение региональных лимфатических узлов? Отдаленные результаты.
С целью регионарного контроля заболевания больным локализованной меланомой кожи без клинически определяемых региональных метастазов с профилактической целью выполняли регионарную лимфаденэктомию (ЛАЭ) или проводили дистанционную лучевую терапию (ДЛТ) на область вероятного оттока лимфы. Сравнительный статистический анализ не выявил преимущества профилактической ЛАЭ в сравнении с ДЛТ. Десятилетняя выживаемость пациентов в группе ЛАЭ составила 65,4±4,0% против 62,1±4,3%, соответственно, в группе ДЛТ (р>0,5). Не было выявлено преимущества профилактической лимфаденэктомии в сравнении с облучением регионарных лимфатических коллекторов и в стратификационном анализе в зависимости от локализации первичной опухоли. Так, десятилетняя выживаемость в группе пациентов с меланомами кожи конечностей в группе ЛАЭ составила 80,3±4,3% против 74,4±7,5% в группе ДЛТ (р>0,5), меланомами кожи туловища – 53,7±9,3% против 55,8±5,8%, соответственно (р>0,5), головы и шеи – 49,3±12,9% против 55,1±12,1%, соответственно (р>0,5).
Таким образом, выполнение ЛАЭ с профилактической целью не улучшало выживаемости больных меланомой кожи без клинически определяемых регионарных метастазов и больше имело диагностическую ценность. В то же время, около 70% больных недиссеминированной меланомой кожи вообще не имеют метастазов в регионарные лимфатические узлы, а у остальных пациентов более чем в половине случаев региональные метастазы являются субклиническими, которые обладают таким же неблагоприятным влиянием на прогноз, как и клинически определяемые. Таким образом, в клинической практике необходим метод выявления регионарных метастазов, разрешающая способность которого, по крайней мере, была сравнима с морфологическим исследованием, но с минимальной инвазивностью.
Исследование сторожевых лимфатических узлов, экспериментально-клиническое обоснование практического применения метода.
Физиологическое свойство лимфатических узлов – утилизировать 85% объема поступающей в него лимфы (Лойт А.А., Гуляев А.В., 2005) позволяет выявить лимфатический узел, через который проходит наибольшее количество лимфы из области расположения первичной опухоли. В частности для клинической практики наиболее приемлемым в этом отношении представляются методы радиоизотопной диагностики, которые позволяют дистанционно картировать лимфатический коллектор, локализовать лимфатический узел, накапливающий наибольшую активность, что позволяет провести прицельную его биопсию. Более того, с помощью ручного гамма-детектора с узконаправленным коллиматором возможно интраоперационно дифференцировать данный узел от окружающих тканей. В МРНЦ РАМН работа в этом направлении, включая технический подготовительный этап, велась в течение 2005-2007 годов. В 2007 году в клинической практике МРНЦ РАМН впервые было выполнено картирование региональных лимфатических коллекторов и позиционирование СЛУ с последующей прицельной его биопсией под контролем ручного гамма-детектора.
В результате проведения данной работы совместно с производителем были усовершенствованы технические характеристики, а также добавлены новые функции,разработанному ранее НТЦ «Амплитуда» макету первого отечественного ручного гамма-детектора «Радикал», который впервые был применен в клинической практике лечения меланомы кожи. Метод в объеме комбинированного и комплексного лечения был применен у пяти пациентов с пигментными новообразованиями кожи спины, передней грудной клетки и нижних конечностей.
Практическое применения метода исследования СЛУ позволило определить лимфатические бассейны, дренирующие лимфу из области расположения первичной опухоли, позиционировать и провести биопсию сторожевых лимфатических узлов (рис. 7 и 8), которые в дальнейшем были исследованы методом серийных срезов.
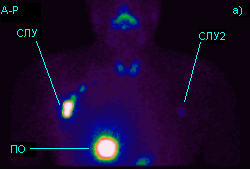

Рис. 7. Распределение активности через 3-4 часа после перитуморального, внутрикожного введения наноцис-Tc99m 40-120 МБк: а) Больной Н. – меланома кожи правой подлопаточной области; б) Больная К. – меланома кожи межлопаточной области (СЛУ – сторожевой лимфатический узел. СЛУ-2 – сторожевой лимфатический узел контрлатерального лимфатического бассейна. ПО – активность в области первичной опухоли).
Отсутствие метастазов в СЛУ позволило отказаться от выполнения регионарной лимфаденэктомии у всех пяти больных и у четверых, с учетом клинических и морфологических характеристик первичной опухоли от адъювантной химиотерапии. Только у одного больного акральной меланомой I пальца правой ноги в виду высокого риска отдаленных метастазов, который был установлен на основании оценки клинических и морфологических характеристик первичной опухоли, была назначена адъювантная системная терапия.
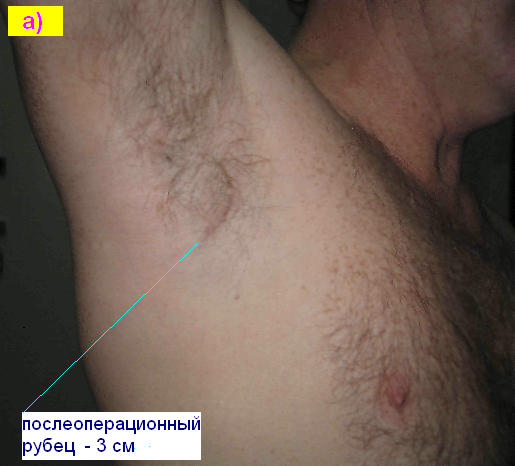

Рис. 8. Малозаметные послеоперационные рубцы в местах биопсии СЛУ. а) больной Н. 10 месяцев, б) больная К. 3 месяца после биопсии.
Клиническое применение метода исследования сторожевых лимфатических узлов в объеме комбинированного и комплексного лечения сократило сроки пребывания больных в стационаре в среднем на четыре недели. Данный метод представляет собой новый качественный уровень диагностики регионарных метастазов и позволяет индивидуализировать терапию больных меланомой кожи. Это стало залогом значительного сокращения времени и средств, необходимых для проведения адекватного лечения, снижения риска реакций и осложнений, связанных с расширением объема оперативного лечения, проведения послеоперационной лучевой и адъювантной цитостатической терапии. Результаты нашего исследования демонстрируют необходимость внедрения данной технологии в широкую клиническую практику.
Адъювантная химиотерапия в объеме комплексного лечения больных недиссеминированной меланомой кожи. Отдаленные результаты.
Высокий риск развития отдаленных метастазов у больных меланомой кожи требует введения в объем лечения средств системного контроля заболевания. Исследование эффективности адъювантной химиотерапии было основано на сравнительном анализе актуриальной специфической и безметастатической выживаемости больных недиссеминированной меланомой кожи в группах комбинированного и комплексного лечения, включавшего три различных режима адъювантной полихимиотерапии (ПХТ) (рис. 9).
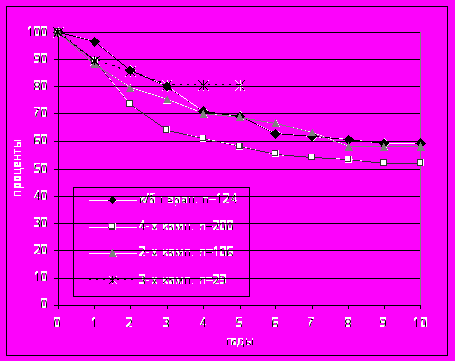
Рис. 9. Актуриальная специфическая выживаемость больных меланомой кожи в исследуемых группах комбинированного и комплексного лечения.
Исследование не выявило различий в эффективности применявшихся режимов ПХТ как, в общем, и ее положительного влияния на результаты лечения в сравнении с группой комбинированной терапии, в которой применялась только предоперационная лучевая терапи. Так, в группе комбинированного лечения пяти- и десятилетняя выживаемость больных составила 69,2±4,4% и 59,4±4,9%, в группе комплексного лечения с четырех компонентной ПХТ (5-FU, Mt, Vk, CF) – 58,2±3,6% и 52,0±3,7% и двух компонентной (CP, Dox) – 68,7±4,9% и 57,9±7,4%, соответственно.
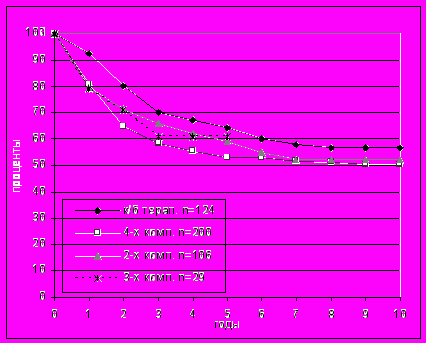
Рис. 10. Безметастатическая выживаемость больных меланомой кожи в группах комбинированной и комплексной терапии.
В группе трехкомпонентной химиотерапии (CP, Dox, DTIC) была оценена только пятилетняя выживаемость, которая составила 80,0±8,3%, соответственно.
Несколько более высокая пятилетняя актуриальная специфическая выживаемость, наблюдавшаяся у больных в группе трехкомпонентной ПХТ, вероятно, была обусловлена меньшим периодом наблюдения в сравнении с другими группами. Это небольшое преимущество не нашло подтверждения в анализе безметастатической выживаемости больных в этих группах, пяти- и десятилетние показатели в которых составили 64,3±4,6% и 56,9±4,8%, 57,5±3,6% и 50,4±3,7%, 63,1±5,0% и 52,0±6,1%, соответственно, а также 60,9±9,9% в группе с трех компонентной ПХТ (рис. 10).
Положительного влияния адъювантной ПХТ на отдаленные результаты лечения не было выявлено и в статистическом анализе, когда пациенты были стратифицированы в группы по стадиям заболевания, толщине первичной меланомы, а также уровню ее инвазии. В этом ряду стратификационных анализов, проведенных по основным факторам прогноза, выживаемость больных меланомой кожи в группе комбинированной терапии была, по крайней мере, не ниже, а иногда и выше, чем в группах комплексной терапии. Только при анализе специфической выживаемости в группах больных с опухолями пятого уровня инвазии она была выше у пациентов, получивших комплексное лечение в сравнении с группой комбинированной терапии. Так, пяти- и десятилетняя выживаемость в группе четырехкомпонентной терапии составила 38,5±8,6% и 35,0±8,5%, пятилетняя выживаемость в группе двухкомпонентной ХТ – 37,0±14,1% (в этой группе не было больных со сроками наблюдения более 7-ми лет). В то же время в группе комбинированной терапии пяти- и десятилетняя выживаемость была на уровне 14,4±8,4% в обоих случаях. Однако различия по пятилетней выживаемости между группами комбинированной терапии в сравнении с четырех компонентной ХТ были достоверны только в 80% доверительном интервале, а с группой двухкомпонентной не достигали и этого уровня.
Таким образом, учитывая полученные результаты, которые подтверждаются данными отечественной и зарубежной литературы, можно заключить, что в настоящее время нет средств адъювантного системного лечения больных меланомой кожи с доказанной клинической эффективностью.
Экспрессия Fas-рецептора и Fas-лиганда клетками первичной меланомы кожи, влияние на эффективность комбинированного и комплексного лечения
Одна из биологических особенностей меланомы кожи, даже исключая множество других, которые обуславливают ее резистентность к ХТ, может свести на нет все усилия, прилагаемые в этом направлении – клетки меланомы обладают меньшей пролиферативной активностью, чем клетки таких критических тканей, как костный мозг и эпителий кишечника. Таким образом, современные цитотоксические средства, эффективность большинства из которых связана с влиянием на клеточный цикл, не могут обладать достаточным терапевтическим интервалом для успешного их применения в лечении меланомы кожи. Эффективность таргетной терапии так же ограничена поликлональностью опухолей, формированием механизмов аутокринной стимуляции роста трансформированных клеток, участием рецепторов к таргетным препаратам в нормальных физиологических механизмах жизнеобеспечения макроорганизма.
В то же время, в литературе неоднократно сообщаются случаи самопроизвольной регрессии меланом, в том числе и ее метастазов (Шанин А.П., 1959; Pellegrini A., 1980; Mikhail G. et al., 1986; Avril M. et al., 1992). Подобное наблюдение есть и в нашей практике. Такие свидетельства поддерживают мнение о том, что существуют малоизученные или неизвестные механизмы, способные инициировать иммунный ответ и обратить вспять развитие опухолевого процесса.
В ряде экспериментальных исследовательских работ было показано, что клетки меланомы в процессе эволюции опухоли приобретают способность экспрессировать связанный с мембранами Fas-лиганд (FasL), который вызывает триммеризацию Fas-рецептора на поверхности активированных против опухоли лимфоцитов, что индуцирует апоптоз клеток мишеней, экспрессирующих этот рецептор. На основании полученных данных было высказано предположение, что посредством этого механизма опухоли способны обеспечивать благоприятное для своего развития микроокружение и, таким образом, уходить из под иммунного надзора (Andreola G. et al., 2002; Soubrane C. et al., 2002).
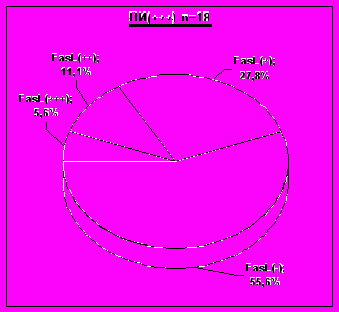
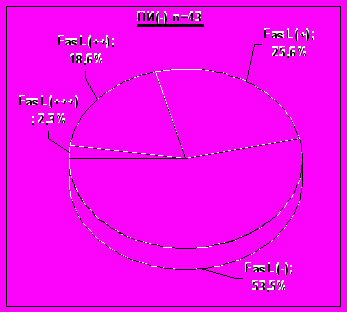
Рис. 11. Распределение опухолей по степени экспрессии FasL в группах лимфоидной инфильтрации.
Учитывая полученные нами данные о значимом влиянии степени лимфоидной инфильтрации на границах меланомы кожи на отдаленные результаты комбинированного и комплексного лечения, была исследована связь экспрессии FasL клетками меланом со степенью выраженности лимфоидной инфильтрации и отдаленными результатами лечения.
Однако в нашем исследовании не было выявлено ожидаемой связи экспрессии FasL опухолевыми клетками со степенью лимфоидной инфильтрации. Степень экспрессии FasL клетками меланом в группах опухолей с выраженной степенью лимфоидной инфильтрации и в группе, где она не определялась вовсе, были сравнимы (рис. 11).
Также не было выявлено различий в выживаемости больных в зависимости от экспрессии FasL опухолевыми клетками. С выживаемостью была ассоциирована только степень лимфоидной инфильтрации, а пациенты с меланомами, клетки которых не экспрессировали FasL, имели даже более низкие результаты лечения (рис. 12).