Кудрявцев дмитрий Владимирович факторы прогноза и отдаленные результаты комбинированного и комплексного лечения меланомы кожи
| Вид материала | Автореферат диссертации |
- План реферата. Актуальность темы. Определение меланомы. Эпидемиология меланомы. Классификация, 240.33kb.
- Реферат на тему : Меланома кожи, 870.72kb.
- Пути улучшения диагностики и лечения меланомы кожи 14. 00. 14 Онкология, 659.38kb.
- От науки к практике, 179.82kb.
- Меланома, 231.45kb.
- Аннотации статей 3 номера «Московский хирургический журнал» за 2009 год, 1235.15kb.
- Щегельский Дмитрий Владимирович программа, 392.59kb.
- Загрудинный зоб хирургическое лечение, 55.58kb.
- Грибковые заболевания кожи, 31.78kb.
- Отдаленные результаты хирургического лечения и качество жизни больных, оперированных, 305.19kb.
Результаты исследования
Основным результатом применения интенсивно-концентрированного предоперационного курса крупнофракционной лучевой терапии на область первичной меланомы кожи стало то, что ни у одного из 502 двух больных не было выявлено локального рецидива заболевания, что выгодно отличает данный метод от самостоятельного хирургического лечения. Так, по данным рандомизированных исследований, в которых использовалось только «экономное» или широкое иссечение первичной опухоли, частота локальных рецидивов в зависимости от локализации составляет от 3 до 16% (Schraffordt K., 1981; Markowitz J., 1991; Charles M. et al., 2001; McKinnon J. et al., 2005) .
Отсутствие локальных рецидивов заболевания позволило рассматривать регионарные рецидивы в ранее интактных лимфатических узлах, а также развитие отдаленных метастазов, как манифестацию субклинических метастазов, уже существовавших на момент начала лечения. Теоретически это может быть обосновано положениями теории «прогрессии опухоли» (Георгиев Г.П., 2000; Demunter A. et al., 2001), предполагающей наличие локализованной и метастатической фаз специфического процесса. Таким образом, когда мы говорим о локализованной форме меланомы кожи, следует иметь в виду, что речь идет только о клинически локализованной или клинически недиссеминированной меланоме кожи. В то же время это не исключает наличия субклинической метастатической фазы заболевания. Следовательно, определение прогноза, учитывая то, что практически единственной причиной летального исхода при меланоме кожи являются отдаленные метастазы, по существу сводится к выявлению или установлению риска наличия скрытой метастатической фазы заболевания у каждого конкретного больного. От правильной оценки прогноза будет зависеть выбор наиболее оптимального и безопасного объема лечения, а следовательно и его эффективность. Данная задача является весьма не простой, так, даже в группе больных с тонкими меланомами, до 1 – 2 мм или II-го уровня инвазии, каждый 4-ый – 5-ый пациент имеет риск возврата заболевании в виде регионарного рецидива или отдаленных метастазов. Следовательно, для уточнения прогноза при меланоме кожи необходимо использовать максимальное число характеристик развивающейся опухоли.
Морфологические факторы прогноза
Исследование морфологических характеристик первичных меланом кожи показало, что, по крайней мере, четыре из них оказывали влияние на эффективность комбинированного и комплексного лечения. Это были как уже известные характеристики – уровень инвазии по Clark, толщина опухоли по Breslow, изъязвление, так и до сих пор малоизученная характеристика первичной меланомы кожи – лимфоидная инфильтрация, определяемая на границе опухоли и здоровых тканей.
В целом общая пяти- и десятилетняя выживаемость всех 502 больных меланомой кожи в исследуемой группе составила 63,9±2,3% и 55,2±2,6%, соответственно. В то же время десятилетняя выживаемость шести пациентов с меланомами I уровня инвазии составила 71,4±24,1%. Небольшое число таких больных затрудняло статистическую интерпретацию полученных результатов. В группе 76 больных меланомой кожи II уровня инвазии показатели десятилетней выживаемости составили 80,9±5,4% против 56,6±4,3% при III (р<0,05) и 50,7±4,8% при IV уровне инвазии (р<0,01), соответственно. Наихудшие результаты лечения наблюдали в группе больных меланомой кожи V уровня инвазии, десятилетняя выживаемость в которой составила только 30,2±6,0% и была статистически достоверно ниже, чем в группах опухолей II (р<0,001), III (р<0,05) и IV уровней инвазии (р<0,1).
Риск развития отдаленных метастазов в последующий период наблюдения был наименьшим у пациентов с опухолями I и II уровней инвазии – 16,7% и 19,7%, соответственно. Значительно чаще отдаленные метастазы диагностировались у больных меланомой кожи III и IV уровней инвазии – 43,1% и 52,9%, соответственно (р<0,01). Наибольший риск развития отдаленных метастазов наблюдали у больных с опухолями V уровня инвазии – 74,7% (р<0,001).
Анализ выживаемости больных меланомой кожи в зависимости от толщины опухоли выявил определенные закономерности, которые более полно отражают данные, сообщаемые в литературе для хирургического лечения меланомы кожи (рис. 1). В отношении пятилетней выживаемости были определены две группы больных, различия между которыми были статистически значимы, это больные с опухолями толщиной до 4 мм и более 4 мм. Показатель пятилетней выживаемости у пациентов с опухолями толщиной до 1 мм составил 86,5±4,2%, от 1 до 2 мм – 80,1±4,8%, от 2 до 3 мм – 77,9±5,1%, от 3 до 4 мм – 68,3±6,3%, соответственно. Пятилетняя выживаемость больных меланомой кожи толщиной от 3 до 4 мм была достоверно выше, чем в группе опухолей толщиной от 4 до 6 мм, которая составила 42,1±6,9% (р<0,05), так же как и в сравнении с группами больных с опухолями от 6 до 10 мм (n=48) – 31,8±7,9% и более 10 мм (n=51) – 30,2±7,0%, соответственно (р<0,05).
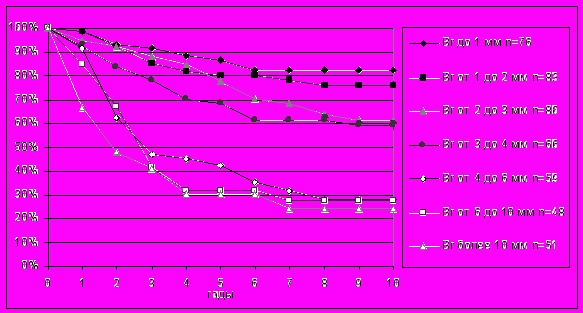
Рис. 1. Влияние толщины опухоли по Breslow на выживаемость больных меланомой кожи после комбинированной и комплексной терапии.
В отношении десятилетней выживаемости можно выделить уже три прогностические группы. Это больные с опухолями до 2 мм, от 2 до 4 мм и более 4 мм. Десятилетняя выживаемость больных меланомой кожи до 1 мм составила 82,4±4,9%, от 1 до 2 мм – 75,8%±45,4%. При превышении меланомами кожи толщины в 2 мм наблюдалась выраженная тенденция к снижению десятилетней выживаемости. Так, в группе больных с опухолями толщиной от 2 до 3 мм этот показатель составил уже 61,3±6,6%, от 3 до 4 мм – 58,9±7,0%, соответственно. Различия между группами до 1 мм и от 3 до 4 мм были значимыми (р<0,05). Десятилетняя выживаемость пациентов в группе опухолей толщиной от 4 до 6 мм составила только 27,8±7,4%, а в группах от 6 до 10 мм – 27,5±7,9%, и более 10 мм – 24,2±7,8%, что было достоверно ниже, чем в группе меланом толщиной от 3 до 4 мм (р<0,05).
Риск развития отдаленных метастазов в последующий период наблюдения был наименьшим при опухолях до 1 мм и от 1 до 2 мм, который составил 21,1% и 26,5%, соответственно, против 43,2% при опухолях от 2 до 4 мм (р<0,01) и 68,4% в группе опухолей более 4 мм (р<0,001).
Таким образом, в отношении пятилетней выживаемости следует выделить две прогностические группы – больные меланомой кожи толщиной до 4 мм и пациенты с опухолями толщиной более 4 мм. В отношении десятилетнего прогноза и риска развития отдаленных метастазов необходимо рассматривать уже три прогностические группы, такие как: меланомы кожи толщиной до 2 мм, от 2 до 4 мм и опухоли толщиной более 4 мм.
Морфологически выявляемое изъязвление меланомы кожи, определяемое как сквозное, включая базальную мембрану, дефект эпидермиса, окруженный скоплениями фибрина и нейтрофилов на фоне истонченного, сглаженного или реактивно гиперплазированного прилежащего эпидермиса, является хорошо известным прогностически фактором для хирургического метода лечения (Spatz, A. 2005). Наличие данной морфологической характеристики было ассоциировано с худшими показателями выживаемости больных меланомой кожи после комбинированного и комплексного лечения. Показатель десятилетней выживаемости в группе неизъязвленных меланом составил 79,5±3,9% против 46,3±3,1% в группе изъязвленных опухолей (р<0,001).
Самостоятельное влияние на отдаленные результаты лечения изъязвление сохраняло и в стратификационном статистическом анализе. Так, в группах больных меланомой кожи III и IV уровней инвазии, обладающих сравнимым прогнозом, десятилетние результаты лечения у пациентов с опухолями без изъязвления составили 77,6±5,4% против 47,0±3,8% с изъязвленными новообразованиями (р<0,001), а у больных с опухолями до 4 мм – 81,4±4,1% против 62,7±4,3% соответственно (р<0,05). При превышении опухолями толщины более 4 мм сохранялась тенденция к лучшей выживаемости пациентов с меланомами без изъязвления – 60,9±13,8% и 23,3±4,6% соответственно (р<0,05).
В работе впервые на значительном клиническом материале показано прогностическое значение такой малоизученной морфологической характеристики, как лимфоидная инфильтрация, определяемая на границе первичной меланомы и здоровых тканей. В пилотном исследовании было выявлено, что степень лимфоидной инфильтрации значимо ассоциирована с результатами лечения. Полученные результаты потребовали проведения целенаправленного исследования прогностического значения степени лимфоидной инфильтрации, которое было выполнено в объеме работы по изучению влияния экспрессии опухолевыми клетками Fas-рецептора (Fas) и Fas-лиганда (FasL) на степень лимфоидной инфильтрации и отдаленные результаты лечения.
В повторном исследовании все стеклопрепараты первичных меланом кожи были пересмотрены одним морфологом. Степень лимфоидной инфильтрации оценивали с использованием модифицированного с целью объективизации варианта ранее разработанной классификации. Результаты исследования не только подтвердили закономерности, выявленные ранее, но и с большей достоверностью и последовательностью продемонстрировали влияние степени лимфоидной инфильтрации на выживаемость больных локализованной меланомой кожи, а также биологическое значение данной морфологической характеристики (рис. 2).
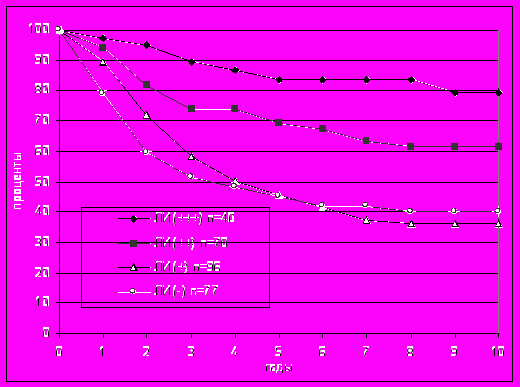
Рис. 2. Десятилетняя актуриальная специфическая выживаемость больных меланомой кожи после комбинированного или комплексного лечения в зависимости от степени лимфоидной инфильтрации.
Десятилетняя выживаемость была значимо выше в группе меланом с выраженной лимфоидной инфильтрацией – 79,5±7,1% против групп опухолей со слабой ее степенью или ее отсутствием – 36,0±5,3% и 40,0±5,9% соответственно (р<0,001 и р<0,01). В группе умеренной лимфоидной инфильтрации десятилетняя выживаемость составила 61,5±6,3% и была достоверно выше этого показателя в группе слабовыраженной инфильтрации (р<0,05), а так же в группе, где она отсутствовала (р<0,1).
Выраженная лимфоидная инфильтрация была характерна для меланом с меньшими уровнями инвазии и опухолей меньшей толщины, но также, как и изъязвление, сохраняла свое влияние на выживаемость в стратификационном анализе у больных с опухолями III-IV уровней инвазии. Десятилетняя выживаемость в зависимости от степени лимфоидной инфильтрации в этом случае составила 76,3±9,7%, 62,2±6,8%, 36,1±6,3% и 50,4±7,6%, соответственно. Различия между группами опухолей с выраженной и умеренной лимфоидной инфильтрацией против слабой ее степени были значимыми (р<0,05). В то же время, в стратификационном анализе, в котором была исследована выживаемость больных меланомой кожи толщиной до 4 мм в зависимости от степени лимфоидной инфильтрации, показатель десятилетней выживаемости составил 90,4±4,3%, 67,8±7,4%, 57,0±7,4% и 60,1±8,7%, соответственно.
Таким образом, степень лимфоидной инфильтрации, определяемой на границе первичной меланомы кожи и здоровых тканей, значимо ассоциирована с выживаемостью больных после комбинированного и комплексного лечения, имеет определяемое самостоятельное прогностическое значение, отражая взаимоотношения макроорганизма и развивающейся опухоли.
Таким образом, наибольшим прогностическим влиянием среди морфологических характеристик меланом обладают критерии, отражающие степень развития опухолевого процесса, такие как: толщина опухоли по Breslow и уровень инвазии по Clark. Однако самостоятельным и значимым прогностическим значением обладают и такие характеристики, как изъязвление и лимфоидная инфильтрация, которые следует связывать с биологическими особенностями меланом кожи и реакцией макроорганизма на ее развитие.
Клинические факторы прогноза
Оценка морфологических характеристик первичной опухоли дает весьма объективную и достоверную информацию в отношении прогноза заболевания, а следовательно, и о необходимом объеме лечения, позволяющего обеспечить наибольшую его эффективность. Однако эта информация становится доступной уже после выполнения одного из наиболее важных этапов лечения меланомы кожи – хирургического, и не позволяет изначально определить адекватный его объем, а так же необходимость назначения средств адъювантной терапии. В связи с этим в данной работе были изучены симптомы, сопровождающие развитие меланомы кожи, а также особенности общего состояния пациента в отношении их влияния на прогноз. Клинические характеристики можно оценить уже на этапе первичного осмотра пациента, основываясь на предъявляемых жалобах, сборе анамнеза заболевания, оценке общего состояния больного, а также визуального и пальпаторного исследования первичной опухоли. Полученные данные продемонстрировали, что клиническая картина развивающейся опухоли тесно ассоциирована с ее морфологическими особенностями, а подробное клиническое исследование заболевания предоставляет достаточную информацию в отношении прогноза риска развития регионарных и отдаленных метастазов, а также эффективности комбинированного и комплексного лечения в целом (табл. 1).
Таблица 1
Клинические характеристики первичной опухоли у больных недиссеминированной меланомой кожи, ассоциированные с риском развития
регионарных и отдаленных метастазов
| Клинический фактор прогноза | Риск Mts фазы % | Стьюдент (t) для Mts | 10-летняя выживаемость | р для выжив. |
| Воспаление | 74,9 vs.* 41,7 | 7,9 | 34,5% vs. 69,1% | р<0,001 |
| Мокнутие и кровоточивость | 64,8 vs. 29,3 | 7,7 | 45,9% vs. 80,4% | р<0,001 |
| Изъязвление | 64,2 vs. 37,3 | 6,0 | 43,4% vs. 76,2% | р<0,001 |
| Быстрый рост | 68,3 vs. 42,7 | 5,9 | 41,1% vs. 67,5% | р<0,001 |
| Инфильтрация основания | 66,9 vs. 41,5 | 5,9 | 45,3% vs. 66,1% | р<0,01 |
| Форма роста (узловая vs. плоской) | 66,8 vs. 41,1 | 5,6 | 41,5% vs. 67,6% | р<0,001 |
| Образование корок | 61,0 vs. 29,6 | 5,4 | 47,8% vs. 82,6% | р<0,001 |
| Боль | 77,5 vs. 51,3 | 5,1 | 36,8% vs. 56,4% | p<0,05 |
| Травма (повышенная травматизация) | 55,9 vs. 39,1 | 3,0 | 50,8% vs. 73,1% | р<0,01 |
| Локализация (др. локал. vs. конечн.) | 59.2 vs. 48.0 | 2,5 | 45,6% vs. 69,5% | р<0,001 |
| На фоне врожденного невуса | 60,2 vs. 48,5 | 2,6 | 51,9% vs. 58,7% | р>0,5 |
*– vs. – от англ. versus (против) показателей в случае отсутствия признака
В работе проанализировано более 20 клинических характеристик, которые, по данным литературы и результатам собственных предварительных исследований, могли бы влиять на эффективность комбинированного и комплексного лечения. В итоге было выявлено 11 клинических характеристик первичной меланомы кожи, значимо ассоциированных с риском развития отдаленных метастазов, 10 из которых были так же ассоциированы с риском развития регионарных метастазов и выживаемостью больных после лечения.
Степень значимости клинической характеристики в отношении риска развития метастазов определяли по значению числа t (критерий Стьюдента), который вычисляли методом «определения достоверности различий при альтернативном варьировании» (значение t ≥ 1,96 соответствует р≤0,05). Собственно под понятием «метастатическая фаза заболевания» принималась совокупность регионарных метастазов меланомы, выявленных на момент проведения лечения, регионарных рецидивов в ранее интактных лимфатических узлах, а также собственно отдаленные метастазы.
Как видно из данных, представленных в таблице 1, больные меланомой кожи, имевшие любую из одиннадцати клинических характеристик, значимо ассоциированных с метастатической фазой заболевания, имели более чем 60% вероятность ее наличия. В случае сочетания первых пяти наиболее значимых симптомов, таких, как воспаление, кровоточивость, изъязвление, быстрый рост и инфильтрация основания меланомы кожи, риск метастатической фазы заболевания на момент постановки диагноза и начала лечения в нашем исследовании возрастал до 82,3% против 26,3% без них, соответственно (t=9,2). Пяти- и десятилетняя выживаемость в этих группах составила 40,8±5,1% и 23,0±5,0% против 90,7±3,6% и 82,7±82,7%, соответственно (р<0,001).
Таким образом, тщательное клиническое обследование пациента с меланомой кожи уже при первом осмотре может предоставить объективную и полноценную информацию не только для постановки правильного диагноза, но и для оценки прогноза заболевания, что позволяет изначально выбрать адекватный объем необходимого лечения.
Необходимо отметить, что не было обнаружено связи прогноза заболевания и таких часто упоминаемых в литературе прогностических факторов, как пол и возраст пациентов. Пол больных меланомой кожи был ассоциирован с преимущественной локализацией первичной опухоли. Так, у женщин меланомы кожи значимо чаще локализовались на коже конечностей – 51,9% против 18,6% у мужчин (р<0,001). Значительно реже меланомы в группе женщин встречались на коже туловища – 26,9% против 56,2% у мужчин (р<0,001) и не было выявлено половых различий в отношении локализации меланом на коже головы и шеи – 12,0% и 17,0%, соответственно (р>0,1). Локализация меланом на коже конечностей в сравнении с локализацией на коже туловища, а также головы и шеи была ассоциирована с лучшей десятилетней выживаемостью как у мужчин, так и у женщин. В случае локализации на конечностях она составила 60,5±9,1% и 71,6±4,1% против 40,6±5,7% и 54,7±6,4% на туловище, а также 42,2±11,1% и 47,2± 9,7% в случае меланом кожи головы и шеи, соответственно. В итоге значимо большее число женщин с меланомами конечностей приводило к кажущейся их лучшей выживаемости в общей группе – 62,2±3,2% против 43,3±4,3% в группе мужчин, что не было подтверждено в стратификационных анализах по локализациям опухоли.
Несмотря на то, что локализация меланомы на коже конечностей оказалась только десятым по статистической мощности фактором, ассоциированным с риском метастатической фазы заболевания и выживаемостью пациентов после комбинированного и комплексного лечения, она имела полностью самостоятельное значение. Это проявилось влиянием данной характеристики на выживаемость, независимо от уровня инвазии, толщины первичной опухоли и, что наиболее интересно, наличия регионарных метастазов, так как частота регионарных метастазов была сравнимой при всех локализациях меланом кожи и не могла в этом случае оказывать влияния на результаты лечения. Десятилетняя выживаемость в группе больных меланомой кожи конечностей составили 69,5±3,8% против 47,1±4,3% у пациентов с опухолями туловища (р<0,01) и 44,6±7,4% головы и шеи, соответственно (р<0,05).
Фототип пациентов был связан с эпидемиологией заболевания, что проявлялось значимо большим числом больных с рыжими и светлыми волосами в исследуемой группе – 44,4% и 10,9%, русыми различных оттенков – 29,8%, против 13,0% брюнетов, 2,3% больных имели седые волосы. Однако не было выявлено связи этого фактора с результатами лечения, десятилетняя актуриальная выживаемость в этих группах составила 53,1±5,2%, 51,0±8,4%, 58,7±4,0% против 42,1± 8,8%, соответственно.
Прогностическое значение состояния региональных лимфатических коллекторов у больных недиссеминированной меланомой кожи
Практика показывает, что на первый взгляд безобидная из-за своих малых размеров меланома кожи может вводить в заблуждение по тяжести прогноза не только самих пациентов, но также и врачей. Особенно часто это проявляется в отношении определения показаний к выполнению региональной лимфаденэктомии (ЛАЭ), когда расширение оперативного вмешательства у больных без видимого поражения региональных лимфатических узлов ведет к значительному увеличению частоты послеоперационных осложнений и сроков стационарного лечения. Особенно в сравнении с широко пропагандируемым, в настоящее время, «экономным» иссечением. Сомнения поддерживаются и тем, что клинически выявляемые региональные метастазы имеют место только у 20-25% больных недиссеминированной меланомой кожи. В нашем исследовании их частота составила 17,7%.
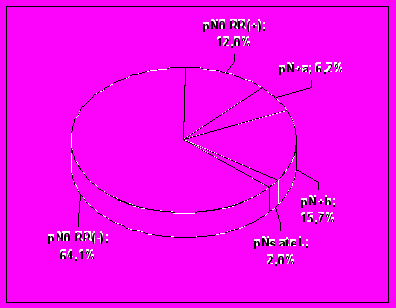
Однако результаты, полученные в ходе выполнения данной работы, показали, что не менее чем в 50% случаев регионарные метастазы меланомы кожи имеют субклинический характер и не могут быть выявлены клиническими или инструментальными методами диагностики, а нередко и рутинным морфологическим исследованием. В данной работе под общей частотой поражения региональных лимфатических коллекторов подразумевалась совокупность региональных метастазов, диагностированных на этапе обследования (pN+b и pNsatel.), выявленных в результате морфологического исследования лимфатических узлов из операционного материла (pN+a), а также региональные рецидивы в ранее интактных лимфатических узлах (pN0 RR(+)) (рис. 3). Необходимо отметить, что вероятность наличия субклинических регионарных метастазов была наибольшей в группе больных с промежуточными меланомами, когда показания к выполнению одномоментной лимфаденэктомии являются наиболее неопределенными (рис. 4).