Задачи: Знать классификацию гидроксилсодержащих соединений. Знать предельные одноатомные спирты, их строение. Изомерию спиртов
| Вид материала | Документы |
- Домашнее задание Примечание 37. Спирты: классификация, номенклатура, изомерия. Коллекция, 162.61kb.
- Рефераты по органической химии (10 класс), 18.07kb.
- Тема Кол-во часов, 296.39kb.
- Задачи: Учебные: Знать основные свойства, которыми должен обладать материал для режущих, 770.45kb.
- Классы кейс к разделу «Сложносочиненное предложение», 88.22kb.
- Методическая разработка по хирургии для студентов IV курса медицинского факультета, 42.2kb.
- Строение, свойства, получение. Цель: изучить строение, свойства и способы получения, 283.21kb.
- Дробот Светлана Сергеевна конспект, 57.86kb.
- Методическая разработка по хирургии для студентов IV курса медицинского факультета, 49.72kb.
- «белки», 92.65kb.
Модуль 5. Спирты и фенолы (8 часов).
Цели модуля: Систематизировать и обобщить знания о спиртах и фенолах.
Задачи:
1. Знать классификацию гидроксилсодержащих соединений.
2. Знать предельные одноатомные спирты, их строение. Изомерию спиртов.
3. Ввести понятие водородная связь и ее влияние на свойства спиртов. 4. Знать первичные, вторичные и третичные спирты. Химические свойства спиртов: взаимодействие с щелочными металлами, галогенуглеводородами, реакция дегидратации, горение.
5. Знать механизм нуклеофильного замещения. Получение спиртов. Генетическую связь между спиртами и углеводородами.
6. Знать многоатомные спирты, их строение и свойства.
7. Знать фенолы, их строение. Свойства фенола, взаимное влияние атомов в молекуле фенола. Орто-, паро-ориентирующее действие гидроксильной группы. Получение и применение фенола.
| | Тема | Всего часов | Теория | Прак-тика | Материалы |
| | Спирты и фенолы | 8 | | | |
| №1 | Классификация гидроксилсодержащих соединений. Предельные одноатомные спирты, их строение. Изомерия спиртов. Водородная связь и ее влияние на свойства спиртов. Первичные, вторичные и третичные спирты. Получение спиртов. | 2 | 1 | 1 | Лекция № 1, тест № 1, тест № 2 |
| №2 | Химические свойства спиртов: взаимодействие с щелочными металлами, галогенуглеводородами, реакция дегидратации, горение. Механизм нуклеофильного замещения. Генетическая связь между спиртами и углеводородами. | 2 | 1 | 1 | Лекция №2, тест №3, Лабораторная работа № 1 |
| №3 | Многоатомные спирты, их строение и свойства. Решение задач. | 2 | 1 | 1 | Лекция №3, тест№ 4, лабораторная работа № 2 |
| №4 | Фенолы, их строение. Свойства фенола, взаимное влияние атомов в молекуле фенола. Орто-, паро-ориентирующее действие гидроксильной группы. Получение и применение фенола. | 2 | | | Лекция № 4, тест № 5 |
Лекция № 1.
Классификация гидроксилсодержащих соединений. Предельные одноатомные спирты, их строение. Изомерия спиртов. Водородная связь и ее влияние на свойства спиртов. Первичные, вторичные и третичные спирты.
Спирты (устар. алкоголи) — органические соединения, содержащие одну или несколько гидроксильных групп (гидроксил, -OH), непосредственно связанных с атомом углерода в углеводородном радикале. Общая формула простых предельных (ациклических) спиртов CnH2n+1OH.
В обиходе слово «спирт» чаще означает просто этиловый спирт (этанол).
Классификация
1. По числу гидроксильных групп спирты могут быть одно-, двух-, трёхатомными и более. Одноатомные спирты также называют алкоголями, двухатомные — гликолями (этиленгликоль), трёхатомные — глицеринами (глицерол). Спирты, содержащие больше трёх групп —OH объединяют названием многоатомные спирты (ксилит, или ксилитол).
СН3 - СН2 - ОН этанол (одноатомный спирт),
СН2 - СН2 - этиленгликоль, СН2 - СН - СН2 - глицерин (трехатомный)
│ │ (двухатомный) │ │ │
ОН ОН, ОН ОН ОН
2. В зависимости от характера углеводородного радикала спирты делятся на алифатические, алициклические и ароматические.
3. Ароматическими являются спирты, включающие бензольное кольцо, причём гидроксильная группа у них не связана непосредственно с углеродом бензольного кольца. Если же группа —OH присоединена непосредственно к бензольному кольцу, такие соединения называют фенолами (например, фенол — C6H5OH).
4. В зависимости от того, при каком атоме углерода находится группа —OH, различают спирты первичные, вторичные и третичные.
первичные R–CH2–OH,
вторичные
R
I
НC–OH,
I
R’
и третичные
R
I
R’– C–OH.
I
R’’
Номенклатура.
Названия алифатических одноатомных спиртов образуются из названия углеводорода с самой длинной углеродной цепью, содержащей гидроксильную группу, путём добавления суффикса -ол. Для многоатомных спиртов перед суффиксом -ол по-гречески (-ди-, -три-, ...) указывается количество гидроксильных групп.
Распространены также традиционные названия спиртов, например, этиловый спирт (этанол), этиленгликоль (этандиол), глицерин (пропантриол).
также часто встречаются тривиальные (бытовые) названия:
СН3–ОН – метанол, метиловый спирт;
СН3–СН2–ОН – этанол, этиловый спирт;
СН3–СН–СН3 – пропанол-2, изопропиловый спирт.
I
OH
Изомерия
1. Изомерия углеродного радикала (начиная с C4H9OH).
2. Изомерия положения гидроксильной группы, (начиная с С3Н7ОН).
3. Межклассовая изомерия с простыми эфирами (СН3–СН2–ОН и СН3–О–СН3).
Физические свойства
Спирты растворимы в большинстве органических растворителей, первые три простейших представителя – метанол, этанол и пропанол, а также третичный бутанол (Н3С)3СОН – смешиваются с водой в любых соотношениях. При увеличении количества атомов С в органической группе начинает сказываться гидрофобный (водоотталкивающий) эффект, растворимость в воде становится ограниченной, а при R, содержащем свыше 9 атомов углерода, практически исчезает.
Благодаря наличию ОН-групп между молекулами спиртов возникают водородные связи.
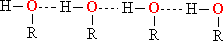
Рис. ВОДОРОДНЫЕ СВЯЗИ В СПИРТАХ (показаны пунктиром)
Молекулы спирта ассоциированы за счет взаимодействия положительно заряженного атома водорода гидроксильной группы одной молекулы со свободной электронной парой кислорода другой молекулы. Такой тип ассоциации носит название водородной связи. Энергия водородной связи составляет 20–40 кДж/моль, что на порядок ниже энергии ковалентных связей. Отсюда ясно, что более высокие температуры кипения по сравнению с соответствующими углеводородами и алкилгалогенидами обусловлены необходимостью разрыва водородных связей при переходе молекул в газовую фазу, для чего требуется дополнительная энергия.
В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов, например, Т. кип. этанола +78° С, а Т. кип. этана –88,63° С; Т. кип. бутанола и бутана соответственно +117,4° С и –0,5° С.
Получение
В промышленности.
1. Метанол синтезируют из синтез-газа на катализаторе (ZnO, Сu) при 250°C и давлении 5-10 МПа:
СО + 2Н2 ® СН3ОН
Ранее метанол получали сухой перегонкой древесины без доступа воздуха.
2. Этанол получают:
a) гидратацией этилена (Н3РО4; 280°C; 8 МПа)
СН2=СН2 + Н2О ® СН3–СН2–ОН
b) брожением крахмала (или целлюлозы):
крахмал ® С6Н12О6(глюкоза) ––ферменты® 2С2Н5ОН + 2СО2
(источник крахмала – зерно, картофель)
В лаборатории.
1. Гидратация алкенов (согласно правилу Марковникова):
СH3–СH=CH2 + H2O ––H+® СH3–CH– СH3
I
OH
2. Гидролиз галогенопроизводных углеводородов:
СH3–СH2–Br + H2O → СH3–CH2–OH + HBr
Чтобы сдвинуть равновесие вправо, добавляют щёлочь, которая связывает образующийся HBr.
3. Восстановление карбонильных соединений:
Альдегиды образуют первичные спирты, а кетоны – вторичны:
O
II
СH3–СH2-C + Н2 ® СH3–CH2-СH2OH
I
H
СH3-C-CH3 + Н2 ® CH3-CH-СH3
║ │
ОН OH
Тест № 1.
1. Вещество пентанол-2 относится к:
1) первичным спиртам, 2) вторичным спиртам; 3) третичным спиртам; 4) двухатомным спиртам.
2. Предельным одноатомным спиртом не является:
1) метанол 2) 3-этилпентанол-1 3)2-фенилбутанол-1 4) этанол
3. Сколько изомерных соединений соответствует формуле С3H8O, сколько из них относится к алканолам?
1) 4 и 3 2) 3 и 3 3) 3 и 2 4) 2 и 2 5) 3 и 1
4. Сколько изомеров, принадлежащих к классу простых эфиров, имеет бутанол-1?
1)Один 2) Два 3)Три 4) Пять
5. Изомером положения функциональной группы для пентанола-2 является:
1) пентанол-1 2) 2-метилбутанол-2 3) бутанол-2 4) 3-метилпентанол-1
6. Сколько первичных, вторичных и третичных спиртов приведено ниже?
1) СН3СН2-OH 2) C2H5-CH(CH3)-CH2- OH 3) (CH3)3C-CH2-OH
4) (CH3)3C-OH д) CH3-CH(OH)-C2H5 е) CH3-OH
1) первичных - 3, вторичных - 1, третичных - 1
2) первичных - 2, вторичных - 2, третичных - 2
3) первичных - 4, вторичных - 1, третичных - 1
4) первичных - 3, вторичных - 2, третичных - 1
7. Какой вид химической связи определяет отсутствие среди гидроксисоединений газообразных веществ (при обычных условиях)?
1) ионная 2) ковалентная 3) донорно-акцепторная 4) водородная
8. Температуры кипения спиртов по сравнению с температурами кипения соответствующих углеводородов:
1) примерно сопоставимы; 2) ниже; 3) выше; 4) не имеют четкой взаимозависимости.
9. Молекулы спиртов полярны из-за полярности связи водорода с:
1) кислородом; 2) азотом; 3) фосфором; 4) углеродом.
10. Выберите верное утверждение:
1) спирты – сильные электролиты;
2) спирты хорошо проводят электрический ток;
3) спирты – неэлектролиты;
4) спирты – очень слабые электролиты.
11. Молекулы спиртов ассоциированы из-за:
1) образования внутримолекулярных связей; 2) образования кислородных связей;
3) образования водородных связей; 4) молекулы спиртов не ассоциированы.
Тест № 2 Получение
1. Какой реагент используют для получения спиртов из галогеналканов?
1) водный р-р КОН 2)раствор Н2SО4 3) спиртовой р-р КОН 4) вода
2. Бутанол-2 и хлорид калия образуются при взаимодействии
1) 1-хлорбутана и водного раствора КОН 2) 2-хлорбутана и водного раствора КОН
3) 1-хлорбутана и спиртового раствора КОН 4) 2-хлорбутана и спиртового раствора КОН
3. При щелочном гидролизе 2-хлорбутана преимущественно образуется
1) бутанол-2 2) бутанол-1 3) бутаналь4) бутен-2
4. Какой реагент используют для получения спиртов из алкенов?
1) воду 2) пероксид водорода 3) слабый р-р Н2SО4 4) р-р брома
5. Каталитическая гидратация этилена используется для получения:
1) метанола; 2) этанола; 3) пропанола; 4) бутанола.
6. При взаимодействии бутена-1 с водой образуется преимущественно
1) бутен-1-ол-2 2) бутанол-2 3) бутанол-1 4) бутен-1-ол-1
7. При гидратации 3-метилпентена-1 образуется:
1)3-метилпентанол-1 2)3-метилпентанол-3 3)3-метилпентанол-2 4) пентанол-2
8. Этанол можно получить из этилена в результате реакции:
1)гидратации 2)гидрирования; 3)галогенирования; 4)гидрогалогенирования .
9. Какие спирты получаются из альдегидов?
1) первичные 2) вторичные 3) третичные 4) любые
10. Из какого вещества нельзя получить пентанол-3:
1) пентен-1 2) пентен-2 3) 3-бромпентан 4) 3-хлорпентан
11. Из какого вещества нельзя получить пропанол-2:
1) пропен 2) пропаналь 3) 2- бромпропан 4) пропанон-2
12. Из какого вещества нельзя получить первичный спирт?
1) кетон 2) альдегид 3) алкен 4) галогеналкан
13. Из какого галогеналкана нельзя получить вторичный спирт?
1)2-хлорпропан 2)2-хлор-3-метилпентан 3)2-хлор-2-метилпропан 4)2-бромбутан
14. Бутанол-1 нельзя получить из:
1) бутена-1 2) бутена-2 3) 1-хлорбутана 4) 1-бромбутана
15. Пропанол-1 нельзя получить:
1) восстановлением карбонильного соединения; 2) гидратацией алкена;
3) гидратацией алкина; 4) гидролизом галогеналкана.
16. Гексанол-2 можно получить гидратацией:
1) гексена-1 2) гексена-2 3) гексена-3 4) гексина-1
17. Этандиол может быть получен в реакции
1) 1,2-дихлорэтана со спиртовым раствором щелочи 2) гидратации ацетальдегида
3) этилена с раствором перманганата калия 4) гидратации этанола
18. Пропанол-1 образуется в результате реакции, схема которой
1) СН3СН2СОН + H2 → 2) СН3СН2СОН + Cu(OH)2 →
3) СН3СН2Сl + H2O → 4) СН3СН2СОН + Ag2O →
19. В результате спиртового брожения глюкозы происходит образование
1) C2H5OH и СО 2) CH3OH и CO2 3) C2H5OH и CO2 4) CH3-CH(OH)-СОOH
20. К промышленному способу получения этанола не относится:
1)спиртовое брожение глюкозы; 2)гидрирование этаналя
3)гидратация этилена 4)гидролиз хлорэтана
21. Сырьем для получения метанола в промышленности служат
1) CO и H2 2) HCHO и H2 3) CH3Cl и NaOH 4) HCOOH и NaOH
22. В промышленности из оксида углерода и водорода под давлением, при повышенной температуре, в присутствии катализатора получают:
1) метанол; 2) этанол; 3) пропанол; 4) бутанол.
Лекция № 2 .
Химические свойства спиртов: взаимодействие с щелочными металлами, галогенуглеводородами, реакция дегидратации, горение. Механизм нуклеофильного замещения. Генетическая связь между спиртами и углеводородами.
Физико-химические свойства спиртов определяются в основном строением углеводородного радикала и функциональной группы -OH, а также их взаимным влиянием:
1) Чем больше радикал, тем сильнее он влияет на функциональную группу, снижая полярность связи О-Н, и реакции, основанные на разрыве этих связей, протекают более медленно.
2) Гидроксильная группа -ОН влияет на углеводородный радикал, уменьшая электронную плотность сигма - связей соседнего атома радикала, вызывая индуктивный эффект по всей углеродной цепи.
Химические свойства спиртов ROH определяются наличием полярных связей Od-–Hd+ и Cd+–Od-, и неподеленных электронных пар на атоме кислорода.
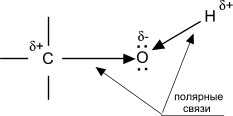
I. Реакции с разрывом связи RO–H
1) Кислотные свойства
Спирты реагируют с щелочными и щелочноземельными металлами, образуя солеобразные соединения – алкоголяты. Со щелочами спирты не взаимодействуют.
2СH3CH2CH2OH + 2Na ® 2СH3CH2CH2ONa + H2
2СH3CH2OH + Сa ® (СH3CH2O)2Ca + H2
В присутствии воды алкоголяты гидролизуются:
(СH3)3С–OK + H2O ® (СH3)3C–OH + KOH
Это означает, что спирты – более слабые кислоты, чем вода.
При увеличении количества электронакцепторных заместителей на углеводородном радикале, увеличивается кислотность соответствующих спиртов (например трифторэтанол более сильная кислота чем 2-фторэтанол, и оба фторированных спирта более сильные кислоты чем этанол). Полифторированные спирты (например трет-перфторбутанол) превосходят по pKa уксусную кислоту.
Соли одноатомных спиртов называются алкоголятами. Отдельные представители называются: CH3ONa - метилат натрия; C2H5ONa - этилат натрия. Алкоголяты представляют собой твердые вещества, растворимые в спирте
2) Взаимодействие с галогеноводородами:
R-OH + HHal -> RHal + H2O
Реакция протекает быстрее всего с третичными спиртами, медленнее всего - с первичными. Данная реакция отображает способность спирта образовывать карбокатион.
Механизм нуклеофильного замещения в спиртах (катализатор - кислота).
Сильные кислоты – это доноры протонов (H+):
H2SO4 = H+ + HSO4–
Спирты являются слабыми основаниями (акцепторами протона) за счет неподеленной пары электронов атома кислорода. Поэтому в присутствии сильной минеральной кислоты происходит протонирование спирта (образование донорно-акцепторной связи Н–О):
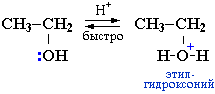
Далее возможно протекание реакции по одному из двух возможных механизмов.
Механизм I.
I стадия. Катион алкилгидроксония, отщепляя воду, превращается в карбокатион:
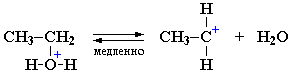
Роль кислоты, таким образом, заключается в превращении ОН-группы в Н2О, которая отщепляется легче, чем анион НО–.
II стадия. Карбокатион вызывает гетеролитический разрыв связи в галогеноводороде и присоединяет галогенид-анион с образованием конечного продукта:

или
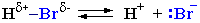
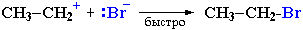
Освободившийся H+ идет на протонирование новых молекул спирта. Механизм II.
Другой возможный механизм нуклеофильного замещения заключается в практически одновременном отщеплении воды и присоединении галогена (без образования карбокатиона) и идет в одну стадию.
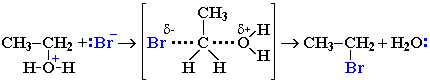
Механизм замещения зависит от строения реагентов и условий реакции. Для третичных спиртов предпочтительней первый механизм, а для первичных - второй. Почему?
На стадии, определяющей скорость реакции (так называемой, лимитирующей стадии), в механизме I образуется карбокатион. Чем стабильнее этот катион, тем легче он образуется. Третичный катион стабильнее, чем первичный (три +I-эффекта алкильных групп в третичном катионе и один - в первичном). С другой стороны, энергия переходного состояния в механизме II тем ниже, чем меньше стерические препятствия, т.е. чем меньше алкильных групп у атакуемого атома углерода.
3) Межмолекулярная дегидратация(образование простых эфиров):
R-OH + R'-OH -> R-O-R' + H2O
Катализатором данной реакции служит кислота. Чаще всего используют серную кислоту. Легче всего реагируют третичные спирты.
4) Внутримолекулярная дегидратация: C2H5OH -> CH2=CH2 + H2O Спирты дегидратируются по правилу Зайцева. Легче всего отщепляют воду третичные спирты. Межмолекулярная и внутримолекулярная дегидратация являются конкурирующими реакциями. Но вторая протекает при более высокой температуре.
5) Реакция этерификации:
Спирты реагируют с кислотами при этом образуются сложные эфиры.
1)R—ОН + HNO3 —> R—О—NO2 + Н2О
2)R'-OH + R-COOH -> R-C(O)-OR' + H2O
Реакция является обратимой. Также при взаимодействии с неорганическими кислотами-окислителями(например с азотной) протекает побочная реакция - окисление.
6) Окисление спиртов: Спирты окисляются легче, чем углеводороды.
Окислители – KMnO4, K2Cr2O7+H2SO4, CuO, O2+катализатор. Легкость окисления спиртов уменьшается в ряду:
первичные ≥ вторичные >> третичные.
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.

При окислении вторичных спиртов образуются кетоны.

Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Процесс идет через стадию дегидратации спирта с последующим деструктивным (жестким) окислением алкена. Например:
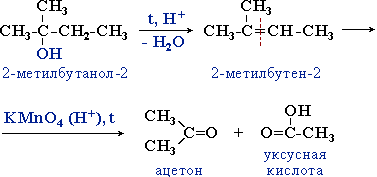
Предельное окисление гидроксисоединений до CO2 и Н2О происходит при их горении, например:
2CH3OH + 3O2 = 2CO2 + 4H2O
Полное окисление метанола идет схеме:
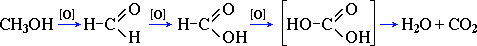
При сгорании спиртов выделяется большое количество тепла.
C2H5OH + 3O2 = 2CO2 + 3H2O + 1370 кДж
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В лабораторной практике этанол применяется как горючее для "спиртовок".
7) Качественная реакция на одноатомные спирты
O
II
CH3OH + CuO ––t°® H–C + Cu + H2O
I
Н
Применение
Метанол и этанол широко применяются для переэтерификации жиров, как растворители.
В последнее время растет роль спиртов, как топлива (метанол — в топливных элементах, этанол и смеси с ним — в двигателях внутреннего сгорания).
Этиловый спирт употребляется при приготовлении различных алкогольных напитков.
В медицине водно-этанольные растворы служат для приготовления экстрактов из лекарственных растений, а также для дезинфекции.
В косметике и парфюмерии этанол — растворитель для духов, лосьонов и т. п. продуктов.
Генетическая связь между углеводородами и спиртами
Произвести непосредственное окисление углеводорода в спирт довольно трудно. Практически проще это сделать через галогено-производное углеводорода. Например, чтобы получить этиловый спирт, исходя из этана, можно сначала получить бромистый этил по реакции:
 а затем бромистый этил превратить в спирт нагреванием с водой в присутствии щёлочи:
а затем бромистый этил превратить в спирт нагреванием с водой в присутствии щёлочи: 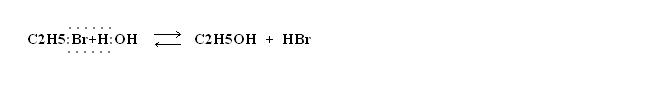 Щёлочь при этом нужна, чтобы нейтрализовать образующийся бромистый водород и устранить возможность реакции его со спиртом, т. е. сдвинуть эту обратимую реакцию вправо.
Щёлочь при этом нужна, чтобы нейтрализовать образующийся бромистый водород и устранить возможность реакции его со спиртом, т. е. сдвинуть эту обратимую реакцию вправо.Подобным же образом метиловый спирт может быть получен по схеме:
 Таким образом, углеводороды, их галогенопроизводные и спирты находятся между собой в генетической связи (связи по происхождению).
Таким образом, углеводороды, их галогенопроизводные и спирты находятся между собой в генетической связи (связи по происхождению).Тест № 3.
Свойства
1. Метанол не взаимодействует с 1) К 2)Аg 3) СuО 4) О2
2. Этанол не взаимодействует с 1) NаОН 2) Nа 3) НСl 4) О2
3. С каким из перечисленных веществ не взаимодействует этанол:
1) Na 2) NaOH 3) HBr 4) O2
4. Пропанол не взаимодействует с 1) Hg 2)О2 3)НСl 4) K
5. Этанол не реагирует с 1) Na 2) CuO 3)HCOOH 4)CuSO4
6. Для предельных одноатомных спиртов характерно взаимодействие с
1) КОН (р-р) 2) К 3) Сu(ОН)2 4) Сu
7. При окислении первичного бутилового спирта получают:
1) пропаналь;2) масляный альдегид;3) этаналь;4) метаналь.
8. При окислении (дегидрировании) вторичного спирта получают:
1) третичный спирт 2) альдегид 3) кетон 4) карбоновую кислоту.
9. Какое из гидроксил-содержащих веществ при дегидрировании превращается в кетон:
1) метанол 2) этанол 3)пропанол-2 4) о-крезол.
10. При окислении бутанола-1 образуется:1) кетон 2) альдегид 3) кислота 4)алкен
11. При окислении метанола образуется
1) метан 2) уксусная кислота 3) метаналь 4) хлорметан
12. При окислении пропанола-2 образуется 1)альдегид 2)кетон 3)алкан 4)алкен
13. При нагревании метанола с кислородом на медном катализаторе образуется
1) формальдегид 2) ацетальдегид 3) метан 4) диметиловый эфир
14. При нагревании этанола с кислородом на медном катализаторе образуется
1) этен 2) ацетальдегид 3) диэтиловый эфир 4) этандиол
15. Одним из продуктов реакции, протекающей при нагревании метанола с конц. серной кислотой, является 1) CH2=CH2 2)CH3-O-CH3 3) CH3Cl 4) CH4
16. При внутримолекулярной дегидратации бутанола-1 образуется:
1) бутен-1 2) бутен-2 3) дибутиловый эфир 4) бутаналь.
17. Внутримолекулярная дегидратация спиртов приводит к образованию
1) альдегидов 2) алканов 3)алкенов 4) алкинов
18. Какое вещество образуется при нагревании этилового спирта до 140оС в присутствии концентрированной серной кислоты?
1) уксусный альдегид 2) диметиловый эфир 3) диэтиловый эфир 4) этилен
19. Кислотные свойства этанола проявляются в реакции с
1) натрием 2) оксидом меди (II)
3) хлороводородом 4) подкисленным раствором перманганата калия
20. Какая реакция свидетельствует о слабых кислотных свойствах спиртов:
1) с Na 2) c NaOH 3) c NaHCO3 4) c CaO
21. Алкоголяты получаются из спиртов при их взаимодействии с:
1) KМnO4; 2) О2 3) CuO 4) Na
22. При взаимодействии пропанола-1 с натрием образуется:
1) пропен; 2) пропилат натрия 3) этилат натрия 4)пропандиол-1,2
23. При воздействии на спирты щелочных металлов образуются:
1) легко гидролизуемые карбонаты; 2) трудно гидролизуемые карбонаты;
3) трудно гидролизуемые алкоголяты; 4) легко гидролизуемые алкоголяты.
24. Какое вещество образуется в реакции пентанола-1 с калием?
1) С5Н12ОК; 2) С5Н11ОК; 3) С6Н11ОК; 4) С6Н12ОК.
25. Вещество, реагирующее с Na, но не реагирующее с NaOH, при дегидратации дающее алкен - это: 1) фенол; 2) спирт 3) простой эфир; 4) алкан
26. Какой из перечисленных спиртов наиболее активно реагирует с натрием?
1) СН3СН2OH 2)CF3CH2OH 3)CH3CH(OH)CH3 4) (CH3)3C-OH
27. Какова молекулярная формула продукта взаимодействия пентанола-1 с бромоводородом?
1) С6Н11Br; 2) С5Н12Br; 3) С5Н11Br; 4) С6Н12Br.
28. В ходе реакции этанола с соляной кислотой в присутствии Н2SО4 образуется
1) этилен 2) хлорэтан 3) 1,2-дихлорэтан 4) хлорвинил
29. Из этанола бутан можно получить последовательным действием
1) бромоводорода, натрия 2) брома (облучение), натрия
3) концентрированной серной кислоты (t> 140°), водорода (катализатор, t°)
4) бромоводорода, спиртового раствора гидроксида натрия
30. Пропанол-1 взаимодействует с веществами:
1) нитрат серебра
2) оксид меди (II)
3) бромоводород
4) глицин
5) оксид серебра (NH3 р-р)
6) гидроксид меди (II)
Лабораторная работа № 1.
1. Напишите уравнения реакций
2. Назовите данные вещества по систематической номенклатуре:
а)

б)
в)
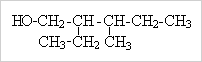
г)
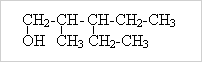
д)
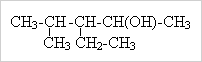
е)

в)
г)
8. Среди представленных веществ наиболее сильными кислотными свойствами обладает
фенол
вода
глицерин
метанол
9. Расположите перечисленные вещества в ряд по усилению кислотных свойств.
А) фенол
Б) 4-нитрофенол
В) 2,4,6-тринитрофенол
Г) этанол
(Запишите ответ в виде последовательности букв с учётом регистра)
10. В схеме превращений
пропен → X → ацетон
веществом «Х» является
пропан
пропанол-1
пропанол-2
пропандиол-1,2
11. Свежеприготовленный осадок Cu(OH)2 растворится, если к нему добавить
пропанол-2
пропандиол-1,2
пропен-1
пропанол-1
12. В отличие от фенола метанол
взаимодействует с растворами щелочей
не обесцвечивает раствор брома
вступает в реакции поликонденсации
реагирует с хлоридом железа (III)
при окислении образует формальдегид
взаимодействует с бромоводородом
13. Вещество, имеющее строение:
обработали раствором гидроксида натрия. Чему равна относительная молекулярная масса образовавшегося органического вещества?
(Ответ запишите в виде целого числа)
14. Водные растворы этанола и глицерина можно различить с помощью
бромной воды
металлического натрия
аммиачного раствора оксида серебра
свежеприготовленного осадка Cu(OH)2
15. В схеме превращений
CH3-CH2-CH2Br X CH3-CH(OH)-CH2OH
вещество X имеет формулу
CH3-CH2-CH2-OH
CH3-CH2-CH=O
CH3-CH=CH2
CH3-CH2-COOH
16. Взаимодействие между какими веществами можно использовать для получения фенилэтилового простого эфира?
C6H5Cl и C2H5OH
C6H5OH и C2H5Cl
C6H5OH и CH≡CH
C6H5ONa и C2H5Br
17. Вещество, не способное к внутримолекулярной дегидратации, –
бутандиол-1,2
2-метилбутанол-2
2,4-диметилфенол
3-фенилпропанол-1
18. При дегидрировании превращается в кетон
2-метилбутанол-1
этанол
2-метилфенол
бутанол-2
19. Вещество состава С8Н10О реагирует с натрием и гидроксидом натрия, а под действием бромной воды превращается в вещество состава С8Н7Br3O. Вещество С8Н10О – это
этилфениловый эфир
2,4-диметилфенол
4-этилфенол
3,5-диметилфенол
20. Из изомерных спиртов состава C5H12O в результате дегидратации образуется один и тот же алкен. При действии на этот алкен кипящим раствором KMnO4 в кислой среде образуется смесь ацетона и уксусной кислоты. Данными спиртами являются:
2-метилбутанол-1
2-метилбутанол-2
2,2-диметилпропанол-1
3-метилбутанол-2
пентанол-2
Лекция № 3.
Многоатомные спирты, их строение и свойства.
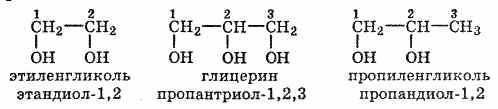
Представители многоатомных спиртов — этиленгликоль и глицерин. Двухатомные спирты, содержащие две гидроксильные группы—ОН, называются гликолями, или диолами, трехатомные спирты, содержащие три гидроксильные группы, — глицеринами, или триолами.
Положение гидроксильных групп указывается цифрами в конце названия.
Физические свойства
Многоатомные спирты — бесцветные сиропообразные жидкости сладковатого вкуса, хорошо растворимы в воде, плохо — в органических растворителях; имеют высокие температуры кипения. Например, tкип этиленгликоля 198°С, плотность () 1,11 г/см3; tкип (глицерин) = 290°С, глицерин = 1,26 г/см3.
Получение
Двух- и трехатомные спирты получают теми же способами, что и одноатомные. В качестве исходных соединений могут быть использованы алкены, галогенопроизводные и другие соединения.
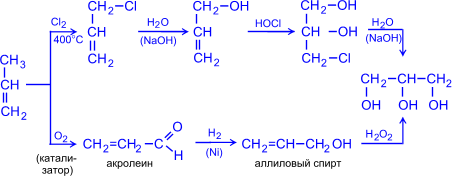
1. Этиленгликоль (этандиол-1,2) синтезируют из этилена различными способами:

3CH2=CH2 + 2KMnO4 + 4H2 O ® 3HO–CH2–CH2–OH + 2MnO2 + 2KOH

2. Глицерин (пропантриол -1,2,3) получают из жиров, а также синтетическим путем из газов крекинга нефти (пропилена), т.е. из непищевого сырья.
Химические свойства
Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. Например, этиленгликоль реагирует не только с щелочными металлами, но и с гидроксидами тяжелых металлов.
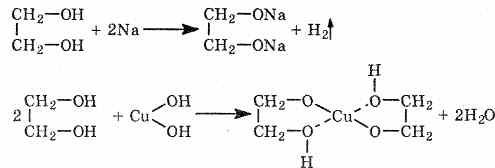
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами.
При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:

Вторая гидроксогруппа замещается труднее, под действием РСl5.
При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение ярко-синего цвета.
Эта реакция используется для обнаружения многоатомных спиртов, имеющих гидроксильные группы при соседних атомах углерода -СH(ОН)-СН(ОН)-:
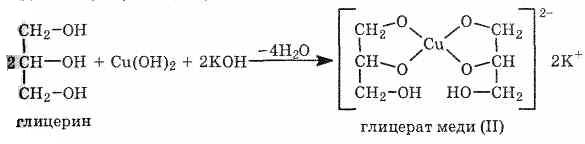
В отсутствие щелочи многоатомные спирты не реагируют с |гидроксидом меди (II) — их кислотность для этого недостаточна.
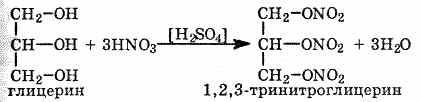
Многоатомные спирты взаимодействуют с кислотами, образуя сложные эфиры (см. §7). При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина):
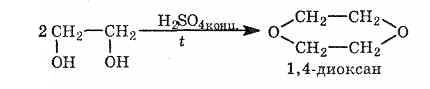
Для спиртов характерны реакции, в результате которых образуются циклические структуры:
Применение
Этиленгликоль используется главным образом для производства лавсана и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время).
Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканей и в других областях народного хозяйства. Наиболее важной областью применения глицерина является производство тринитрата глицерина (неверно называемого нитроглицерином) — это сильное взрывчатое вещество, которое взрывается от удара, а также лекарство (сосудорасширяющее средство). Сорбит (шестиатомный спирт) используется как заменитель сахара для больных диабетом.
Тест № 4.
Свойства многоатомных спиртов
1. С какими из перечисленных ниже веществ будет реагировать глицерин?
1) HBr 2) HNO3 3) H2 4) H2O 5)Cu(OH) 2 6) Ag2O/NH3
2. Глицерин не реагирует с 1)HNO3 2)NaOH 3)CH3COOH 4)Cu(OH)2
3. Этиленгликоль не реагирует с 1)HNO3 2)NaOH 3)CH3COOH 4)Cu(OH)2
4. Со свежеосажденным гидроксидом меди (II) не будет взаимодействовать: 1) глицерин;
2) бутанон 3) пропаналь 4) пропандиол-1,2
5. Свежеприготовленный осадок Сu(ОН)2 растворится, если к нему добавить
1)пропандиол-1,2 2)пропанол-1 3) пропен4)пропанол-2
6. Глицерин в водном растворе можно обнаружить с помощью
1) хлорной извести 2) хлорида железа (III) 3) гидроксида меди (II) 4) гидроксида натрия
7. Какой из спиртов реагирует с гидроксидом меди (II)?
1)СН3ОН 2) СН3СН2ОН 3) С6Н5 ОН 4)НО-СН2СН2-ОН
8. Характерной реакцией для многоатомных спиртов является взаимодействие с
1) H2 2) Сu 3) Ag2O (NH3 р-р) 4) Cu(OH)2
9. Вещество, реагирующее с Na и Cu(OH)2 – это:
1) фенол; 2) одноатомный спирт; 3) многоатомный спирт 4) алкен
10. Этандиол-1,2 может реагировать с
1) гидроксидом меди (II)
2) оксидом железа (II)
3) хлороводородом
4)водородом
5) калием
6) фосфором
Лекция № 4.
Фенолы, их строение. Свойства фенола, взаимное влияние атомов в молекуле фенола. Орто-, паро-ориентирующее действие гидроксильной группы. Получение и применение фенола
ФЕНОЛЫ – класс органических соединений. Содержат одну или несколько группировок С–ОН, при этом атом углерода входит в состав ароматического (например, бензольного) кольца.
Классификация фенолов. Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле (рис.1)
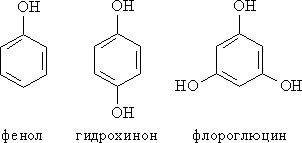
Рис. 1. ОДНО-, ДВУХ- И ТРЕХАТОМНЫЕ ФЕНОЛЫ
В соответствии с количеством конденсированных ароматических циклов в молекуле различают (рис. 2) сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы (рис. 2).
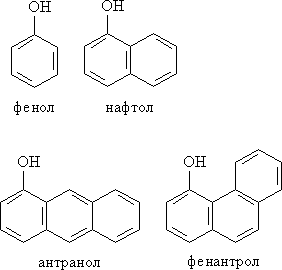
Рис. 2. МОНО- И ПОЛИЯДЕРНЫЕ ФЕНОЛЫ
Номенклатура фенолов
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей (рис. 3).
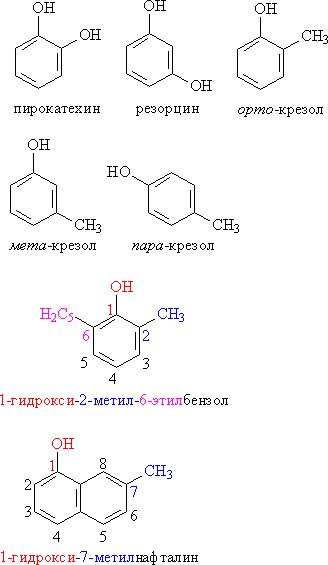
Рис. 3. НОМЕНКЛАТУРА ФЕНОЛОВ. Замещающие группы и соответствующие цифровые индексы для наглядности выделены различными цветами.
Химические свойства фенолов
Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Фенильная группа оттягивает на себя неподеленную электронную пару от атома кислорода в ОН-группе (рис. 4). В результате на атоме Н этой группы увеличивается частичный положительный заряд (обозначен значком d+), полярность связи О–Н возрастает, что проявляется в увеличении кислотных свойств этой группы. Таким образом, в сравнении со спиртами, фенолы представляют собой более сильные кислоты. Частичный отрицательный заряд (обозначен через d–), переходя на фенильную группу, сосредотачивается в положениях орто- и пара- (по отношению к ОН-группе). Эти реакционные точки могут атаковаться реагентами, тяготеющими к электроотрицательным центрам, так называемыми электрофильными («любящими электроны») реагентами.
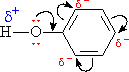
Рис. 4. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В ФЕНОЛЕ
В итоге для фенолов возможны два типа превращений: замещение атома водорода в ОН-группе и замещение Н-атомобензольном ядре. Пара электронов атома О, оттянутая к бензольному кольцу, увеличивает прочность связи С–О, поэтому реакции, протекающие с разрывом этой связи, характерные для спиртов, для фенолов не типичны.
1. Обладает слабыми кислотными свойствами, при действии щелочей образует соли — феноляты (например, фенолят натрия - C6H5ONa):
C6H5OH + NaOH = C6H5ONa + H2O
Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп, увеличивает реакционную способность кольца к этим реакциям, и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
Реакция Кольбе-Шмидта.
2. Взаимодействие с металлическим натрием:
C6H5OH + Na = C6H5ONa + H2↑
3. Взаимодействие с бромной водой (качественная реакция на фенол):
C6H5OH + 3Br2(водн.) → C6H2(Br)3OH + 3HBr образуется 2,4,6 трибромфенол
4. Взаимодействие с концентрированной азотной кислотой:
C6H5OH + 3HNO3конц → C6H2(NO2)3OH + 3H2О образуется 2,4,6 тринитрофенол
5. Взаимодействие с хлоридом железа (III)(качественная реакция на фенол):
C6H5OH + FeCl3 → [C6H5OFe]2+(Cl)2- + HCl образуется дихлоридфенолят железа (III)(фиолетовое окрашивание)
Способы получения фенолов.
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь). Промышленный способ получения самого фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4 (рис. 8А). Реакция проходит с высоким выходом и привлекательна тем, что позволяет получить сразу два технически ценных продукта – фенол и ацетон. Другой способ – каталитический гидролиз галогензамещенных бензолов (рис. 8Б).

Рис. 8. СПОСОБЫ ПОЛУЧЕНИЯ ФЕНОЛА
Применение фенолов.
Раствор фенола используют в качестве дезинфицирующего средства (карболовая кислота). Двухатомные фенолы – пирокатехин, резорцин (рис. 3), а также гидрохинон (пара-дигидроксибензол) применяют как антисептики (антибактериальные обеззараживающие вещества), вводят в состав дубителей для кожи и меха, как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии.
В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – феноло-альдегидных смол (рис. 7), полиамидов, полиэпоксидов. На основе фенолов получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин, кроме того, красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений.
Тест № 5 Фенолы
1. Сколько существует фенолов состава С7Н8О? 1)Один 2) Четыре 3) Три 4) два
2. Атом кислорода в молекуле фенола образует
1) одну σ-связь 2) две σ-связи 3) одну σ- и одну π-связи 4) две π-связи
3. Фенолы — более сильные кислоты, чем алифатические спирты потому, что ...
1) между молекулами спирта образуется прочная водородная связь
2) в молекуле фенола больше массовая доля ионов водорода
3) в фенолах электронная система смещена в сторону атома кислорода, что приводит к большей подвижности атомов водорода бензольного кольца
4) в фенолах электронная плотность связи О-Н уменьшается из-за взаимодействия неподеленной электронной пары атома кислорода с бензольным кольцом
4. Выберите верное утверждение:
1) фенолы диссоциируют в большей степени, чем спирты;
2) фенолы проявляют основные свойства;
3) фенолы и их производные не обладают токсическим действием;
4) атом водорода в гидроксильной группе фенола не может быть замещен на катион металла под действием оснований.
Свойства
5. Фенол в водном растворе является
1) сильной кислотой 2) слабой кислотой 3) слабым основанием 4) сильным основанием
1. Вещество, реагирующее с Na и NaOH, дающее фиолетовое окрашивание с FeCl3 – это:
1) фенол; 2) спирт 3) простой эфир; 4) алкан
6. Влияние бензольного кольца на гидроксильную группу в молекуле фенола доказывает реакция фенола с
1) гидроксидом натрия 2) формальдегидом 3) бромной водой 4) азотной кислотой
7. Химическое взаимодействие возможно между веществами, формулы которых:
1) С6Н5OH и NaCl 2) С6Н5OH и HCl 3) С6Н5OH и NaOH 4) С6Н5ONa и NaOH.
8. Фенол не взаимодействует с
1) метаналем 2) метаном 3) азотной кислотой 4) бромной водой
9. Фенол взаимодействует c
1) соляной кислотой 2) этиленом 3) гидроксидом натрия 4) метаном
10. Фенол не взаимодействует с веществом, формула которого
1)HBr 2)Br2 3)HNO3 4)NaOH
11. Фенол не реагирует с 1) НNO3 2) KОН 3) Вr2 4) Сu(OH)2
12. Кислотные свойства наиболее выражены у 1)фенола 2)метанола 3)этанола 4)глицерина
13. При взаимодействии фенола с натрием образуются
1) фенолят натрия и вода 2) фенолят натрия и водород
3) бензол и гидроксид натрия 4) бензоат натрия и водород
14. Установите соответствие между исходными веществами и продуктами, которые преимущественно образуются при их взаимодействии.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А) С6Н5ОН + К 1) 2,4,6-трибромфенол + НВr
Б) С6Н5ОН + КОН 2) 3,5-дибромфенол + НВr
В) С6Н5ОН + НNО3 3) фенолят калия + Н2
Г) С6Н5ОН + Вr2 (р-р) 4) 2,4,6-тринитрофенол + H2O
5) 3,5-динитрофенол + НNO3
6) фенолят калия + Н2О
15. Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) С6Н5ОН + Н2 1) С6Н6+ Н2О
Б) С6Н5ОН + К 2) С6Н5ОК + Н2О
В) С6Н5ОН + КОН 3) С6Н5ОН + КНСО3
Г) С6Н5ОК + Н2О + СО2 4) С6Н11ОН
5) С6Н5ОК + Н2
6) С6Н5СООН + КОН
16. Фенол взаимодействует с растворами
1) Сu(ОН)2
2) Н2SO4
3) [Аg(NH3)2]OH
4) FеСl3
5) Вr2
6) КОН
17. Фенол реагирует с
1) кислородом
2)бензолом
3) гидроксидом натрия
4) хлороводородом
5) натрием
6) оксидом кремния (IV)
Получение
18. При замещении водорода в ароматическом кольце на гидроксильную группу образуется:
1) сложный эфир; 2) простой эфир; 3) предельный спирт; 4) фенол.
19. Фенол может быть получен в реакции
1) дегидратации бензойной кислоты 2) гидрирования бензальдегида
3) гидратации стирола 4) хлорбензола с гидроксидом калия
Взаимосвязь, качественные реакции.
20. Метанол. этиленгликоль и глицерин являются:
1)гомологами; 2)первичным, вторичным и третичным спиртами;
32)изомерами; 4) одноатомным, двухатомным, трехатомным спиртами
21. Вещество, не реагирующее ни с Na, ни с NaOH, получаемое при межмолекулярной дегидратации спиртов - это: 1) фенол 2) спирт 3) простой эфир; 4) алкен
22.Взаимодействуют между собой
1)этанол и водород 2)уксусная кислота и хлор
3)фенол и оксид меди (II) 4)этиленгликоль и хлорид натрия
23.Вещество Х может реагировать с фенолом, но не реагирует с этанолом. Это вещество:
1)Na 2) O2 3)HNO3 4)бромная вода
24. Ярко-синий раствор образуется при взаимодействии гидроксида меди (II) с
1)этанолом 2) глицерином 3) этаналем 4) толуолом
25. Гидроксид меди (II) может быть использован для обнаружения
1) ионов Аl3+ 2)этанола 3) ионов NO3- 4) этиленгликоля
26. В схеме превращений C6H12O6 à X à C2H5-O- C2H5 веществом «Х» является
1) C2H5OH 2) C2H5COOH 3) CH3COOH 4) C6H11OH
27.В схеме превращений этанол à Хà бутан веществом Х является
1)бутанол-1 2)бромэтан 3)этан 4)этилен
28. В схеме превращений пропанол-1à Х à пропанол-2 веществом Х является
1) 2-хлорпропан 2) пропановая кислота 3) пропин 4) пропен
29.Водные растворы этанола и глицерина можно различить с помощью:
1)бромной воды 2)аммиачного раствора оксида серебра
4) металлического натрия 3)свежеприготовленного осадка гидроксида меди (II);
30. Отличить этанол от этиленгликоля можно с помощью:
1) натрия; 2) NaOH; 3) Cu(OH)2 4) FeCl3
31. Отличить фенол от метанола можно с помощью:
1) натрия; 2) NaOH; 3) Cu(OH)2 4) FeCl3
32. Отличить фенол от простого эфира можно с помощью:
1) Cl2 2) NaOH 3) Cu(OH)2 4) FeCl3
33. Отличить глицерин от пропанола-1 можно с помощью:
1) натрия 2)NaOH 3) Cu(OH)2 4) FeCl3
34. Какое вещество надо использовать для того, чтобы в лабораторных условиях отличить друг от друга этанол и этиленгликоль?
1) Натрий 2) Соляную кислоту 3) Гидроксид меди (II) 4) Гидроксид натрия
