Синтез модифицированных природных хлорофиллов и изучение их свойств для бинарных методов терапии в онкологии 02. 00. 10 Биоорганическая химия
| Вид материала | Автореферат |
- * Исследование физико-химических и сорбционных свойств синтезированных сорбентов, 26.1kb.
- Учебная программа курса по выбору по дисциплине «Биоорганическая химия» Специальность:, 174.53kb.
- Синтез и изучение химических свойств адамантилзамещенных эфиров кето- и дикетокарбоновых, 394.66kb.
- Методы модификации полимерных материалов углеродными наноструктурами, 35.19kb.
- Программа спецкурса «методы расчета физико-химических свойств веществ» для студентов, 40.47kb.
- Тематический план лабораторных занятий по дисциплине «общая химия, биоорганическая, 46.73kb.
- Учебно-методическая карта дисциплины, 62.2kb.
- Синтез и свойства биологически активных соединений, содержащих no-донорный фрагмент, 577.21kb.
- Программа «аналитическая химия» по направлению подготовки 020100 «Химия», 31.74kb.
- Изучение свойств нервной системы учащихся, 286.83kb.
На правах рукописи
Грин Михаил Александрович
СИНТЕЗ МОДИФИЦИРОВАННЫХ ПРИРОДНЫХ ХЛОРОФИЛЛОВ И ИЗУЧЕНИЕ ИХ СВОЙСТВ ДЛЯ БИНАРНЫХ МЕТОДОВ ТЕРАПИИ В ОНКОЛОГИИ
02.00.10 – Биоорганическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора химических наук
Москва – 2010
Работа выполнена на кафедре химии и технологии биологически активных соединений
им. Н.А. Преображенского Московской государственной академии тонкой химической технологии им. М.В. Ломоносова.
Научный консультант: доктор химических наук, профессор
Миронов Андрей Федорович
Официальные оппоненты: член-корр. РАН, доктор химических наук,
профессор Койфман Оскар Иосифович
доктор химических наук, профессор
Пономарев Гелий Васильевич
доктор химических наук, профессор
Томилова Лариса Годвиговна
Ведущая организация: Учреждение Российской академии наук
Институт химии растворов РАН
Защита диссертации состоится «22» ноября 2010 г. в 15.00 час на заседании Диссертационного совета Д 212.120.01 при Московской государственной академии тонкой химической технологии им. М.В. Ломоносова (МИТХТ) по адресу: 119571 Москва, пр. Вернадского, 86.
С диссертацией можно ознакомиться в библиотеке МИТХТ им. М.В.Ломоносова по адресу 119571, Москва, пр. Вернадского, 86.
С авторефератом диссертации можно ознакомиться на сайте ВАК РФ:
v.ru
Автореферат разослан «_____»_________2010 г.
Ученый секретарь Диссертационного Cовета
кандидат химических наук,
старший научный сотрудник Лютик А.И.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Проблема борьбы со злокачественными новообразованиями остается одной из приоритетных для современного общества. Согласно официальным данным ежегодно в России каждый час злокачественные опухоли поражают 57 человек. В связи с этим разработка новых подходов к лечению онкологических заболеваний чрезвычайно актуальна.
Основными методами лечения в онкологии являются хирургическое вмешательство, лучевая терапия и химиотерапия. Однако в последнее десятилетие все большее распространение получают новые методы, среди которых следует отметить фотодинамическую терапию (ФДТ) и борнейтронозахватную терапию (БНЗТ) рака, которые являются примерами бинарной терапии, когда два раздельно введенных нетоксичных агента (фотосенсибилизатор или соединение бора, с одной стороны, и лазерное излучение или поток тепловых нейтронов, с другой стороны) при встрече в клетке-мишени генерируют цитотоксические вещества, приводящие к разрушению жизненно важных структур раковых клеток и их гибели.
В настоящее время применяются в клинике или находятся на разных стадиях клинических испытаний фотосенсибилизаторы (ФС) различных классов (порфирины и их металлокомплексы, хлорины, бензопорфирины, фталоцианины и др.). Среди них особый интерес представляют природные хлорофиллы и их производные с интенсивным поглощением в красной и ближней ИК-области спектра, поскольку их терапевтическое окно поглощения (660 - 800 нм) открывает новые возможности для диагностики и лечения злокачественных новообразований. Свет с подобной длиной волны проникает в ткань на глубину до 20 мм, что позволяет проводить лечение глубокозалегающих и пигментированных опухолей.
Выбор природных пигментов для создания новых ФС обусловлен рядом причин, включая их распространенность в природе, интенсивное поглощение в длинноволновой области спектра, возможность химической модификации боковых заместителей, структурную близость к эндогенным порфиринам, что предполагает низкий уровень токсичности подобных соединений и быстрое выведение из организма.
Однако сами хлорины и бактериохлорины имеют ограниченное применение в качестве ФС из-за высокой гидрофобности, низкой химической и фотостабильности, умеренной селективности накопления в раковых клетках. Это диктует необходимость создания устойчивых производных хлоринов и бактериохлоринов с улучшенными спектральными характеристиками, повышенной гидрофильностью для растворимости в полярных растворителях и воде, обладающих значительной тропностью к опухолям.
Представленная работа посвящена решению этих задач и является дальнейшим развитием основополагающих научных исследований, проведенных ранее в МИТХТ им. М.В. Ломоносова на кафедре химии и технологии тонких органических соединений в области химии порфиринов и родственных соединений, и выполнена по теме фундаментальных научных исследований № 1Б-4-355 «Разработка химических и биотехнологических методов модификации биологически активных соединений с целью моделирования жизненно важных процессов в природе».
Работа выполнялась при поддержке Российского фонда фундаментальных исследований (гранты РФФИ № 04-03-33064, 06-03-32459, 07-03-00452, 09-03-00701, 09-03-12203-офи-м), аналитической ведомственной целевой программы (проект 2.1.1/2889) «Развитие научного потенциала высшей школы (2009-2010 годы) и гранта INTAS № 01-0461.
Целью работы является разработка методов направленной химической модификации хлорофилла а (Хл а) и бактериохлорофилла а (Бхл а) с целью улучшения их фотофизических характеристик, синтеза конъюгатов с другими классами соединений и получения ФС с интенсивным поглощением в ближнем ИК-диапазоне для бинарных методов терапии в онкологии.
Поставленная проблема имеет комплексный характер, что потребовало решения следующих экспериментальных задач:
- Разработка способов получения производных Хл а и Бхл а с дополнительными кислород- и азотсодержащими шестичленными циклами.
- Направленная модификация заместителей в пиррольных кольцах A и С природных хлорофиллов.
- Разработка методов синтеза амфифильных ФС на основе природных хлоринов и бактериохлоринов, включая положительно заряженные, а также нейтральные гидрофильные производные.
- Создание конъюгатов хлоринов и бактериохлоринов с полиэдрическими соединениями бора для эффективной доставки атомов бора в опухоль с целью использования в БНЗТ и комбинированной (БНЗТ-ФДТ) рака.
- Разработка способов синтеза конъюгатов природных хлоринов с углеводами для рецептор-опосредованного эндоцитоза ФС в опухоль.
- Проведение необходимых фотофизических и биологических испытаний и выбор наиболее перспективных ФС для ФДТ и БНЗТ рака.
Научная новизна. Разработана новая стратегия функционализации природных хлоринов, позволяющая получать высокореакционноспособные производные Хл а и Бхл а для их последующей химической модификации.
Осуществлен синтез новых N-аминоциклоимидов в ряду Хл а. Впервые получены N-гидрокси- и N-аминоциклоимиды в ряду Бхл а и показана возможность их дальнейшей модификации.
Предложены новые методы химической модификации пиррола А в бактериохлориновом макроцикле, позволяющие получать амфифильные производные с гидроксилсодержащими заместителями, а также показана перспективность этих соединений в качестве эффективных ФС для ФДТ рака.
Впервые получены катионные ФС в ряду Бхл а и показана их антимикробная фотодинамическая активность.
Разработаны методы синтеза конъюгатов природных хлоринов с молекулами других классов, базирующиеся на современных реакциях органической химии, включая “click chemistry” (Cu-катализируемое 1,3-диполярное циклоприсоединение терминальных алкинов с азидами), палладий-катализируемые реакции (реакция Соногаширы), реакции кросс-сочетания (метатезис олефинов) и др.
Впервые получены борсодержащие конъюгаты и гликоконъюгаты в ряду Бхл а.
Практическая значимость. Разработаны универсальные подходы к созданию новых высокоэффективных фотосенсибилизаторов на основе природных пигментов.
Предложен новый способ получения гидразидов в ряду Бхл а, обладающих высокой фотодинамической активностью.
Проведен биологический скрининг различных производных в ряду Хл а и Бхл а и отобраны наиболее перспективные соединения для проведения предклинических испытаний на экспериментальных животных с глубокозалегающими и пигментированными опухолями, трудно поддающимися лечению с использованием ныне существующих ФС.
Разработан новый высокоэффективный инфракрасный ФС на основе N-алкоксибактериопурпуринимида для ФДТ меланомы и создана его наноструктурированная инъекционная форма.
Получены водорастворимые производные хлоринов и бактериохлоринов, которые используются в практической работе биологов, связанной с изучением направленного внутриклеточного транспорта фотосенсибилизаторов.
Разработан эффективный способ доставки борных полиэдров в опухоль путем связывания с хлоринами и бактериохлоринами. Высокое накопление борсодержащих конъюгатов как в раковых клетках, так и в опухолях у экспериментальных животных делает этот способ перспективным для БНЗТ рака.
Получен модификационный ряд гликоконъюгатов на основе природных хлоринов и показана перспективность использования некоторых из них в ФДТ рака.
Основные положения, выносимые на защиту:
- Методы синтеза и свойства циклических имидов и их производных в ряду
хлоринов и бактериохлоринов.
- Способ получения амфифильных бактериохлоринов с гидроксилсодержащими
заместителями в пирроле А.
3. Синтез катионных ФС в ряду бактериохлорофилла а и их эффективность в антимикробной ФДТ.
4. Методы получения биоконъюгатов на основе природных хлоринов.
5. Синтез конъюгатов хлоринов и бактериохлоринов с борными кластерами для БНЗТ
рака.
6. Методы синтеза гликоконъюгатов на основе природных хлоринов.
Личный вклад автора. Автору принадлежит решающая роль на всех этапах исследования – от постановки задачи, планирования и проведения ключевых экспериментов до обсуждения и литературного оформления полученных результатов.
Апробация работы. Результаты работы были представлены и обсуждены на:
VIII Международной конференции «Spectroscopy and chemistry of porphyrins and their analogs» (Минск, Беларусь, 1998), III Международном симпозиуме «Новые и нетрадиционные растения и перспективы их использования» (Пущино, 1999), Школе-конференции «Горизонты физико-химической биологии». (Пущино, 2000), III и IV Съездах фотобиологов России (Воронеж, 2001; Саратов, 2005), III Съезде биохимического общества (Санкт-Петербург, 2002), VIII Международной научной конференции «High-tech in Chemical Engineering 2002» (Уфа, 2002), IX Международной конференции по химии порфиринов и их аналогов (Суздаль, 2003), Международных конференциях по порфиринам и фталоцианинам (ICPP-3, США, 2004; ICPP-4, Италия, 2006; ICPP-5, Россия, 2008), XVIII Менделеевском съезде по общей и прикладной химии (Москва, 2007), Седьмой школе-конференции молодых ученых стран СНГ по химии порфиринов и родственных соединений (Одесса, 2007), ежегодных научно-практических конференциях «Отечественные противоопухолевые препараты» (2007-2010), 13-ом Международном конгрессе по нейтронозахватной терапии (Флоренция, Италия, 2008), Десятой международной конференции по физической и координационной химии порфиринов и их аналогов (Иваново, 2009), VIII Школе-конференции молодых ученых стран СНГ по химии порфиринов и родственных соединений (Гагры, Абхазия, 2009).
Публикации. Материалы диссертации опубликованы в монографии [23], 2-х обзорах [19, 20], 1 патенте, 24 статьях в отечественных и зарубежных журналах, более чем в 20-ти тезисах докладов на российских и международных конференциях.
Объем диссертации. Диссертация состоит из введения, литературного обзора, обсуждения результатов, экспериментальной части, выводов и списка литературы.
Работа изложена на_______стр., содержит______рисунков,______схем, ________таблиц.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Гидрированные аналоги порфиринов – хлорины и бактериохлорины – играют важную роль в природе, в том числе участвуют в фотосинтезе и родственных ему процессах. Большой интерес к этим соединениям обусловлен широким спектром полезных свойств их направленно модифицированных производных. Уникальная способность хлорофиллов избирательно накапливаться в опухолевых тканях и вызывать под действием лазерного облучения определенной длины флуоресценцию либо фотодинамический эффект, успешно используется в флуоресцентной диагностике (ФД) и ФДТ злокачественных новообразований.
Используя Хл а и Бхл а в качестве исходных соединений, в настоящей работе были выполнены исследования, целью которых явилось:
- получение устойчивых индивидуальных производных пигментов со спектральными характеристиками, не уступающими исходным хлорофиллам, а в ряде случаев и превосходящими их;
- снижение гидрофобности и придание амфифильных свойств молекулам пигментов с целью улучшения растворимости в полярных растворителях и воде;
- введение в макроцикл функциональных групп для присоединения других биоактивных молекул с целью повышения тропности к раковым клеткам и направленного внутриклеточного транспорта.
Выполненная работа строилась путем проведения исследований по следующим основным направлениям:
- синтез и изучение свойств циклических имидов хлорина и бактериохлорина и создание на их основе новых перспективных ФС;
- синтез и изучение свойств конъюгатов природных хлоринов с борными полиэдрами;
- разработка новых подходов к синтезу гликоконъюгатов в ряду Хл а и Бхл а.
1. Синтез и изучение свойств циклических имидов в ряду хлорофилла а и бактериохлорофилла а и создание на их основе новых высокоэффективных ФС
Создание высокоэффективных ФС на основе природных пигментов – комплексная проблема, включающая разработку методов синтеза стабильных производных Хл а и Бхл а с улучшенными спектральными и фотофизическими характеристиками, конструирование новых амфифильных молекул с оптимальным соотношением гидрофобных и гидрофильных заместителей, а также повышение эффективности и избирательности фотодинамического действия сенсибилизаторов. Структура молекул Хл а и Бхл а открывает широкие возможности для их направленной функционализации (Схема 1).

Схема 1. Возможные химические модификации хлорофилла а и бактериохлорофилла а.
Присоединение к основному макроциклу шестичленного ангидридного цикла приводит к повышению общей устойчивости системы. Следует отметить, что впервые пурпурин 18 был синтезирован Г. Фишером (Fischer H. et al., Die Chemie des Pyrrols, 1940), затем рядом других исследователей (Kenner G.V. et al., J. Chem. Soc., Perkin Trans. 1, 1973; Lee S.-J. H. et al., J. Chem. Soc., Perkin Trans.1, 1993); на нашей кафедре методика его получения была существенно улучшена (Миронов А.Ф. и др., Патент РФ № 2 054944, 1996). Что касается бактериопурпурина (БП), то его синтез осуществлен на кафедре впервые (Mironov A.F. et al., Proc. SPIE, 1992).
Для получения пурпуринов хлорофиллы экстрагируют из биомассы и затем без выделения и дополнительной очистки окисляют в щелочной среде кислородом воздуха. Последующая обработка соляной кислотой приводит к образованию ангидридного цикла и получению пурпурина 18 и бактериопурпурина (Схема 2).

Схема 2. Хлорофилл а и бактериохлорофилл а и их производные.
Введение экзоцикла приводит к батохромному сдвигу полосы Qy для пурпурина 18 до 700 нм и для БП до 818 нм. Однако, ангидридный цикл устойчив лишь в нейтральной и кислой средах, а в присутствии оснований происходит его быстрое раскрытие с образованием хлорина р6 и бактериохлорина р, поглощающих при 670 и 770 нм, соответственно. Это обстоятельство потребовало превращения ангидрида в более стабильное производное.
К началу наших исследований были известны методы замены атома кислорода в экзоциклах пурпурина 18 и бактериопурпурина на азот при взаимодействии с алкиламинами (Pandey, R.K. et al., Bioorg. Med. Chem. Lett., 1994; Kozyrev, A.N. et al., Tetrahedron Lett., 1996). Полученные таким способом циклоимиды, однако, не могли быть использованы для синтеза других N-замещенных циклических имидов.
Принципиально новые возможности были обнаружены при замене в этой реакции алкиламинов на бифункциональные агенты – гидразингидрат и гидроксиламин. Во-первых, использование сильных нуклеофильных реагентов значительно упростило получение циклоимидов. Во-вторых, наличие в синтезированных циклоимидах амино- или гидроксильной групп при атоме азота позволило на основе лишь одного соединения получать модификационные ряды пурпурин- и бактериопурпуринимидов, что значительно упростило поиск новых наиболее эффективных ФС.
Первоначально реакция с одним из реагентов – гидроксиламином – была выполнена в ряду Хл а с образованием N-гидроксипурпуринимида на кафедре ХТБАС (Mironov A.F., Lebedeva V.S. Tetrahedron Lett., 1998).
В настоящей работе предпринято систематическое изучение взаимодействия производных Бхл а с гидроксиламином, а также Хл а и Бхл а с гидразингидратом.
мино- или гидроксильной групп пых циклоимидах
1.1. Новые N-аминопурпуринимиды в ряду хлорофилла а
Превращение ангидридного цикла пурпурина 18 1 в N-аминоимидный цикл включает две основные стадии (Cхема 3). На первом этапе происходит раскрытие экзоцикла и образование смеси моногидразидов 2а и 2б, сопровождающееся гипсохромным смещением полосы Qy в область 670 нм. Добавление в реакционную смесь соляной кислоты приводит к внутримолекулярной циклизации с образованием N-аминоциклоимида 3. Структура его метилового эфира 4 подтверждена спектром 1Н ЯМР, в котором имеется сигнал двух протонов экзоциклической аминогруппы в виде несколько уширенного синглета при 5.7 м.д.
Аминогруппа легко алкилируется и ацилируется. Так, при обработке циклоимида 4 метилиодидом или тозилхлоридом были получены N,N-диметиламино 5 и N-тозильное 6 производные, соответственно. Принципиальная возможность использования первичной аминогруппы в циклоимиде 4 для присоединения биомолекул, несущих формильную функцию, была показана на примере конденсации последнего с п-нитробензальдегидом с образованием основания Шиффа 7.
В ходе превращения пурпурина 18 1 в циклоимид 3 была обнаружена возможность восстановления винильной группы в пирроле А под действием гидразина. Кинетика восстановления прослеживалась с помощью 1Н ЯМР и электронных спектров, в то время как заметных различий в хроматографической подвижности получаемых продуктов не наблюдалось. Через 48 часов основным продуктом реакции являлся 3-этил-3-девинил-N-аминопурпуринимид 3 с гипсохромным смещением основной полосы поглощения с 715 до 703 нм.

Схема 3. Синтез N-аминопурпуринимида и его химические модификации.
Описанное восстановление винильной группы с помощью гидразингидрата является новым подходом к получению мезохлорина, наряду с традиционно используемым каталитическим гидрированием винильной группы.
1.2. N-Аминоциклоимиды в ряду бактериохлорофилла а
Изучение взаимодействия БП с гидразингидратом (Схема 4) показало, что, как и в случае с пурпурином 18, на первом этапе очень быстро происходит раскрытие ангидридного цикла и образование моногидразидов 9а и 9б, при этом ацетильная группа превращается в гидразон. Предположение о возможном образовании гидразона в ходе реакции и последующем его гидролизе в кислой среде было подтверждено реакцией бактериохлорина р 11 с гидразином. Продукт 12 выделяли без добавления кислоты. Масс-спектр последнего подтвердил образование гидразона, который в присутствии соляной кислоты легко гидролизуется в исходный бактериохлорин р 11.
В дальнейшем, появившаяся в электронном спектре полоса при 750 нм смещается до 836 нм, что свидетельствует о самопроизвольной циклизации моногидразидов. Этот процесс значительно ускоряется при подкислении реакционной массы соляной кислотой.

Схема 4. Реакция бактериопурпурина с гидразингидратом.
В отличие от аналогичной реакции с пурпурином 18, где мы имели возможность сравнивать собственные результаты с литературными данными по взаимодействию последнего с алкиламинами и гидроксиламином, в случае бактериопурпурина можно было ожидать образование двух изомерных циклоимидов 10а и 10б.
Доказательство структуры проводилось с помощью химических модификаций и ЯМР-спектроскопии. Обработка полученного продукта метилиодидом согласно масс-спектру высокого разрешения давала N,N-диметилпроизводное 13 (Схема 5), в 1Н ЯМР спектре которого присутствуют два синглета, соответствующие метильным группам при 3.36 и 3.37 м.д. Появление этих сигналов позволило использовать двумерный гетероядерный резонанс для доказательства размеров образовавшегося цикла. Отсутствие в спектре гетероядерной корреляции через множественные связи (HMBC) кросс-пиков между протонами N-метильных групп Н-135 и карбонильными атомами углерода С-131 свидетельствует в пользу структуры 13а. В изомере 13б эти атомы, разделенные только четырьмя связями, должны взаимодействовать между собой и в спектре HMBC давать соответствующие кросс-пики.
Усреднение сигналов шести протонов метильных групп при нагревании образца 13 до 500С является еще одним доказательством в пользу структуры 13а. О наличии свободной аминогруппы также свидетельствует образование основания Шиффа при взаимодействии 13 с п-нитробензальдегидом и ацилирование ее тозилхлоридом с получением соответствующего тозилата.
Способ получения N-аминоциклоимидов в ряду бактериохлорофилла а защищен патентом РФ (Миронов А.Ф., Грин М.А., Ципровский А.Г. и др. Патент РФ № 2223274 от 10.02.2004).
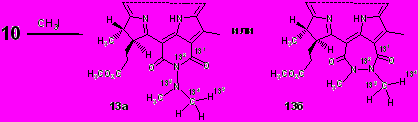
Схема 5. Возможные структуры N,N-диметилпроизводного бактериопурпуринимида 13.
