Синтез модифицированных природных хлорофиллов и изучение их свойств для бинарных методов терапии в онкологии 02. 00. 10 Биоорганическая химия
| Вид материала | Автореферат |
- * Исследование физико-химических и сорбционных свойств синтезированных сорбентов, 26.1kb.
- Учебная программа курса по выбору по дисциплине «Биоорганическая химия» Специальность:, 174.53kb.
- Синтез и изучение химических свойств адамантилзамещенных эфиров кето- и дикетокарбоновых, 394.66kb.
- Методы модификации полимерных материалов углеродными наноструктурами, 35.19kb.
- Программа спецкурса «методы расчета физико-химических свойств веществ» для студентов, 40.47kb.
- Тематический план лабораторных занятий по дисциплине «общая химия, биоорганическая, 46.73kb.
- Учебно-методическая карта дисциплины, 62.2kb.
- Синтез и свойства биологически активных соединений, содержащих no-донорный фрагмент, 577.21kb.
- Программа «аналитическая химия» по направлению подготовки 020100 «Химия», 31.74kb.
- Изучение свойств нервной системы учащихся, 286.83kb.
1.3. Катионные бактериопурпуринимиды и их свойства
Известно, что тетрапирролы, несущие одну или несколько положительно заряженных группировок, обладают антимикробной активностью при использовании в ФДТ. Это связано с инактивацией вирусов, бактерий, дрожжевых грибов и простейших активными формами кислорода, которые генерируются фотосенсибилизаторами при освещении. Данный метод значительно отстает по уровню фундаментальной разработки и практическому использованию от ФДТ рака, поэтому актуальны исследования в области.
N-Аминоциклоимид бактериохлорина р 10 явился ключевым соединением в синтезе серии производных бактериохлорофилла а, имеющих в своей структуре катионные фрагменты. Первоначально планировалось использовать для этих целей N,N-диметиламинопроизводное 13. Однако обработка его избытком иодистого метила или диметилсульфата не приводила к кватернизации атома азота.
Более успешным оказался иной подход, основанный на ацилировании N-аминопроизводного 10 хлорангидридом изоникотиновой кислоты с последующей кватернизацией атома азота в пиридиновом кольце соединения 14 иодистым метилом с образованием соли 15 (Схема 6).
В 1Н ЯМР спектре циклоимида 14 наблюдалось удвоение сигналов всех протонов. Этот факт можно объяснить наличием изомеров с очень близкой хроматографической подвижностью, исключающей возможность их препаративного разделения. Существование изомерных форм связано, по-видимому, как с кето-енольной таутомерией, так и наличием стереоизомерии, обусловленной отсутствием свободного вращения вокруг связи C(O)-N.

Схема 6. Синтез катионного бактериопурпуринимида.
Для выяснения этого предположения циклоимид 14 был обработан диазометаном (Схема 7), что привело к получению двух новых соединений с одинаковыми молекулярными массами и разной хроматографической подвижностью. Более подвижному изомеру была приписана структура N-метилгидразида 16, а второму изомеру – O-метилимидата 17. Структура изомера 16 была подтверждена встречным синтезом, который включал монометилирование N-аминобактериопурпуринимида 10 стехиометрическим количеством иодистого метила и последующее ацилирование монометильного производного 18 хлорангидридом изоникотиновой кислоты. Полученное соединение по молекулярной массе и хроматографической подвижности оказалось идентичным с быстродвижущимся изомером 16.
В спектрах 1Н ЯМР последнего сохраняется удвоение сигналов, подобное тому, что наблюдается для исходного циклоимида 14. Данное явление, по-видимому, связано с отсутствием свободного вращения вокруг связи C(O)-N. Съемка спектров 1Н ЯМР соединений 14 и 16 при 500 приводит к слиянию сигналов, что соответствует преодолению энергетического барьера вращения для таких изомеров. В то же время, в спектре 1Н ЯМР O-метилимидата 17 подобное удвоение сигналов отсутствует, что объясняется наличием одного Z- или E- изомера.
Катионный ФС 15 является значительно более гидрофильным соединением по сравнению с исходными бактерипурпуринимидами 10 и 14, в связи с чем для него характерна лучшая растворимость в водно-спиртовых растворах, что делает его удобным для биологических испытаний и перспективным для последующего медицинского применения.

Схема 7. Доказательство структуры изомеров 14 и 14а.
Антимикробная активность циклоимида 15 и его синтетического предшественника 14 тестировалась по методу фотоиндуцированного подавления биолюминесценции генно-инженерного штамма светящихся грамотрицательных бактерий.1 В отличие от циклоимида 14, не имеющего в структуре заряженных групп, ФС 15 вызывал фотоиндуцированное подавление биолюминесценции штамма бактерий, степень которого увеличивалась с ростом концентрации фотосенсибилизатора и дозы облучения (Рис. 1).
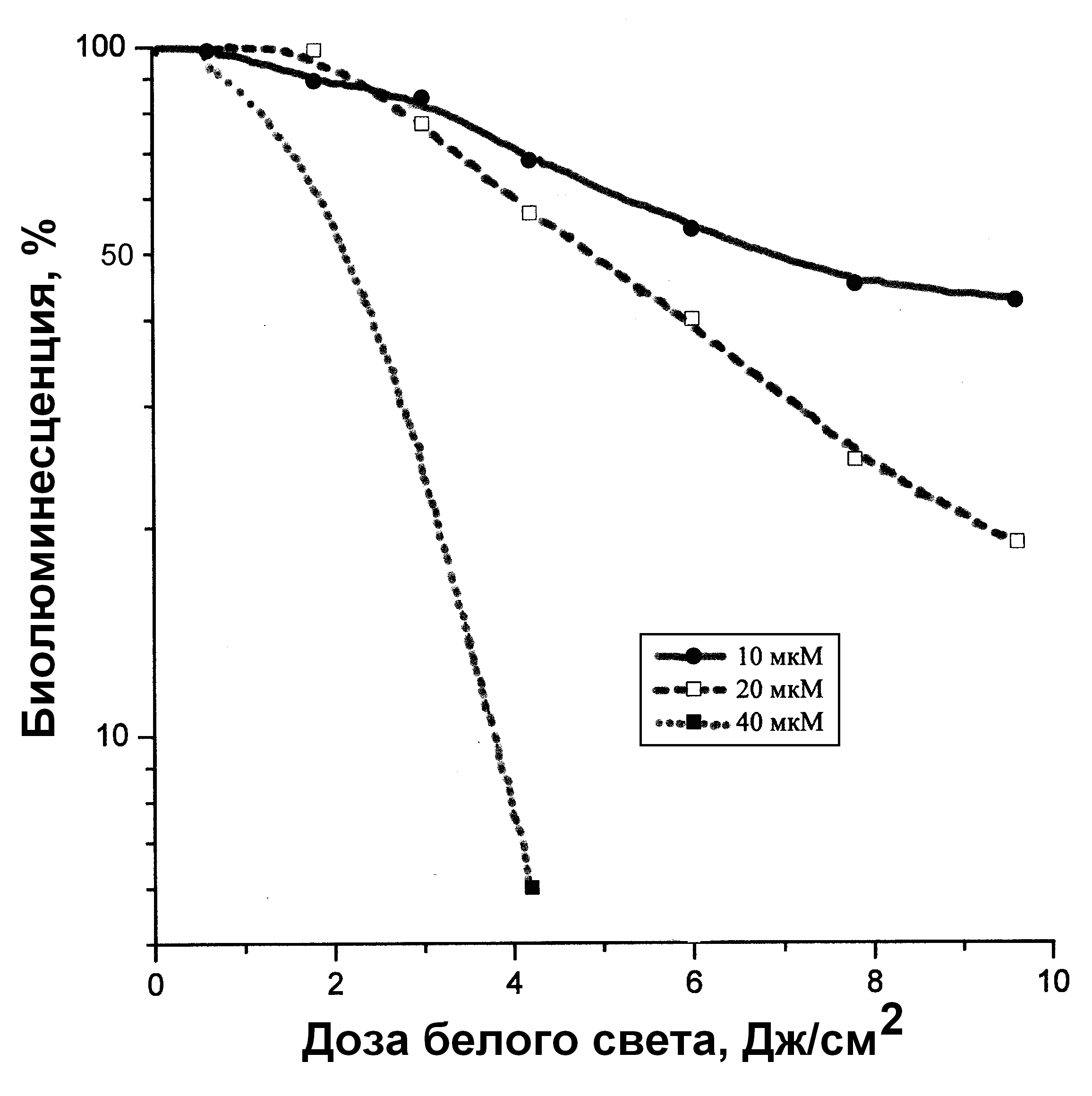
Рис. 1. Дозовые кривые подавления биолюминесценции биосенсора, проинкубированного 10 мин с различными концентрациями циклоимида 15.
__________________________________
1Работа по определению антимикробной и антифунгицидной активности проведена на биологическом факультете МГУ им. М.В. Ломоносова с.н.с. Страховской М.Г.
Следует отметить, что сам по себе белый свет не оказывал влияния на интенсивность бактериальной биолюминесценции. С другой стороны, в отсутствие облучения ФС 15 не вызывал заметного подавления интенсивности биолюминесценции.
Изучение антифунгицидной активности показало, что катионный фотосенсибилизатор 15 обладает не только антибактериальной активностью, но и проявляет высокую эффективность в инактивации дрожжей рода Candida guilliermondii. Учитывая тот факт, что длинноволновый максимум поглощения циклоимида 15 находится при 830 нм, такого рода ФС в сочетании с соответствующим лазерным источником излучения может быть использован для фотосенсибилизации плотных культур микроорганизмов.
Для оценки влияния структурных особенностей гетероциклических фрагментов, вводимых в молекулу ФС, на химическую активность и изомерию последних, нами в качестве ацилирующих агентов были использованы хлорангидриды 6-метилпиколиновой и 6-метилникотиновой кислот (Схема 8).

Схема 8. Синтез и кватернизация циклоимидов с остатками пиридин- и хинолинкарбоновых кислот.
Оказалось, что кватернизация циклоимида 21, имеющего остаток 6-метилпиколиновой кислоты, с помощью иодистого метила невозможна, по-видимому, из-за отсутствия свободного доступа атакующей метильной группы к атому азота гетероцикла.
Удаление атома азота от карбоксильной группы в остатке 6-метилникотиновой кислоты 19 способствует успешному протеканию реакции кватернизации с образованием четвертичной соли 20. Подобное различие в химической активности также наблюдалось и для циклоимидов с остатками хинолинкарбоновых кислот (Схема 8). Конденсация N-аминоциклоимида 10 с хлорангидридами 2- и 6-хинолинкарбоновых кислот давала циклоимиды 22 и 24, из которых только соединение 22 превращалось в четвертичную соль 23. Мы не исключаем возможности образования внутримолекулярной водородной связи между атомом азота гетероцикла и амидным водородом в соединениях 21 и 24, что приводит к образованию пятичленного цикла и препятствует кватернизации.
1.4. Борсодержащие конъюгаты на основе
N-аминобактериопурпуринимида
Присоединение борных полиэдров к производным природных хлорофиллов обеспечивает направленную доставку атомов бора в опухоль, что используется при создании препаратов для борнейтронозахватной терапии (БНЗТ) рака.
Нами разработан новый метод синтеза борсодержащих конъюгатов в ряду бактериохлорофилла а с использованием в качестве ключевого соединения N-аминобактериопурпуринимида 10 (Схема 9).
Наличие экзоциклической аминогруппы в нем позволило разработать два пути синтеза, один из которых включал создание CO-NH связи между макроциклом и борными кластерами, а другой заключался в получении конъюгатов путем взаимодействия циклоимида 10 с оксониевым производным металлокарборана (Схема 9).2
Первый подход был реализован за счет взаимодействия циклоимида 10 с карборанилкарбоновыми кислотами, используя различные методы активации карбоксильной группы. Конъюгат 27 получали, действуя на исходный N-аминобактериопурпуринимид 10 хлорангидридом додекаборатсодержащей карбоновой кислоты 25 в присутствии триэтиламина, в то время как конъюгат 28 был получен в результате взаимодействия того же циклоимида 10 с кислотой 26, активированной дициклогексилкарбодиимидом.
_______________________________
2Производные бис(дикарболлид)кобальта и клозо-додекаборат анионов получены в лаборатории д.х.н., проф. Брегадзе В.И., ИНЭОС РАН.

Схема 9. Синтез конъюгатов N-аминобактериопурпуринимида с борными полиэдрами.
Однако, такой способ синтеза борсодержащих конъюгатов позволил получить целевые продукты с выходами, не превышающими 20%. Более эффективным оказался подход, включающий нуклеофильное раскрытие цикла в оксониевом производном бис(дикарболлид)кобальта 29 в присутствии DIPEA. Конъюгат 30, содержащий два борных полиэдра, был получен с выходом 64%. Он имеет поглощение при 830 нм и может рассматриваться как перспективный ФС для комбинированной ФДТ-БНЗТ рака.
1.5. N-Гидроксициклоимиды в ряду бактериохлорофилла а
1.5.1. Синтез и свойства N-гидрокси- и
N-алкоксибактериопурпуринимидов
Принципиально новые возможности для получения циклоимидов и их последующих химических превращений открылись при использовании гидроксиламина.
В случае БП можно было ожидать, что появление нового реакционного центра (ацетильная группа вместо винильного заместителя в пурпурине 18) несколько осложнит синтез. При обработке БП 8 гидроксиламином в пиридине первоначально образуется оксим 31, и лишь при использовании избытка реагента вторая молекула гидроксиламина вступает в реакцию с ангидридным циклом, давая оксим N-гидроксибактериопурпуринимида 36 (Схема 10).

Схема 10. Взаимодействие бактериопурпурина с гидроксиламином и алкоксиаминами.
Наличие в последнем подвижного атома водорода позволяет существенно расширить круг циклоимидов за счет реакций ацилирования и алкилирования. Наиболее интересным оказалось O-метильное производное 41, которое образуется с высоким выходом при действии диазометана на циклоимид 36.
В ходе исследования было обнаружено два интересных факта. Кислотность атома водорода в оксимной функции настолько понижена, что последняя не участвует в реакции с диазометаном. Кроме того, тщательный анализ (ТСХ, масс-спектры) N-метоксипроизводного 41 показал, что вещество является смесью двух изомеров с очень близкими значениями Rf. Выделенные изомеры были охарактеризованы спектрами 1Н ЯМР, включая спектроскопию 1D NOE, и на основании полученных данных сделан вывод о существовании соединения в двух стереоизомерных формах (син- и анти-).
Соединение 41 имело хорошие фотофизические свойства. Так, квантовый выход синглетного кислорода (в 1% эмульсии Кремофора в воде) оказался достаточно высоким (φ∆=0.57) и, как следствие этого, пигмент имеет значительную фотоиндуцированную цитотоксичность на линии клеток А549 (IC50=0.97мкМ).3
Однако при изучении фармакокинетики данного соединения обнаружился ряд свойств, ограничивающих возможность его дальнейшего использования. Так, вещество имеет низкий индекс селективности (1.2 – 1.6), а динамика изменения концентрации ФС в опухоли, включая короткий период накопления (20-80 мин) и быстрое выведение, не дает возможности проведения эффективного сеанса ФДТ.
Для повышения общей гидрофобности молекулы были получены циклоимиды 42-45, содержащие алкоксильные группы как в экзоцикле, так и в пирроле А.
На биологическую активность ФС существенное влияние оказывает не только общая липофильность молекулы, но и расположение функциональных групп в макроцикле.
В связи с этим нами была разработана схема региоселективного синтеза производных бактериопурпуринимида, содержащих гидроксильную и алкоксильные группы в пиррольном кольце А и экзоцикле (Схема 11).
Предложенный подход позволил получить ряд региоизомеров 57-64 с алкильными заместителями разной длины с целью проведения скрининговых биологических испытаний и поиска наиболее эффективного ФС.
Изучение фотодинамической активности полученных циклоимидов проводилось in vitro на линии клеток A549 аденокарциномы легкого человека и in vivo на мышах F1 с опухолью
Эрлиха (ELD) и мышах BDF1 с меланомой B16.
____________________________
3Эксперименты in vitro проведены в Московском научно-исследовательском онкологическом институте им. П.А. Герцена в лаборатории д.б.н., проф. Якубовской Р.И.

Схема 11. Синтез алкоксипроизводных бактериопурпуринимида.
В экспериментах на клетках оценивалась фотоиндуцированная цитотоксичность соединений, тогда как на животных изучались три основных параметра биологической эффективности, включая коэффициент накопления активного вещества в опухоли (индекс
селективности), торможение роста опухоли (ТРО) и увеличение продолжительности жизни (УПЖ) животных.
По этим параметрам среди всех исследованных соединений наиболее эффективным оказался циклоимид 43, для которого в дальнейшем были созданы наноструктурные инъекционные формы.
1.5.2. Метиловый эфир O-этилоксима N-этоксибактериопурпуринимида и
фотодинамическая терапия с его использованием
Циклоимид 43 имеет высокую фотоцитотоксичность (IC50=0.26 мкМ), которая коррелирует со значительным ингибирующим эффектом препарата на опухоль. Экспериментальная ФДТ мышиной меланомы B16T с использованием соединения 43 в форме мицеллярной дисперсии на основе Кремофора EL показала эффективное фотоиндуцированное воздействие вещества на опухоль, что привело к торможению роста опухоли с индексом ТРО, достигающим 91%, а величина УПЖ составила 61,3%.*
Изучение фотоиндуцированной активности ФС 43 при лечении человеческой меланомы Mel7, которая была подкожно перевита бестимусным мышам и характеризуется чрезвычайно высокой агрессивностью и резистентностью к известным химиотерапевтическим препаратам, показало также высокую эффективность воздействия на опухоль с индексом ТРО около 96%. Хорошая фармакокинетика циклоимида 43, включающая максимальное накопление препарата в опухоли в течение 5 часов после введения с индексом селективности, достигающим 11, и высокая фотодинамическая активность делают это соединение весьма перспективным для дальнейшего изучения в качестве высокоэффективного ФС для ФДТ глубокозалегающих и пигментированных опухолей.
1.5.3. Разработка наноструктурированных инъекционных форм метилового эфира O-этилоксима N-этоксибактериопурпуринимида
Учитывая гидрофобный характер исследуемого соединения 43, для биологических испытаний in vivo были созданы наноструктурированные (липосомальные и мицеллярные) инъекционные формы препарата.
Кроме мицеллярной дисперсии на основе Кремофора была получена дисперсия на основе Эмуксола-268 и липосомальная инъекционная форма, состоящая из липосом с диаметром около 100 нм на основе фосфатидилхолина, холестерина, фосфатидилэтаноламина и ПЭГа 2000. Выполнены сравнительные биологические испытания трех лекарственных форм препарата и показано, что наилучшей фармакокинетикой и фотоиндуцированной активностью обладает липосомальная форма. Так, величина ТРО для ФС 43, заключенного в липосомы, превысила этот параметр для мицеллярных дисперсий и составила 81 % (Рис.2).
Таким образом, наноструктурирование является существенным фактором, обеспечивающим высокую селективность накопления ФС в опухоли за счет эффективной диффузии наночастиц через дефектный эндотелиальный слой сосудов новообразований.
__________________________
* Значения ТРО и УПЖ получены при дозах ФС 0.5-1 мг/кг массы тела животных, облучение лазером с длиной волны 797 нм через 1 час после введения препарата, плотность мощности 200 мВт/см2, время облучения 20 мин.
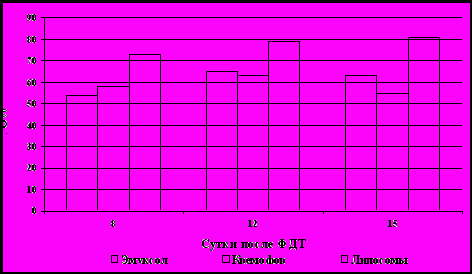
Рис. 2. Эффективность ФДТ на меланоме В16 с использованием 3-х инъекционных форм циклоимида 43.4
Способ получения метилового эфира O-этилоксима N-этоксибактериопурпуринимида и фотодинамическая терапия с его использованием явились предметом заявки на изобретение (Миронов А.Ф., Грин М.А. и др, 2009).
1.6. Бактериохлорины, модифицированные по пиррольному кольцу А
1.6.1. Синтез винильного аналога бактериопурпурина
Наличие ацетильной группы в производных Бхл а серьезно осложняет протекание реакции с гидроксиламином. Поэтому в настоящей работе предложен способ превращения ее в винильную (Схема 12).
Восстановление ацетильной группы проводилось не на БП 8, а на бактериохлорине р
65, во избежание возможного восстановления ангидридного экзоцикла в -лактонный
(Mironov A.F., Efremov A.V., Efremova O.A. et al. J. Chem. Soc., Perkin Trans 1, 1998).
Полученную из БП 8 трикислоту 65 восстанавливали боргидридом натрия в соответствующий спирт 66, имеющий максимум поглощения при 740 нм. Обработка последнего соляной кислотой в диоксане приводила лишь к замыканию ангидридного цикла и не затрагивала -гидроксиэтильной группы. Образование соединения 67 также наблюдалось при действии тозилхлорида на спирт 66, причем если реакция проводилась более 2 часов, то преимущественно получался О-тозилат.
____________________________
4Эксперименты in vivo проведены в НИИ экспериментальной диагностики и терапии опухолей ГУ РОНЦ им. Н.Н. Блохина РАМН с.н.с. Мееровичем Г.А. и с.н.с. Мееровичем И.Г.

Схема 12. Синтез и модификации 3-винил-3-деацетилбактериопурпурина 68.
Нами разработан эффективный способ дегидратации, основанный на обработке спирта 66 п-толуолсульфокислотой. При этом обнаружено, что наряду с образованием винильной группы происходит замыкание ангидридного экзоцикла в соединении 68, что приводит к возвращению основной спектральной полосы Qy в область 783 нм. Наряду с кислотой 68а получены ее метиловый 68б и этиловый 68в эфиры.
При взаимодействии соединений 68а и 68б с гидроксиламином были получены соответствующие N-гидроксициклоимиды 69а и 69б, а обработка 69а диазометаном давала метиловый эфир N-метоксициклоимида 69в, который является структурным аналогом метилового эфира N-метоксипурпуринимида (λмакс.=711нм), (Mironov A.F., Lebedeva V.S. Tetrahedron Lett., 1998) в бактериохлориновом ряду со спектральной полосой Qy, смещенной в район 810 нм.
1.6.2. Амфифильные производные бактериохлоринов
Использование гидрофобных ФС, несмотря на имеющиеся в клинической практике примеры, неудобно, так как оно трудоемко и удорожает лекарственные формы. В этой связи стоит проблема синтеза амфифильных ФС. Известно, что природные бактериохлорины отличаются высокой гидрофобностью. Для успешного их использования в ФДТ необходимо наличие более сбалансированного соотношения гидрофобных и гидрофильных заместителей в молекуле.
Для увеличения гидрофильности бактериопурпуринимидов нами был осуществлен синтез производных, которые содержат в пирроле А гидроксилсодержащие заместители, присоединенные к макроциклу за счет простой эфирной связи (Схема 13).

Схема 13. Синтез бактериопурпуринимидов с полярными заместителями в пиррольном кольце А.
Модификации проводили на N-метоксициклоимиде 70, для получения которого спирт 67 обрабатывали гидроксиламином и диазометаном. Гидроксильную группу в пирроле А активировали с помощью ангидрида трифторуксусной кислоты и полученный трифторацетат 71 конденсировали с метиловым эфиром этиленгликоля, ди- и триэтиленгликолями и глицерином, получая соединения 72-75.
Изучение фотофизических свойств бактериопурпуринимидов 72-75 показало, что характер полярного заместителя в пиррольном кольце А не оказывает существенного влияния на спектральные характеристики пигмента. Однако по сравнению с исходным бактериопурпурином 8 введение в молекулу кислородсодежащих заместителей вдвое повышает генерацию синглетного кислорода (φΔ=0.27 для БП и φΔ~ 0.55 для циклоимидов 70, 72-75).
Этот факт коррелирует с фотоиндуцированной активностью полученных соединений. В экспериментах in vitro на линиях клеток HeLa и A549 было показано, что фотоцитотоксичность соединений с кислородсодержащими заместителями в пирроле А в 20 раз выше, чем у исходного бактериопурпурина (Рис.3).
Причина столь высокой активности полученных препаратов связана с их повышенной селективностью к раковым клеткам (коэффициент селективности 8-13) и значительным
квантовым выходом генерации синглетного кислорода (0.54-0.57).5 Анализ распределения ФС в тканях показал наибольшее накопление в сосудах опухоли, приводящее к гипоксии и некрозу последней, что полностью согласуется с данными израильских исследователей по механизму действия производных Бхл а.

Рисунок 3. Фотоцитотоксичность бактериопурпуринимидов с полярными заместителями в пирроле А.
