Развитие методики совместного электронографического и масс-спектрометрического эксперимента и её применение для изучения структуры ряда молекул неорганических соединений 02. 00. 04 -физическая химия
| Вид материала | Автореферат диссертации |
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Секция 1 Аналитическая химия, 3791.21kb.
- Рабочая программа дисциплины «физическая химия», 80.79kb.
- Биосинтез 2h-меченого инозина высокого уровня дейтерированности, 263.02kb.
- Задачи урока: Образовательные: Закрепить на практике знания о классах неорганических, 211.06kb.
- Рабочая программа дисциплины «Физическая химия» Модуль «Химическая кинетика», 318.27kb.
- Программа курса химия IX класс авторы: Кучеренко Н. Я., к Х. н., доцент, 281.2kb.
- Синтез и физико-химические свойства координационных соединений рения(V) с производными, 208.83kb.
Структура молекулы гексахлорида вольфрама. Впервые структура молекулы гексахлорида вольфрама была исследована на заре метода ЭГ, в 1938 году Эвенсом и Листером. Авторы работы отмечают, что молекула WCl6 имеет предположительно структуру правильного октаэдра с расстоянием W–Cl, равным 2,26 ± 0,02 Ǻ. В конце 1980-х нами совместно с норвежской ЭГ группой были начаты исследования структуры молекул хлоридов вольфрама. Одной из причин послужили результаты, полученные для молекулы гексаметилвольфрама, где координационный полиэдр представляет собой тригональную пирамиду, а не октаэдр, как можно было бы ожидать для молекул d0 ML6, Более того, для кристаллического WCl6 были обнаружены две различные октаэдрические модификации.
При интерпретации ЭГ данных, полученных в данной работе, было обнаружено, что табулированные факторы рассеяния плохо воспроизводят экспериментальные кривые интенсивности рассеяния в так называемой «точке зануления» - точке инверсии g-функции для пары атомов W -Cl (“beatout”). Данное различие было, по крайней мере частично, исправлено путем умножения фазы рассеяния η вольфрама на константу, равную 1,0675. Определенны структурные параметры молекулы WCl6: ra(W–Cl)=2,281(3), l(W–Cl) = 0,058(3), ra(Cl…Cl) 90o = 3,223(4), l(Cl…Cl) 90o= 0,143(4), δ(Cl…Cl) 90o = 0,003(4), ra(Cl…Cl) 180o = 4,562(9), l(Cl…Cl) 180o = 0,080(10), δ(Cl…Cl) 180o = 0,001(9) Ǻ, которые свидетельствуют о прекрасном согласии ЭГ результатов с моделью молекулы WCl6 симметрии октаэдра. Эффекты сокращения и амплитуды колебаний для несвязанных расстояний очень малы, что позволяет рассматривать молекулу как довольно жесткую.
Исследование процессов сублимации пента– и тетрахлорида вольфрама На основании анализа литературных данных можно сделать вывод, что данные по испарению и диспропорционированию галогенидов вольфрама, полученные для фаз различного состава, а также разными авторами с помощью различных методов, не вполне согласуются друг с другом; противоречивы также и сведения о структуре молекул низших хлоридов вольфрама.
Для исследований использовались два типа препаратов стехиометрического соотношения «WCl4» - кристаллический и порошковый, оба полученные в лаборатории проф. Мессерле (университет Айова), но разными способами, а также кристаллический препарат WCl5. Масс-спектральные эксперименты выполнялись на приборах МИ1201 и АПДМ-1. В работе впервые получен полный масс-спектр пентахлорида вольфрама: WCl5 (393 K, 50эВ): 13,6(W+), 19,8(WCl+), 28,1(WCl2+), 32,3(WCl3+), 100(WCl4+), 10,1(WCl5+). Тетрахлорид вольфрама. На приборе МИ1201 получены масс-спектры паров над кристаллическим WCl4, и на основании кривых эффективности ионизации (КЭИ), (рис. 6) найдены потенциалы появления ионов, на основании чего было установлено, что в паре сосуществуют молекулы WCl5, WCl4, W2Cl6, а также в небольших количествах, <1%, W3Cl9. Следует отметить также, что заметной разницы в поведении двух типов препаратов тетрахлорида вольфрама не обнаружено. Сублимация препарата сопровождается диспропорционированием образца, приводящим к постепенному накоплению в твердой фазе низших хлоридов, а затем и образованию металлического вольфрама. На рис. 7 приведена временнáя зависимость ионных токов в масс-спектре паров над WCl4 на последних стадиях сублимации препарата, свидетельствующая о диcпропорционировании образца, из которой следует, что происходит обогащение газовой фазы тетрахлоридом и димером W2Cl6.
Масс-спектр чистого WCl4 был выделен из масс-спектра смеси тетра- и пентахлорида вольфрама (с небольшим содержанием димера)путем вычитания масс-спектра WCl5 из ионных токов общего масс-спектра: 19 (W+), 25(WCl+), 33 (WCl2+), 100 (WCl3+), 21 (WCl4+).
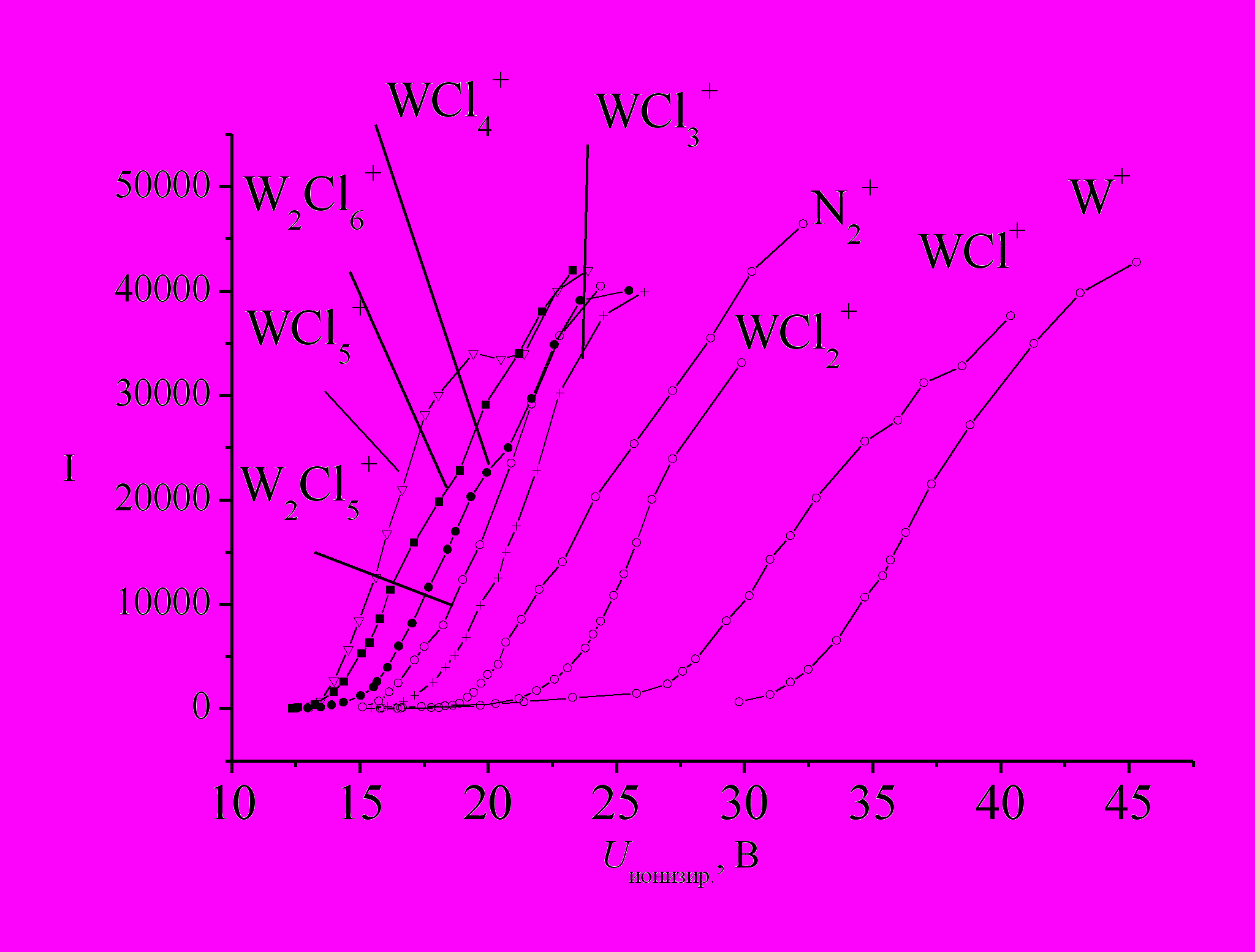 Рис. 6. Кривые эффективности ионизации (КЭИ) для ионов, зарегистрированных в паре над кристаллическим WCl4. |
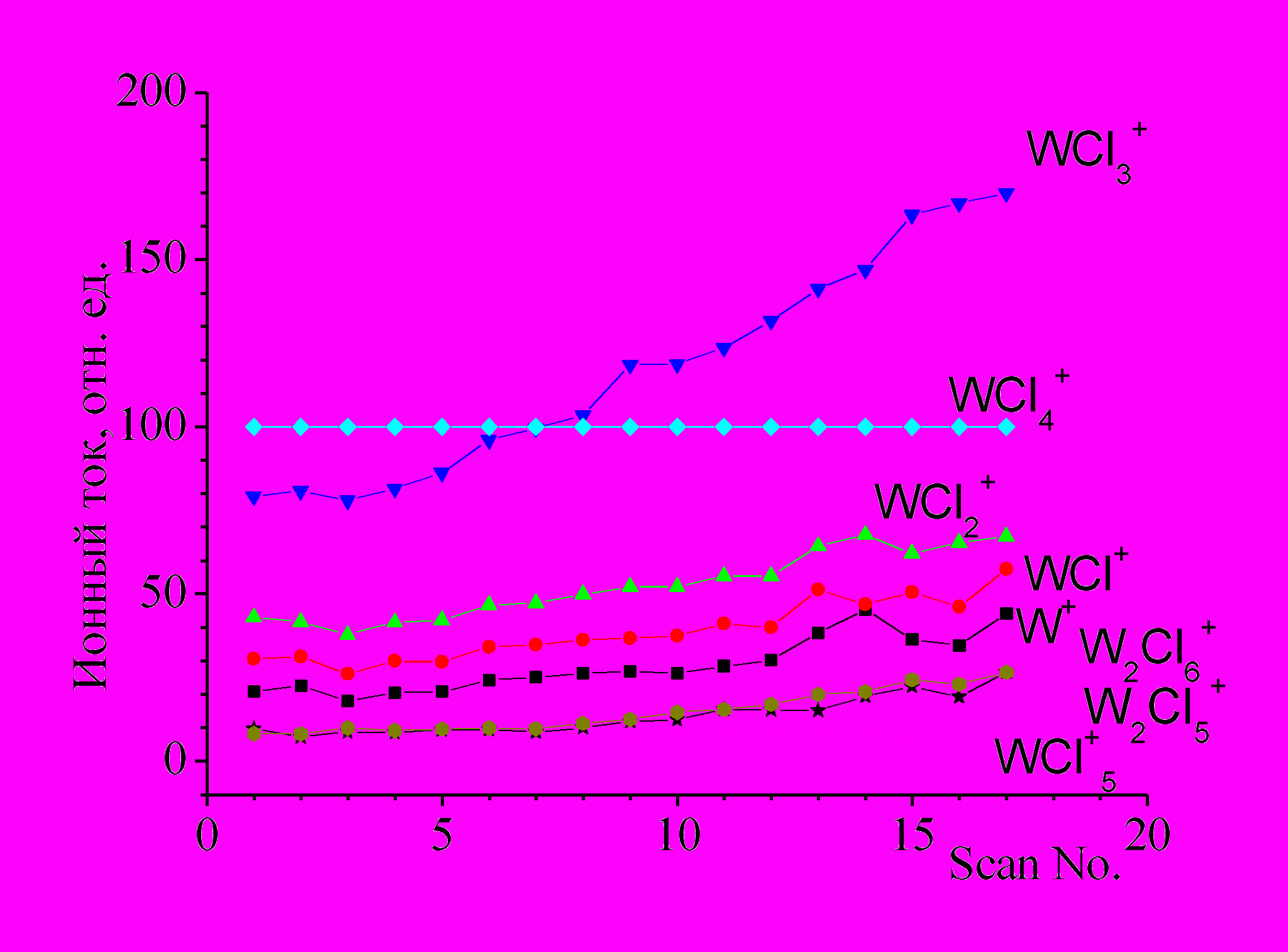 Рис.7. Временнáя зависимость ионных токов в масс-спектре паров над WCl4 на последних стадиях сублимации препарата |
Глава 6. Термодинамические масс-спектральные исследования
В главе 1 было дано подробное описание аппаратурно-методических разработок, в результате которых были, в том числе, модернизированы два масс-спектрометра, монополярный АПДМ–1 и магнитный МИ1201. В предыдущих главах также отмечалось, что большинство объектов, изученных в данной работе, связаны со сложным составом газовой фазы в силу олигомеризации паров или диспропорционирования исходной конденсированной фазы. В данной работе мы провели термодинамические исследования дигаленидов бериллия (BeX2)n , где Х=Cl, Br, I и n=1, 2, а также ряда три- и дигалогенидов лантанидов.
Термодинамические характеристики дигалогенидов бериллия. Исчерпывающий анализ литературных данных по термодинамическим свойствам, в частности дигалогенидов бериллия, был выполнен авторами фундаментального справочного издания “Термодинамические свойства индивидуальных веществ ”. В то же время, термодинамические свойства дибромида и дийодида бериллия оставались мало изученными.
Величина димH(BeCl2) была определена на основании результатов синхронного ЭГ/МС эксперимента. Оба метода дали одинаковый результат: 97,5 и 2,5 мол.% для мономера и димера, соответственно. Рассчитанное на основании этих величин значение димНо0(BeCl2)= –91,9±3,5 кДж/моль, которая в пределах погрешности согласуется с величиной, рекомендованной в справочнике ТДС, –95±20 кДж/моль, но существенно уточняет ее. С использованием найденной величины димНо0(BeCl2) была уточнена энтальпия образования газообразного димера дихлорида бериллия, составившая –816(5) кДж/моль.
Процесс сублимации BeBr2 изучался в интервале температур 466 - 508 K (см. рис. 8, в общей сложности было получено по 25 температурных точек для каждого ионного тока), а в случае BeI2 - в интервале температур 537–570 К (от 20 до 36 точек, в зависимости от ионного тока). С помощью II закона термодинамики определены энтальпии (кДж/моль) следующих процессов: сублимации ΔsH(BeBr2, 0 К) = 132(4), ΔsH(Be2Br4, 0 К) =179(11), ΔsH(BeI2, 0 К)= 126(5), ΔsH(Be2I4, 0 К) =167(8), образования ΔfH(BeBr2, г,0 K) = –224(9), ΔfH(Be2Br4, г,0 K) = –533(14), ΔfH(BeI2, г,0 K) = –65(9), ΔfH(Be2I4, г,0 K) = –215(18), димеризации ΔдимH(BeBr2, 0 K) = –86(12), ΔдимH(BeI2, 0 K) = –85(13) (II закон) и –95(5) (III закон). Следует отметить, что энтальпия димеризации дН0(BeI2,газ, 0К)= –955 кДж/моль найденная по III закону термодинамики, не согласуется с результатами обработки по II закону, по всей видимости, из-за неверной оценки величины общего давления пара - на порядок меньшая величина, около 0,1 Торр, что представляется более правдоподобным в данном случае, чем оценка в 1 Торр, (что представляетя более правдоподобнвм в данном ых данных по давлению над иодидлом бериллияпривопр приводит к значению ΔдимH(Be2X4, 0 K)= –81(4) кДж/моль.
Энергетические характеристики мономерных и димерных молекул дигалогенидов бериллия. Энтальпии образования газообразных мономеров BeF2, BeCl2, BeBr2, BeI2 и энтальпии образования газообразных димеров Be2F4, Be2Cl4 и Be2Br4 были использованы для расчета их энергий атомизации Dат(BeX2) и Dат(Be2X4). Между величинами межъядерных расстояний и средних энергий разрыва связей в мономерных молекулах BeX2 наблюдается отчетливая корреляция (рис.9). Близкий к единице коэффициент корреляции свидетельствует, что данный прием может с успехом применяться для проверки правильности получаемых соответствующих молекулярных характеристик для других простых многоатомных молекул.
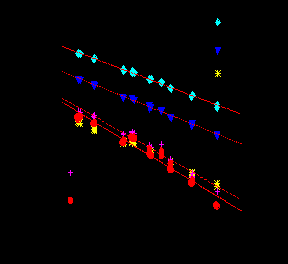 Рис.8. Температурные зависимости ионных токов в масс-спектрах насыщенных паров дибромида бериллия. | 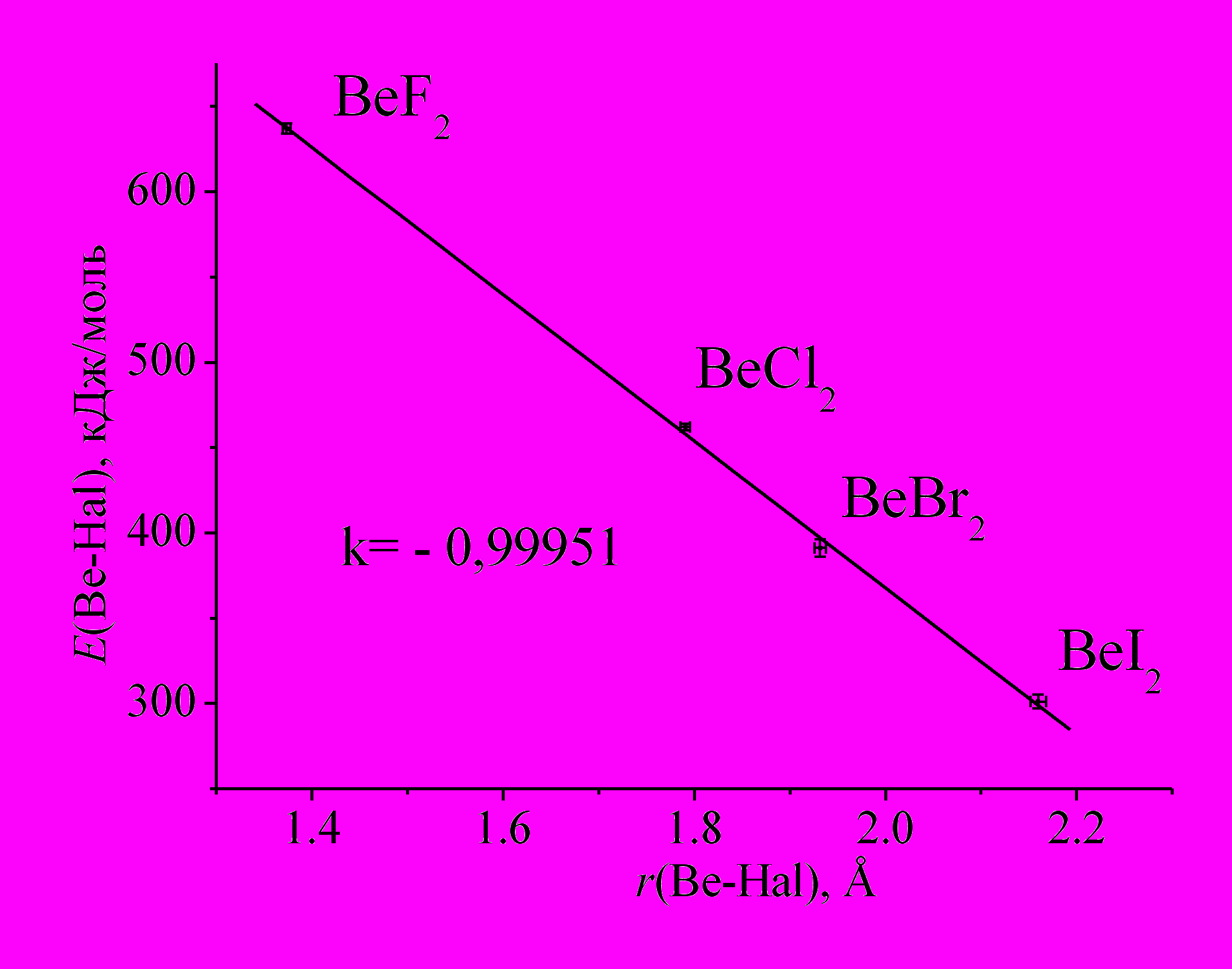 Рис. 9 Связь между длиной связи и величиной средней энергии разрыва связи в молекулах ВеХ2 . |
Термодинамика парообразования некоторых три- и дигалогенидов лантанидов. Исследованию характеристик парообразования ди- и тригалогенидов лантанидов посвящен ряд работ, результаты которых тщательно собраны и проанализированы в таких справочных изданиях, как, например, ТДС, база данных ИВТАНТЕРМО. Последним, по времени издания, видимо является обзор Конингса и Ковача, который, наряду с термохимическими характеристиками веществ, вобрал в себя также и данные о структуре свободных молекул. Интерес к термодинамическим исследованиям соединений данного ряда соединений особенно заметно возрос в последнее десятилетие. Так, например, проводятся систематические масс-спектральные исследования Л.С.Кудиным и др. (Иваново), Т.Маркусом и др. (Юлих, Германия), торсионным методом и методом потери массы Брунетти и др. (Италия).
В настоящей работе масс-спектральным методом в сочетании с эффузионным методом Кнудсена изучены процессы парообразования трихлорида и трибромида эрбия, трибромидов диспрозия и лютеция, трихлорида и трибромида европия. Измерения проводились на масс-спектрометре МИ1201 с использованием для испарения препаратов молибденовых и графитовых эффузионные ячеек. Дихлорид и дибромид европия получались при разложении соответствующего тригалогенида было с интенсивным выделением на начальной стадии галогена. Тщательный поиск ионов, которые могли бы образовываться при ионизации тригалогенидов европия, успеха не имел успеха. Тригалогениды лантанидов. По второму закону термодинамики были определены энтальпии испарения и/или сублимации мономерных и димерных форм некоторых тригалогенидов лантанидов (табл. 8) и дигалогенидов европия.
| Табл.8. Энтальпии сублимации (испарения) в кДж/моль мономерных форм некоторых галогенидов лантанидов | |||
| LnXn | T, K | | sHT |
| ErCl3 | 950–1045 | Субл. | 266(4) |
| | 1045–1115 | Испар. | 227(7) |
| ErBr3 | 902–1048 | Субл. | 255(5) |
| DyBr3 | 1000–1125 | Субл. | 242(4) |
| LuBr3 | 800–1150 | Субл. | 259(4) |
| EuCl2 | 1027–1131 | Субл. | 322(6) |
| | 1131–1253 | Испар. | 302(4) |
| EuBr2 | 1158–1276 | Испар. | 290(5) |
7. Структура и конформационные свойства молекул хальклгенсодержащих шестичленных гомо- и гетероатомных соединений
В данной главе приведены результаты исследования циклических халькогенсодержащих соединений. Пар над этими соединениями является простым сточки зрения стехиометрического соотношения атомов в молекуле, но может оказаться осложненным с точки зрения конформационного состава. Кроме того, как будет показано в главе 8, интерес представляют не только конформационные свойства этих молекул, но также связанные с ними температурные эффекты.
Н
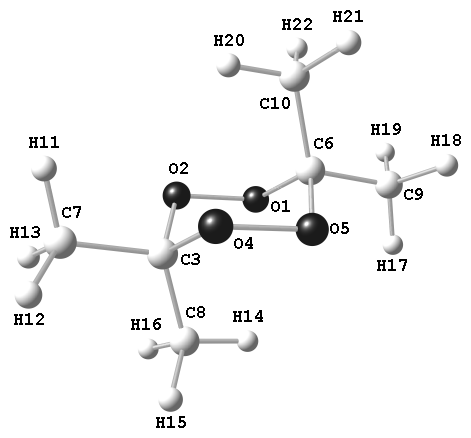 езамещенный 1,2,4,5-тетраоксан и его 3,3,6,6-тетраметил замещенный аналог. Для насыщенных циклических шестичленных соединений наряду с конформацией «кресло» могут быть также характерны конформации «ванна» и «твист». Конформация «кресло» циклогексана симметрии D3d представляет собой идеальный случай с углами C-C-C, близкими к тетраэдрическим, и торсионными углами (C-C-C-C), близкими к 60о. В циклических соединениях, содержащих гетероатомы, имеют место отличающиеся длины связей, а валентные и двугранные углы более заметно отклоняются от своих «идеальных» значений, приводя к повышению деформационных энергий как валентной, так и торсионной. Кроме того, замещение может оказывать значительное влияние на величины относительных энергий возможных конформеров.
езамещенный 1,2,4,5-тетраоксан и его 3,3,6,6-тетраметил замещенный аналог. Для насыщенных циклических шестичленных соединений наряду с конформацией «кресло» могут быть также характерны конформации «ванна» и «твист». Конформация «кресло» циклогексана симметрии D3d представляет собой идеальный случай с углами C-C-C, близкими к тетраэдрическим, и торсионными углами (C-C-C-C), близкими к 60о. В циклических соединениях, содержащих гетероатомы, имеют место отличающиеся длины связей, а валентные и двугранные углы более заметно отклоняются от своих «идеальных» значений, приводя к повышению деформационных энергий как валентной, так и торсионной. Кроме того, замещение может оказывать значительное влияние на величины относительных энергий возможных конформеров. В настоящей работе выполнено ЭГ и КХ исследование структурных и конформационных свойств молекулы 3,3,6,6-тетраметил-1,2,4,5-тетроксана Me2(C2O4)-Me2, или диацетон дипероксида (далее ДАДП). Данное вещество принадлежит к разряду взрывчатых циклических пероксидов, хотя является менее взрывчатым, чем, например, 9-членный цикл триацетон трипероксида [Dubnikova, et al., J.Am.Chem.Soc. 2005, 127, 1146]. Из литературы известно, что в твердом состоянии ДАДП существует в виде конформера «кресло» с симметрией, близкой к C2h. для ДАДП выполнены ЭГ/МС эксперимент и КХ расчеты, тогда как для незамещенного соединения, для последнего нами были выполнены только КХ расчеты, ввиду разложения препарата.
 Рис. 9. ППЭ конверсии «кресло–твист» для молекулы ДАДП |
Функции f(r) радиального распределения (рис.10), полученные в ЭГ/МС эксперименте при 291 K, и разности «эксперимент – теория» свидетельствуют невозможности описать электрографические данные в рамках модели твист (a) и о хорошем согласии с расчетными (b) и оптимизированными (c) параметрами модели кресло. Как КХ, так и ЭГ данные свидетельствуют о небольшом, в пределах 2% и 3,5%, соответственно, содержании формы твист при температурах, близких к комнатным. Валентные углы цикла в ДАДП 108.2(7) и 107.7(4)o несколько меньше, чем в циклогексане, тогда как двугранные углы 63.7(4) and -63.9(4)o несколько больше, чем 55.1(7)o в циклогексане. Последний близок к идеальной величине цепочечной в молекуле CH3-CH2-CH2-CH3, для которой характерно минимальное торсионное напряжение.
Эффект метильного замещения. Установлено, что в случае циклогексана и тетроксана наблюдается уменьшение энергетической разницы между формами кресло и твист при введении метильных заместителей в пара-положениях. При этом эффект в гетероатомном цикле существенно выше, чем в циклогексане. На последнем этапе были проведены расчеты уровня
 Рис. 10. Функции радиального распределения молекулы ДАДП |
(
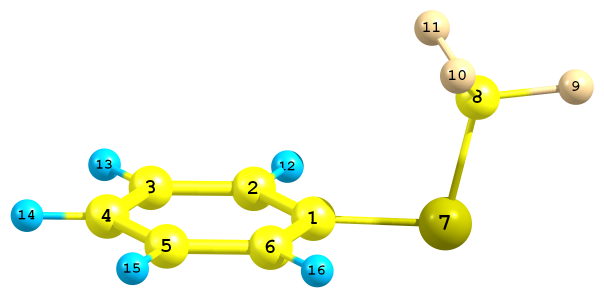 Трифторметил)тиобензол C6H5SCF3. Рассчитанные для молекулы C6H5SCF3 ППЭ вращения группы SCF3, полученные методами MP2 и B3LYP, существенно отличаются друг от друга. В методе MP2 функция U(CCSC) (угол CCSC равен нулю, когда связь S-C лежит в плоскости бензольного кольца) имеет четко выраженный минимум при угле CCSC = 90° и высокий барьер внутреннего вращения (V0 = 2.7 ккал/моль при угле CCSC = 0° и 180°). Таким образом, метод MP2 определяет молекулу как жесткую. Метод B3LYP/6-31G(d) дает потенциальную функцию U(CCSC), которая формально имеет минимум при CCSC = 79°, однако в диапазоне изменений угла CCSC от 75° до 105° функция характеризуется практически одинаковой энергией с небольшим барьером (V0 = 0,038 ккал/моль) при угле CCSC = 90°, т.е. сильно отличается от гармонической. Добавление диффузных функций на тяжелых атомах при использовании метода B3LYP/6-31+G(d) приводит к результатам аналогичным полученным методом MP2/6-31+G(d,p). Метод HF барьер вращения около 4 ккал/моль. Отметим также, что КХ расчеты, выполненные в МГУ в следующих комбинациях MP2/6-31G(d), MP2/cc-pVTZ и B3LYP/cc-pVTZ, также привели к наличию одного минимума, который соответствует ортогональной конформации молекулы с барьерами внутреннего вращения, равными соответственно 3,6, 2,7 и 2,4 ккал/моль. МНК-анализ, выполненный в ИГХТУ, привел к фактору рассогласования Rf=2,9% для ортогонального конформера и 13.6% при попытке рассмотреть молекулу как обладающую плоской ориентацией. Данный факт свидетельствует о том, что плоская конформация молекулы маловероятна.
Трифторметил)тиобензол C6H5SCF3. Рассчитанные для молекулы C6H5SCF3 ППЭ вращения группы SCF3, полученные методами MP2 и B3LYP, существенно отличаются друг от друга. В методе MP2 функция U(CCSC) (угол CCSC равен нулю, когда связь S-C лежит в плоскости бензольного кольца) имеет четко выраженный минимум при угле CCSC = 90° и высокий барьер внутреннего вращения (V0 = 2.7 ккал/моль при угле CCSC = 0° и 180°). Таким образом, метод MP2 определяет молекулу как жесткую. Метод B3LYP/6-31G(d) дает потенциальную функцию U(CCSC), которая формально имеет минимум при CCSC = 79°, однако в диапазоне изменений угла CCSC от 75° до 105° функция характеризуется практически одинаковой энергией с небольшим барьером (V0 = 0,038 ккал/моль) при угле CCSC = 90°, т.е. сильно отличается от гармонической. Добавление диффузных функций на тяжелых атомах при использовании метода B3LYP/6-31+G(d) приводит к результатам аналогичным полученным методом MP2/6-31+G(d,p). Метод HF барьер вращения около 4 ккал/моль. Отметим также, что КХ расчеты, выполненные в МГУ в следующих комбинациях MP2/6-31G(d), MP2/cc-pVTZ и B3LYP/cc-pVTZ, также привели к наличию одного минимума, который соответствует ортогональной конформации молекулы с барьерами внутреннего вращения, равными соответственно 3,6, 2,7 и 2,4 ккал/моль. МНК-анализ, выполненный в ИГХТУ, привел к фактору рассогласования Rf=2,9% для ортогонального конформера и 13.6% при попытке рассмотреть молекулу как обладающую плоской ориентацией. Данный факт свидетельствует о том, что плоская конформация молекулы маловероятна. Фторирование метильной группы приводит к конформационному сдвигу - от плоской ориентации S-CH3 группы в тиоанизоле к перпендикулярной ориентации группы S-CF3 в C6H5SCF3. Подобный эффект наблюдался в винилсульфидах при переходе от CH2=CHSCH3 к CH2=CHSCF3, а также в анизолах при
| Рис. 10. 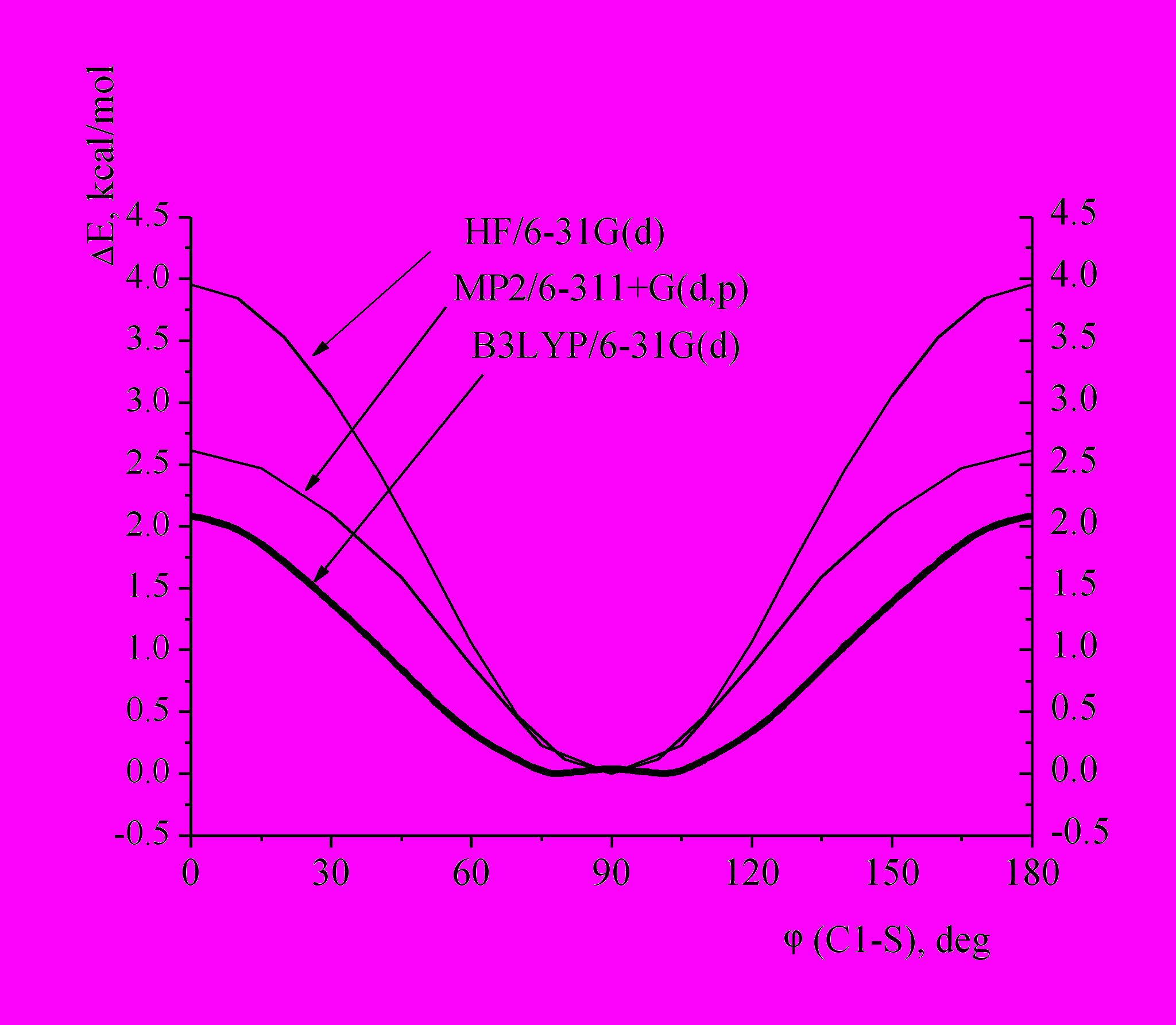 Теоретические потенциальные кривые внутреннего вращения вокруг связи C(sp2)–S. Теоретические потенциальные кривые внутреннего вращения вокруг связи C(sp2)–S. |
