Разработка биологических препаратов для повышения питательности и эффективности использования кормов 03. 00. 23. Биотехнология 06. 02. 02. Кормление сельскохозяйственных животных и технология кормов
| Вид материала | Автореферат диссертации |
СодержаниеRuminococcus albus 1-33 R. Albus 1-33 R. albus 1-33 R. albus 1-33 |
- Программа-минимум кандидатского экзамена по специальности 06. 02. 02 «Кормление сельскохозяйственных, 75.09kb.
- Программа-минимум кандидатского экзамена по специальности [Кормление сельскохозяйственных, 73.76kb.
- Программа-минимум кандидатского экзамена по специальности 06. 02. 02 «Кормление сельскохозяйственных, 80.45kb.
- Эффективность использования однотипной круглогодовой системы кормления коров в высокопродуктивном, 579.8kb.
- Влияние экструдирования и химического способа "защиты" протеина кормов на обмен веществ, 458.71kb.
- Эффективность использования биологически активных веществ и полнорационных комбикормов, 1317.55kb.
- Темы рефератов для поступления в аспирантуру по научной специальности 06. 02. 08 кормопроизводство,, 23.77kb.
- Программа-минимум кандидатского экзамена по специальности 06. 02. 02 «Кормление сельскохозяйственных, 119.14kb.
- Программа вступительного экзамена для поступления в магистратуру по профессионально-образовательной, 41.2kb.
- Эффективность использования пувмкк «золотой фелуцен» №3092 при выращивании бычков, 415.9kb.
3.2.1.Анализ целлюлазной активности содержимого рубца КРС.
Целлюлозолитические микроорганизмы рубца представлены как бактериями, так и грибами-хитридиомицетами. При лабораторном изучении переваривания целлюлозосодержащих субстратов (фильтровальной бумаги и ячменной соломы) было установлено, что нативная рубцовая жидкость разлагала значительное количество навески субстрата. В табл.1 приведены результаты изучения действия популяций микроорганизмов рубцовой жидкости на микробиологическое разложение фильтровальной бумаги и соломы без антибиотиков и с антибиотиками.
Из таблицы следует, что добавление пенициллина и стрептомицина привело к снижению переваривания обоих субстратов. Вместе с тем добавление нистатина не сказалось на разложении фильтровальной бумаги, тогда как количество переваренной соломы в этом случае было значительно ниже, чем в случае без добавления антибиотиков. Совместное добавление всех трех антибиотиков прекращало переваривание обоих субстратов, что свидетельствовало об отсутствии активности целлюлаз каких либо других организмов.
Таблица 1.
Действие ^ Ruminococcus albus 1-33 на разложение субстратов популяциями бактерий и грибов рубца
| Вариант опыта | Разложено субстрата в % к массе исходной навески | |
| Фильтровальная бумага | Солома | |
| Рубцовая жидкость | 26,8±1,15 | 33,3±2,00 |
| Рубцовая жидкость + ^ R. Albus 1-33 | 32,6±2,15 | 28,0±4,0 |
| Рубцовая жидкость + пенициллин и стрептомицин | 20,0±0,00 | 28,0±0,00 |
| Рубцовая жидкость + нистатин | 31,0±1,15 | 22,0±2,00 |
| Рубцовая жидкость + нистатин + ^ R. albus 1-33 | 38,4±2,42 | 22,0±2,15 |
| Рубцовая жидкость + пенициллин, стрептомицин и нистатин | 0 | 0 |
Из таблицы 1 также видно, что вклад грибов в переваривание соломы значительно выше, чем в переваривание фильтровальной бумаги. Суммарное количество субстрата, разложенное бактериями (вариант с добавлением нистатина) и грибами (вариант с добавлением пенициллина) было достоверно выше количества субстрата, переваренного нативной рубцовой жидкостью (вариант без добавления антибиотиков, (Р< 0,99). Таким образом, каждая группа целлюлозолитиков утилизирует больше субстрата в отсутствие другой группы. Следует отметить, что в экологии увеличение потребления субстрата популяцией одного вида в отсутствие популяции другого вида считается одним из признаков конкурентных отношений между ними (Connel, 1983, Schoener, 1983).
Конкурентные отношения, безусловно, затрудняют прямое определение доли субстрата перевариваемого бактериями или грибами в естественных условиях. Использование двухфакторного дисперсионного анализа позволяет вычислить силу действия популяций бактерий или грибов на переваривание субстрата (рис.1).
Нами изучен вопрос о том, как влияет добавление к рубцовой жидкости дополнительного количества целлюлозолитических бактерий Ruminococcus albus, входящих в состав целлюлозолитической ассоциации 1-33. К исходному содержимому рубца, которое включало 3 млн/мл клеток бактерий-целлюлозолитиков, была добавлена культура с содержанием R.albus 0,45 млрд/мл.
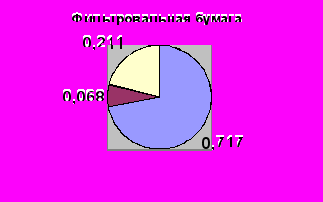
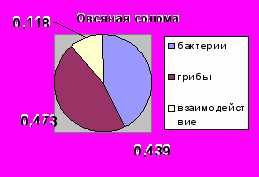
Рис. 1 Доля бактерий и грибов рубца в переваривании целлюлозосодержащих субстратов.
Таким образом, численность целлюлозолитических бактерий была увеличена более чем в 100 раз. Из таблицы 1 видно, что добавление бактерий повысило целлюлазную активность (определяемую по разложению фильтровальной бумаги), но не увеличило количество переваренной соломы. Даже при подавлении грибов не происходило увеличения перевариваемого субстрата. Таким образом, увеличение численности целлюлозолитических микроорганизмов не привело к увеличению переваримости
Мы предположили, существование конкурентных отношений между популяциями бактерий и грибов рубца. В классической математической экологии для описания конкурирующих популяций используется система из двух дифференциальных уравнений – уравнения Лотки-Вольтерра:
dN1 K1 - N1 - N2α12
______ = r1 N1 ________________________
dt K1
dN2 K2 - N2 - N1α21
______ = r2 N2 ________________________
dt K2
где N1 – плотность популяций грибов, N2 – плотность популяций бактерий, K1 – плотность насыщения популяции грибов при подавлении бактерий, K2 – плотность насыщения популяций бактерий при подавлении грибов, r1 и r2 – максимальные удельные скорости увеличения популяций, α12 - коэффициент конкуренции, характеристика популяции бактерий. Отражающая меру ее конкурентного давления на популяции грибов, α21 – аналогичная величина для популяций грибов.
Поскольку в работе изучали популяции микроорганизмов, значительно различающиеся друг от друга по своим размерам, жизненным циклам, активности, то был введен дополнительный коэффициент k, который не только переводит
численность популяций в соизмеримые единицы, но и учитывает различные способы определения численности популяций (определение титра бактерий и подсчет спорангиев на субстрате при микроскопировании).
Было рассчитано значение этого коэффициента для бумаги (k = 4,2 х 106) и соломы (k = 6,5 х 106). Он означает, что к 48 часам 6,5 х 106 бактерий переваривают такое же количество сухого вещества соломы, что и грибы, при численности, равной одному спорангию, обнаруживаемому при микроскопировании. Данный коэффициент позволяет приравнивать численность бактерий к численности грибов. Были экспериментально определены для фильтровальной бумаги K1 = 4,0, K2 = 3,1 х 107, N1 = 2,1, N2 = 2,0 х 107. Для соломы эти значения составили K1 = 10,0, K2 = 6,5 х 107, N1 = 5,4, N2 = 3,5 х 107. Существует способ определения α12 и α21, разработанный Г.Ф.Гаузе (Гаузе, 1967) и основанный на том, что при достижении насыщающих концентраций популяций (то есть при прекращении их роста) K1 - N1 – N2α12 = 0 и K2 – N2 – N1α21 = 0. Было рассчитано, что для первого субстрата α12 = 0,377, α21 = 1,138. и для второго субстрата α12 = 0,460, α21 = 0,462.
Таким образом, α12 показывает степень подавляющего действия бактерий на грибы, а α21 степень подавляющего действия грибов на бактерий. Эти коэффициенты не равны нулю, что свидетельствует о существовании конкурентных отношений между целлюлозолитическими бактериями и грибами в рубце. Конкуренция отмечена в 527 экспериментах с 215 видами, или же в 90% экосистем ей подвержено 76% видов (Connel, 1983, Schoener, 1983). По-видимому, рубец жвачных не является исключением в этом отношении, и они возможны между целлюлозолитическими микроорганизмами рубца. Это позволяет объяснить данные, приведенные в табл. 1. Понятно, что введение дополнительного количества целлюлозолитических бактерий не приводит к увеличению переваривания соломы.
На основании соотношений коэффициентов можно прогнозировать исход конкуренции вытекающей из уравнения Лотки-Вольтерра в зависимости от соотношения величин α12 и α21.
На рис. 2. приведен пример, когда K1/ α12> K2 и K2/ α21> K1. Он приводит к следующему исходу: ни одна популяция не может сдерживать развитие другой – происходит устойчивое сосуществование популяций.
По оси абсцисс (N1) отложена численность популяций грибов, выраженная в количестве спорангиев. По оси ординат (N2) – численность популяций бактерий, выраженная в условных единицах (в пересчете на соответствующее количество спорангиев грибов через коэффициент k). Графики представляют собой геометрическое место точек, соответствующие равновесным состояниям популяций грибов и бактерий. Точка пересечения графиков говорит о возможности устойчивого сосуществования грибов и бактерий в содержимом рубца жвачных.
Понимая сложность применения уравнений Лотки-Вольтерра к естественным экосистемам, следует учитывать, что эти уравнения содержат ряд допущений. Однако в нашем случае данная модель основана на экспериментальных результатах, полученных в наших исследованиях, и была подтверждена в дальнейших экспериментах по скармливанию ассоциации 1-33.
Известно, что клетчатка корма в рубце переваривается не полностью. Ранее это увязывали с дефицитом целлюлаз. Исходя из полученных нами данных, а также данных других авторов (Akin, Rigsby, 1995), можно скорее говорить об определенном «избытке» потенциальной целлюлазной активности в рубце.
Сделанный нами вывод позволяет рекомендовать способ повышения переваримости клетчатки рациона у взрослых животных не путем использования ферментных препаратов на основе целлюлаз, а проводя технологическую обработку целлюлозосодержащих субстратов, повышая доступность целлюлозы для действия целлюлаз. Другим путем повышения переваримости клетчатки может быть создание препаратов, стимулирующих рост и развитие популяций целлюлозолитических микроорганизмов.
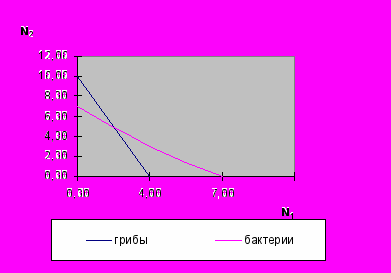
Рис. 2. Анализ возможности устойчивого сосуществования популяций грибов и бактерий в содержимом рубца на основе экспериментальных коэффициентов, рассчитанных согласно модели Лотки-Вольтерра.
2.2. Изучение целлюлазной активность ассоциации 1-33.
Было отобрано 5 наиболее активных ассоциаций 1-33, у которых сравнительно высокая скорость разложения клетчатки сочеталась с высокой целлюлазной активностью. Эти пять ассоциаций были подвергнуты более детальному микробиологическому исследованию и все они, при высеве, характеризовались наличием двух компонентов:
1.Клетки имеют форму кокков от 0,7 до 2,0 мк в диаметре. Единичные или в коротких цепочках. Спор нет. Грампозитивны. На МПА и МПБ не растут. Сбраживают целлюлозу, глюкозу, целлобиозу, лактозу, целлобиозу, фруктозу. Не сбраживают сахарозу, арабинозу, маннит, сорбит, мальтозу, рамнозу, дульцит. Растут на молоке и молоке с NaCl. Лакмусовое молоко через 24 ч восстанавливают, через 48 ч – подкисляют. Обладают целлюлазной активностью. Изолят был определен, как Ruminococus albus.
2. Клетки имеют форму коротких палочек, которые встречаются поодиночке или собраны в короткие и длинные цепочки-нити, подвижны. Грампозитивны. Рост на МПА и МПБ отсутствует. Спор нет. Сбраживают глюкозу, арабинозу, целлобиозу, сахарозу, маннит, галактозу, мальтозу, раффинозу, фруктозу. Не сбраживают сорбит, дульцит и рамнозу. Каталазу не образуют. Растут на молоке и на молоке с добавлением 4-6% NaCl, желчи (20%, 40%), фенола (0,4%), лакмусовое молоко подкисляют. Они были определены как Lactobacillus acidophilus.
Один из вариантов, обозначенный нами как 3-7, выделенный из рубца лося и превосходящий ассоциацию 1-33 по целлюлазной активности был использован
для наработки опытных партий целлобактерина с целью проведения производственных испытаний.
Предварительное изучение влияния рН на скорость гидролиза растворимой КМ-целлюлозы под действием внеклеточных целлюлаз R. albus 1-33 показало, что оптимум рН реакции соответствует 6,4 - 6,6 и рН-профиль целлюлазной активности имеет достаточно симметричный колоколообразный вид (рис.3). (Условия: 40С, 0,1М уксусно-ацетатный буфер, рН 4,0-6,4, 0,1М фосфатный буфер, рН 6,4-8,0, концентрация КМЦ – 4 г/л. Активность (А) дана в условных единицах). Следует отметить, что для большинства целлюлаз аэробных грибов рН сдвинут в кислую сторону 1,5 - 2 единицы. Все дальнейшие эксперименты проводили при рН 6,6. Активность бактериальных целлюлаз нормальным образом увеличивается с ростом температуры, и при 40 °С (близкой к температуре в рубце жвачных равной 39 °С) она в 7,2 раза выше, чем при 20° С. При повышении температуры происходит заметная инактивация целлюлаз, поэтому все последующие опыты, кроме тех в которых температуру варьировали, проводили при 40° С.
Рис. 3. Влияние рН на скорость гидролиза растворимой карбоксиметилцеллюлозы под действием эндоглюканазы R. albus 1-33.
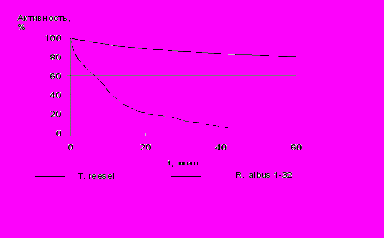
Рис. 4. Необратимая инактивация эндоглюканазы R. albus 1-33 при 60С: при рН 6,6 активность определялась вискозиметрически по отношению к гидролизу КМЦ. Активность дана в %.
Целлюлазная (эндоглюканазная) активность культуральной жидкости ассоциации 1-33 оказалась низкой, значительно ниже активности культуральной жидкости аэробных грибов. Если активность внеклеточных целлюлаз T. reesei
составляет 10-30 ед/м. культуральной жидкости, то активность культуральной жидкости ассоциации 1-33 после центрифугирования в течение 30 мин при 13 тыс. об/мин равнялась 0,098±0,003 ед/мл. После более скоростного центрифугирования (2 ч. при 30 тыс. об/мин ) она практически не изменилась, составляя 0,095±0,003 ед/мл. Активность же самих бактериальных клеток, отмытых буферным раствором при рН 6,4 на холоде составила 30 ед/г в расчете не массу сухих клеток, что соответствует активности промышленных продуцентов.
Рис.5. Влияние температуры на скорость выхода целлюлаз R. albus 1-33 в среду при инкубации в фосфатном буфере (0,1М, рН6,6).
Из полученных результатов следует, что штаммы целлюлозолитического компонента ассоциации не секретирует целлюлаз в культуральную среду.
На рис. 4. показана кривая термоинактивации КМЦ-активности целлюлазного комплекса ^ R. albus 1-33 при 60оС. Для сравнения приведена соответствующая зависимость эндоглюканазы T. reesei. Из полученных результатов следует, что целлюлазы R. albus не отличаются высокой термостабильностью.
Изучение зависимости выхода целлюлаз из клеток в культуральную среду от температуры приведено на рис. 5. Установлено, что при инкубации клеток R. albus на холоде в течение 12 ч в ацетатном буфере с рН 6,6 в раствор переходит до 57% целлюлаз, тогда как при 37оС в течение 1,% ч – до 97%. Если «экстракция» целлюлаз сопряжена с разрывом ковалентных химических связей (как при автолизе), то энергия активации составляет 12-20 ккал/моль (скорость процесса возрастает в 2-3 раза при повышении температуры на каждые 10Со. Если же выход целлюлаз связан с простой диффузией, то энергия активации составит 1-6 ккал/моль (скорость процесса возрастает в 1,06-1,4 раза при повышении температуры на каждые 10ОС). Полученные результаты свидетельствуют о том, что «вымывание» целлюлаз буферным раствором, вероятно, обеспечивается диффузией. Тот факт, что при перемешивании процесс ускоряется, подтверждает предположение, что целлюлазы прикреплены к внешней поверхности клеточной стенки бактерий. Эти результаты соответствуют общепринятому положению, что у бактерий, в том числе и у R. albus целлюлазы объединены в целлюлосому – структуру, расположенную на поверхности клеток.
Свойства целлюлаз, выделенных из других бактериальных изолятов были схожи с описанной выше целлюлазой.
3.3. Использование целлобактерина для молодняка крупного рогатого скота.
Проведены исследования по интродукции целлюлозолитической бактерии в рубец телят. В табл. 2. приведена схема эксперимента по применению целлобактерина телятам эстонской красной породы в опытном хозяйстве «Тарту» Института животноводства и ветеринарии (республика Эстония, Тарту). Результаты других опытов представлены в таблице 3. Результаты опытов (табл.3.) свидетельствуют о том, что действие препарата зависело от возраста телят. Статистически достоверное увеличение среднесуточных привесов по сравнению с контрольными вариантами (без скармливания препарата) были получены только во втором опыте – на телятах в возрасте 2,5 мес.
Таблица 2.
Схема опытов по скармливанию целлобактерина телятам в различном
возрасте
| № опыта | Возраст телят, мес. | Группы | Число телят | Кормление в учетном периоде |
| 1 | 1 | 1 2 | 7 7 | Основной рацион –1 (ОР-1) ОР-1 + целлобактерин |
| 2 | 2,5 | 3 4 | 7 7 | ОР-2 ОР-2 + целлобактерин |
| 3 | 4 | 5 6 | 10 10 | ОР-3 ОР-3 + целлобактерин |
Статистически достоверных различий не было обнаружено в опытах 1 и 3 – на телятах в возрасте 1 и 4 мес. Мы полагаем, что именно в период 2-4 месяца происходит формирование микрофлоры рубца, и животное становится способным к эффективному усвоению клетчатки.
Таблица 3.
Затраты кормов и питательных веществ на одного теленка и среднесуточный прирост живой массы при скармливании целлобактерина
| Группы | Показатели | ||
| Живая масса в начале учетного периода, кг | Живая масса в конце учетного периода, кг | Среднесуточный прирост, г | |
| 1 | 47,9 ±7,9 | 109,3±11,1 | 675 |
| 2 | 46,4±5,4 | 106,9±8,9 | 664 |
| 3 | 70,4±7,98 | 117,3±13,83 | 710 |
| 4 | 69,3±8,30 | 127,0±14,46 | 874 |
| 5 | 128,7±11,58 | 196,5±15,65 | 969 |
| 6 | 130,1±15,36 | 200,8±20,25 | 1010 |
В табл. 4 приведены результаты изучения переваримости клетчатки теленком в этот период. Как видно из таблицы, у животных, получавших препарат, практически все показатели, связанные с перевариванием клетчатки были выше. Отсутствие эффекта у животных в 1 опыте можно объяснить недостаточным развитием рубца в анатомо-гистологическом и физиологическом отношениях, не связанных с заселением рубца микроорганизмами. Как известно, основные структурные преобразования рубца, сетки и книжки в постнатальном онтогенезе завершаются лишь к концу третьего месяца.
В более старшем возрасте, на одних и тех же животных, были поставлены две серии опытов: первая – на животных в возрасте 3,5 мес., вторая – 4,5 мес. Основной рацион телят в первой серии состоял из комбикорма (1,8 кг) и сена лугового (2,5 кг), во второй серии - сена в том же количестве и кукурузного силоса (5,0 кг). Контрольная группа получала комбикорм в количестве 1,95 кг, опытная – 1,8 кг, для сбалансирования рациона по общей питательности и протеину. Добавление препарата приводило к статистически достоверному увеличению количества ЛЖК в рубце. Однако эффект был более четко выражен у животных младшего возраста (1 серия). Через 2 часа после кормления статистически достоверные различия между опытом и контролем были только в 1 серии опытов.
Полученные на телятах результаты подтверждают ранее сделанные заключения о целесообразности интродукции целлюлозолитических бактерий в период формирования экосистемы рубца (табл. 4).
Таблица 4.
Влияние целлобактерина на переваримость клетчатки у телят.
-
Показатели
Группы
Контрольная
опытная
Целлюлозолитическая активность,%
20,0±0,0
30,5±1,7*
Потреблено, г
406,4±86,5
515,0±7,8
Переварено в желудке, г
284,5±10,2
377,0±7,8*
Прошло в дуоденальном химусе, г
121,9±10,2
128,1±1,61
Переварено в кишечнике, г
5,2±0,8
5,9±1,0
Выделено с калом, г
116,6±28,8
132,2±35,0
Переварено, г
289,9±58,5
382,9±27,2*
Коэффициент переваримости
71,3
74,3
* Р > 0,999
