Халькогенсодержащие органические соединения для преобразователей энергии и информации. Выбор вида, свойства, способы и технология их получения >02. 00. 05 электрохимия
| Вид материала | Автореферат |
- Тема урока: органические соединения: микро- и макромолекулы. Углеводы: строение, свойства,, 76.1kb.
- Лабораторная работа №2 Важнейшие классы неорганических соединений, 88.03kb.
- Карбонильные соединения, 186.01kb.
- Лекция Информация и ее основные свойства, 421.3kb.
- Стереохимия, область химии, изучающая пространственное строение молекул и влияние этого, 19.63kb.
- 3 лекция Носители, знаки, символы и сигналы. Виды сигналов. Свойства информации. Способы, 287.92kb.
- Разработка и строительство экологически безопасной технологии производства кремния, 48.31kb.
- Тема: «циклопарафины: строение, свойства, применение», 55.94kb.
- Рабочая программа по Теоретической электрохимии для специальности 250300 Технология, 375.63kb.
- «нетрадиционные способы получения энергии», 572.54kb.
5.1. Фотохимическое окисление тиа(селена)циклогексанов. Изучены фотохимические превращения тиа(селена)циклогексанов, так как их фотоактив-ность отражается на электрохимических свойствах.
Исходя из анализа масс-спектров, регистрируемых в ходе протекания фото-химических реакций, предположена следующая схема 6 превращения:
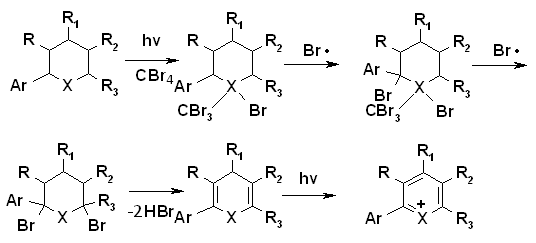
Схема 6. X – S, Se.
Механизм данной реакции может быть представлен соответствующим образом (схема 7).
Полученное соединение не может термодинамически существовать в инди-видуальном состоянии и претерпевает следующие превращения:
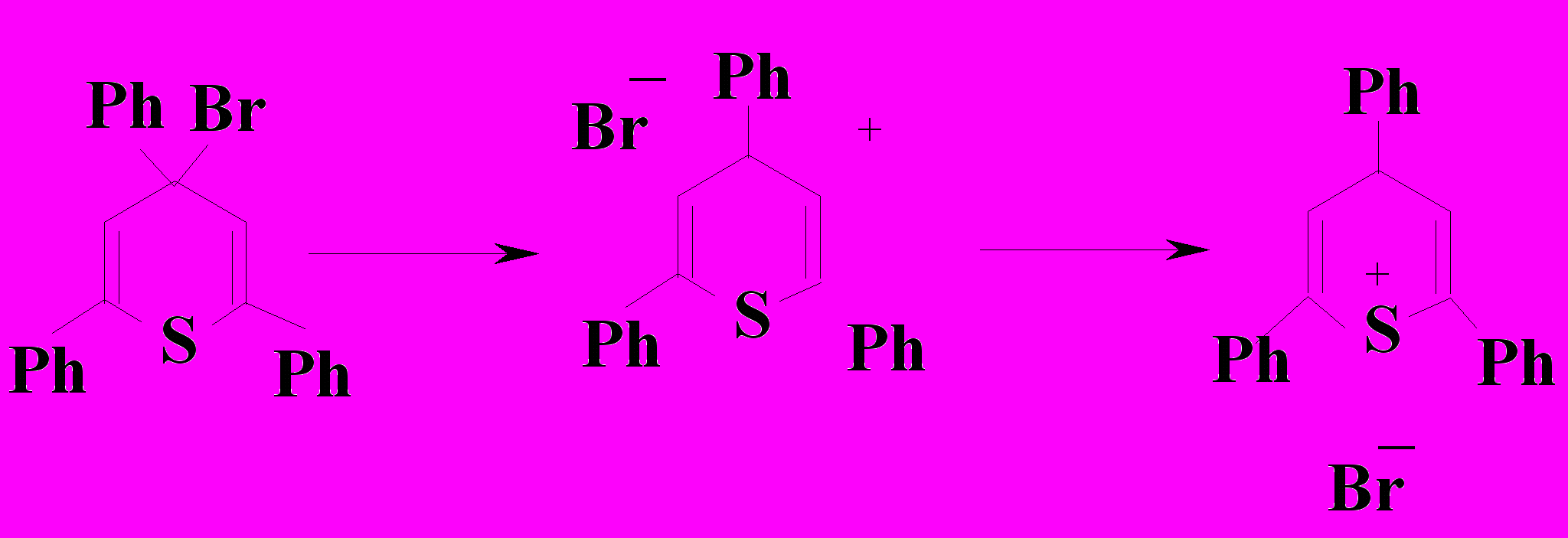
Существование последней структуры термодинамически наиболее выгодно. Соответствующая соль халькогенопирилия поглощает квант света в видимой области спектра, переходя при этом в возбужденное состояние и передает энергию комплексу халькогенопирана (НР) с CВr4, который разлагается на бромид халько-генопирилия и бромоформ.
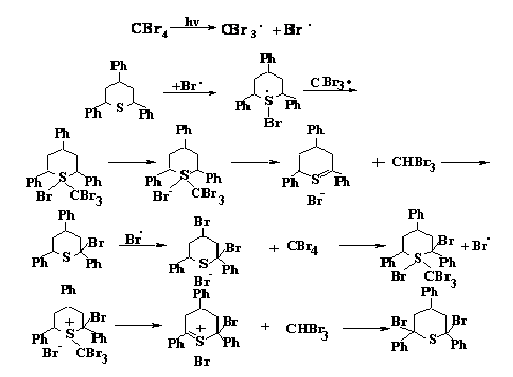
Схема 7.
Обнаружено, что халькогенациклогексаны способны подвергаться фото-химическому окислению в присутствии CCl4 и CBr4 с образованием гетероаро-матических катионов, при этом халькогенациклогексаны могут служить в качестве сенсибилизаторов при фотохимическом окислении. Зафиксированы промежуточ-ные соединения А, Б и В, что можно представить как механизм реакций:
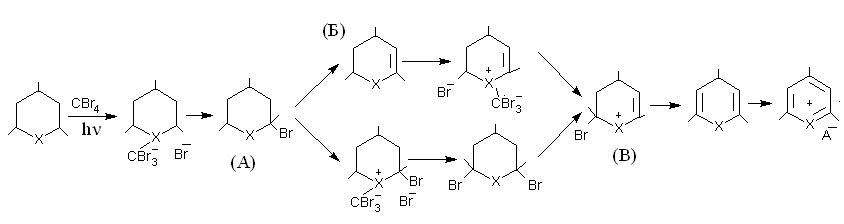
Установлено, что при окислении 4Н-селенопиранов термодинамически наиболее стабильными продуктами реакции являются соответствующие производ-ные ароилселенофенов и реакции фотохимического окисления селенопиранов могут протекать как по положению С4 гетероцикла, так и по гетероатому. В результате проведения фотохимических превращений халькогенациклогексанов найдена новая модификация перегруппировки Пуммерера, которая сопровождается полным элиминированием реагента с образованием соответствующего непредель-ного соединения.
5.2. Фотохимическое окисление 9 – Симм. – октагидрохалькогено-ксантенов. Для установлении особенностей механизма протекания свободно-радикальных реакций в октагидрохалькогеноксантеновых структурах и изучения строения продуктов фотохимического окисления использовались ГХ с МСД, ВЭЖХ и УФ-спектроскопия. Характеристичные ионы, обнаруженные в масс-спектрах 9-фенил-симм.-октагидрохалькогеноксантенов после их фотохимического окисления, совпадают с характеристическими ионами, проявляющимися в масс-спектрах анализируемых веществ. Наличие данных характеристичных ионов подт-верждает предполагаемый нами механизм реакций фотохимического окисления 9-фенил-симм.-октагидрохалькогеноксантенов.
Нами доказано, что фотохимическое окисление происходит до получения бромидов соответствующих гетероароматических катионов. Установлено, что реакции протекают по цепному свободнорадикальному механизму. Хроматографи-чески обнаружено присутствие в реакционной смеси бромоформа, бромбензола и тетрабромэтилена.
5.3. Изучение кинетики реакций окисления 9- симм-октагидрохалькогено-ксантенов бромом. Октагидрохалькогеноксантены, содержащие в качестве гетероатома кисло-род, серу и селен, были выбраны как модельные соединения для изучения влияния гетероатома на окислительно – восстановительные свойства гетероциклических соединений. С целью выявления общих закономерностей процессов окисления 9-симм-октагидрохалькогеноксантенов бромом и установления особенностей протее-кания, схемы их окислительных превращений, нами было проведено изучение кинетики реакций окисления бромом. Анализ реакционной среды проводился методом УФ-спектрометрии. Из анализа полученных УФ – спектров следует (рис. 20), что вероятно образование компонента с переносом заряда с последующим его разрушением и переходом в соль по схеме:
Данные УФ-спектров реакционной среды свидетельствуют об образовании соответствующего комплекса 9-фенил-симм.октагидроселеноксантена и его посте-пенном распаде с образованием соответствующей соли. Было показано влияние увеличения концентрации окислителя на смещение равновесия илидный комплекс- соль.
Из анализа УФ- спектров прослеживается некоторые общие тенденции.
На рис. 21 приведен УФ - спектр 9-симм-октагидроксантена, полученный в среде хлороформа в начальный момент времени от начала реакции, из анализа которого видно, что в начальный период реакции не отмечается образование илидного комплекса.
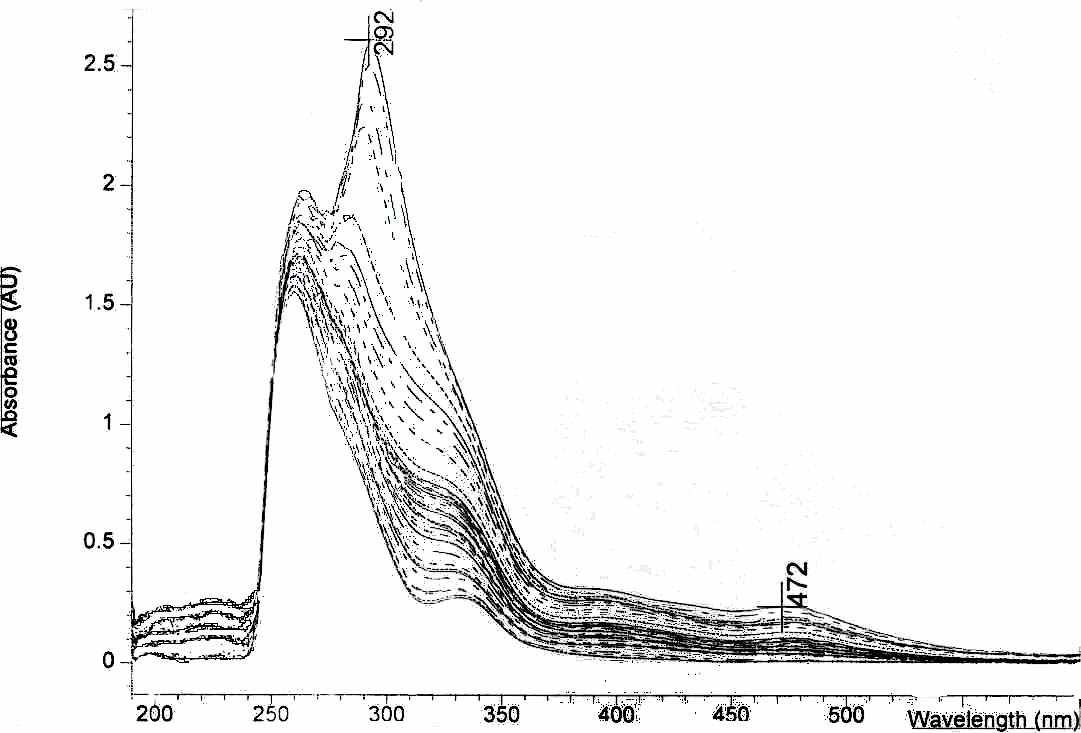 | 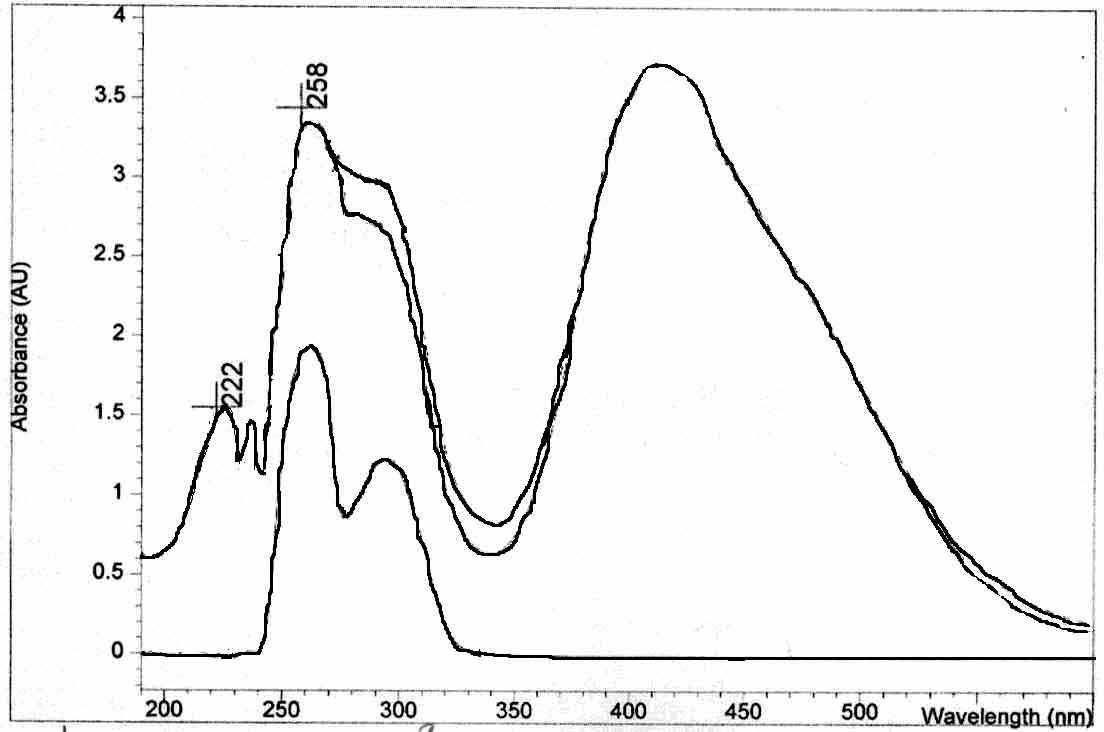 |
| Рис. 20. УФ – спектры 9 – фенил – Симм. – октагидротиоксантена, полученные в реакции окисления бромом при непрерыв-ном увеличении его концентрации | Рис. 21. УФ-спектры 9-симм-октагидро-ксантена, полученные при реакции взаимо-действия с бромом в среде хлороформа через 10 мин от начала реакции |
Во-первых, стабильность комплексов хальгеноксантенов с бромом падает в ряду Se>S>>0, что можно обьяснить увеличением доли ковалентного связывания гетероатома при переходе от атома серы к селену. Во-вторых, что добавление избытка Br2 способствует образованию ароматических структур. В результате выявлены общие закономерности изучаемых процессов и установлено, что основными факторами, определяющими направление реакций окисления, является при-рода гетероатома. Показано, что при взаимодействии брома с 9-фенил-симм.-окта-гидрохалькогеноксантенами происходит образование комплекса, который затем может перегруппировываться в соответствующую соль.
ГЛАВА 6. ЭЛЕКТРОФОРЕТИЧЕСКОЕ ПОЛУЧЕНИЕ МАТЕРИАЛОВ ФУНКЦИОНАЛЬНОГО НАЗНАЧЕНИЯ, ИХ ЭЛЕКТРОХИМИЧЕСКИЕ, АДСОРБЦИОННЫЕ И ПОВЕРХНОСТНО-АКТИВНЫЕ СВОЙСТВА
6.1. Технология электрофоретического способа получения комбини-рованных покрытий. Нами получены комбинированные покрытия электрофо-ретическим путем с использованием анионактивного полимера - гипана, которые можно использовать в качестве сепараторов для Ni – Cd аккумуляторов. С целью оптимизации процесса электрофоретического получения комбинированных сепараторов были изучены электроповерхностные свойства частиц в асбестовых суспензиях и гетеросуспензиях с добавками TiO2 и ZnO2 – электрокинетические потенциалы и электрофоретические подвижности.
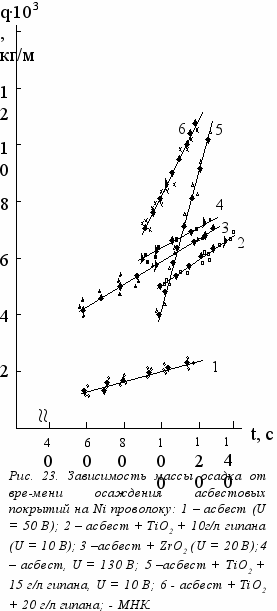
При определении электрокинетических потенциалов частиц в асбестовых суспензиях был использован метод, основанный на определении выхода электрофоретического осадка. На основании зависимостей массы осадка от напряженности электрического поля (рис. 22), полученных при осаждении на плоские электроды, были определены электрофоретические подвижности по формуле: m = uэфф·c·t·S·E, представленные в таблице 10. Так как гетеросуспензии включают две твердые фазы – частицы асбеста и оксидов металлов, то в таблице 10 приводятся эффективные величины электрофоретических подвижностей и электрокинетических потенциалов. На основании uэфф были рассчитаны
 - потенциалы по формулам Гельмгольца - Смолуховского и Сеннета – Оливье:
- потенциалы по формулам Гельмгольца - Смолуховского и Сеннета – Оливье: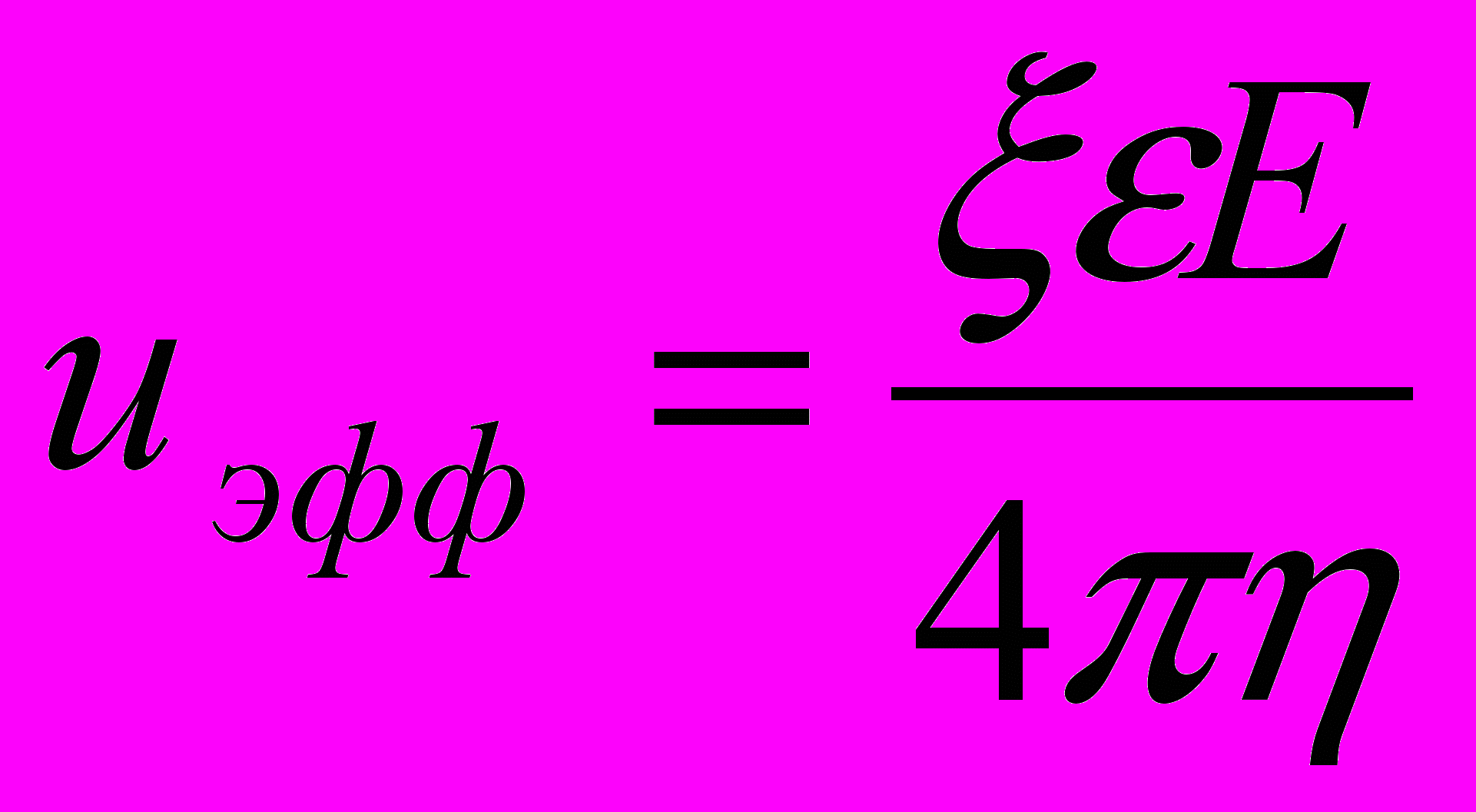 ( 1);
( 1); 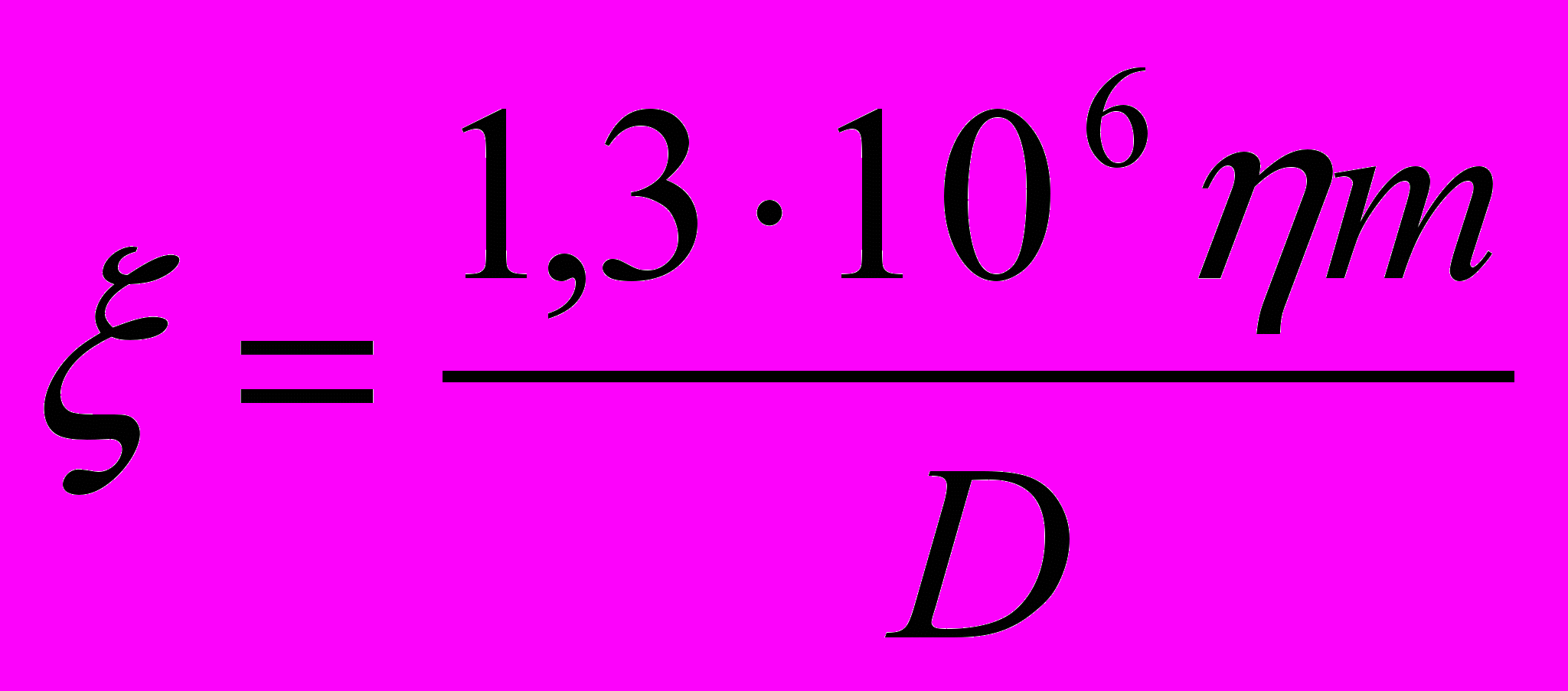 (2).
(2).Потенциалы гетеросуспензий < 25 мВ, что является подтверждением их малой устойчивости. Эффективный
 - потенциал частиц гетеросуспензий принимали как среднее значение от суммы
- потенциал частиц гетеросуспензий принимали как среднее значение от суммы  - потенциалов разнородных частиц, составляющих дисперсную фазу:
- потенциалов разнородных частиц, составляющих дисперсную фазу: 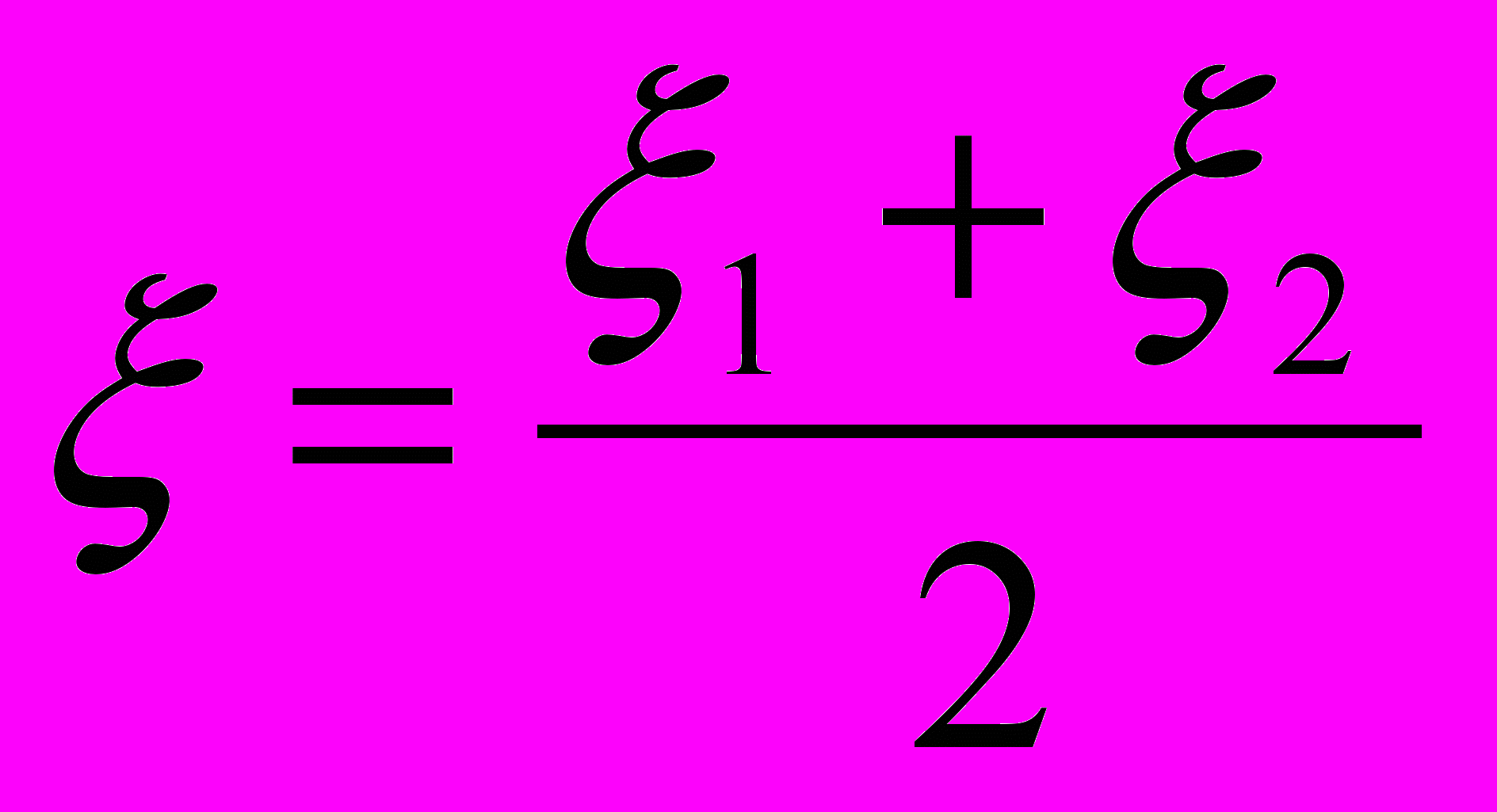 (3).
(3).Таблица 10. Электрокинетические потенциалы и электрофоретические подвижности гетеросуспензий, содержащих гипан, для гетеросуспензий различных составов: I – асбест – 12 г/л; гипан (17 % р-р) – 8 г/л; вода до 1 л; II - асбест – 15 г/л; гипан (17 % р-р) – 10 г/л; TiO2 – 60 г/л; вода до 1 л; III -- асбест – 15 г/л; гипан (17 % р-р) – 10 г/л; ZrO2 – 50 г/л; вода до 1 л; VI - асбест – 8 г/л; гипан (17 % р-р) – 5 г/л; TiO2 – 25 г/л; вода до 1 л;
| Состав суспен-зии | Время осажде-ния, t, c | Uэфф, 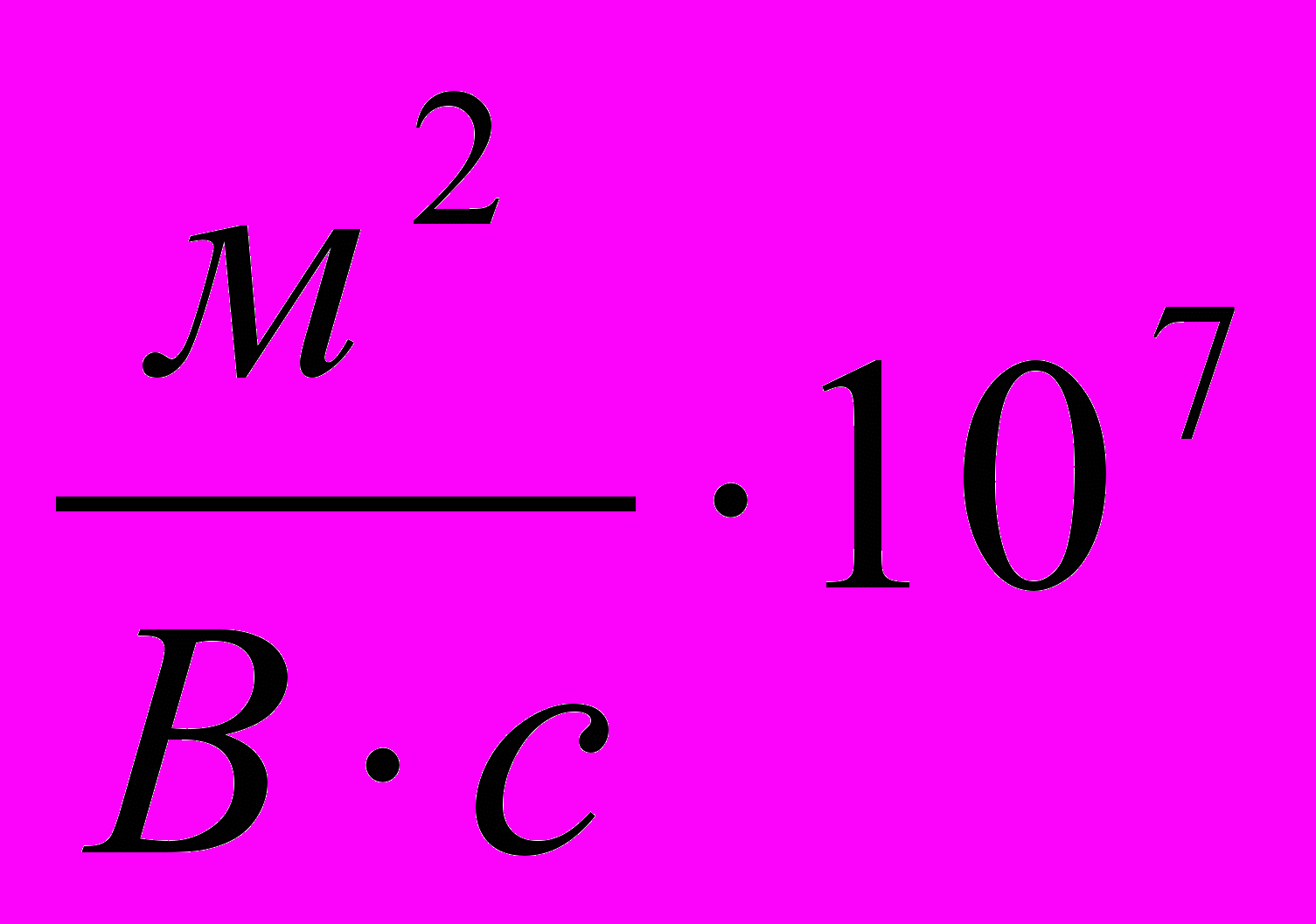 | 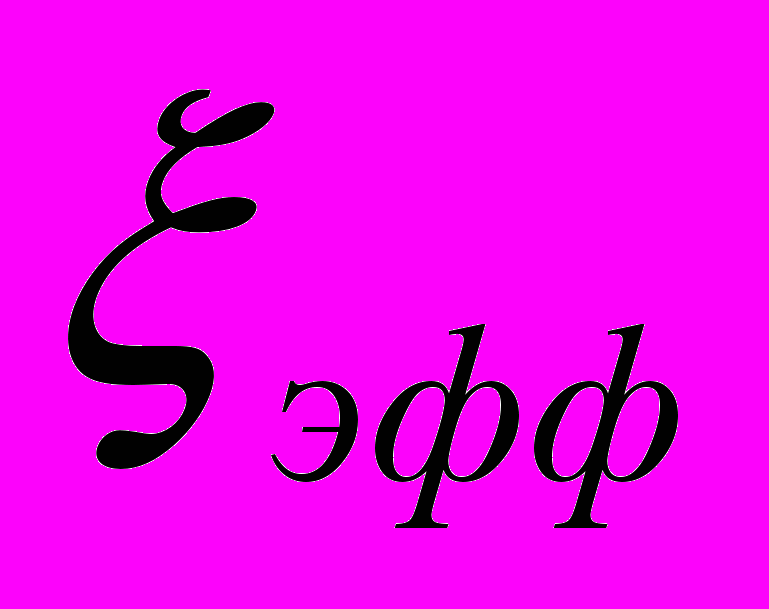 , ,мВ | Вяз- кость 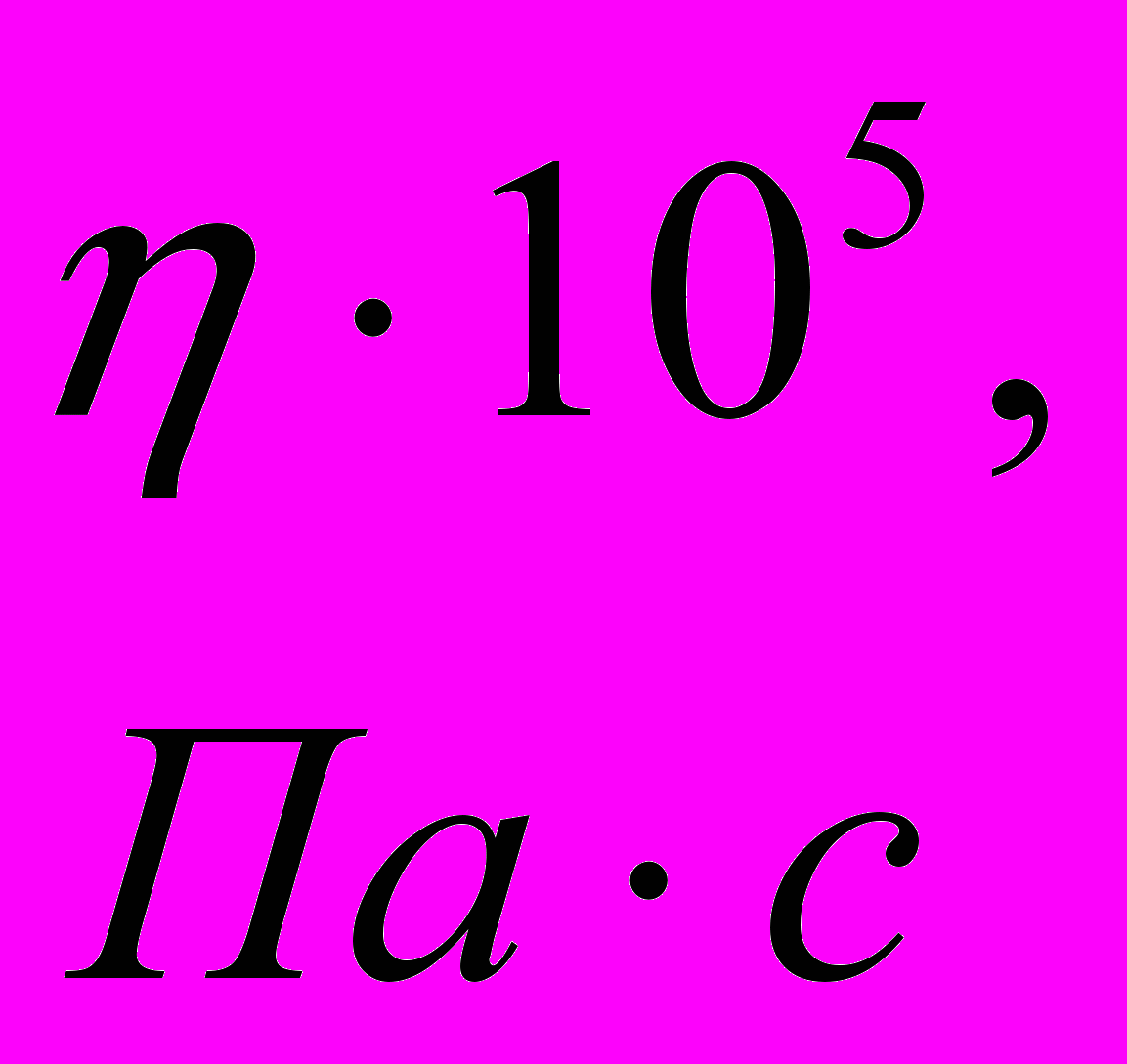 |  , мВ , мВ | Объемная концент-рация твердой фазы, C0, 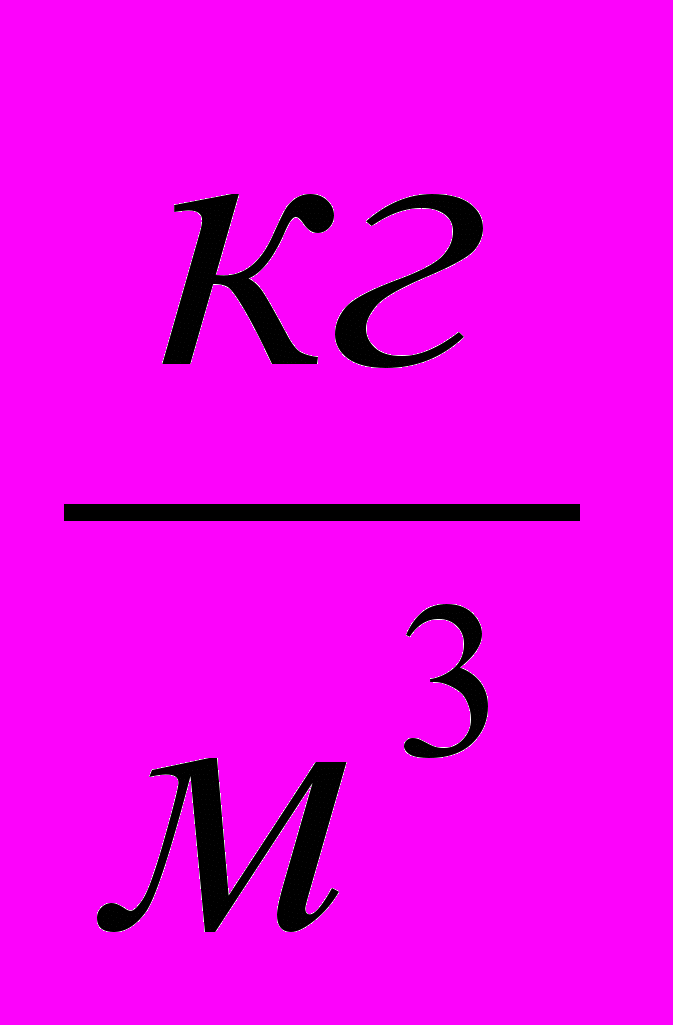 | Концент-рация в приэлект- родной зоне, Cm, 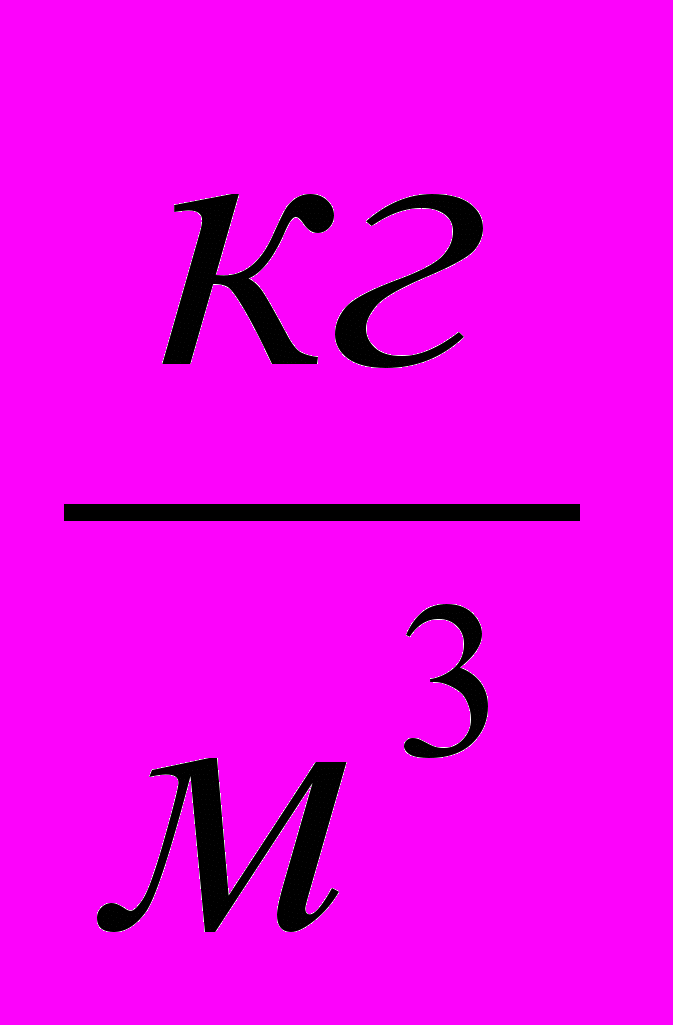 | |||
| (1) | (2) | (3) | (4) | |||||||
| I | 180 | 1,5 | -5,6 | -4,3 | 5,46 | - | - | 12,0 | 12,45 | |
| 240 | 1,7 | -6,4 | -4,8 | |||||||
| II | 90 | 1,3 | -9,9 | -5,0 | 7,25 | -13,7 | -23,1 | 75,0 | 77,10 | |
| III | 180 | 2,6 | -9,7 | -8,3 | 5,93 | -21,6 | -13,5 | 65,0 | 69,50 | |
| IV | 15 | 2,6 | -5,6 | -7,6 | 5,46 | -5,2 | -13,1 | 32,0 | - | |
Величины электрокинетических потенциалов рассчитывали также по форму-ле с учетом концентрации:
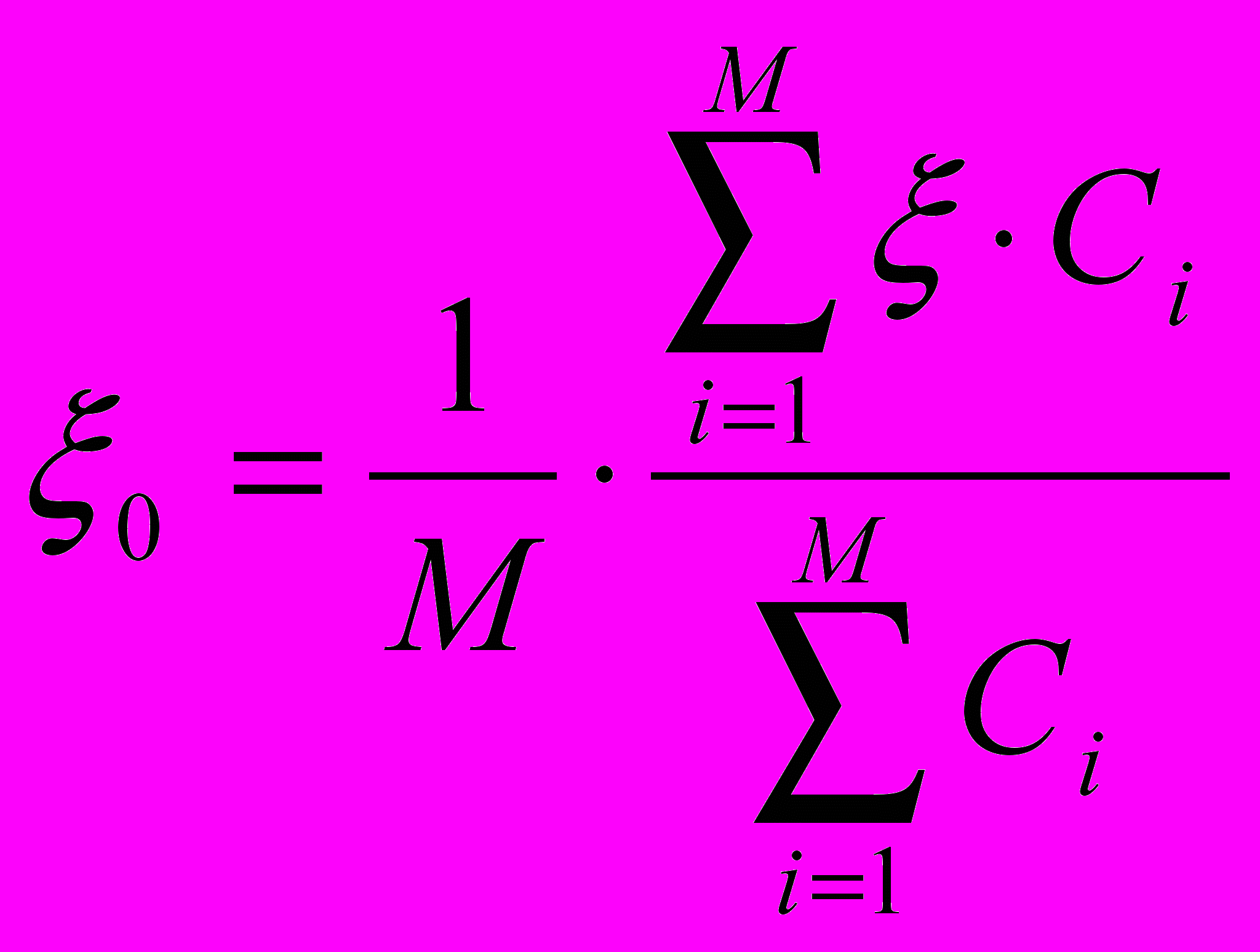 (4).
(4).Измеряя экспериментально величину
 , также были вычислены
, также были вычислены  - потен-циалы соответствующих компонентов (табл.10).
- потен-циалы соответствующих компонентов (табл.10).Была определена концентрация суспензии в приэлектродной зоне при электрофоретическом осаждении из гетеросуспензий в электрическом поле, задан-ном системой коаксиальных цилиндрических электродов на основании зависимос-тей выхода электрофоретического осадка от времени (рис. 23) и уравнению:
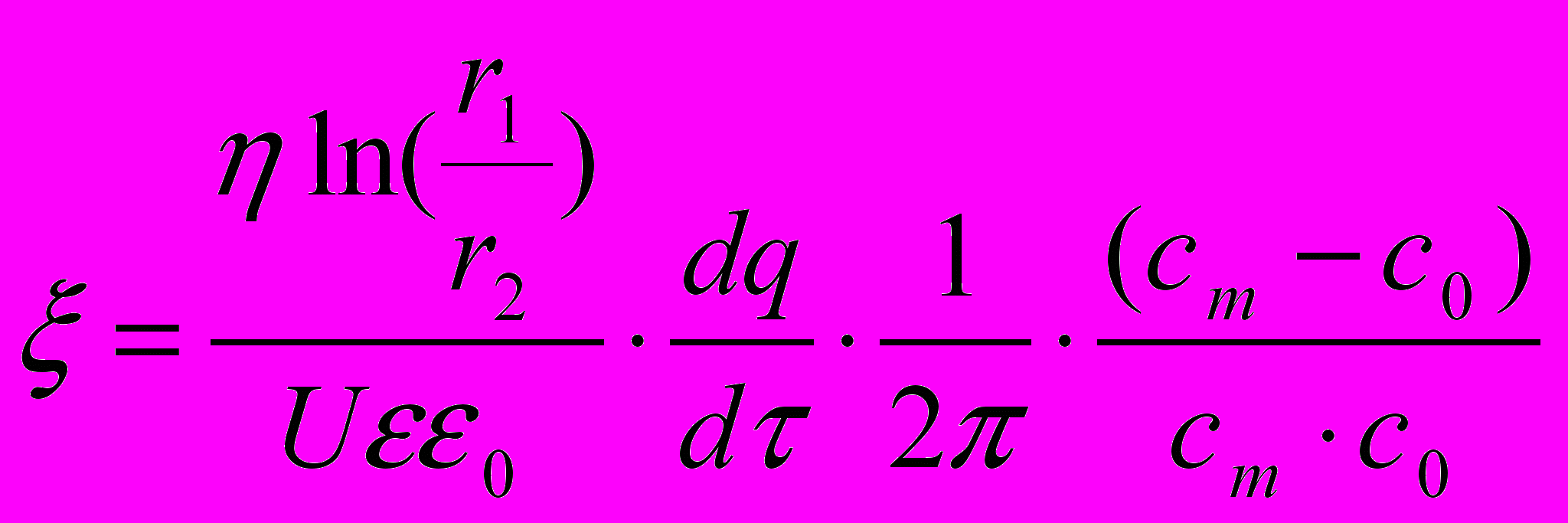 (5)
(5)Полученные результаты по определению эффективных значений uэфф и
 эфф позволяют более надежно оптимизировать условия электрофоретического осаждения комбинированных покрытий, так как электрофоретический выход и состав осадка зависят от этих величин. Гипан, применяемый в качестве связующего компонента, является анионактивным полимером. При наложении электрического поля происходит движение волокон асбеста с адсорбированным полимером к аноду. В водной среде анодная поляризация приводит к подкислению приэлект-родного слоя. В кислой среде полимер образует нерастворимую форму, в результа-те чего на электроде высаживаются частицы асбеста вместе с полимером. Образую-щ
эфф позволяют более надежно оптимизировать условия электрофоретического осаждения комбинированных покрытий, так как электрофоретический выход и состав осадка зависят от этих величин. Гипан, применяемый в качестве связующего компонента, является анионактивным полимером. При наложении электрического поля происходит движение волокон асбеста с адсорбированным полимером к аноду. В водной среде анодная поляризация приводит к подкислению приэлект-родного слоя. В кислой среде полимер образует нерастворимую форму, в результа-те чего на электроде высаживаются частицы асбеста вместе с полимером. Образую-щ
аяся гелеобразная масса имеет прочное сцепление с поверхностью. Полученные сепарационные материалы обладают высокими барьерными свойствами по сравне-н
ию с традиционными (хлорин, капрон), применяемыми в Ni-Cd аккумуляторах, способствуют предотвращению шунтообразования.
6.2. Адсорбционные свойства макромолекул полимеров, применяемых в качестве сепараторов. Нами исследована адсорбция поливинилхлорида (ПВХ) при различных температурах из разбавленных растворов его в дихлорэтане на волокнистых сорбентах, используемых в качестве армирующих наполнителей полимерных композиционных материалов. Рассмотрено применение основного уравнения теории объемного заполнения микропор (ТОЗМ) для оценки параметров пористой структуры волокнистых сорбентов. Применение уравнения ТОЗМ к системам полимер – растворитель – волокно можно обосновать исходя из термодинамического подобия процессов сорбции на полимерах и микропористых сорбентах. С термодинамической точки зрения, процессы сорбции паров полимерами и микропористыми сорбентами подобны, поэтому закономерно их описание одним уравнением ТОЗМ. При изучении адсорбционных равновесий в системе поливинилхлорид марки С-7059-М (ПВХ) – растворитель - волокно из бинарных разбавленных растворов рассмотрено применение основного уравнения ТОЗМ для оценки параметров пористой структуры используемых волокнистых сорбентов (гидроцеллюлозного и полиакрилонитрильных волокон).
Изученные адсорбционные характеристики высокопрочных углеродных волокон из разбавленных растворов фенола и применение ТОЗМ для описания адсорбционных равновесий дало возможность рассчитать параметры пористой структуры углеродных волокон, что обеспечивает эффективное применение альтернативной технологии – поликонденсационного способа наполнения для углепластиков.
6.3. Термодинамика адсорбционных равновесий в системах ДАФС-25 – растворитель – сорбент. Приведеннные на рис. 24 изотермы адсорбции ДАФС-25 из ДИПЭ на активированном угле, силикагелях АСК, МСК, карбонате кальция и цеолите NaХ в области разбавленных растворов имеют одинаковый характер, при этом наибольшие значения величин избыточной адсорбции наблюдаются при адсорбции ДАФС - 25 на активированном угле, в меньшей степени на силикагелях МСК и АСК, цеолите NaX и меньше всего на карбонате кальция. Такие величины адсорбции можно объяснить строением молекулы дикетона. Последняя обладает звеньями, на периферии которых локально сос-редоточена электронная плотность (π - cвязи, свободные электронные пары).
Из возможных механизмов адсорбции вероятнее всего хемосорбция, что соответствует представлению о такой ориентации адсорбируемых молекул, при которой взаимодействие с поверхностью осуществляется за счет полярных групп, а цепочки углеводородных радикалов обращены к раствору. Можно предположить, что в механизме адсорбции на силикагелях главную роль играет эффективный объем, в котором сказывается влияние карбонильной группы. Из рис. 24 видно, что изотерма адсорбции на угле более крутая, что связано, очевидно, с возрастанием энергии адсорбционного потенциала микропор угля по сравнению с потенциалом более широких пор других адсорбентов. Заполнение тонких пор молекулами происходит уже при относительно низких концентрациях адсорбата в растворах.
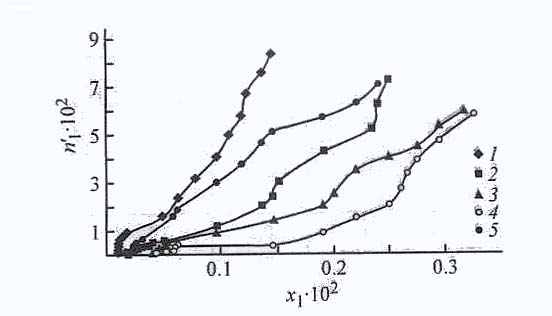 | 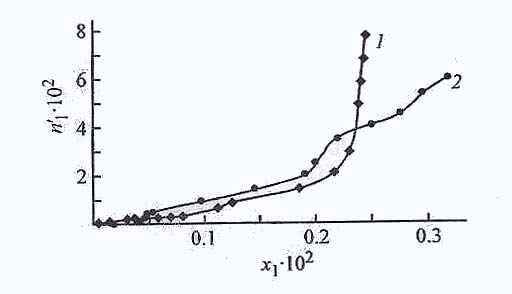 |
| Рис. 24. Изотермы адсорбции ДАФС-25 из ДИПЭ на адсорбентах АУ, NaX, силикагелях АСК и МСК и карбонате кальция при 298 К. n11-количество адсорбированного ДАФС-25 (ммоль∙г -1), х1, - мольная доля ДАФС-25 в растворе; то же для рис. 2, 3. 1 - АУ, 2 - АСК, 3 - NaX, 4 – СаСО3, 5 - МСК. | Рис. 25. Изотермы адсорбции ДАФС-25 из разбавленных растворов ДИПЭ (1) и толуола (2) на цеолите NaX при 298 К. |
Анализ экспериментально полученных изотерм адсорбции ДАФС - 25 из ДИПЭ и толуола на цеолите NaX показывает, что в начальной области концент-раций величины адсорбции ДАФС - 25 незначительны. Это можно объяснить кон-курентной адсорбцией ДАФС - 25 и растворителя (рис. 26).
Наибольшие величины адсорбции ДАФС - 25 из бинарных растворов наблюдаются на активированном угле, что не противоречит теории адсорбции на адсорбентах различной химической природы. Установлено, что величины адсорб-ции ДАФС - 25 из бинарных растворов при повышении температуры увеличивают-ся (рис. 27). По - видимому, в адсорбционной системе ДАФС - 25 – карбонат каль-ция с ростом температуры ослабляется взаимодействие молекул растворителя с адсорбентом. При этом конкурирующая способность молекул растворителя за обладание мест на поверхности карбоната кальция с повышением температуры становится малой.
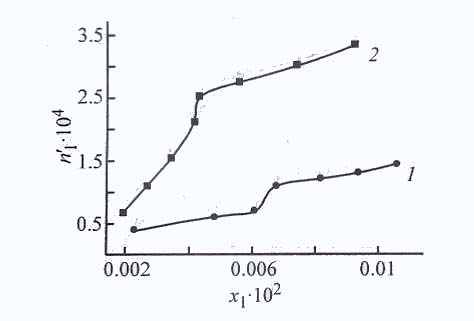 |  |
| Рис. 26. Изотермы адсорбции ДАФС-25 из разбавленных растворов в ДИПЭ на карбонате кальция при температурах 293 (1) и 313 К (2). | Рис. 27. Концентрационные зависимости изменения химического потенциала ∆Ф (Дж∙г-1) (1-5) сорбентов и свободной энергии Гиббса ∆G (Дж∙г-1) (1’-5’) адсорбции ДАФС-25 из толуола при 298 К. х1 - мольная доля ДАФС-25 в растворе; то же для рис. 30, 31. 1,1'- NaX; 2, 2’ - АСК; 3, 3' - АУ; 4, 4' – СаСO3; 5, 5' -МСК. |
Так как растворы очень разбавлены и растворимость растворяемого вещест-ва ограничена низкой мольной долей, изотерма изменения состава раствора преоб-разуется в индивидуальную изотерму адсорбции растворенного вещества, несмотря на возможность адсорбции значительного количества растворителя.
Для термодинамического рассмотрения адсорбционных систем использовали метод избыточных величин Гиббса. Химический потенциал сорбента определяли по уравнению:
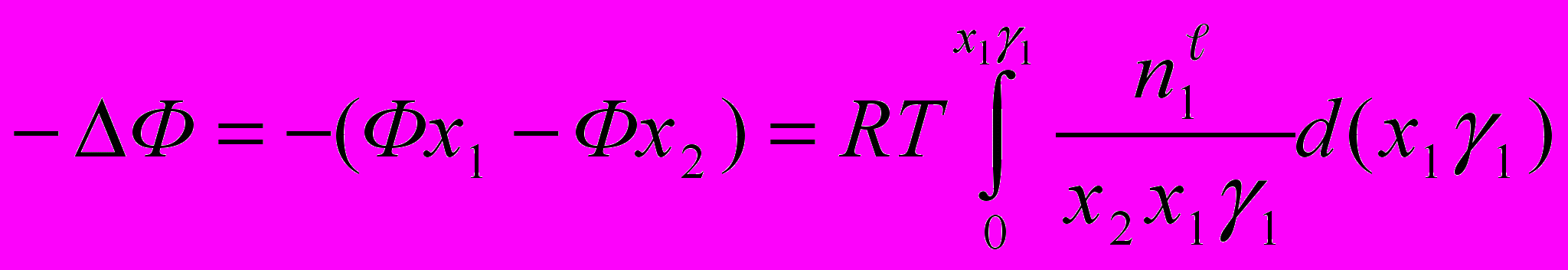
где
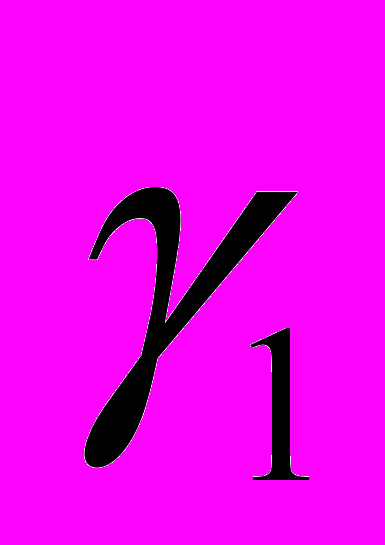 - коэффициент активности компонента 1 объемного раствора.
- коэффициент активности компонента 1 объемного раствора.Изменение свободной энергии сорбционной системы вычисляли по уравне-нию:
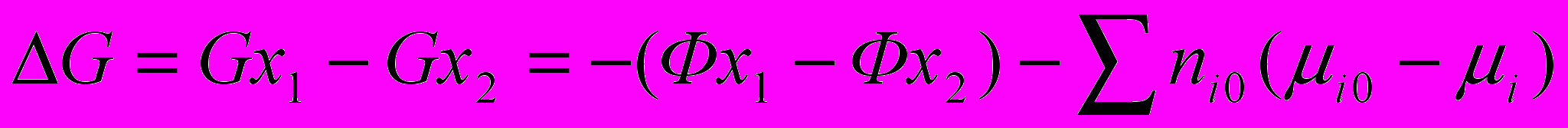
где (Фx1 – Фx2) – изменение химического потенциала сорбента;
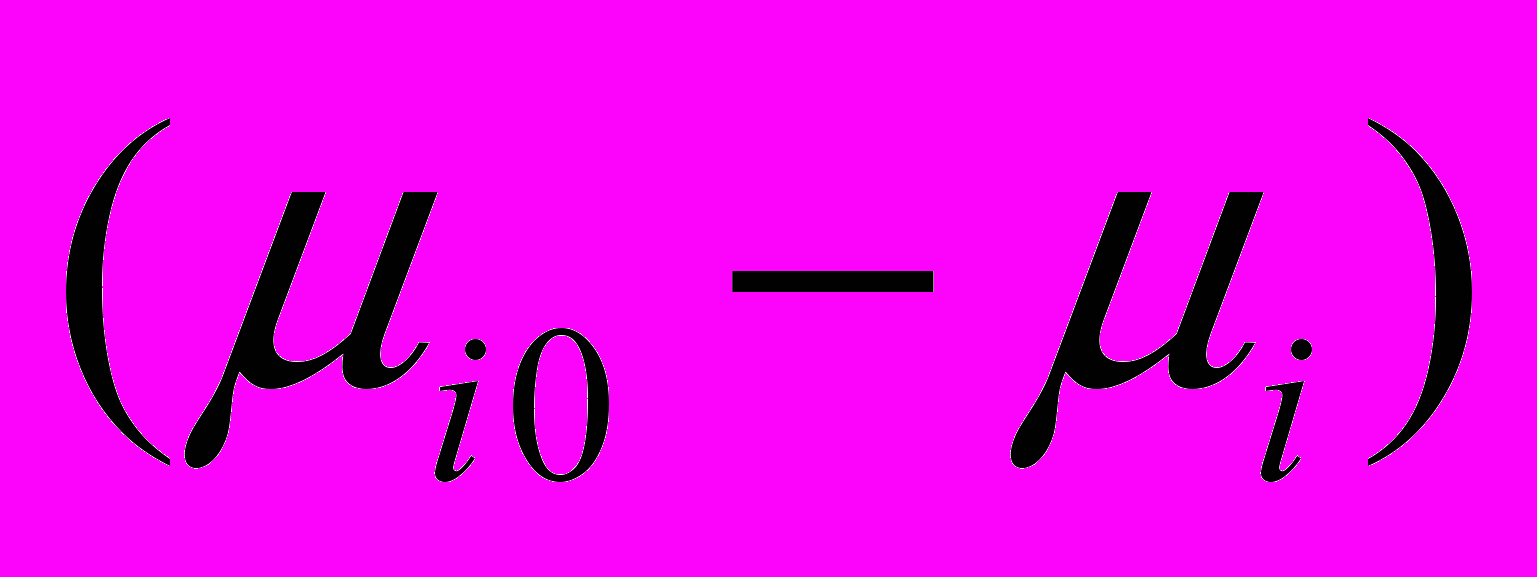 - изменение химического потенциала объемного раствора.
- изменение химического потенциала объемного раствора. 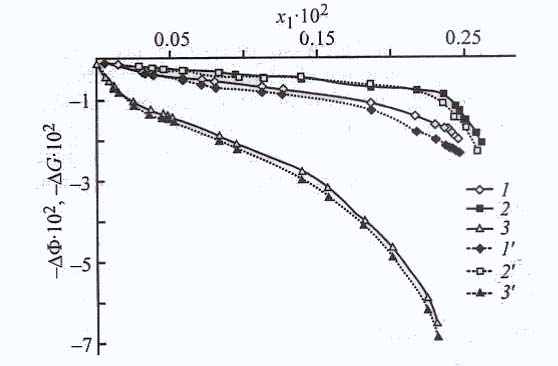 | Рис. 28. Концентрационные зависимости изменения химического потенциала ∆Ф (Дж∙г-1) (1-3) сорбентов и свободной энергии Гиббса ∆G (Дж∙г-1) (1'-5') адсорбции ДАФС-25 из ДИПЭ при 298 К. 1,1’ - NaX; 2, 2’ – СаCO3; 3, 3' - АСК. |
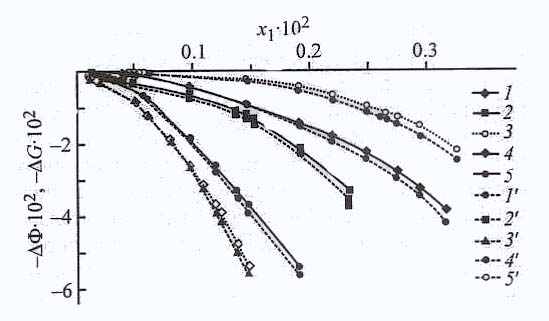
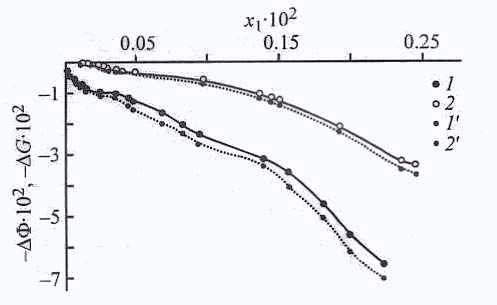
Наибольшие значения изменения химического потенциала ΔФ (рис. 28) и энергии Гиббса ΔG наблюдаются при адсорбции из толуола на активированном угле, что хорошо согласуется с величиной избыточной адсорбции, а в меньшей степени – на карбонате кальция.
К
Х1, мол. доля
онцентрационные зависимости изменения химического потенциала ΔФ и энергии Гиббса ΔG адсорбции ДАФС - 25 из ДИПЭ на цеолите NaX, карбонате кальция и силикагеле АСК, приведенные на рис. 28, свидетельствуют о том, что если изменения химического потенциала ΔФ и энергии Гиббса ΔG ДАФС - 25 на цеолите NaX и карбонате кальция сравнимы по величине, то на силикагеле АСК они значительно выше.
Термодинамические функции позволяют более надежно проследить влияние растворителя. На рис. 29а) представлены изменения потенциала ΔФ и энергии Гиббса ΔG при адсорбции ДАФС - 25 из толуола и ДИПЭ на силикагеле АСК. На основе рассмотренных значений изменения термодинамических функций можно утверждать, что адсорбция из ДИПЭ выше, чем из толуола, а на цеолите NaX влияние растворителя не слишком сказывается при адсорбции ДАФС-25.
Концентрационные зависимости изменения химического потенциала ΔФ и энергии Гиббса ΔG (рис. 29 б) свидетельствуют, что в ДИПЭ адсорбция на карбонате протекает значительно лучше. В результате проведенного термодина-мического анализа можно указать на возможную конкуренцию растворителя с растворенным веществом за адсорбционные центры поверхности. Поверхности используемых адсорбентов химически неоднородны, так как на них находятся различные центры с высокой и низкой энергией адсорбции, как полярные, так и неполярные группы.
Проведенные исследования показали, что характер адсорбции из растворов зависит не только от свойств объемного раствора, но и от химической природы поверхности и размера пор сорбента.
В
Х1, мол. доля
озможны процессы проникновения биологически - активных веществ на основе ДАФС - 25 через клеточные мембраны и в случае использования угля в качестве энтеросорбента это вещество, его метаболиты или продукты распада будут сорбироваться и выводиться из организма. Полученные данные могут быть использованы для создания новых энтеросорбентов, обладающих антиоксидант-ными свойствами, и которые могут быть применены для профилактики отравле-ний различного рода токсикантами.
 а а | б  |
| Рис. 29. Концентрационные зависимости изменения химического потенциала ДФ (Дж∙г-1) (1, 2) силикагеля АСК (а) и CaCO3 (б) и свободной энергии Гиббса ∆G (Дж∙г-1) (1', 2') адсорбции ДАФС-25 из ДИПЭ (1, 1') и толуола (2, 2') при 298 К. | |
6.4. Поверхностная активность селеносодержащих гетероароматических соединений в реакциях катодного выделения – анодного растворения кадмия и его сплавов на медном электроде. Изменение природы гетерального фрагмента в
 - электронной структуре органического катиона приводит к сильному изме-нению удельной электропроводности и, как следствие, поверхностной активности, которая нами была исследована для 4H – селенопирана, перхлората и бромцинката 2,4,6-трифенилселенопирилия, а также перхлоратов 2-метоксифенил, 4-фенил-тиохромилия и 2-фенил, 4-метилтиохромилия.
- электронной структуре органического катиона приводит к сильному изме-нению удельной электропроводности и, как следствие, поверхностной активности, которая нами была исследована для 4H – селенопирана, перхлората и бромцинката 2,4,6-трифенилселенопирилия, а также перхлоратов 2-метоксифенил, 4-фенил-тиохромилия и 2-фенил, 4-метилтиохромилия.По величине электропроводности эти соли относятся к полупроводникам (удельная электропроводность в кристаллическом состоянии лежит в пределах (0,1 …8,1)∙10-3 Cм/см. Сопоставление величин электропроводности перхлоратов показывает, что введение заместителей алкильного или арильного типа в боковую цепь вызывает снижение электропроводности почти на 1,5 – 2 порядка, что можно объяснить изменением степени сопряжения в углеродном остове катиона.
Увеличение числа фенильных заместителей в органическом катионе и пере-ход от бициклических соединений к моноциклическим сопровождается увеличе-нием предельного тока окисления на 2 порядка.
Предварительные исследования показали, что электровыделение кадмия на медном электроде протекает в две стадии:
C
 d2+ + 2
d2+ + 2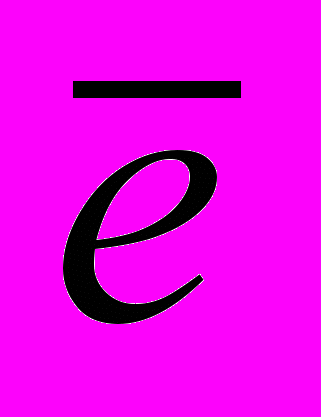 + Cu
+ Cu  Cd(Cu) (1)
Cd(Cu) (1)Cd2+ + 2
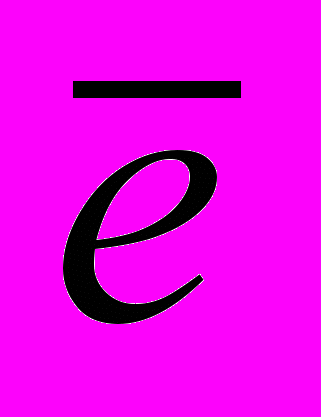
 Cd (2)
Cd (2)которым на i,t – кривых отвечают две площадки тока. На начальном этапе образуется интерметаллическое соединение CdCu2. Скорость реакции (1) харак-теризуется более высокой плотностью тока и не зависит от концентрации раствора в интервале 0,5 – 1,5 моль/л. Последующий анализ состояния поверхности электро-дов с помощью метода анодной хронопотенциометрии показал, что в 1,5 M раство-ре СdSO4 наиболее затруднена стадия растворения зародышей сплава СdCu2.
Высокая концентрация ионов кадмия в растворе затрудняет их переход из сплава в раствор. Построение зависимости lgi -
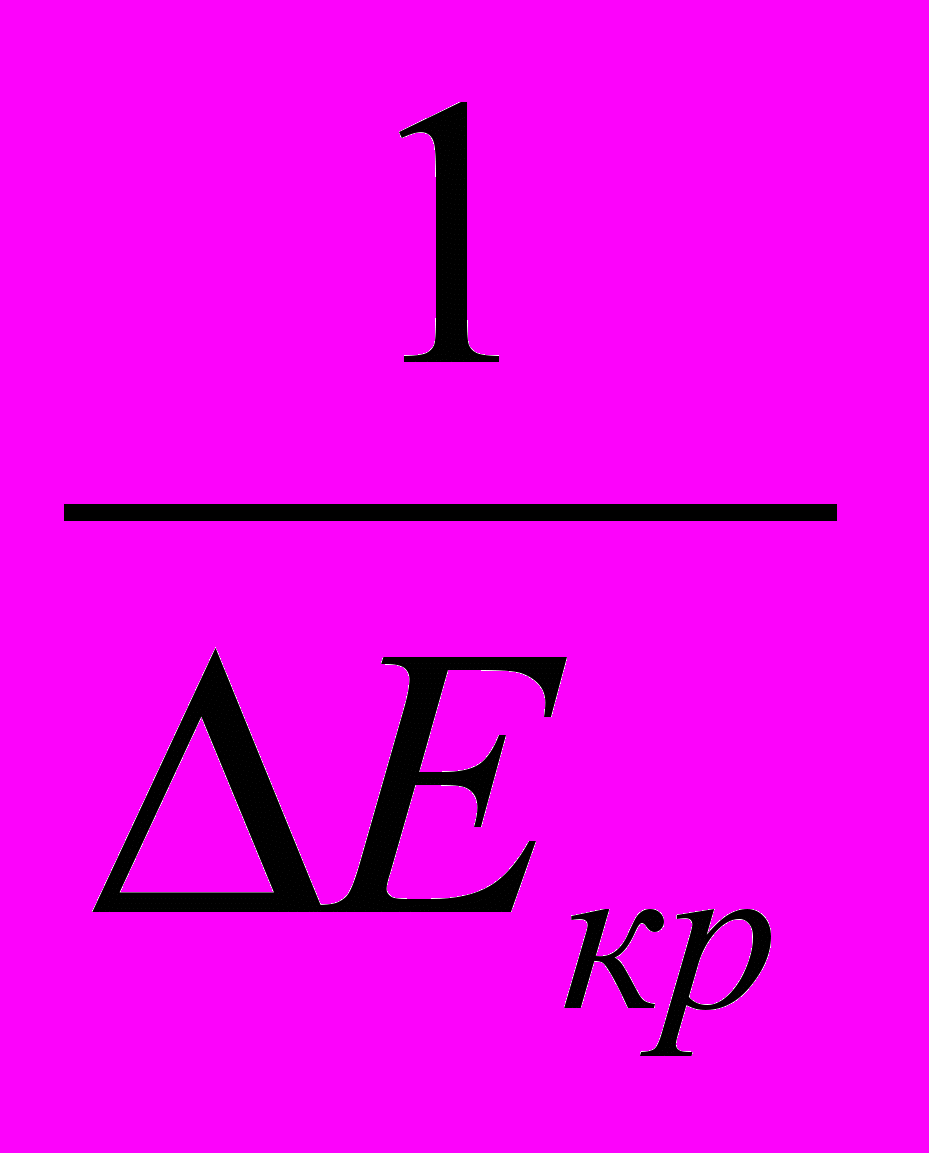 показало, что реакция (1) в анодном направлении протекает по двумерному механизму путем послойного сня-тия сформированного осадка. Величина
показало, что реакция (1) в анодном направлении протекает по двумерному механизму путем послойного сня-тия сформированного осадка. Величина  практически не зависит от введения ПАВ в раствор СdSO4, но пик потенциала появляется позже и меняется переходное время
практически не зависит от введения ПАВ в раствор СdSO4, но пик потенциала появляется позже и меняется переходное время  процесса анодного растворения кадмия. Потенциал реакции (задержка на E,t – кривой) оказывается весьма чувствительным к концентрации ПАВ при введении в раствор CdSO4 добавок NH4Cl и H3BO3. В первом случае при изменении содержания ПАВ от 10-6 до 10-3 моль/л потенциал задержки в ходе анодной E,t – кривой смещается от – 0,20 до – 0,45 В, а в случае добавки H3BO3 фиксируется в области -0,15 …-0,30 B. Значительно сокращается переходное время
процесса анодного растворения кадмия. Потенциал реакции (задержка на E,t – кривой) оказывается весьма чувствительным к концентрации ПАВ при введении в раствор CdSO4 добавок NH4Cl и H3BO3. В первом случае при изменении содержания ПАВ от 10-6 до 10-3 моль/л потенциал задержки в ходе анодной E,t – кривой смещается от – 0,20 до – 0,45 В, а в случае добавки H3BO3 фиксируется в области -0,15 …-0,30 B. Значительно сокращается переходное время  процесса. В выбранном интервале концентраций ПАВ (10-6
процесса. В выбранном интервале концентраций ПАВ (10-6  10-3 моль/л) оно соответственно составило:
10-3 моль/л) оно соответственно составило:| CdSO4 (ПАВ) | CdSO4 + NH4Cl (ПАВ) | CdSO4 + H3BO3 (ПАВ) |
| 1500 - 2160 | 1360 - 1800 | 900 - 1300 |
Таким образом, адсорбция ПАВ на поверхности осадка оказывает на него стабилизирующее действие и затрудняет его переход в раствор. Исследование влияния ПАВ ионогенного гетероциклического строения, содержащего селен в качестве гетероатома на процесс электровыделения и анодного растворения кадмия на Сu электроде в растворе состава 1M CdSO4 + 0,6M NH4Cl + 0,5 M H3BO3 в потенциостатическом режиме (Ek = - 0,9 B) показало, что значительное влияние на скорость процесса оказывает природа аниона гетероароматической соли (таблица 11). Полученные данные позволили предположить, что в стационарных условиях адсорбирующиеся на электроде катион - радикалы селенопирилия участвуют в реакции катодного внедрения кадмия и встраиваются в структуру медного электро-да с образованием сплава типа CdxSeyCu.
Исследование электрохимического поведения образующейся фазы методом анодной хронопотенциометрии в интервале плотностей анодного тока 25…100 мА/см2 показало, что с увеличением плотности анодного тока потенциал задержки на Е – t – кривых становится менее отрицательным и уменьшается переходное время процесса.
Снижение также концентрации 4H – селенопирана в растворе в пределах 10-3…10-5 моль/л мало влияет на величину потенциала задержки, но вызывает увеличение переходного времени. Практически не сказывается на величине потен-циала задержки на Е-t – кривых введение трибромцинката 2,4,6 – трифенил-селенопирилия, и замена трибромцинкат – аниона на перхлорат сопровождается смещением потенциала в отрицательную сторону и увеличением переходного вре-мени процесса анодного растворения кадмия из сплава.
В отличие от катодного процесса образования зародышей новой фазы CdxSey(Cu), их анодное растворение протекает по двумерному механизму путем десорбции образующихся ионов с поверхности.
Cогласно представленным данным, замена перхлората 2,4,6 – трифенил-селенопирилия на 4H-селенопиран не вызывает сколько – нибудь заметных измене-ний в кинетике электровыделения кадмия из растворов, содержащих борную кислоту. Хотя имеет место некоторое возрастание стационарной плотности тока при уменьшении концентрации 4H-селенопирана, величина iстац остается выше, чем в чистом растворе CdSO4 без добавок и близка к значениям, фиксируемым в растворе CdSO4 + H3BO3 c добавками перхлората 2-метоксифенил – 4 – фенил-триметилентиопирилия.
При замене 4H – селенопирана на перхлорат и бромцинкат 2,4,6 – трифенил-селенопирилия обнаружен интересный эффект: увеличение концентрации бром-цинката сопровождается снижением плотности тока, однако, не ниже значений, наблюдаемых в растворах с добавкой 4Н -селенопирана, т.е. ингибирующий эффект ослабевает по мере снижения концентрации трибромцинката в большей степени и стационарная плотность тока возрастает в 1,5 – 2 раза по сравнению с 4H – селенопираном.
Таблица 11. Влияние концентрации 4H – селенопирана (I), трибромцинката 2,4,6 – трифенилселенопирилия (II), перхлората 2,4,6 – трифенилселенопирилия (III) и плотности тока на кинетические характеристики процесса анодного растворения Cd из Cu(Cd)-электрода в растворе 1 моль/л CdSO4 + 0,5 моль/л H3BO3 + 0,6 моль/л NH4Cl
| СПАВ, 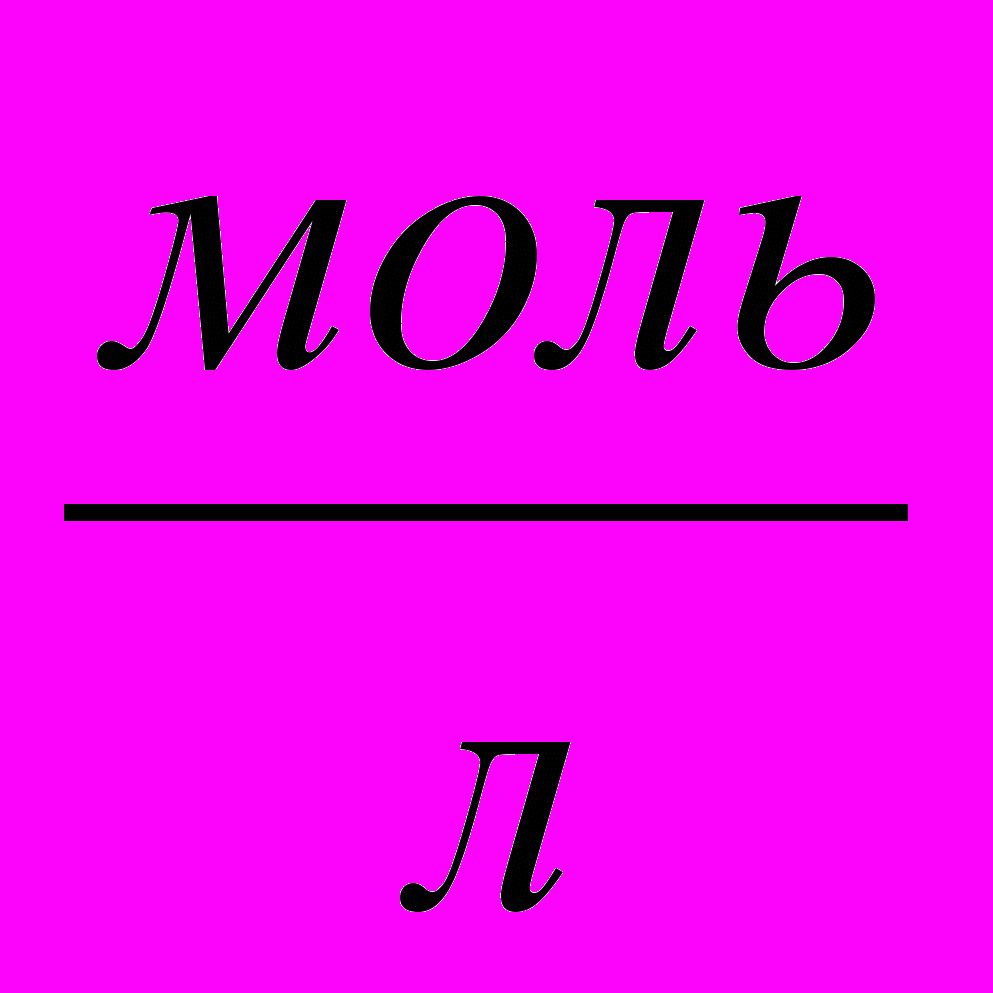 | ip, мА/см2 |  перех, c перех, c |  , , 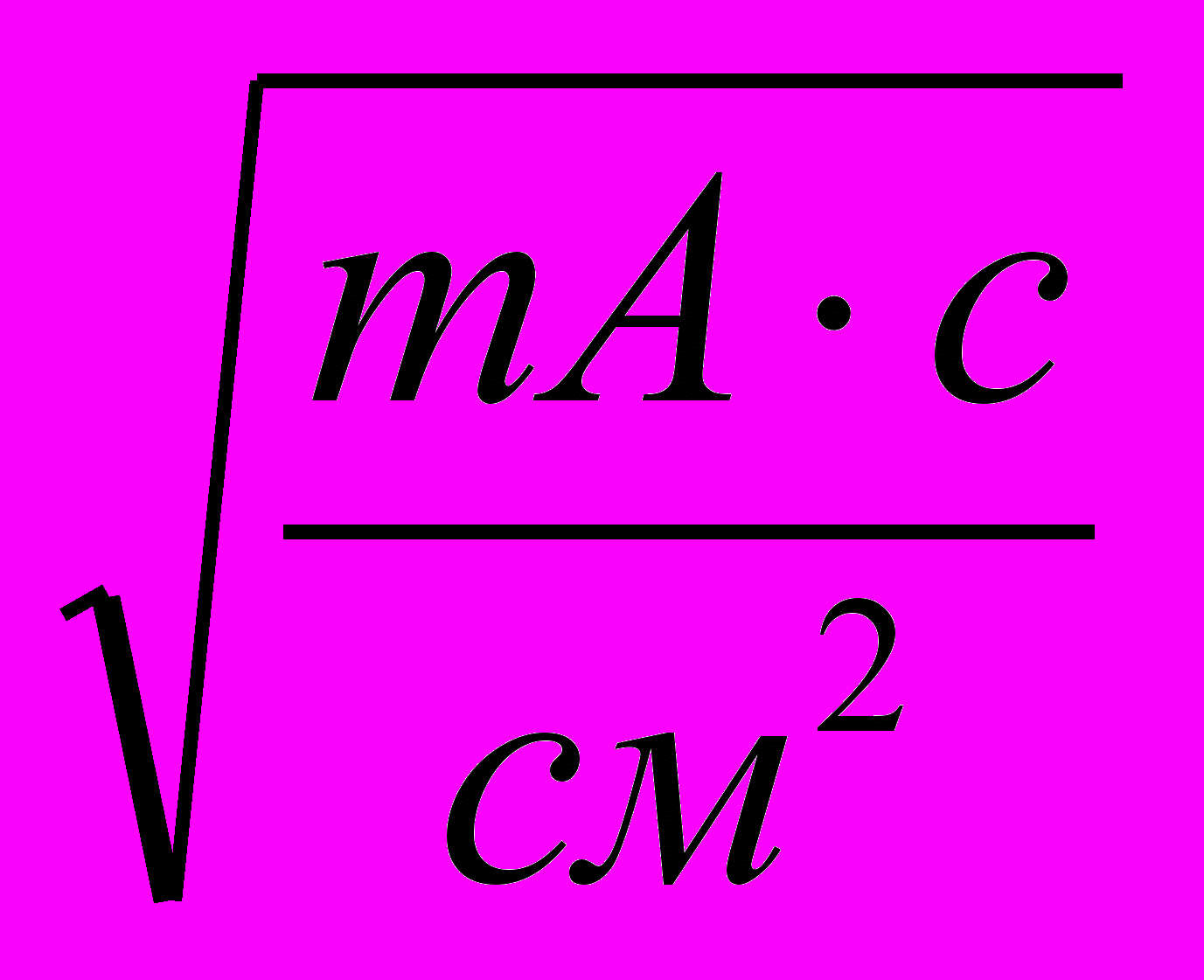 | -Eисх, В | ∆Екр, В | ||||||||||
| I | II | III | I | II | III | I | II | III | I | II | III | I | II | III | |
| 10-3 | 30 35 40 45 | 30 35 40 60 | 20 30 40 60 | 1347 2176 1230 1736 | 1438 1562 1618 1617 | 2935 1232 1898 1194 | 201 276 222 279 | 208 234 254 311 | 242 192 276 268 | 0,65 0,65 0,60 0,65 | 0,64 0,64 0,64 0,64 | 0,62 0,62 0,63 0,64 | 0,2 0,24 0,21 0,27 | 0,20 0,21 0,24 0,29 | 0,15 0,16 0,26 0,05 |
| 10-4 | 25 30 35 45 | 30 35 40 45 | 25 35 30 100 | 1527 1464 2622 1258 | 501 1404 1564 1258 | 1969 1268 1352 1780 | 262 210 303 177 | 126 222 250 238 | 222 211 201 422 | 0,64 0,64 0,64 0,64 | 0,64 0,64 0,64 0,64 | 0,63 0,62 0,63 0,55 | 0,23 0,20 0,28 0,12 | 0,21 0,22 0,24 0,22 | 0,18 0,16 0,16 0,26 |
| 10-5 | 30 35 40 100 | 30 35 40 45 | 30 35 40 45 | 1581 1285 1459 1220 | 1626 1222 1627 1735 | 1012 1008 1565 760 | 218 212 242 349 | 221 207 255 279 | 174 188 250 185 | 0,62 0,63 0,63 0,64 | 0,64 0,64 0,64 0,64 | 0,62 0,62 0,62 0,63 | 0,21 0,19 0,20 0,18 | 0,18 0,19 0,24 0,26 | 0,07 0,14 0,22 0,17 |
| 10-6 | 30 35 40 45 | 25 30 35 40 | 25 35 40 100 | 1168 1069 1572 1356 | 1275 1591 1328 1734 | 2718 2963 1720 1505 | 187 193 251 247 | 179 218 216 263 | 261 322 262 388 | 0,64 0,63 0,64 0,64 | 0,64 0,64 0,65 0,64 | 0,65 0,64 0,64 0,64 | 0,17 0,20 0,24 0,21 | 0,15 0,20 0,20 0,25 | 0,21 0,27 0,19 0,19 |
Таким образом, природа аниона органической соли оказывает значительное влияние на скорость процесса. Это может быть связано с особенностями строения анионов СlO4- и ZnBr3- и их взаимодействием с ион-молекулярной структурой связей водного раствора сульфата кадмия, в какой-то мере уже разрушенной в результате внедрения в нее молекул NH4Cl и H3BO3.
Установлено, что как в растворе CdSO4, так и в смеси его с H3BO3, при введении ПАВ перенапряжение кристаллизации ΔЕкр снижается. Скорость катодного процесса максимальна при содержании ПАВ менее 10-3 М. Однако, при концентрации ПАВ 10-2 М дальнейшее уменьшение ΔЕкр становится пренебрежимо малым.
