Халькогенсодержащие органические соединения для преобразователей энергии и информации. Выбор вида, свойства, способы и технология их получения >02. 00. 05 электрохимия
| Вид материала | Автореферат |
- Тема урока: органические соединения: микро- и макромолекулы. Углеводы: строение, свойства,, 76.1kb.
- Лабораторная работа №2 Важнейшие классы неорганических соединений, 88.03kb.
- Карбонильные соединения, 186.01kb.
- Лекция Информация и ее основные свойства, 421.3kb.
- Стереохимия, область химии, изучающая пространственное строение молекул и влияние этого, 19.63kb.
- 3 лекция Носители, знаки, символы и сигналы. Виды сигналов. Свойства информации. Способы, 287.92kb.
- Разработка и строительство экологически безопасной технологии производства кремния, 48.31kb.
- Тема: «циклопарафины: строение, свойства, применение», 55.94kb.
- Рабочая программа по Теоретической электрохимии для специальности 250300 Технология, 375.63kb.
- «нетрадиционные способы получения энергии», 572.54kb.
В целях исключения влияния твердого электролита на формирование орга-низации суперионного состояния в органических электронопроводящих системах полупроводниковой природы была предпринята попытка исследования этого явле-ния непосредственно в прямом контакте щелочного металла и органического про-водника.
4.1 Электрохимическое поведение 4-метил-2-фенил-5,6- тетраметилен-тиопирилия
Исследованы зависимости плотности тока электрохимического восстановле-ния перхлората 4-метил-2-фенил-5,6- тетраметилентиопирилия (IX) от потенциала, скорости и длительности катодной поляризации, содержания сажи в составе электрода.
На рис. 12 - 14 приведены потенциодинамические кривые (хроновольт-амперограммы) соли IX при различных скоростях развертки потенциала. Из хода потенциодинамических кривых (рис. 12) видно, что на катодном полуцикле электрохимическое восстановление соли тиопирилия характеризуется максимумом тока. После реверса тока в катодной области пик исчезает, однако на кривой обратного хода при потенциале пика имеется излом.
В анодной области потенциалов на анодном полуцикле потенцио-динамической кривой регистрируется второй максимум, которому на кривой обратного хода также отвечает излом. Таким образом, при катодной поляризации в области потенциалов от 0 до 2,2 В протекает один катодный процесс. Спектры ЭПР показали, что в этих условиях на катоде образуется органический катион-радикал 4-метил-2-фенил-5.6- тетраметилентиопирилия. При реверсе тока в анодную сторо-ну протекает обратный процесс окисления продукта катодной реакции до исход-ного катиона.
В анодной области потенциалов происходит процесс окисления сажи с обра-зованием соединения внедрения с органическим катионом, образование которого обнаруживается уже в отсутствие тока при простом механическом перетирании.
Введение сажи в состав катодного материала и образование соединения внедрения облегчает протекание процесса катодного восстановления органической соли и переводит процесс в диффузионный режим, что подтверждается линейным характером зависимости плотности тока при потен-циале максимума Eмакс от корня квадратного из скорости развертки потенциала
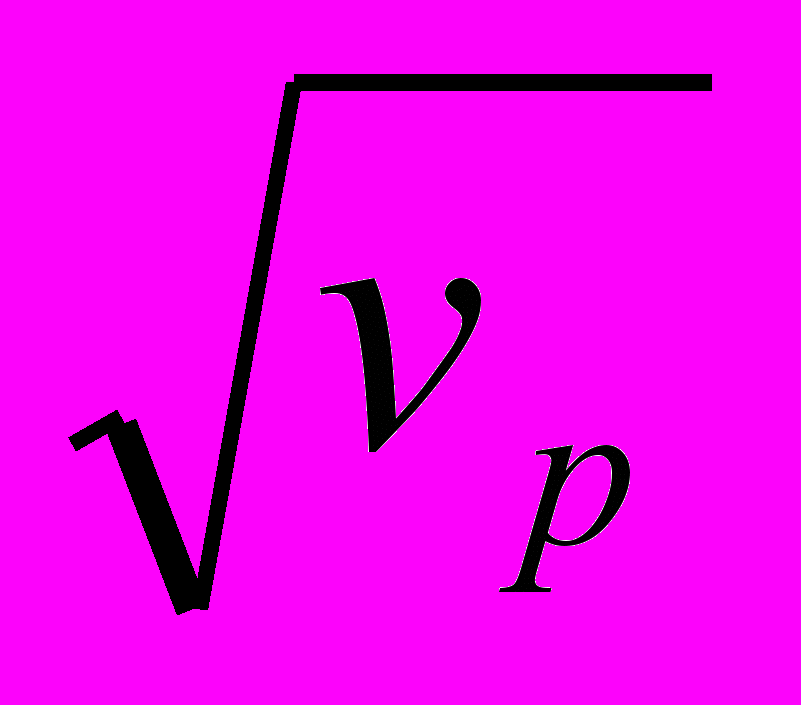 . Давление прессования оказывает существенное влияние на увеличение скорости электрохимического процесса (рис. 12 и 13).
. Давление прессования оказывает существенное влияние на увеличение скорости электрохимического процесса (рис. 12 и 13).Такое объяснение экспериментальных данных согласуется с зависимостью хода циклических потенциодинамических кривых от количества сажи в составе электрода (рис.15). С увеличением количества сажи от 10 до 50 масс. % плотность тока в максимумах потенциодинамических кривых на катодном и анодном полуциклах возрастает. Снижение плотности тока на электроде при более высоком содержании сажи можно объяснить пересыщением структуры соли частицами сажи. Таким образом, сажа играет важную роль в твердофазных превращениях на электроде из ИОС: она не только облегчает перенос электрического тока, но через образующееся соединение внедрения оказывает каталитическое влияние на процесс восстановления ИОС. С рассмотренных позиций возрастание плотности тока на электроде при многократном циклировании (более 10 циклов) можно объяснить накоплением соединения внедрения и увеличением скорости его обра-зования вследствие роста количества поверхностных дефектов в результате такой катодно-анодной проработки электрода.
Из рис. 15 и таблицы 3 следует, что с увеличением Vp плотность тока на катодном полуцикле растет и достигает своего максимального значения при содер-жании сажи в составе электрода 50 %, в то время как при реверсе тока увеличение содержания сажи практически не оказывает влияния на скорость процесса. В анодной области потенциалов от 2,5 до 4 В наблюдается тот же эффект, что можно проследить в согласии с данными таблицы 3.
Изучение природы замедленной стадии процесса электрохимического восстановления cоединения IX.
Ход гальваностатических кривых (рис. 16) указал на замедленность стадии кристаллизации, а именно на торможение скорости образования зародышей новой фазы. Значения разности потенциалов в пике и на площадке E, t – кривой для раз-личных плотностей катодного тока приведены в таблице 5. Эту разность потен-циалов Екр можно принять за перенапряжение кристаллизации.
Полученные данные позволяют говорить об электрохимическом превраще-нии на катоде катиона органической соли в катион-радикал с его последующей димеризацией. Образование новой фазы происходит по механизму двумерных зародышей. Вследствие разрастания зародышей в монослой местом реакции оказы-вается внутренняя граница раздела между образовавшейся фазой продуктов и материалом катода. Таким образом, скорость электрохимических процессов на гра-нице ионной органической соли с твердым электролитом должна в значительной степени определяться состоянием этой границы.
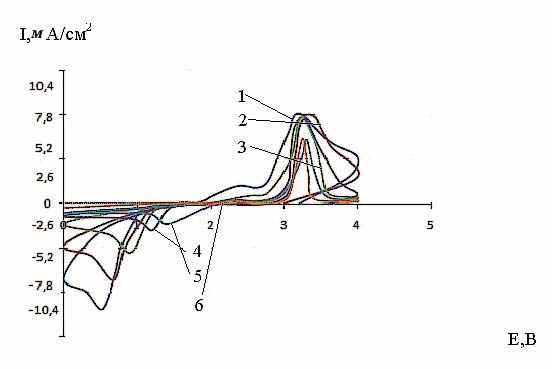 | 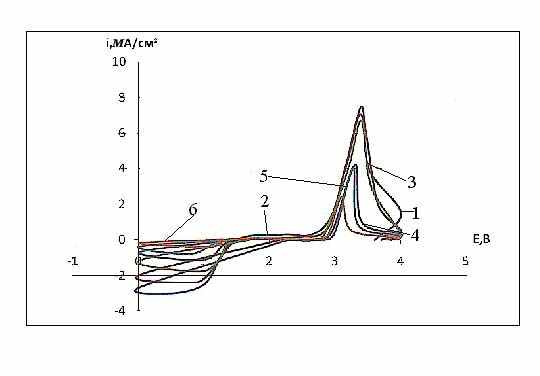 |
| Рис. 12. Циклические потенциодина-мические кривые электрохимического прев-ращения cоли IX при 20°С и скоростях развертки потенциала (мВ/с):1-80;2-40;3-20;4-8;5-4;6-2; содержа-ние сажи в катоде 30 мас.%, давление прессования 10 кгс/см2. | Рис. 13. Циклические потенциодинамические кривые электрохимического превращения cоли IX при 20°С и различными скоростями развертки потенциала (мВ/с) : 1-80, 2-40, 3-20, 4-8, 5-4, 6-2; давление прессования 12,5 кгс/см2; содержание сажи в катоде 30 масс. % |
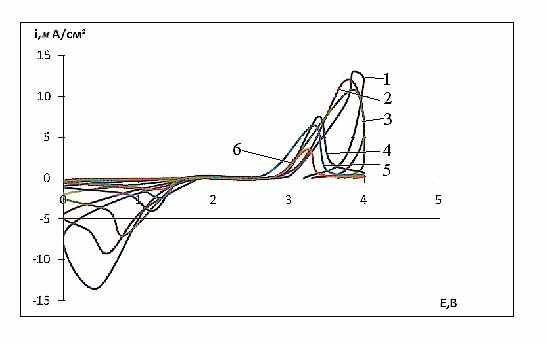 | 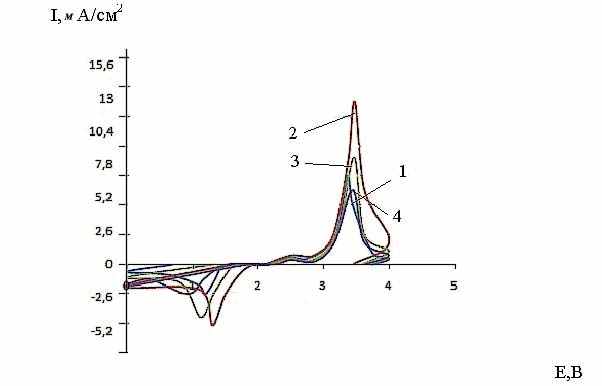 |
| Рис. 14. Циклические потенциодинамичес-ие кривые электрохимического превращения cоли IX при 20°С и различными скоростями развертки потен-циала, мВ/с: 1-80, 2 - 40, 3 - 20, 4 - 8, 5 - 4, 6 - 2; давление прессования 15кгс/см2; содер-жание сажи в катоде 30 масс. % | Рис. 15. Циклические потенциодинамические кривые электрохимического превращения cоли IX при 20°С с различным содер-жанием сажи и скорости развертки потенциала 8 мВ/с: 1-30; 2-50; 3-85; 4-90 мас.% соли тиопирилия; 70; 50; 15; 10 мас.% сажи. |
Таблица 3. Значения плотности тока iмакс и потенциала Емакс в максимумах потенцио-динамических кривых на катодном полуцикле для электрода из ИОС IX при различном содержании сажи в зависимости от скорости развертки потенциала и температуре 200 С (потенциалы представлены относительно Na/Na+ электрода сравнения, также в табл.4,5).
| | Скорость развертки потенциала, Vр, мВ/с | Содержание сажи в составе электрода, масс. % | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| | | 10 | 15 | 30 | 70 | |||||
| | | iмакс, мА/см2 | Емакс, В | iмакс, мА/см2 | Емакс, В | iмакс, мА/см2 | Емакс, В | iмакс, мА/см2 | Емакс, В | |
| | 2 | 0,91 | 1,08 | 3,90 | 3,16 | 0,39 | | 1,30 | 1,12 | |
| | 4 | 2,34 | 0,95 | 7,30 | 3,30 | 1,89 | 1,41 | 1,89 | 1,14 | |
| | 8 | 2,60 | 0,80 | 9,40 | 3,45 | 2,65 | 1,22 | 2,60 | 0,75 | |
| | 20 | 5,20 | 0,61 | 11,95 | 3,60 | 4,68 | 0,95 | 4,94 | 0,50 | |
| | 40 | 7,70 | 0,46 | 13,5 | 3,70 | 7,54 | 0,74 | 7,49 | 0,35 | |
| | 80 | 12,5 | 0,48 | 14,5 | 3,90 | 10,40 | 0,52 | 9,75 | 0,40 | |
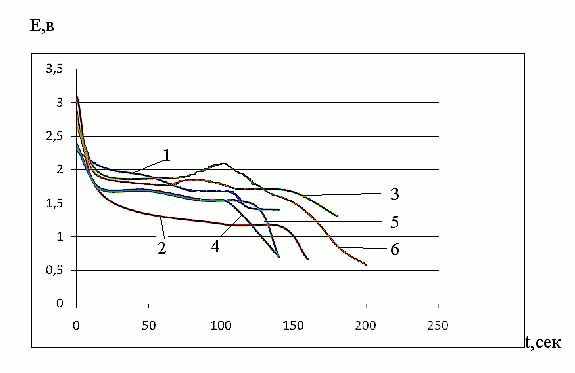 | Рис.16. Гальваностатические E,t – кривые атодного восстановления соли IX при 200 при плотности тока 0,065 мА см-2 с различным содержанием соли в катоде ( мас.%) : 1 - 30; 2 - 50; 3 - 70; 4 - 80; 5 - 85; 6 - 90. | |||||||||
Обнаруженные закономерности хорошо согласуются с результатами иссле-дования межфазной границы органическая соль – твердый электролит в потенцио-статическом режиме. Экспериментально обоснована зависимость скорости электрохимических превращений на электроде из ионной органической соли ряда тиопирилия от величины и скорости изменения потенциала и от концентрации до-бавки сажи в составе электрода. Установлено, что с наибольшей скоростью электрохимические превращения протекают на исследуемом электроде при содер-жании в его составе сажи в количестве 50 масс. % и такой состав электрода можно рекомендовать для дальнейших технологических разработок с целью использо-вания в твердофазных ХИТ. Показано, что процесс электрохимического восста-новления соли IX на границе с твердым электролитом, проводящим по ионам натрия, протекает по механизму образования двумерных зародышей.
Таблица 4. Значения плотности тока iмакс и потенциала Eмакс в максимумах потен-циодинамических кривых на анодном полуцикле для электрода из ионной органической соли IX при 200 С и различном содержании сажи в зависимости от скорости развертки потенциала
| vр, мВ/с | Содержание сажи в составе электрода, масс. % | |||||||
| | 10 | 15 | 30 | 70 | ||||
| iмакс, мА/см2 | Емакс, В | iмакс, мА/см2 | Емакс, В | iмакс, мА/см2 | Емакс, В | iмакс, мА/см2 | Емакс, В | |
| 2 | 0,160 | 3,19 | 0, 018 | 3,18 | 0,021 | 3,19 | 0,014 | 3,20 |
| 4 | 0,122 | 3,35 | 0,024 | 3,32 | 0,027 | 3,35 | 0,018 | 3,32 |
| 8 | 0,028 | 3,50 | 0,032 | 3,50 | 0,038 | 3,48 | 0,020 | 3,50 |
| 20 | 0,030 | 3,68 | 0,040 | 3,70 | 0,047 | 3,69 | 0,023 | 3,70 |
| 40 | 0,032 | 3,80 | 0,045 | 3,79 | 0,053 | 3,80 | 0,025 | 3,78 |
| 80 | 0,034 | 4,07 | 0,048 | 4,06 | 0,060 | 3,99 | 0,026 | 4,06 |
Таблица 5. Значения разности потенциалов в пике и на площадке E, i – кривых при различных плотностях тока катодной поляризации ионной органической соли с добавкой 30 масс. % сажи при 200 С.
| Потенциал E, В | Плотность катодного тока, мА/см2 | ||||||
| 0,015 | 0,025 | 0,045 | 0,065 | 0,075 | 0,085 | ||
| Потенциал Eпика | 1,75 | 1,60 | 1,52 | 1,35 | 1,27 | 1,18 | |
| Потенциал Еплощадки | 1,725 | 1,57 | 1,47 | 1,28 | 1,19 | 1,08 | |
| Потенциал ∆Eкр | 0,02 | 0,03 | 0,05 | 0,07 | 0,08 | 0,10 | |
Кривые i- t (рис.17) имеют характерный ход. Быстрый рост плотности тока на начальном этапе поляризации, появление максимума или площадки и мало меняющихся значений плотности тока на следующем этапе, затем быстрый спад плотности тока и выход на площадку постоянных значений при более длительной поляризации.
Снижение температуры ячейки в область отрицательных значений приводит к появлению на i,t – кривых двух максимумов на начальных этапах поляризации. Полученные данные хорошо согласуются с представлениями об образовании двух продуктов катодного восстановления соли IX. При отрицательных температурах длительная поляризация приводит к смене лимитирующей стадии как катодного, так и анодного процессов – оба процесса переходят в режим диффузионного контроля.
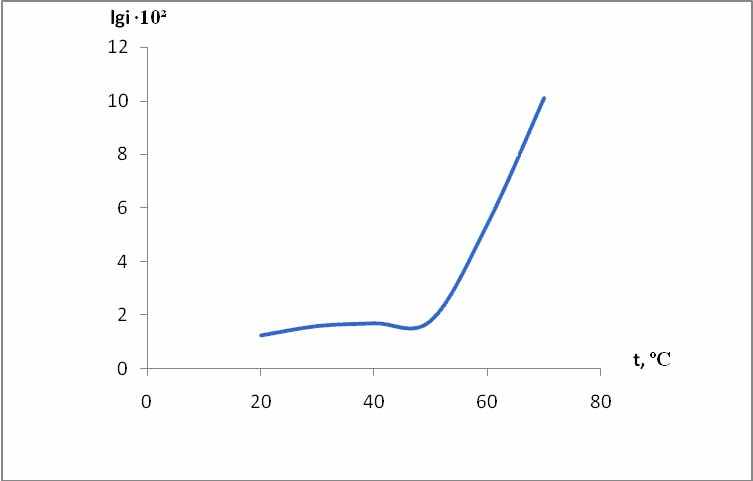
4.1.1. Влияние температуры и определение энергии активации. Нами исследовалось поведение электрода из ИОС при различных температурах. По зависимости lgi от 1/T рассчитаны значения эффективной энергии активации, представленные в таблицах 6, 7.
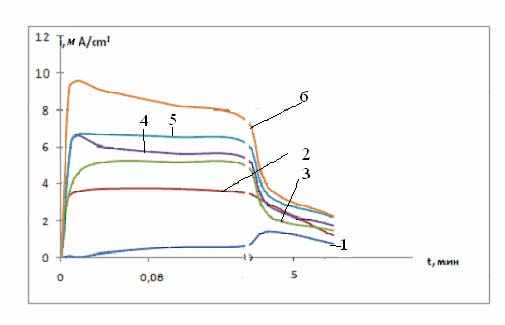 | Рис. 17. Потенциостатические i,t- кривые катодного восстановления cоли IX на границе с β-Al2O3 при 70°С , давление прессования 10 кгс/см2 и различных потенциалах, В (относительно натриевого электрода сравнения):1-1,4; 2-1,2; 3-1,0 ;4-0,8; 5-0,6; 6-0,4; содержание сажи в катоде 30 масс. % |
Анализ зависимости емкости от температуры, полученной QКП или отданной QАП электродом в процессе поляризации (рис.18) показывает, что при температурах 40…500C емкость мало меняется с температурой и составляет для катодного процесса (125…170)∙ 10-3 А ·с/см2, а для катодного (65…90) 10-3 А· с/см2. В области более высоких температур емкость резко возрастает и меняется линейно с температурой. При этом температурный коэффициент для катодного процесса
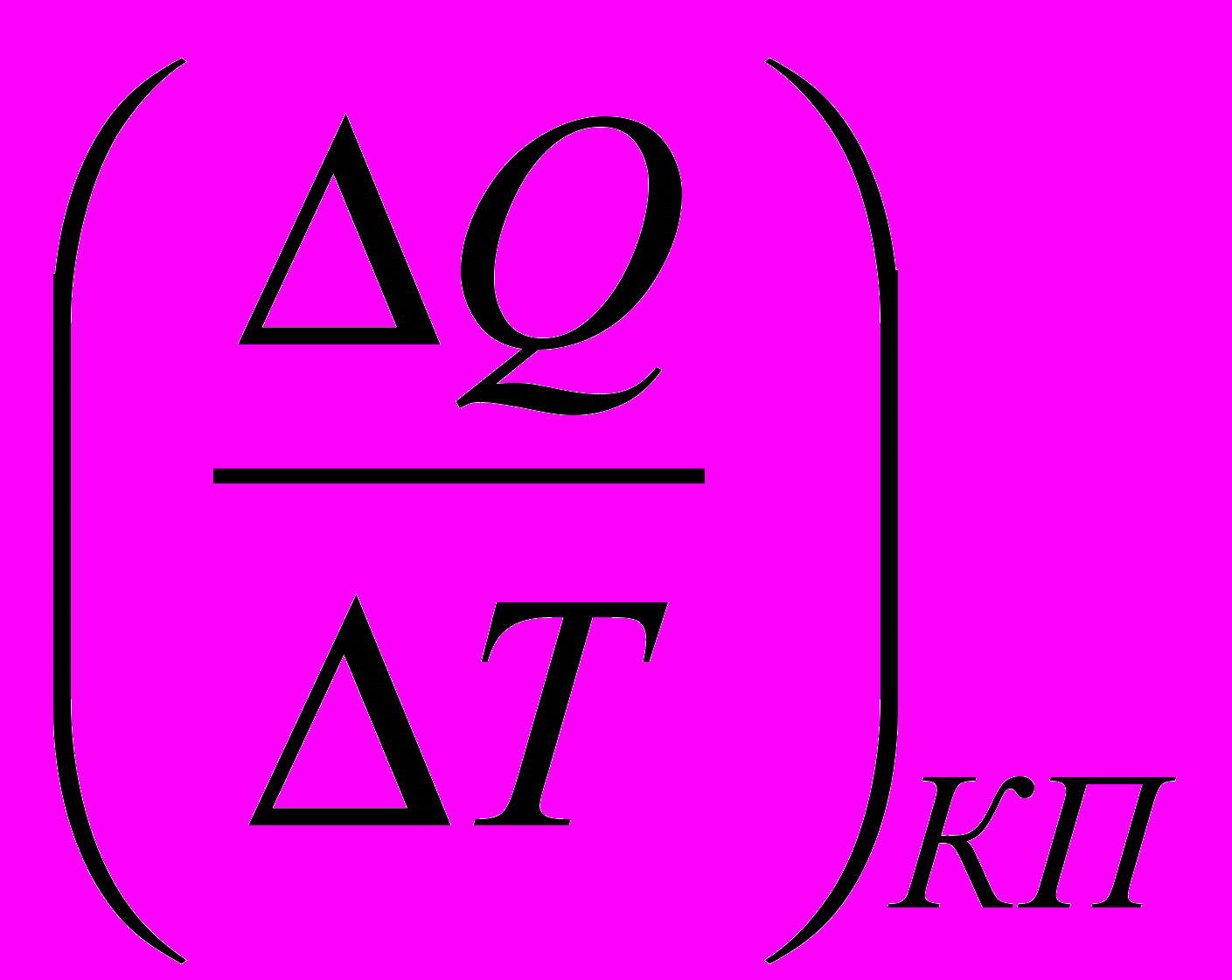 - 40· 10-3 А ·с/см2 град, а для анодного 12 ·10-3 А ·с/см2 град. Исследовалась частотная зависимость омической и емкостной составляющих импеданса границы электрод – твердый электролит при различных вариантах сборки электролитической ячейки: Na (β – Al2O3) Na(1); Na (β – Al2O3) Na 4-метил-2-фенил-5,6-тетраметилентиопирилия перхлорат (2); Na (β – Al2O3) 4-метил-2-фенил-5,6-тетраметилентиопирилия перхлорат 70 %, сажа 30 % (3); Na (β – Al2O3) cажа (4); Na (сажа β – Al2O3) cажа) Na (5); Na (сажа β – Al2O3) cажа) 4-метил-2-фенил-5,6-тетраметилентиопирилия перхлорат (ИОС) (6); ИОС(сажа(β – Al2O3) cажа) ИОС) (7).
- 40· 10-3 А ·с/см2 град, а для анодного 12 ·10-3 А ·с/см2 град. Исследовалась частотная зависимость омической и емкостной составляющих импеданса границы электрод – твердый электролит при различных вариантах сборки электролитической ячейки: Na (β – Al2O3) Na(1); Na (β – Al2O3) Na 4-метил-2-фенил-5,6-тетраметилентиопирилия перхлорат (2); Na (β – Al2O3) 4-метил-2-фенил-5,6-тетраметилентиопирилия перхлорат 70 %, сажа 30 % (3); Na (β – Al2O3) cажа (4); Na (сажа β – Al2O3) cажа) Na (5); Na (сажа β – Al2O3) cажа) 4-метил-2-фенил-5,6-тетраметилентиопирилия перхлорат (ИОС) (6); ИОС(сажа(β – Al2O3) cажа) ИОС) (7).Годографы импеданса этих систем представлены на рис. 19. Путем экстраполяции на ось омической составляющей импеданса было определено сопротивление R ячеек, которое составило соответственно:
Система 1 2 3 4 5 6 7
R, Ом 500 10000 340 600 300 650 11000
Таблица 6. Значения кажущейся энергии активации Еэфф для процесса катодного восстановления cоли XI на границе с β-Al2O3 в зависимости от величины ΔЕ и длительности катодной поляризации 8 с.
| Е, В | Т1 = 313 К i1 (А/см2)·10-3 | T2 = 343 K i2 (А/см2)·10-3 | Eэфф, кДж/моль |
| 1,4 | 0,445 | 0,60 | 8,88 |
| 1,2 | 0,660 | 3,68 | 51,10 |
| 1,0 | 0,570 | 5,15 | 65,40 |
| 0,8 | 0,460 | 5,55 | 74,00 |
| 0,6 | 0,425 | 6,40 | 80,60 |
| 0,4 | 0,390 | 7,90 | 89,40 |
Хемосорбция атомов углерода на поверхности полупроводника может про-исходить с частичным либо полным переносом заряда электрона из полупровод-ника на атом сажевого углерода с образованием ад-атомов.
Данные процессы облегчают протекание катодного восстановления органи-ческого катиона соли и способствуют переходу его в диффузионный режим. Такая интерпретация механизма процесса хорошо согласуется с результатами потенцио-статических измерений и линейным характером зависимости потенциала и плот-ности тока в максимуме потенциодинамических кривых от скорости развертки потенциала. Установленные зависимости между потенциалом, плотностью тока и составом вещества могут способствовать разработке новых катодных материалов твердофазных ХИТ.
Таблица 7. Значение кажущейся энергии активации Еэфф в анодном процессе для cоли XI на границе с β-Al2O3 в зависимости от величины ΔЕ и длительности катодной поляризации 8 с
| | EАП, В | Т1 = 313 К i1 (А/см2)·10-3 | T2 = 343 K i2 (А/см2)·10-3 | Eэфф, кДж/моль | ||
|---|---|---|---|---|---|---|
| | 2,8 | 0,35 | 1,07 | 48,40 | ||
| | 3,0 | 0,26 | 1,84 | 84,70 | ||
| | 3,2 | 2,02 | 2,00 | 0,43 | ||
| | 3,4 | 0,63 | 1,70 | 42,90 | ||
| | 3,6 | 0,11 | 1,55 | 114,50 | ||
| | 3,8 | 0,07 | 1,12 | 120,00 | ||
 |  | | ||||
| Рис. 23. Зависимость емкости от температуры для электрода из cоли XI при катодной поляризации в интервале температур от 20°С до 70°С; давление прессования 10 кгс/см2 ; содержание сажи в катоде 30% масс. | Рис. 24. Годографы импеданса систем: 1 - (Na) сажа/ β-AI2O3/сажа (ИОС); 2- (Na) сажа/ β-AI2O3/сажа (Na); 3 - (Na) / β-AI2O3/70% ИОС+ сажа 30%; 4- (Na) / β-AI2O3/сажа; 5 - (Na) / β-AI2O3/Na | | ||||
При использовании литиевого анода в виде сплавов алюминия образую-щаяся при предварительном анодном оксидировании оксидная пленка обеспечи-вает хорошую ионную проводимость. Такая система может быть использована в твердофазных ХИТ с органическими катодами.
4.2. Электрохимическая активность солей Симм.-октагидротиоксанти-лия и Симм.-октагидроксантилия. Проводимость солей определялась методом переменного тока в ячейке с двумя титановыми электродами. Величина удельной проводимости солей составила порядка 10-4 Ом-1*см-1, поэтому в дальнейшем в состав навесок солей вводили электропроводные добавки из смеси сажи и графита. При добавке смеси сажи и графита в количестве 10 масс % величина удельной проводимости исследуемых соединений составила 10-3 – 10-2 Ом-1*см-1. Обнару-жено, что величина удельной проводимости мало зависит от вида гетероатома и природы аниона, что показано в таблице 8.
Таблица 8. Удельная проводимость (σ) солей Симм.-октагидротиоксантилия в смеси 10% электропроводной добавкой
-
Анион
σ, Ом-1*см-1
I-
4,0*10-3
BF4-
1,2*10-3
ClO4-
4,0*10-3
FeClO4-
4,0*10-3
Окислительно-восстановительные потенциалы исследуемых систем с серой в качестве гетероатома уменьшаются в ряду:
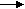
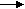
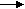 BF4- ClO4- FeCl4- I- .
BF4- ClO4- FeCl4- I- .а кислородсодержащих гетероциклов:
 I3- ClO4- FeCl4- .
I3- ClO4- FeCl4- .Для йодсодержащих анионов наблюдается тенденция снижения чувстви-тельности потенциала гетероцикла к величине плотности поляризующего тока, что связано не с природой гетероатома, а с комплексной структурой аниона I3-.
Данные таблицы 9 позволили предположить, что катодное восстановление исследуемых солей протекает через образование катион-радикалов, способных к дальнейшему восстановлению с концентрацией заряда на атоме углерода в поло-жении 9.
Методом РФА установлено, что катодное восстановление тетрахлорфер-риатов сопровождается образованием новой фазы, причем что оно протекает одновременно с образованием соединений внедрения с кристаллитами графита или сажи, вводимых в качестве электропроводной добавки. Катион натрия, который подходит к границе раздела фаз из электролита, взаимодействует с анионом FeCl4- c образованием солей NaCl, FeCl3. Органический катион, присоединяя электрон, превращается в радикал А, который при присоединении второго электрона обра-зует органический пиранил - анион Б, стабилизированный катионом натрия.
Скорость электрохимического восстановления солей симм-октагидротио-ксантилия и симм-октагидроксантилия также зависит от природы аниона и наибо-лее высока для тетрахлорферриатов и тетрафторборратов. Электрохимическая активность солей возрастает при замене кислорода на серу в гетероцикле и уменьшается при введении радикалов в положение 9.
Таблица 9. Электрическая проводимость (
 ) и потенциалы (отностельно Na/Na+ электрода) на границе с β – Al2O3 при 200 С; R1, R2, R3 – катион-радикалы октагидроксантилия, октагидротиоксантилия, октагидротиохромилия соответственно
) и потенциалы (отностельно Na/Na+ электрода) на границе с β – Al2O3 при 200 С; R1, R2, R3 – катион-радикалы октагидроксантилия, октагидротиоксантилия, октагидротиохромилия соответственно| Соль |  общ 104, общ 104, См ·см-1 | E, В | W, Вт· ч/кг |
| R1BF4- | - | 2,81 | 534 |
| R2BF4- | 13 | 2,85 | 516 |
| R1J5 | 11,4 | 2,86 | 168 |
| R2J5 | 4 | 2,75 | 174 |
| R3J3 | - | 3,2 | 345 |
| R1FeCl4 | 0,9 | 2,28 | 310 |
| R2FeCl4 | 40 | 2,68 | 352 |
| R3FeCl4 | - | 3,0 | 408 |
| R1ClO4 | 1,6 | 2,44 | 256 |
| R2ClO4 | - | 2,63 | 449 |
Параллельно возникает обратимая димеризация пиранил - радикала с образо-ванием дипирана В. Анодное окисление ведет к образованию катионов пирилия.
Продукты электрохимического восстановления солей способны обратимо окисляяться до исходных солей. Зависимость скорости восстановления исследуемых солей на катоде от содержания в составе катода сажи и графита, а также увеличение скорости восстановления при повторной катодной поляризации и после хранения позволили высказать предположение, что образующиеся соеди-нения внедрения оказывают каталитическое действие на процесс восстановления солей Cимм.-октагидротиоксантилия и Cимм.-октагидроксантилия. Образование новой фазы подтвердилось результатами рентгенофазного анализа и ИК-спектро-скопии.
Анализ экспериментальных данных позволил установить, что катодное вос-становление тетрахлорферриата симм-октагидротиоксантилия и тетрахлорфер-риата симм-октагидроксантилия является многостадийным процессом и протекает через образование радикала замещенного тиопирилия, который способен к даль-нейшему восстановлению с концентрацией заряда на атоме углерода в положение 9 и образованием натриевой соли. Параллельно возможна димеризация радикала. Таким образом, катионы натрия, образующие на аноде и диффундирующие через слой твердого электролита к границе с катодом, на первой стадии восстановления органических солей взаимодействуют с их анионами, а на второй – в реакции солеобразования участвует уже органический анион, образующийся в результате восстановления радикал симм-октагидроксантилия (симм-октагидротиоксантилия).
Таким образом, катионы натрия, образующиеся на аноде и диффунди-рующие через слой твердого электролита к границе с катодом, на первой стадии восстановления органических солей взаимодействуют с их анионами, а на второй – в реакции солеобразования участвует уже органический анион, образующийся в результате восстановления радикала симм-октагидроксантилия (симм-октагидро-тиоксантилия).
