Халькогенсодержащие органические соединения для преобразователей энергии и информации. Выбор вида, свойства, способы и технология их получения >02. 00. 05 электрохимия
| Вид материала | Автореферат |
- Тема урока: органические соединения: микро- и макромолекулы. Углеводы: строение, свойства,, 76.1kb.
- Лабораторная работа №2 Важнейшие классы неорганических соединений, 88.03kb.
- Карбонильные соединения, 186.01kb.
- Лекция Информация и ее основные свойства, 421.3kb.
- Стереохимия, область химии, изучающая пространственное строение молекул и влияние этого, 19.63kb.
- 3 лекция Носители, знаки, символы и сигналы. Виды сигналов. Свойства информации. Способы, 287.92kb.
- Разработка и строительство экологически безопасной технологии производства кремния, 48.31kb.
- Тема: «циклопарафины: строение, свойства, применение», 55.94kb.
- Рабочая программа по Теоретической электрохимии для специальности 250300 Технология, 375.63kb.
- «нетрадиционные способы получения энергии», 572.54kb.
Проведен анализ данных по электрохимическим и фотохимическим превра-щениям некоторых халькогенсодержащих соединений во взаимосвязи с биоло-гической и цитотоксической активностью, антиоксидантным и радиопротекторным действием.
Анализ литературных данных показывает практически отсутствие системати-ческих исследований по электрохимии этого класса соединений, между тем перс-пективность изучения электрохимического поведения халькогеносодержащих гетероциклов, создание основ их электрохимического получения во взаимосвязи с фотохимическими и адсорбционными свойствами связаны с тем, что благодаря особенностям строения эти вещества могут оказаться перспективными материа-лами для преобразователей энергии и информации.
ГЛАВА 2. ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В работе изучены следующие объекты:
1. 1,5 – дикетоны различного строения: 1,3,5 – трифенилпентадион - 1,5; 1,5 – дифе-нил - 3-метоксифенилпентадион - 1,5; 1,3,5 – триметоксифенилпентадион-1,5; 1,3,5 – три-метоксифенилпентадион-1,5; 1,5 –дифенил-3-селенапентандион-1,5 (препарат ДАФС – 25).
2. Водорастворимые селеноорганические соли: хлорид 2,6 – ди-(п-метокси-фенил)-4-фенилселенопирилия ( I); трифторацетат 2,4,6 – трифенилселенопирилия (II); бромид 2,4,6-трифенилселенопирилия (III); трифторацетат триметоксифенилселенопирилия (IV); трифторацетат 2,4,6 – три(п-метоксифенил)селенопирилия (V); трибромцинкат 2,4,6 – три-фенилселенопирилия (VI); трихлорцинкат 2,4,6 – трифенилселенопирилия (VII); перхло-рат 2,4,6 – трифенилселенопирилия (VIII);
3. Cоли тиопирилия (перхлорат 4-метил-2-фенил-5,6-тетраметилентиопирилия (IX) и др.);
4. Cоли тиохромилия (перхлораты 2-метоксифенил, 4 – фенилтиохромилия и 2-фенил-4-метилтиохромилия;
5. Cелена(тиа)циклогексаны: 2,4,6-трифенилтиациклогексан, 2,6-диметоксифенил-4-фенил-селенациклогексан, 2,4,6 - трифенилселенациклогексан; 2,6-дифенил-4-метокси-фенилселенациклогексан и 2,4,6-триметоксифенилселенациклогексан;
6. 9 – фенил – Симм. – октагидрохалькогеноксантены (9 –фенил. – Симм. – октагидроселеноксантен; 9-фенил.- Симм. –октагидротиоксантен; 9 –фенил.-Симм. – октагидроксантен) .
7. 4H -селенопираны.
Применялись связующие: анилинофенолоформальдегидный олигомер марки СФ – 342А (АФФО) – (ГОСТ 18694 – 80); фенолоформальдегидный олигомер (ФФО), синтезируемого из фенола и формальдегида с добавкой катализатора – NaOH; поливинилхлорид суспензионный ПВХ С7059М, гипан (продукт омыления полиакрил-нитрила - [С2Н3InСООNаСNп-мIТУ 6-01-166-74). В качестве магнитных наполнителей использовались легированный интерметаллический сплав системы неодим – железо – бор (Nd – Fe – B) марки HM – 20 P (ТУ 14-123-97-92), феррит бария BaO∙ 6Fe2O3 (TY 6 – 09-4788-79), феррит стронция SrO · 6Fe2O3 (ТУ 6 – 09 – 41 – 04 – 87); традиционные наполнители:
- тальк – гидратированный силикат магния 3MgO· 5 SiO2 · H2O; сажа – твердый тонкодисперсный углеродный продукт неполного сгорания или термического разложения углеводородов (ГОСТ 18307 – 78); каолин тонкодисперсная глинистая порода Al2Si2O5(OH)2; мел – химически осажденный CaCO3 (ГОСТ 8253 – 79); сланцевая зола; гидратцеллюлозное штапельное волокно – ТУ 10546 – 80.
Адсорбенты: силикагели, цеолиты, активированный уголь.
В работе использовался комплекс электрохимических методов исследования, таких как: потенциометрический, хроновольтамперометрический, потенциостатический и гальваностатический, циклическая вольтамперометрия, метод импеданса. Электрохими-ческие измерения проводились на потенциостатах ПИ – 50 – 1.1, П5848 и вольт-амперометрическом анализаторе ТА - 2.
При проведении электрохимических измерений использовались металлические электроды: платина (чистота 99,9 %), никель, медь; селеновые электроды различной конструкции; вращающийся дисковый электрод с кольцом (кадмий – кадмий), твердые микроэлектроды на основе кадмия; ртутно – пленочный и золото- графитовый электроды; селеновые электроды различной конструкции. В качестве электродов сравнения использо-вались хлорсеребряный, оксидно - ртутный, натриевый электрод.
Для идентификации состава и структуры продуктов электрохимического синтеза и электрохимических реакций использовались газовая хроматография с масс-селективным детектором (ГХ с МСД), высокоэффективная жидкостная хроматография (ВЭЖХ), УФ – спектроскопия, рентгенофазовый анализ, дифференциальная сканирующая калориметрия, термогравиметрический анализ, электронная микроскопия, тонкослойная хроматография, ИК - спектроскопия. В работе использовался газовый хроматограф HP 5890/5972 c масс-селективным детектором HP 5972А фирмы «Хьюлетт – Паккард» США. Пробы в хроматограф вводили с помощью автоматического прободозатора HP 6890 фирмы «Хьюлетт – Паккард» США, микрошприцем на 5 мкл.
Условия хроматографии: Тинж.= 200 0С; tнач = 3 мин; Tнач = 500С; Ткон.= 280 0С. Скорость подъема температуры ∆Т= 10 0С/мин; газ-носитель гелий; v = 1 мл/мин. Хроматографическая колонка НР 5МС, капиллярная, с фазой 5% дифенил- и 95% диметилполисилоксан, d = 0,25 мм, L = 30 м.
УФ – спектры снимались на спектрофотометре HP А 8452.
ПМР спектры получены на спектрометре Varian FT 80A при температуре 30 оС. Рабочая частота при получении ПМР спектров 80 Мгц. Внутренний стандарт ГМДС - 0,15 м.д. относительно ТМС).
Методика электрохимического синтеза. Электрохимический синтез проводился в стеклянной трехэлектродной электрохимической ячейке с неразделенными анодным и катодным пространствами в неводной среде при термостатировании и перемешивании. В качестве вспо-могательного электрода (анода) служила платина. Рабочими электродами служили метал-лические электроды с селеновым покрытием, либо электроды из селена, полученные согласно специально разработанным методикам. Первоначально отрабатывалась конструкция электро-дов. Селен наносился на никелевые, медные и платиновые электроды различных конфигураций. Порошок селена насыпался в керамический тигель и помещался в муфельную печь, где плавился при температуре t = 273 °С. В расплав селена опускались металлические электроды, выдерживались в расплаве в течение пяти секунд. Затем электроды извлекали и оставляли на воздухе до полного затвердевания селена. Было использовано две методики. По первой в полую трубку из тугоплавкого стекла длиной l = 10 см и внутренним диаметром dвн= 2 мм набивался порошок селена на высоту 2 см. Затем трубка нагревалась на газовой горелке до расплав-ления селена в трубке. С одной стороны трубки создается «капающий» селен, с другой - помещается токоотвод (тонкая никелевая проволока). Трубка удерживалась на открытом воздухе до застывания селена.
Таблица 1. Условия проведения электрохимического синтеза
| Конструкция электрода | Масса 1,5-дикетона в электролите, г | Условия электролиза | ||
| ток, мА | напряжение, мВ | время, ч | ||
| Se/Cu медная проволока, d=2,5 мм | 0,05 | 6 | 25 | 2,5 |
| Se/Cu медная проволока, d=1,5 мм | 0,05 | 10 | 38 | 8 |
| Se/Ni никелевая пластина, S=5 см2 | 0,05 | 10 | 38 | 13 |
| Se/Ni никелевая пластина, S=5 см2 | 0,05 | 15 | 53 | 7 |
| Se/Pt платиновая проволока, d=2,5 мм | 0,05 | 1 5 10 10 | 9 21 25 38 | 2 4 2 4 |
| Se электрод в виде конуса, S=3 см2 | 0,05 | 10 20 | 38 68 | 1 2 |
| Se в стеклянной трубке, S=0,8 см2 | 0,05 | 5 10 | 21 38 | 2 2 |
По второй полая трубка длиной l = 10 см и внутренним диаметром dвн= 5 мм запол-нялась расплавленнымй селеном на высоту 3 см. Удерживая трубку в вертикальном положении, создавали на одном конце трубки «капающий» селен. После застывания селена среднюю часть трубки нагревали на газовой горелке и вводили в трубку токоотвод. Конструкции электродов и условия электролиза приведены в таблице 1.
Методика электрохимических измерений в твердофазных ячейках. Электрохимическая способность солей халькогенопирилия исследовалась в твердофазных ячейках методами хроновольтамперометрии, хроноамперометрии и хронопотенциометрии в совокупности со спектральными и рентгенофазовыми исследованиями продуктов катод-ной реакции, а также поляризационными измерениями на модельных электродах. Состав синтезированных cолей определяли элементным анализом и газовой ГХ с МСД. Электро-химические исследования проводили с помощью потенциостата П-5848 в комплекте с самопишущим потенциометром КСП-4. Расхождение значений тока и потенциала в парал-лельных опытах не превышало соответственно 3 и 5 %.
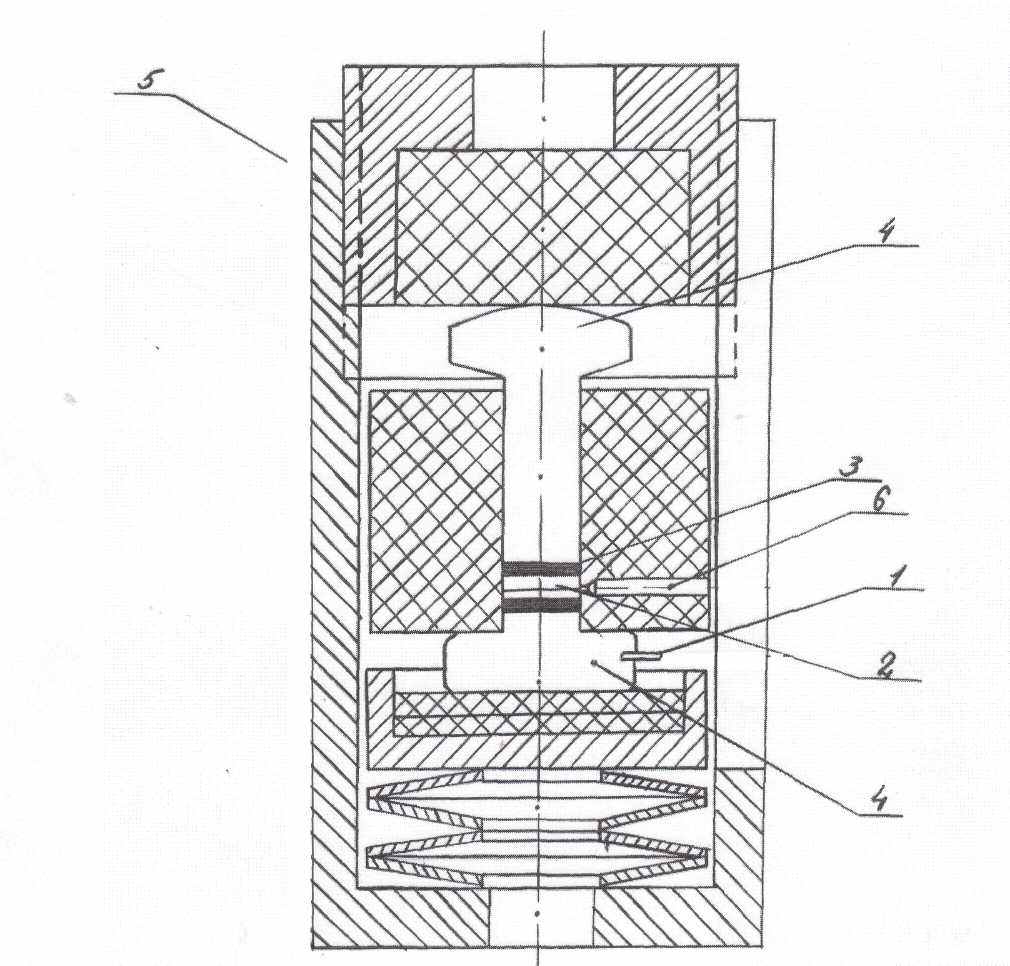
Потенциодинамические кривые снимали в области потенциалов от 0 до 4 В (относительно натриевого электрода сравнения при скоростях линейной развертки потенциала: 80, 40,20, 8, 4, 2 мВ/с). Гальваностатические измерения проводили при плот-ностях тока 15, 25, 45, 65 мкА/см2. Ионную органическую соль (рабочее вещество катода) предварительно доводили до мелкодисперсного состояния, смешивали с сажей в заданном соотношении и вновь тщательно перетирали в течение 30 минут. Вспомогательный электрод - пластина металлического натрия. В качестве электрода сравнения использовали металлический натрий, который вносили в таблетку электролита с боковой стороны через отверстие в ячейке с помощью поджимного винта. Схема электрохимической ячейки приведена на рис.1.
Методика измерения электропроводности. Измерения электропроводности проводили кондуктометром КПЦ – 026 в кварцевой ячейке специальной конструкции в свежеприготовленных растворах, так как соли селенопирилия способны подвергаться фотохимическим реакциям даже при обычном свете. При проведении фотохимических процессов ячейку присоединяли к термостату ТЖ-ТС-01/16 - 150, контактным термомет-ром устанавливали температуру 200 C во избежание разогрева раствора от лампы УФ – излучения, в течение 5-7 мин раствор выдерживали в данном температурном режиме и за-тем приступали к измерениям. В работе использовали платиновые электроды площадью 1 см2, расположенные параллельно друг другу. Источником УФ-излучения служила лампа ОКН – 11 М с длиной волны λ = 250-380 нм.
Для исследования электропроводности в твердофазных ячейках навеску вещества и засыпали в цилиндрический корпус ячейки, предварительно вставив в него титановый электрод, сверху поджимали вторым электродом и прессовали в виде таблеток диаметром 5 мм, толщиной 0,5 – 0,7 мм.
Методика фотохимического окисления. Реакции фотохимического окисления проводились в среде ССl4 и CBr4 при инициировании УФ – излучением. Реакционная смесь помещалась в кварцевый реактор, снабженный кварцевой рубашкой с водяным ох-лаждением при поддержании рабочей температуры 200С термостатом ТЖ-ТС-01/16 - 150. При этом реагенты перемешивались электрической мешалкой и облучались с помощью источника полихроматического УФ – излучения (λ = 200-380 нм), расположенного на уровне реакционного сосуда. Облучение реакционной смеси проводили до полного исчез-новения исходного соединения.
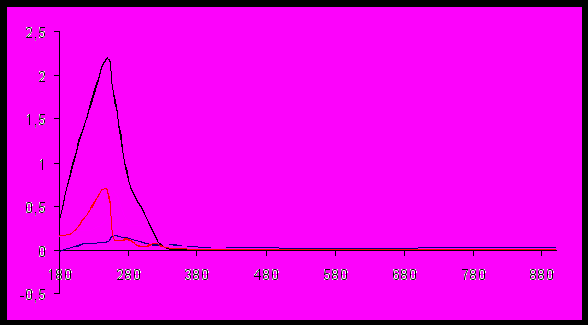
Методика изучения адсорбционных равновесий. Для снятия изотерм адсорбции использовали спектрофотометр HP А 8452, на основе анализа УФ – спектров выбиралась область максимума поглощения, при которой регистрировались показания оптической плотности. УФ – спектры препарата ДАФС-25 в различных растворителях, приведенные на рис. 1´ указывают, что область максимума поглощения практически одинакова во всех используемых растворителях и находится в области 250 – 280 нм. По градуировочным зависимостям оптической плотности от концентрации исходного раствора определяли состав равновесного раствора и рассчитывали величины избыточной адсорбции.
 а) а) | б 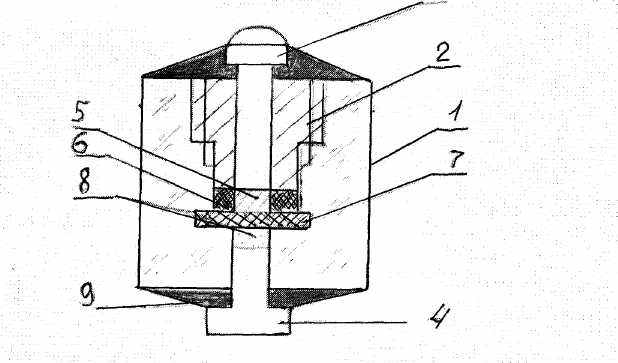 ) ) |
| Рис. 1. Схема электрохимической ячейки: а) 1 – токоотводы; 2 – электрод; 3 – электролит; 4 – пуансоны; 5 – корпус «бомбы»; 6 – электрод сравнения; б) 1 - корпус; 2 - гайка; 3,4 - пуансон титановый; 5 - анодная масса; 6 - фторопластовое уплотнение; 7 - электролитная мембрана; 8-катодная масса; 9 - герметик. | |
Методика электрофоретического получения комбинированных поктрытий.
Электрофоретическое нанесение асбеста с добавкой TiO2 осуществлялось из суспензии, содержащей: асбестовое волокно (АХО) – 15 г/л; TiO2 – 60 г/л; гипан 17% раствор – 15 г/л.
Для получения сепараторов с добавкой ZrO2 использовался состав суспензии: асбестовое волокно (АХО-2) – 15 г/л; ZrO2 – 50 г/л; гипан 17% раствор – 10 г/л.
А
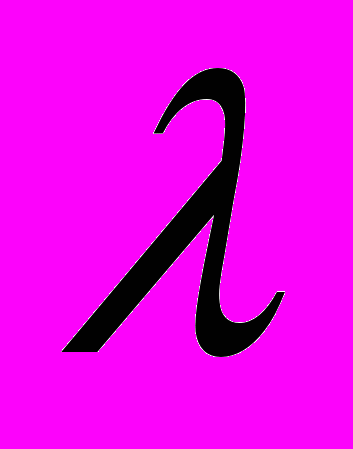 ,нм
,нмРис. 1´. УФ-спектры препарата ДАФС-25 в растворителях: 1- диметилформамиде; 2- этилацетате; 3- этаноле; 4- изопропиловом спирте.
ГЛАВА 3. ЭЛЕКТРОХИМИЧЕСКИЙ СИНТЕЗ СЕЛЕНООРГАНИЧЕС-КИХ СОЕДИНЕНИЙ И ИХ ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА.
3.1. Электрохимические синтезы селеноорганических соединений
При рассмотрении различных реакций органического электросинтеза селеноорганических соединений нередко встречаются указания на образование в процессе электролиза элементорганических соединений. Их образование наблюдалось в результате как анодных, так и катодных процессов. Эти реакции - весьма своеобразный метод синтеза соединений, содержащих связь углерод-элемент.
Обычно при электролизе смеси раствора электролита с органическим веществом на катоде протекают процессы восстановления органического вещества. Однако иногда наблюдается совершенно иной тип катодного процесса, сопровождающийся раство-рением материала катода. Такой тип реакции характерен преимущественно для электровосстановления альдегидов, кетонов, некоторых ненасыщенных соединений и галогеналкилов. Вопрос о механизме образования элементорганических соединений при катодных процессах является в настоящее время дискуссионным. Сам по себе факт «катодного растворения элемента» весьма парадоксален.
Большинство исследователей считает, что образование элементорганических соединений протекает по радикальному механизму за счет взаимодействия первоначаль-но возникающего на катоде радикала с материалом электрода. Однако такие представле-ния не могут объяснить всего разнообразия реакций образования элементорганичес-ких соединений при катодных процессах. Эти факты заставляют предположить, что радикалы, возникающие в процессе электролиза, по-видимому, существуют не в виде кинетически независимых частиц, а что более вероятно, находятся в состоянии пере-ходного комплекса с материалом катода. При благоприятных условиях такой комплекс отрывает атом из кристаллической решетки катода, образуя элементорганическое соединение. Встречаются случаи, когда образование элементорганического соединения не является результатом непосредственно электрохимической реакции.
При электролизе спиртовых растворов 1,5-дикетонов нами было зафиксирова-но образование растворов 4Н-селенопирана при избытке селеноводорода с дальнейшим присоединением HSe - группы по кратным связям селенопиранового кольца с обра-зованием гидроселенопроизводных. Обнаружено также образование гидроселено-производых непосредственно из 1,5-дикетонов.
Арилалифатические 1,5-дикетоны в процессе электрохимического синтеза претерпевают превращения по трем основным направлениям (схема 1): образова-нием арилалифатических 4Н-селенопиранов (A), образованием продуктов дис-пропорционирования 4Н-селенопиранов (Б), присоединением селеноводорода по кратным связям селенопиранового кольца (В), отличающимся разной степенью превращения.
Хроматомасс-спектрометрический анализ продуктов электролиза показал на образование 2,4,6-трифенилселенопирана. Последний зафиксирован уже при неболь-ших токах (6 мА) и времени электролиза - 1 ч. Образованием селенациклогексанов (направление Б) подтверждено хроматограммами и масс- спектрами (рис. 2, 3). Хроматограммы полученных при проведении электролиза солей селенопирилия в виде перхлоратов показаны на рис. 4, 5. Перхлораты 2,4,6- триарилзамещенных солей селенопирилия, согласно данным анализа методом ГХ/МС при анализе мето-дом ГХ/МС трансформируются в соответствующие ароилселенофены. Выход 4H - селенопиранов составил 67 - 82 %.
Дальнейший электролиз в течение 1,5 часов при тех же значениях тока приводит к заметному увеличению количества 2,4,6-трифенилселенопирана и уменьшению количества исходного 1,3,5-трифенилпентадиона-1,5. После прекращения электролиза в спиртовой среде исключена возможность образования солей селенопирилия и соот-ветствующих селенациклогексанов в результате реакции диспропорционирования 4Н-селенопирана по схеме 2.
Учитывая тот факт, что соли селенопирилия хорошо растворимы в спирте и не образуют осадка, можно предположить, что в осадок выпадает 2,4,6-трифенил-селенациклогексан, который плохо растворим в данной среде.
При использовании электроактивного 1,5-дифенил-3-(п-метоксифенил)-пентандиона-1,5 образующийся в ходе реакции 2,6-дифенил-4-(п-метоксифенил)-4Н-селенопиран сразу вступает в реакцию диспропорционирования и выделяется в виде бромцинката селенопирилия.

Схема 1. Ar, R = Ph; R1, R2 - H; Х = Cl, Br
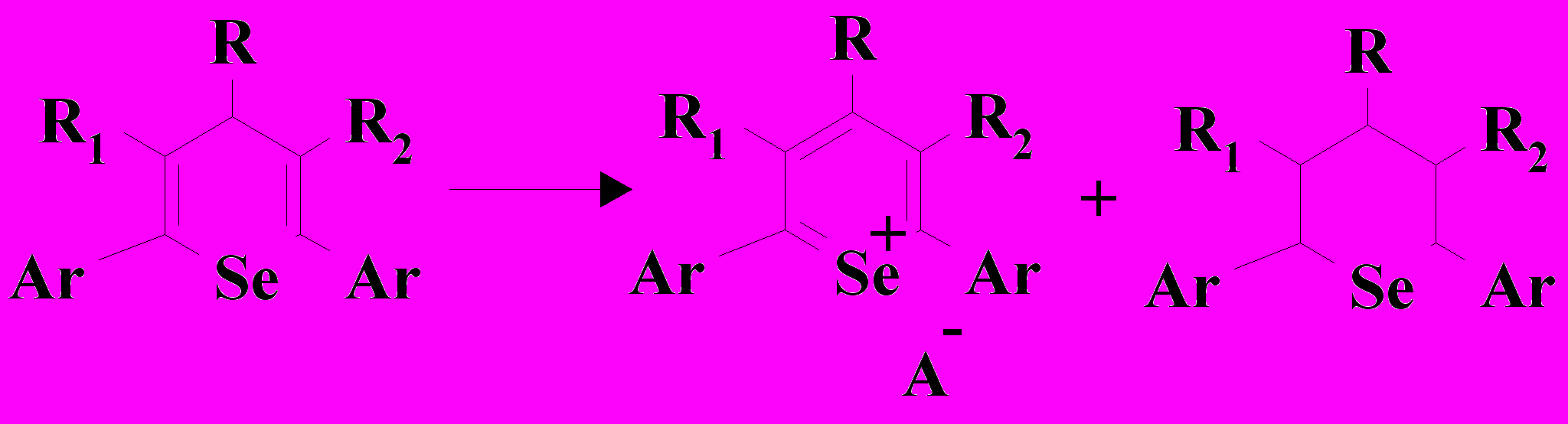
Схема 2. Ar, R = Ph; R1, R2 - H; Х = Cl, Br
Электролиз ячейке с катодом из никелевой пластины с нанесенным на нее селеном в течение 13 ч при постоянных значениях тока (I =10 мА) и напряжения происходит с количественным выходом 2,4,6-трифенилселенопирана наблюдалось уже после 1 ч реакции. Последующий анализ проводился через каждые два часа. Через пять часов с момента начала электролиза согласно данным ГХ с МСД, образуются соединения, которые можно идентифицировать как гидроселенопроизводные, в частности 2,6-(дигидроселено)-2,4,6-трифенилселенациклогексан и соответствующие им диселени-ды: гидроселенопроизводные окисляются кислородом воздуха до диселенидов. Реак-ционная системаб по данным ГХ с МСД, содержала очень малые количества исход-ного 1,5 - дикетона, что свидетельствует о том, что реакция прошла практически до конца.
Изменение параметров электролиза (I = 15 мА, время - 7 ч) не оказывает влияния на качественный состав продуктов, но вызывает ускорение процесса увеличение их количеств. Таким образом, можно считать, что реакция протекает по схеме 3 в направлении:
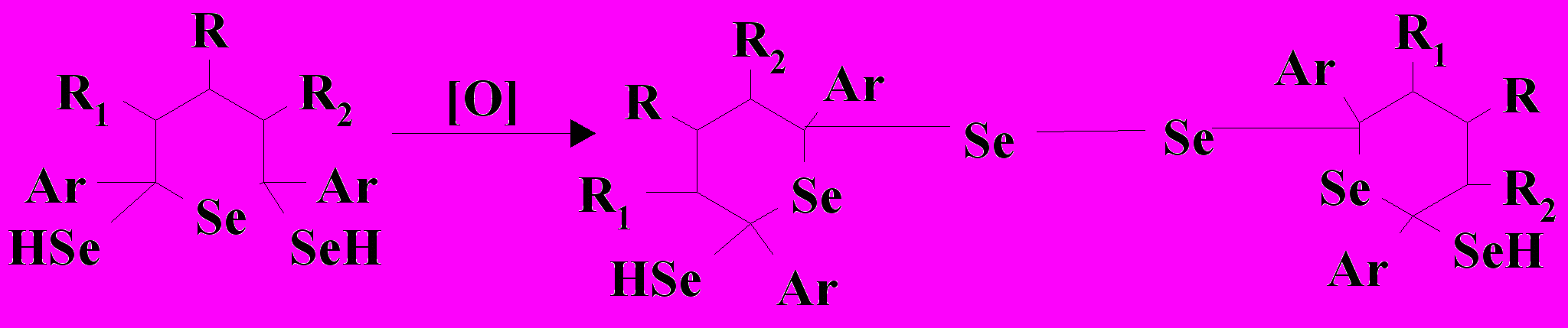
Схема 3. Ar, R = Ph; R1, R2 - H; Х = Cl, Br
Таким образом, в изученных условиях электрохимический синтез гетероцик-лических соединений, содержащих в качестве гетероатома селен, в неводных сре-дах сопровождается образованием смеси продуктов согласно схеме 3.
 | 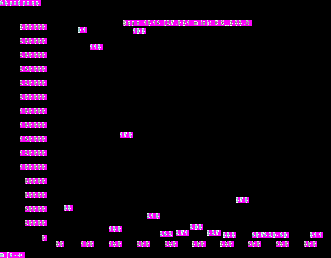 | |
| Рис. 2. Хроматограмма 2,4,6– трифенилселенациклогексана | Рис. 3. Масс – спектр селенациклогексана | |
 |  | |
| Рис.4. Хроматограмма перхлората 2,4,6-трифенилселенопирилия | Рис. 5. Масс – спектр перхлората 2,4,6 – трифенилселенопирилия | |
Следует отметить, что в ходе электролиза происходит расход материала катода. Это может быть связано с протеканием процессов в несколько стадий и образованием свободных радикалов.
Результаты анализа методом ГХ с МСД хорошо согласуются с данными цик-лической вольтамперометрии.
После анодной обработки системы H2Se + 1,5-дикетон при Ea = 2,0 В На циклических вольтамперограммах (ЦВА) обнаружен частично обратимый одно-электронный пик в области Eпа = 1,12 В 2,4,6 - трифенилселенопирана. Анало-гичный результат имеет место при проведении электросинтеза с участием 1,5 – дикетонов различного строения.
Учитывая, что в неводных средах 1,5 – дикетоны стойки к окислению, а потенциалы их анодного окисления лежат в области выше +2,0 В, то обна-руженные отличия в значениях потенциалов могут быть связаны с влиянием природы заместителей.
Частично обратимый пик окисления при Епа = 1,25 B (рис.6) на анодной ветви ЦВА, отвечающий за образование нестабильного катион-радикала селено-пирана, был идентифицирован добавлением в систему 2,4,6 – трифенилселено-пирана, синтезированого препаративным методом. На анодной ветви ЦВА полу-ченного химическим путем 2,4,6 – трифенилселенопирана зафиксированы аннало-гичные пики (рис.6).
| | | | | | | | | | ||
|---|---|---|---|---|---|---|---|---|---|---|
| | 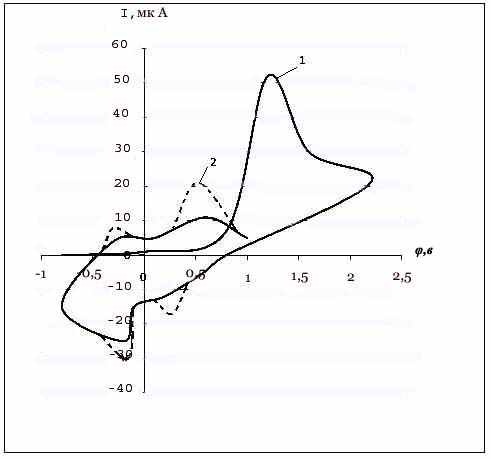 Рис.6. Циклическая вольтамперная характеристика 2,4,6-трифенилселенопирана до (сплошная линия) и после (штрих) его электролиза при потенциале Епа =1,3 В; Pt анод;Ag/AgCl; V=0,5 B/c | Проведенный эксперимент показал, что окисление селеноводорода до катион-радикала превращает его в частицу, об-ладающую высокой реакционной способ-ностью, подобно катион-радикалу серо-водорода. Предполагаемый механизм образования 4H - селенопиранов при участии селеноводорода в качестве основ-ного реагента согласуется с классической схемой: 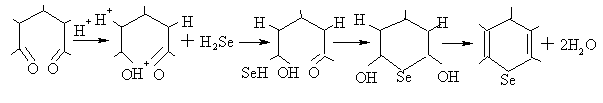 Таким образом, электроокислительная активация селеноводорода электрохи-мическим способом в присутствии одно-электронных окислителей позволяет по-лучить 2,4,6 – трифенилселенопиран и перхлорат 2,4,6-трифенилселенопири-лия, 2,6-дифенил-4-(п-метоксифенил)-4Н-селенопиран и его соли в виде бро-мидов. | | | | | | | ||
| | | | ||||||||
Образование гетероароматических катионов происходит за счет отрыва электроно-донорного заместителя от молекулы 4-Н-селенопирана.
Разработанный нами новый электрохимический способ синтеза 2,4,6 – три-фенилселенопирана, 2,6-дифенил-4-(п-метоксифенил)-4Н-селенопирана и солей селенопирилия из 1,5– дикетонов в условиях кислотного катализа при электро-окислительной активации селеноводорода электрохимическим способом и в при-сутствии одноэлектронных окислителей в неводной среде позволяет получить 4H-селенопиран, который легко вступает затем в реакцию диспропорционирования с образованием соли 2,6-дифенилселенопирилия и гидрированных продуктов: 2,6-дифенилселенациклогексана и 2,6-дифенил-4Н-дигидроселенопирана. Идентифика-ция продуктов электрохимического синтеза с помощью методов проанализированы методами ГЖХ с масс-селективным детектором, ПМР ициклической вольтамперо-метрии показала хорошее соответствие полученных данных. Большим преиму-ществом электрохимического способа получения селеноорганических соединений является возможность получить чистые вещества с высокими выходами (80 – 85 %) в отличие от разработанных ранее химических синтезов (Древко Б.И., Блинохватов А.Ф.), контролировать состав продуктов реакции на каждой из стадий по величине потен-циала и плотности тока.
3.2. Электрохимическое поведение солей селенопирилия и их электропровод-ность.3.2.1. Электрохимическое поведение солей селенопирилия. Изучено электровосстановление и окисление некоторых солей селенопирилия методом циклической вольтамперометрии.
Cоль (I) восстанавливается в области сильно отрицательных потенциалов, исследование ее электрохимического поведения проводили в нейтральной среде, где выделение водорода на поверхности ртути возможно лишь при потенциалах, более отрицательных, чем -1,7 -1,8 В.
Вольтамперометрическое поведение веществ I - III практически одинаково, что свидетельствует о том, что окислению-восстановлению на электродах подвер-гается гетероароматическое кольцо, а не заместители, что можно представить на схеме 4.
Продукт восстановления соединения (III) не осаждается на поверхности электрода, а собирается в приэлектродном слое.
Изучение зависимости высот пиков от скорости развертки и их потенциалов от lgVp показало, что процессы сопровождается процессами адсорбции на электро-де и сопутствующими химическими реакциями.
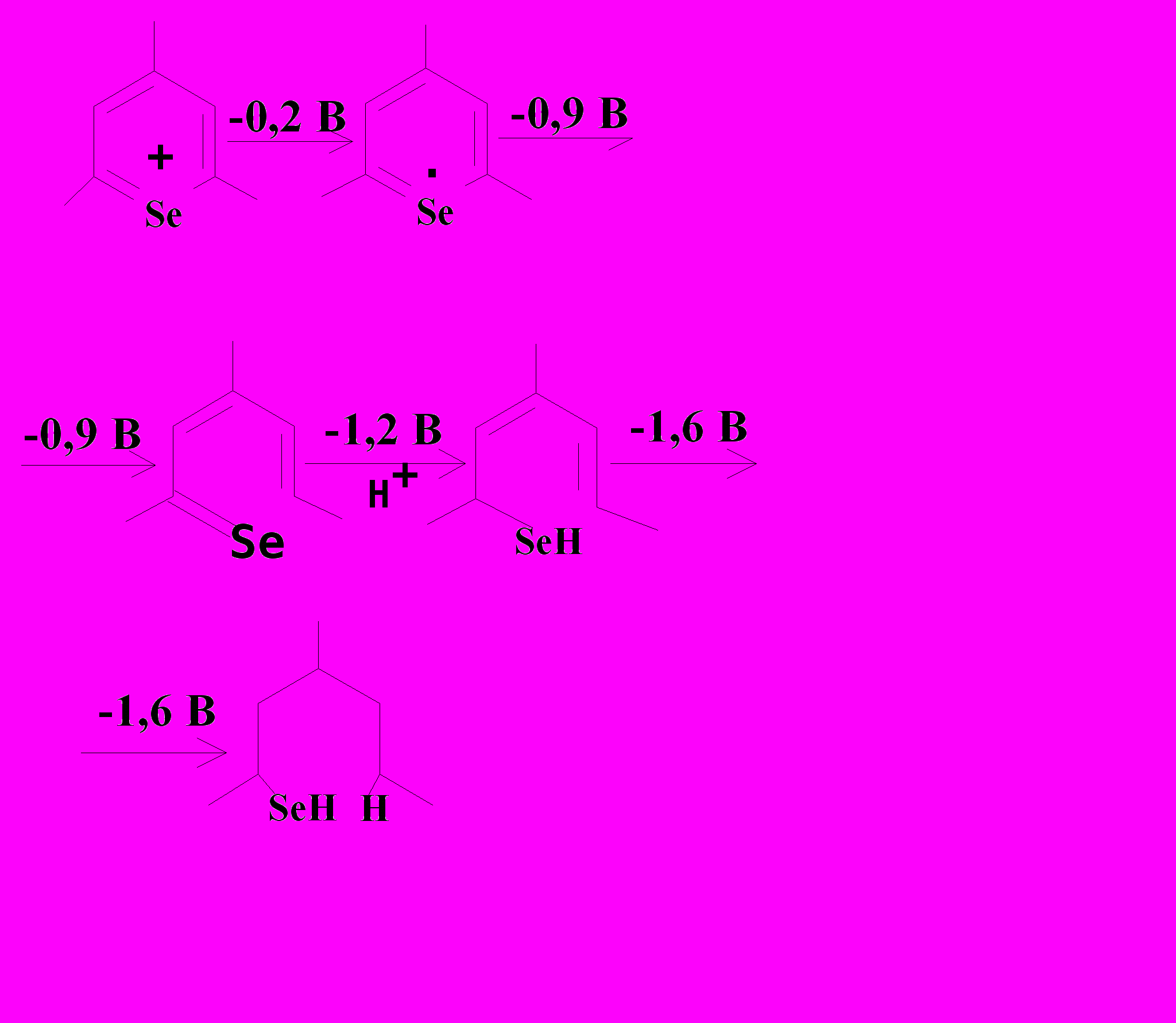 Схема 4. | 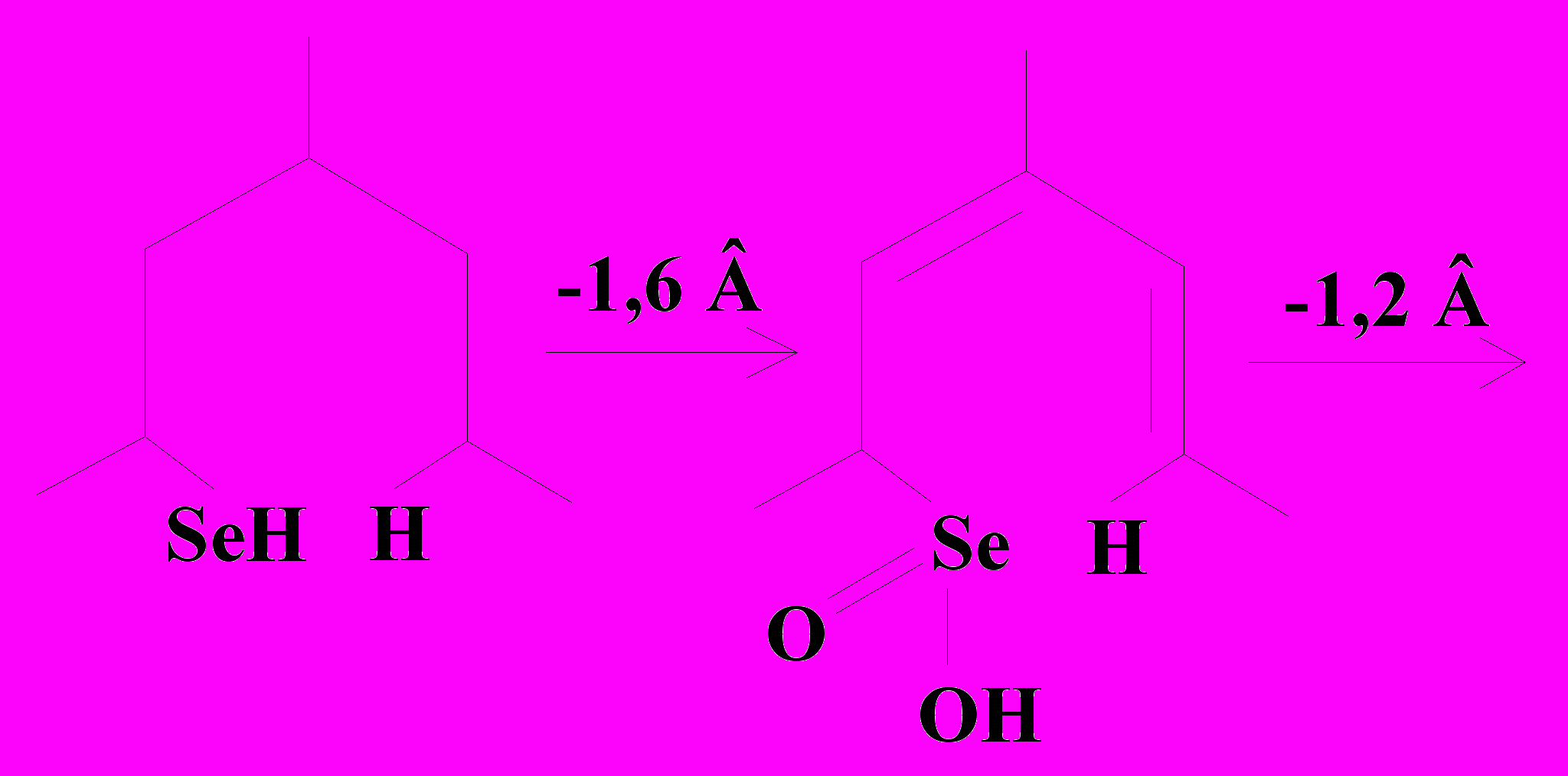 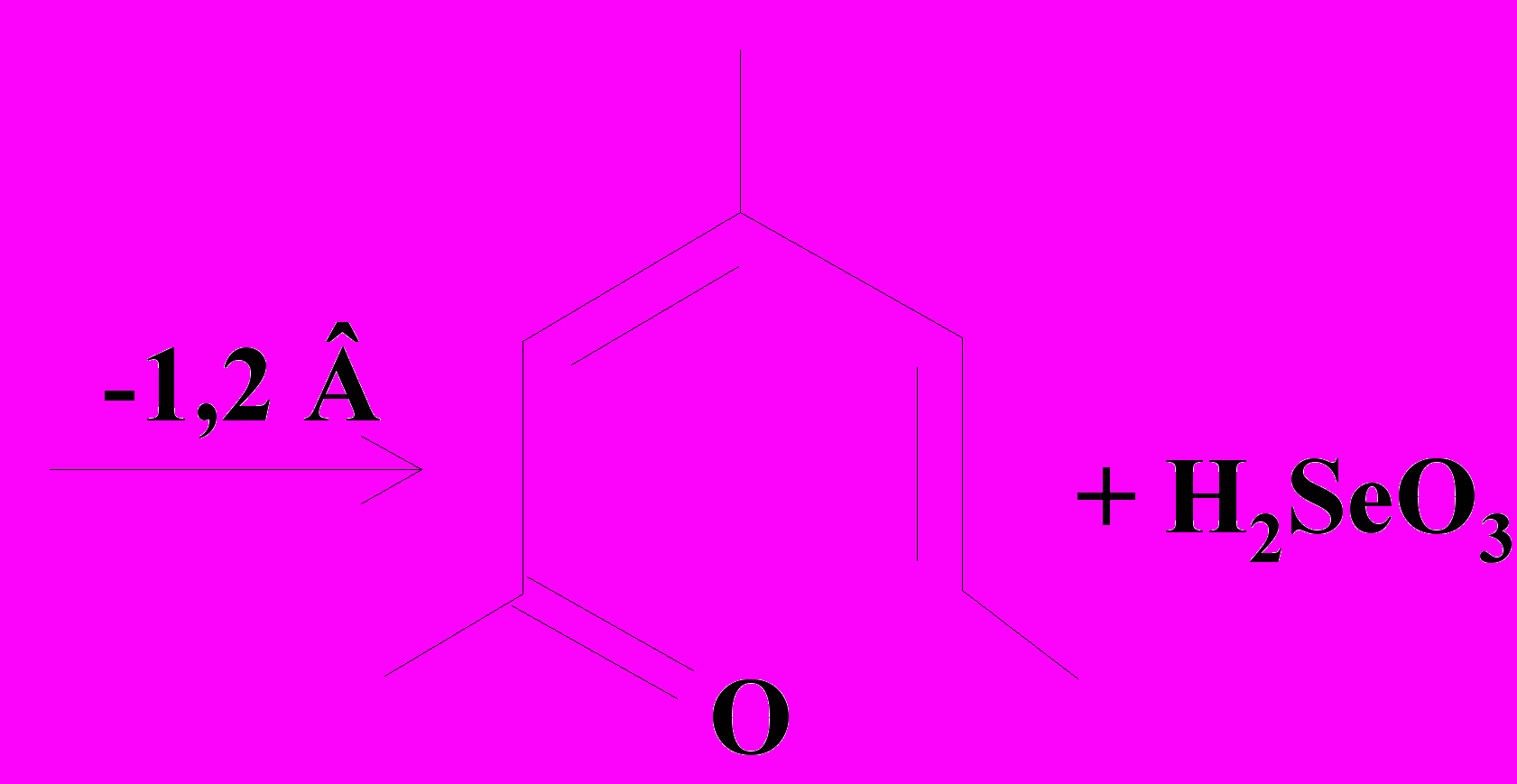 Схема 5. |
В результате исследования концентрационных зависимостей сигналов в диапазоне от 5∙10-6 до 5∙10-5 моль/л соли (III) высота пика пропорциональна кон-центрации, что может быть использовано для контроля содержания данного ве-щества в растворе при проведении электрохимического синтеза.
При катодной развертке происходит восстановление соединения ( IV), при этом процесс осуществляется в несколько стадий.
Таким образом, процесс восстановления соединения (IV) - многостадийный. На катодной кривой проявляются два сигнала (около -0,95 В и -1,6 В). При анодной развертке также присутствуют два пика, которые отвечают окислению образовав-шихся продуктов. Рост анодных сигналов после выдерживания электрода при ра-зомкнутой цепи можно объяснить как неполным окислением, так и адсорбцией восстановленной формы на поверхности электрода.
Таким образом предложен механизм электродных процессов с участием солей селенопирилия, согласно которому электропревращению подвергается гетероаро-матический катион. Полученные результаты вольтамперометрических измерений могут быть использованы для вольтамперометрического определения солей селе-нопирилия в водных средах и контроле продуктов электросинтеза.
3.2.2. Электропроводность солей селенопирилия. Исследована электро-проводность водных и неводных растворов cолей V, VI, VII, VIII, установлено влияние температуры, УФ- излучения, концентрации, определены термодинами-ческие функции диссоциации.
На рис. 7 приведена зависимость удельной электропроводности от концентра-ции водного раствора cоли (V) при различных температурах. Удельная электро-проводность данной соли при всех исследуемых температурах имеет четко выра-женный максимум, напоминающий классическую зависимость для водных раство-ров. Максимальная электропроводность, как следует из рис. 7, наблюдается при концентрации 3-4 ·10-5 моль/л и при дальнейшем ее росте происходит существе-ный спад электропроводности, что указывает на возможность образования ионных комплексов и ассоциатов, тормозящих движение ионов в растворе.
Причем в максимуме электропроводности повышение температуры на 40 К приводит к возрастанию электрической проводимости в 2 раза.
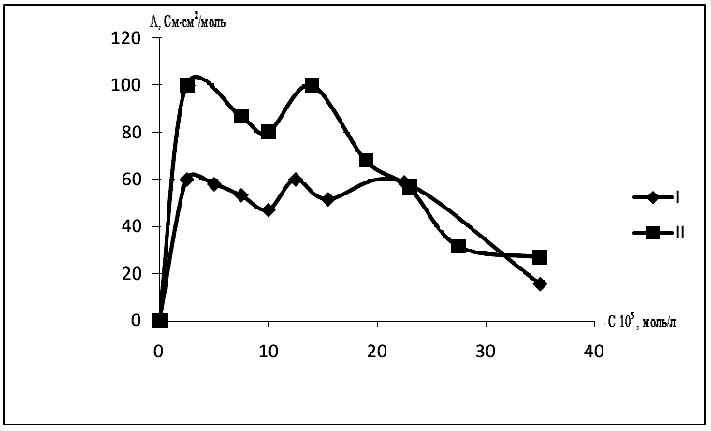
Из рис. 8 следует, что различные анионы в составе солей оказывают су-щественное влияние на удельную электропроводность. Так, в начальной области концентрации наблюдается значительный скачок электропроводности и ее посте-пенное снижение, причем перхлорат-анион оказывает наибольшее влияние на увеличение молярной электропроводности, в то время как для трифторацетата и трибромцинката удельные электрические проводимости практически совпадают для солей, имеющих одинаковый гетероароматический катион.
Положение сигналов протонов фенильных заместителей и гетероароматичес-кого катиона, как показали ПМР-спектры солей селенопирилия, сильно зависят от природы растворителя, что проявляется и в значениях молярной электропровод-ности, имеющей аномальный характер и представленной на рис.9. ПМР – спектры солей селенопирилия содержат сигналы протонов ароматических заместителей в области 6,65 – 8,3 м.д., причем сигналы протонов фенильных групп, имеющих заместители в «пара» - положении ароматического кольца, проявляются в виде двух дублетов с константой спин-спинового взаимодействия I = 7,7 – 10,0 Гц.
Полученные значения констант диссоциации (0,75 – 3,48∙10-6) сравнимы c величинами, характерными для растворов слабых электролитов органических солей, имеющих подобное строение, причем на величины констант диссоциации оказывает влияние природа заместителя селенопирилиевых солей и природа раст-ворителя. Теоретическое обсуждение полученных результатов в случае неводных растворов исследуемых растворов в настоящее время затруднено ввиду отсутствия надежных экспериментальных данных для чисел переноса в неводных средах. В изученных нами системах следует ожидать образования значительного количества ионных пар. Снижение молярной электропроводности прямо пропорционально числу образовавшихся ионных пар, поэтому эффект «разбавления» гораздо сильнее влияет на электропроводность. Рассчитанные по экспериментальным данным вели-чины предельной электрической проводимости
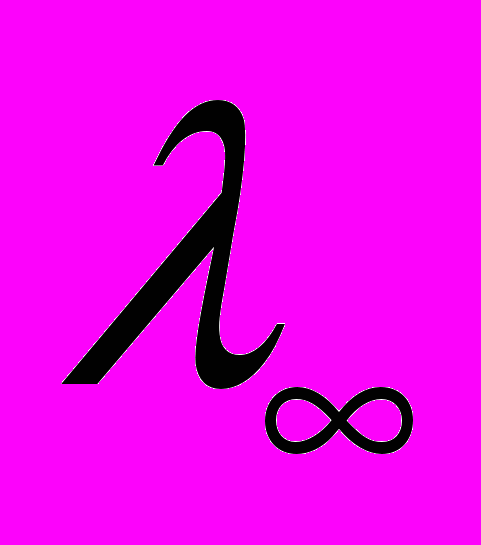 составляют 0,55∙ 10-3 и 1 ·10-3 Cм ·см2 ·моль-1 для cолей (VIII) и (VII) соответственно.
составляют 0,55∙ 10-3 и 1 ·10-3 Cм ·см2 ·моль-1 для cолей (VIII) и (VII) соответственно.Рассчитанное изменение энтальпии диссоциации для соли (VII) в ацето-нитриле, значение которой составляет 23,89 кДж/моль, что согласуется с теоретическими сведениями, что для органических растворителей температурный коэффициент электропроводности положителен. В таблице 2 приведены значения свободной энергии Гиббса, энтропии.
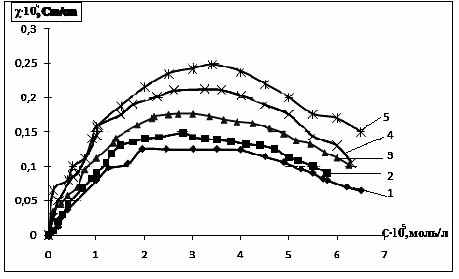 | 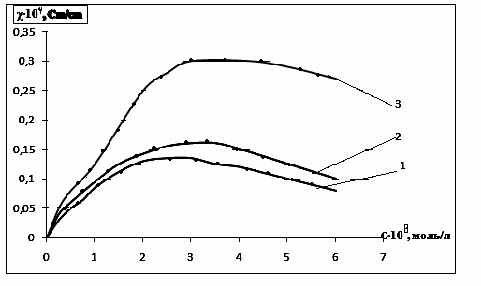 |
| Рис. 7. Зависимость удельной электропровод-ности от концентрации водного раствора соли (V) при различных температурах: 1-293 К; 2-303К; 3-313 К; 4-323 К; 3-333 К | Рис. 8. Зависимость удельной электро-проводности от концентрации в водных растворах: 1 - V; 2 - VI; 3 - VIII |
 | На рис. 10 ярко выражено возрастание значения удельной электропроводности при УФ-облучении во времени до постоян-ного значения, что можно объяснить образованием ионных ассоциатов вследствие электростатического притяжения разноименно заряжен-ных ионов и слабым взаимодейст-вием неполярных частей органичес-ких соединений с молекулами воды, что способствует связыванию гид-рофобных органических молекул. |
| Рис. 9. Зависимость молярной электропровод-ности cоли VII в: 1- хлороформе; 2 – ацето-нитриле |
Соли селенопирилия в изучаемой нами группе растворителей (вода, ацето-нитрил, хлороформ, этанол) существуют в диссоциированной форме. При поглоще-нии кванта света происходит перераспределение электронной плотности в катионе селенопирилия, причем при возбуждении молекулы возможен перенос одного из неподеленных электронов. В водных растворах соли селенопирилия диссоциируют с образованием окрашенного катиона.
Значения удельной электропроводности cоли ( VI) на несколько порядков выше, чем у соли (V), что можно объяснить влиянием природы аниона. На рис.11 сопоставлены величины удельной электрической проводимости до и после УФ-излучения, из которого следует, что при концентрации 3∙10-4 моль/л она увеличи-вается в 1,3 раза.
Были рассчитаны константы скорости реакций фотохимического окисления по данным электропроводности согласно уравнению:
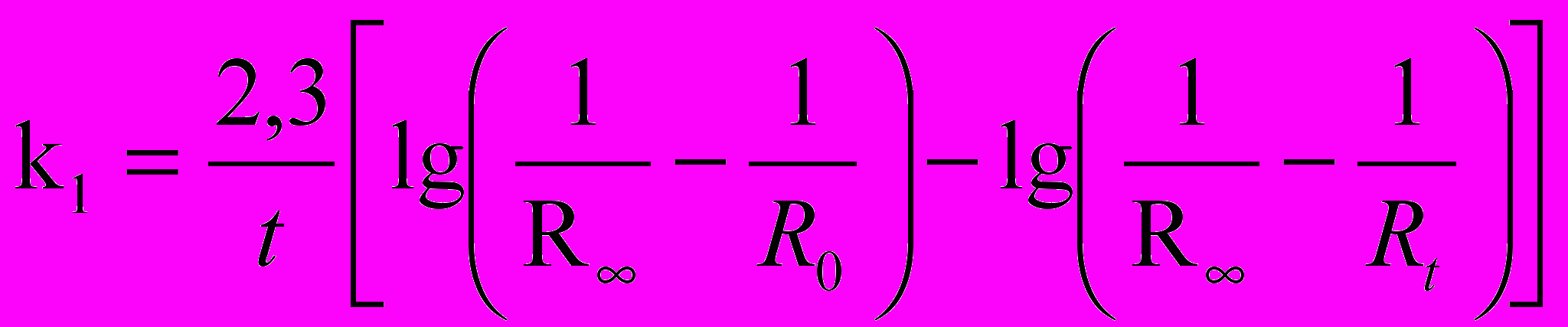 ,
,где k - константа скорости реакции; τ – время, мин; R0,
 , τ – сопротивление в начальный момент времени при наименьшей концентрации раствора, изменяющееся во времени, Ом.
, τ – сопротивление в начальный момент времени при наименьшей концентрации раствора, изменяющееся во времени, Ом. Таблица 2. Константы диссоциации и термодинамические функции диссоциации соли (VII) в ацетонитриле
| lnKg | Kg*106 | T, К | ∆H, 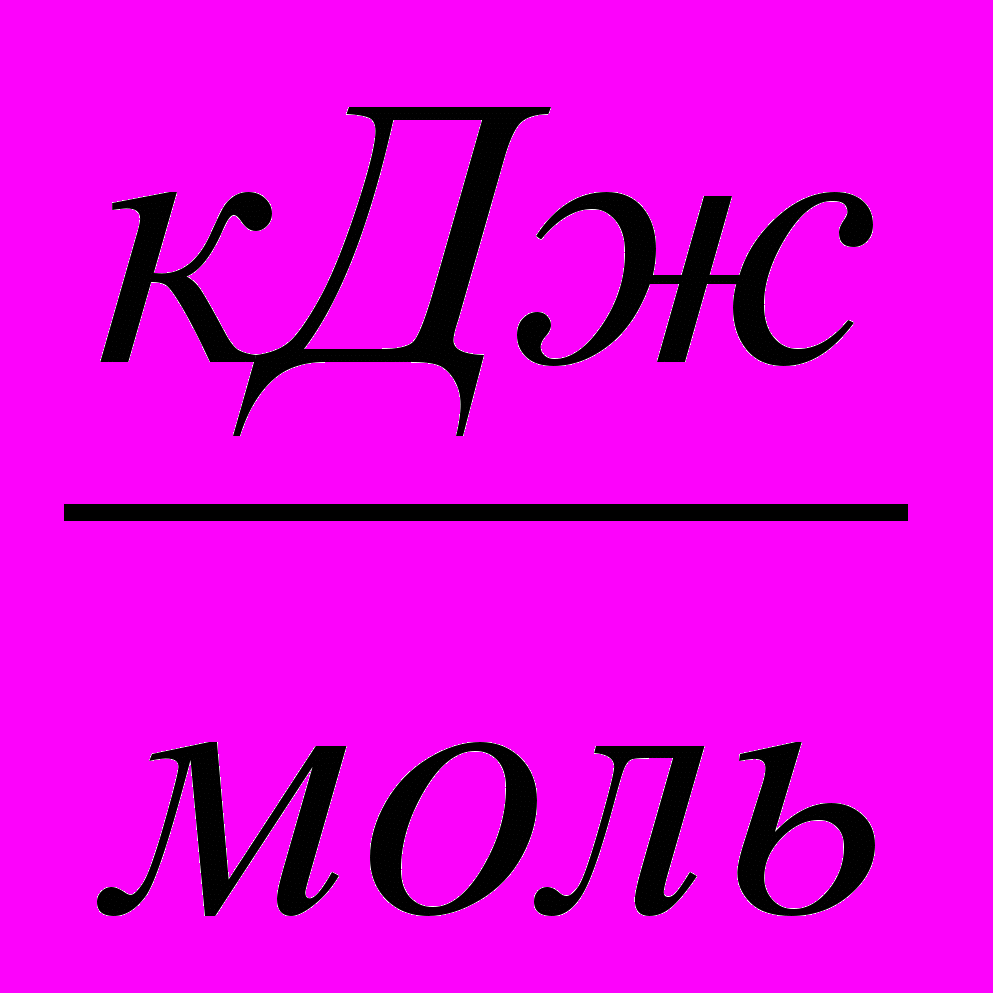 | - ∆G, 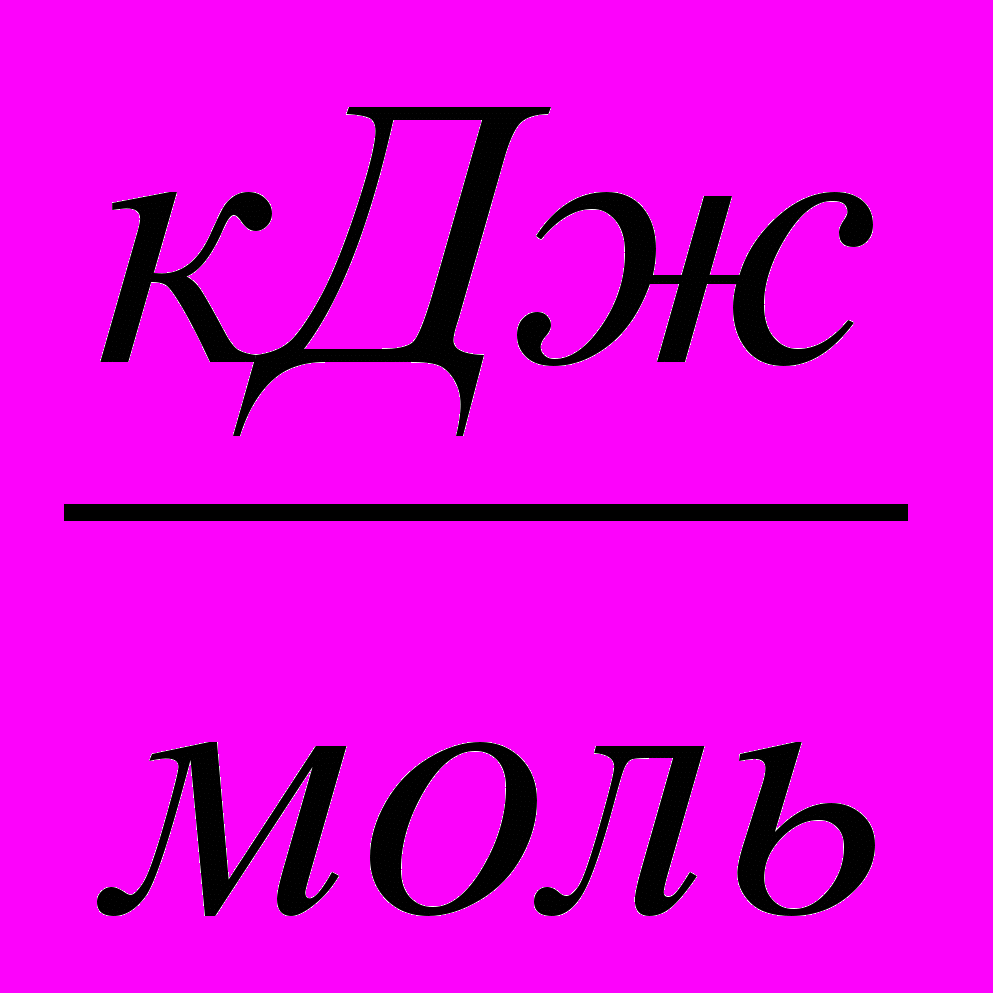 | Еа, 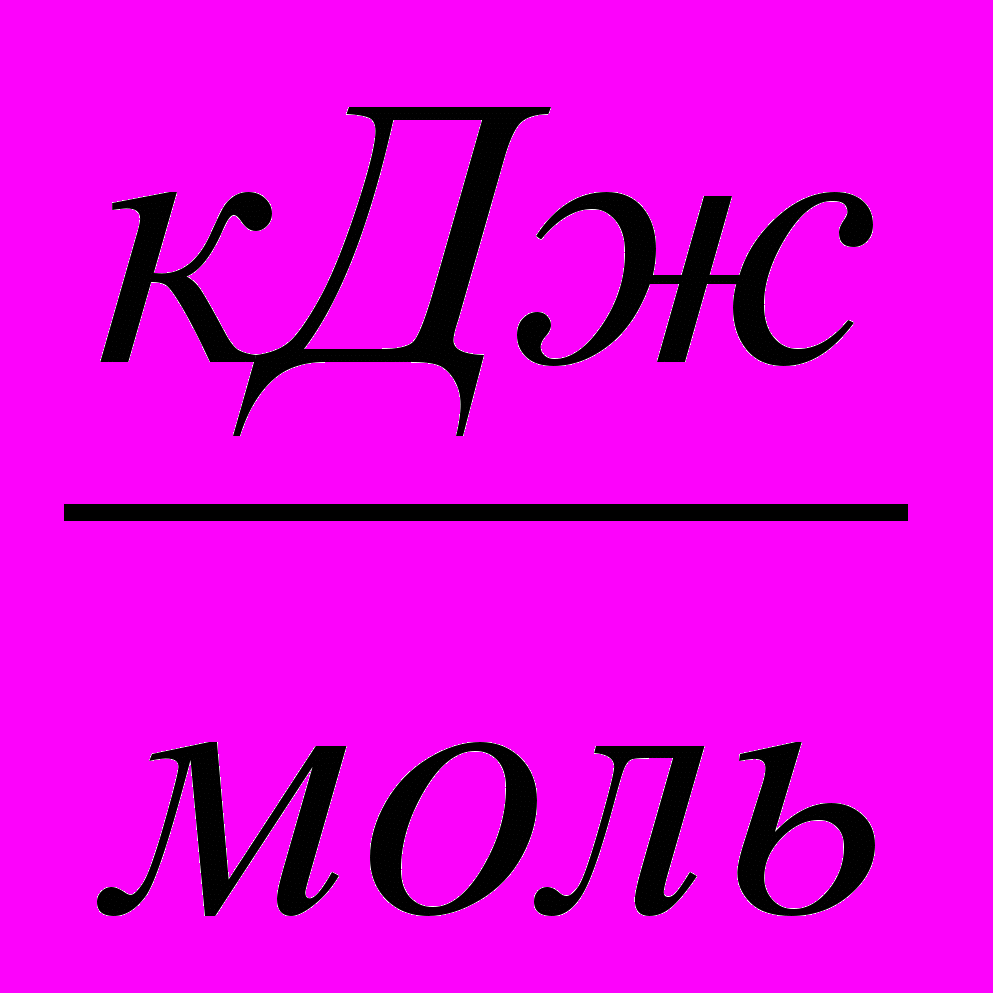 | ∆S, 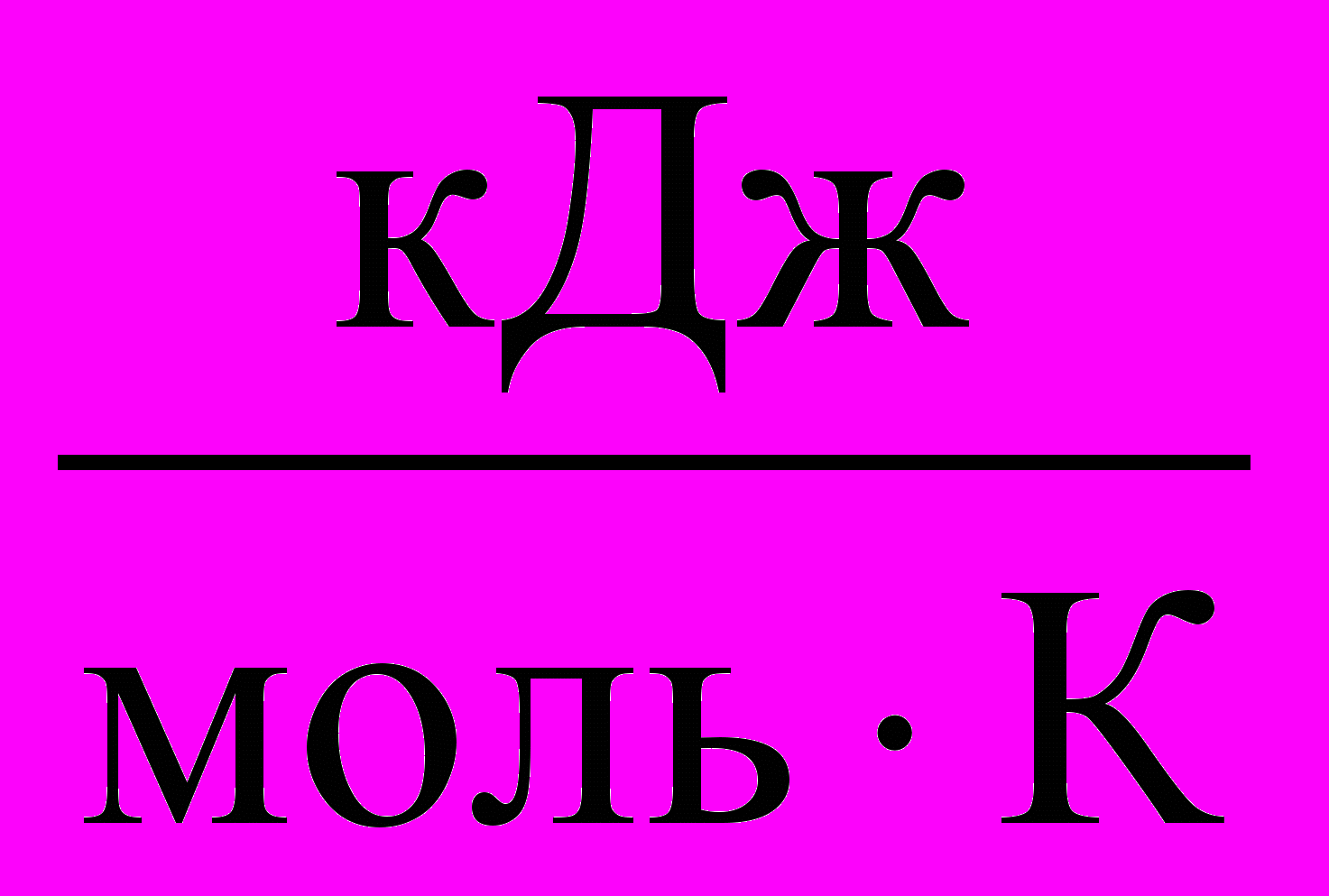 |
| -14,13 | 0,73 | 298 | 23,896 | 35 | 27,68 | 0,208 |
| -13,24 | 1,78 | 323 | ||||
| -13,02 | 2,20 | 333 | ||||
| -12,56 | 3,48 | 343 |
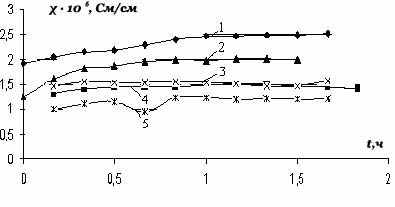 | 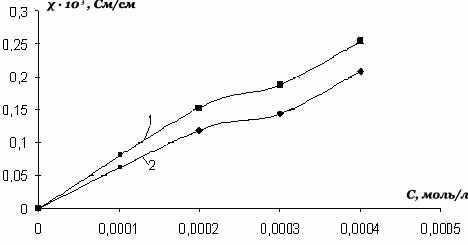 |
| Рис. 10. Зависимость удельной электро-проводности соли (V) в водных растворах от времени при УФ-излучении для раз-личных концентраций: 1- 3·10-3моль/л; 2 - 2,25∙10-5 моль/л; 3 - 2∙10-5 моль/л; 4-1,75·10-5 моль/л; 5- 1∙ 10-5 моль/л. | Рис.11. Зависимость удельной электропроводности cоли (VI) от концентрации в водных растворах (1 – после УФ – излучения; 2 – до УФ - излучения). |
Значения констант скорости существенно возрастают по мере увеличения концентраций исследуемых солей и варьируются в пределах от 8*10-4 до 1,3*10-3 мин-1.
Таким образом, исследована удельная и молярная электропроводности неко-торых селенопирилиевых солей в водных и неводных растворах и установлено, что при воздействии УФ – излучения величины молярной и удельной электро-проводности водных и неводных растворов селенопирилиевых солей увеличи-ваются. Очевидно, что УФ – излучение вызывает ионизацию и возбуждение моле-кул селенопирилиевых солей, причем часть обусловленных этим изменением строения и свойств наблюдается лишь в процессе излучения и носит обратимый характер. Эти обратимые изменения наиболее существенно влияют на электро-проводность исследуемых солей. Необходимо отметить, что при исследовании влияния ионизирующих излучений на электропроводность возникают существен-ные методические затруднения, обусловленные как спецификой работы с источ-никами, так и сложностью процессов, протекающих в веществе под воздействием излучения.
