На правах рукописи
| Вид материала | Автореферат |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
На правах рукописи
Балмасов Анатолий Викторович
повышение качества поверхности металлов методами электрохимической и химической обработки: закономерности и технологические решения
Специальность 05.17.03 –
Технология электрохимических процессов и защита от коррозии
Автореферат
диссертации на соискание ученой степени
доктора технических наук
Иваново 2006
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования Ивановский государственный химико-технологический университет
Научный консультант: доктор химических наук, профессор
Лилин Сергей Анатольевич
Официальные оппоненты: доктор технических наук, профессор
Галанин Сергей Ильич
доктор химических наук, профессор
Гамбург Юлий Давидович
доктор технических наук, профессор
Смоленцев Владислав Павлович
Ведущая организация: ГОУВПО Самарский государственный аэрокосмический университет им. академика С.П. Королева
Защита состоится “____” _________2007 г. в _______ часов в аудитории Г205 на заседании диссертационного совета Д 212.063.02 при ГОУВПО Ивановский государственный химико-технологический университет по адресу:
153000, г. Иваново, пр. Ф. Энгельса, 7.
С диссертацией можно ознакомиться в библиотеке ГОУВПО ИГХТУ по адресу: 153000, г. Иваново, пр. Ф. Энгельса, 10.
Автореферат разослан “_______” _____________ 2007 г.
Ученый секретарь
диссертационного совета Гришина Е.П.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Повышение качества поверхности металлов при электрохимической и химической обработке имеет важное практическое значение. Состояние поверхности непосредственно влияет на технические и эксплуатационные свойства деталей, узлов и изделий в целом. Говоря о повышении качества поверхности при электрохимической обработке, чаще всего обращают внимание на уменьшение шероховатости, повышение отражательной способности, увеличение коррозионной стойкости. Это относится как к анодным (электрополирование, размерная электрохимическая обработка), так и катодным процессам (гальванотехника). Однако в некоторых случаях, наоборот, поверхность должна быть достаточно развитой (подготовка поверхности перед пайкой, нанесением защитных покрытий и др.). В любом случае для оптимизации условий проведения процесса нужно знать особенности электрохимического поведения различных металлов в электролитных системах разной природы.
Решение прикладных задач повышения качества поверхности металлов при электрохимической обработке тесно связано с изучением влияния эффектов массопереноса на показатели электрохимических процессов. Проведение анодного растворения металлов в области диффузионного контроля часто способствует уменьшению шероховатости поверхности, повышению ее отражательной способности и коррозионной стойкости. Такого рода эффекты имеют место при размерной электрохимической обработке, электрохимическом и химическом полировании металлов. Напротив, при катодном осаждении металлов в области предельных токов обычно наблюдается увеличение шероховатости.
Значительное влияние на электрохимическое поведение металлов оказывают физико-химические свойства раствора, в котором протекают электрохимические и химические процессы. Увеличение вязкости среды, переход от простых гидратированных ионов металла к комплексным частицам способствует усилению влияния диффузионных процессов. Использование неводных и водно-органических растворов электролитов позволяет изменять электропроводность, вязкость, сольватирующую и комплексообразующую способность рабочей среды, что дает возможность целенаправленно влиять на технологические показатели электрохимических процессов. Однако к настоящему времени эти преимущества водно-органических растворов использованы далеко не в полном объеме.
Дополнительные возможности регулирования условий протекания электрохимических процессов с учетом явлений массопереноса появляются при использовании нестационарных методов электролиза. Применение импульсных режимов позволяет в ряде случаев повысить качество поверхности металла как при анодной обработке, так и при катодном осаждении. Кроме того, применение нестационарных электрических режимов способствует повышению точности анодного электрохимического формообразования и равномерности распределения металла по поверхности катода в процессах гальваностегии. В то же время, внедрение перспективных технологических процессов с использованием импульсного тока тормозится недостатком знаний в этой области.
На основании выше изложенного, является актуальным изучение и обобщение данных по влиянию физико-химических свойств растворов электролитов и электрических режимов на технологические показатели процессов электрохимической и химической обработки металлов и разработка научно обоснованных рекомендаций по оптимизации составов рабочих растворов и условий обработки.
Работа выполнялась в рамках научного направления ГОУВПО ИГХТУ (2001 - 2005 гг.) «Электрохимические и электрокаталитические процессы в различных межэлектродных средах, гальванотехника и обработка поверхности» и «Решения о научно-техническом сотрудничестве» между ИГХТУ и Государственным рязанским приборным заводом (2003-2004 гг.).
Цель работы: установление закономерностей поведения металлов при электрохимической и химической обработке и разработка на их основе высокоэффективных растворов и технологий, обеспечивающих повышение качества обработанной поверхности.
Для достижения поставленной цели решались следующие задачи:
- исследование поведения металлов различной природы (вольфрам, никель, медь, серебро, титан, цирконий, гафний и сплавы на их основе) при анодном и химическом растворении в водных и водно-органических растворах электролитов при условиях, обеспечивающих сглаживание микрорельефа поверхности;
- изучение зависимостей показателей процессов электрохимического и химического растворения металлов от физико-химических свойств растворов электролитов;
- исследование влияния состава раствора и условий проведения процесса на физико-химические свойства поверхностных слоев, формирующихся на металлах при анодной поляризации или химической обработке;
- изучение влияния свойств поверхностных слоев на процессы формирования микрорельефа, активирования и пассивирования поверхности;
- исследование влияния импульсного электрического режима на распределение электрического поля в электролизере и металла на поверхности катода, а также на качество поверхности как при анодной обработке, так и при катодном осаждении металлов;
- разработка новых высокоэффективных электролитов и технологических процессов электрохимической и химической обработки вольфрама, меди, серебра, металлов подгруппы титана и сплавов на их основе.
Научная новизна:
- Впервые проведены систематические исследования анодного поведения вольфрама, никеля, меди, серебра, металлов подгруппы титана в водно-органических и водных растворах электролитов. Показано, что для изученных металлов в исследованных растворах при высоких анодных потенциалах лимитирующей стадией процесса является массоперенос в растворе.
- Развиты и обобщены представления о формировании микрорельефа поверхности исследованных металлов при электрохимической и химической обработке, учитывающие влияние состава и физико-химических свойств растворов на эффекты массопереноса и свойства поверхностных слоев. Увеличение вязкости раствора при введении органического растворителя и повышение сопротивления поверхностного слоя вследствие легирования его компонентами раствора способствуют переходу процесса в режим полирования.
- С использованием метода фрактальной геометрии установлен более равномерный характер растворения вольфрама и серебра при их электрополировании в водно-органических электролитах.
- Установлено, что применение импульсного тока миллисекундного диапазона обеспечивает повышение катодной поляризации и поляризуемости при электроосаждении серебра из полилигандных электролитов. Это способствует формированию мелкозернистого осадка серебра и повышению равномерности его распределения по поверхности катода.
- На основе развитых представлений разработан ряд новых высокоэффективных электролитов для электрохимической и химической обработки металлов, обеспечивающих высокое качество обработанной поверхности, составы которых защищены авторскими свидетельствами и патентами РФ.
Практическая значимость:
- Разработаны составы растворов и определены режимы электрохимической обработки вольфрама и вольфрамокобальтовых твердых сплавов, циркония и гафния, позволяющие повысить точность копирования электрода-инструмента и качество обработанной поверхности. Разработанные электролиты используются на ФГУП НПП «Алмаз» г. Саратов для обработки деталей электровакуумных приборов из гафния. Их применение позволило повысить качество обработанной поверхности деталей и повышение стабильности характеристик готовых изделий при сохранении необходимой производительности процесса.
- Определены режимы нестационарного электролиза при электроосаждении серебра из полилигандных электролитов, позволяющие улучшить равномерность распределения катодного осадка по поверхности изделий сложного профиля и уменьшить шероховатость покрытия. Разработана технологическая схема серебрения деталей из жаростойкого сплава с использованием нестационарного электролиза, прошедшая успешную апробацию в условиях промышленного производства на ОАО ГМЗ «Агат», г. Гаврилов-Ям Ярославской обл.
- Оптимизированы условия подготовки поверхности титана, обеспечивающие нанесение серебряного покрытия без промежуточных металлических подслоев. Разработана технологическая схема однослойного серебрения деталей из титанового сплава, позволяющая повысить коррозионную стойкость изделий. Элементы технологии рекомендовано принять за базовые при разработке новой технологической схемы изготовления волноводов из титана ВТ1-0 на Государственном рязанском приборном заводе.
- Разработанный технологический процесс пассивации серебряных покрытий рекомендован к внедрению на ЗАО «Красная Пресня» г. Приволжск Ивановской обл.
- Процессы химического полирования и удаления заусенцев с деталей из сплавов на основе меди в разработанных растворах внедрены в серийном производстве деталей топливной аппаратуры на ЗАО «Инта-Центр», г. Ярославль. Применение разработанной технологии химического полирования на ОАО «Шадринский автоагрегатный завод», г. Шадринск Курганской обл. обеспечило повышение герметичности радиаторов, изготавливаемых по технологии «Купробрейз».
Автор защищает:
- закономерности анодного поведения никеля, металлов подгруппы титана, вольфрама и сплавов на его основе, серебра, меди в водных и водно-органических растворах электролитов (природа лимитирующей стадии, зависимость скорости процесса от физико-химических свойств раствора);
- результаты исследования влияния физико-химических свойств поверхностных слоев, формирующихся на металлах при анодной и химической обработке, на скорость электродных процессов и качество обработанной поверхности;
- новые составы растворов электролитов, обеспечивающие повышение эффективности анодной и химической обработки, обладающие пониженной коррозионной активностью;
- результаты исследования влияния импульсных режимов электролиза на распределение электрического поля в электролизере и металла по поверхности катодов сложной конфигурации;
- технологические рекомендации по проведению процессов электрохимической обработки деталей из циркония, гафния и вольфрамокобальтового сплава ВК8, электрохимического полирования серебра и сплава СрМ925, химического полирования титана, меди и ее сплавов, электрохимического осаждения серебра на изделия из титана и жаростойкого сплава с применением импульсного тока.
Достоверность результатов.
Достоверность результатов работы обеспечивалась использованием научно обоснованных методов исследования и приборов, регулярно поверяемых метрологической службой. Погрешности измерений оценивались по многократным измерениям с последующей обработкой результатов в соответствии с ГОСТ 8.207-76. Подтверждением правильности полученных результатов является их практическая реализация в условиях промышленного производства.
Апробация результатов работы и личный вклад автора.
Основные результаты диссертационной работы были доложены и обсуждены на Международных, Всесоюзных и Всероссийских конференциях, в том числе на 5 Всесоюзном совещании по химии неводных растворов неорганических и комплексных соединений (Москва - 1985); 37 совещании Международного электрохимического общества (Вильнюс - 1986); Всесоюзной конференции «Электрохимическая размерная обработка деталей машин» (Тула - 1986); 1 Всесоюзной и 3 Российской конференциях «Химия и применение неводных растворов» (Иваново - 1986, 1993); 7 Всесоюзной конференции по электрохимии (Черновцы - 1988); 8 Всесоюзном симпозиуме «Двойной слой и адсорбция на твердых электродах» (Тарту - 1988); 1 Всесоюзной конференции «Электрохимическая анодная обработка металлов» (Иваново - 1988); 4 и 5 научно-технических семинарах с международным участием по неконвенциональным технологиям в машиностроении (Болгария, Ботевград - 1989, 1991); 6, 7, 8 Международных Фрумкинских симпозиумах (Москва - 1995, 2000, 2005); 6 и 7 Международных конференциях «Проблемы сольватации и комплексообразования в растворах» (Иваново - 1995, 1998); Всероссийской научно-технической конференции «Современная электротехнология в машиностроении» (Тула - 1997); 2 – 5 Международных научно-практических семинарах «Современные электрохимические технологии в машиностроении» (Иваново - 1999, 2001, 2003, 2005); Международной научно-технической конференции «Кристаллизация в наносистемах» (Иваново - 2002); Всероссийской научно-практической конференции «Гальванотехника, обработка поверхности и экология в XXI веке» (Москва - 2003); Международной научно-технической конференции «Электрохимические и электролитно-плазменные методы модификации металлических поверхностей» (Кострома - 2003); 2 Международной конференции «Покрытия и обработка поверхности» (Москва - 2005).
Разработанная технология химического полирования титана отмечена дипломом Ивановского инновационного салона «Инновации-2004»; технология химического полирования меди и ее сплавов – серебряной медалью VI Московского международного салона инноваций и инвестиций (Москва, ВВЦ, 2006).
Работа выполнена в Ивановском государственном химико-технологическом университете. Автором лично проведен критический анализ литературных данных по теме диссертации. Экспериментальные результаты, а также теоретические обобщения и расчеты, представленные в работе, выполнены под руководством автора или лично автором.
По материалам диссертации опубликована 41 работа, в том числе 23 статьи в ведущих научных журналах, получено 2 А.с. СССР, 3 патента РФ и положительное решение о выдаче патента РФ на изобретение.
Структура и объем работы:
Диссертация состоит из введения, 6 глав, общих выводов, списка литературы и приложения. Общий объем диссертации составляет 325 страниц, содержит 102 рисунка и 49 таблиц. Список литературы включает 350 наименований.
Основное содержание работы
Глава 1. Введение и состояние проблемы
Дается анализ работ А.Д. Давыдова, Ю.Д. Гамбурга, С.Я. Грилихеса, Д.Ландольта, Е.М. Румянцева, Б.П. Саушкина, С.И. Галанина и др., в которых рассматриваются проблемы формирования микрорельефа поверхности металлов в зависимости от распределения электрических полей, физико-химических свойств вязких приэлектродных слоев и поверхностных пленок. Рассмотрены вопросы, связанные с влиянием состава раствора на эффекты массопереноса и свойства поверхностных слоев. Показано, что применение электролитов, содержащих органические растворители, позволяет значительно расширить возможности управления процессом формирование микрорельефа.
Использование нестационарного электрического режима позволяет интенсифицировать массоперенос и регулировать процессы формирования пассивирующих слоев. Электролиз с применением импульсного или реверсивного тока дает возможность получения мелкокристаллических гальванических осадков из простых по составу электролитов, а при анодной обработке обеспечивает полирование поверхности.
В заключение первой главы сформулированы цель работы и задачи, подлежащие решению.
Глава 2. Общая методика исследований и используемая аппаратура
Объекты исследования: никель Н0; цирконий (99,9%) и гафний (99,9%); полученные йодидной возгонкой с последующими переплавкой в атмосфере аргона или гелия и рекристаллизационным отжигом; технически чистый титан ВТ1-0; медь М1; латуни ЛС59 и Л60; серебро Ср999 и его сплав с медью СрМ925 (92,5% Ag, 7,5% Cu); вольфрам (99,98%), а также спеченные твердые вольфрамокобальтовые сплавы ВК8 (92% WC, 8% Co) и Т15К6 (79% WC, 15% TiC, 6% Co).
В качестве электролитов использовали водные растворы неорганических солей (NaCl, NaNO3, KCNS и др.), а также электролиты, содержащие органические растворители (пропиловый и изопропиловый (ИПС) спирты, этиленгликоль (ЭГ), глицерин (Г), моноэтаноламин (МЭА), диметилформамид (ДМФА)). Для приготовления растворов использовали реактивы марки х.ч. и дистиллированную воду. При экспериментах на электрохимических станках для приготовления растворов электролитов использовали технические реактивы и водопроводную или дистиллированную воду (при объеме электролита до 50 л ).
Поляризационные исследования проводили в потенциостатическом и потенциодинамическом режимах на стационарном и вращающемся дисковом электроде с использованием потенциостата ПИ-50-1 в комплекте с программатором ПР-8 и двухкоординатным потенциометром ПДА-1. Значения потенциалов измеряли относительно хлоридсеребряного электрода сравнения, а затем пересчитывали относительно водородного электрода.
Фотоэлектрополяризационные измерения проводили в специальной ячейке при импульсном освещении исследуемого электрода ртутной лампой ДРШ-250. Амплитуду и знак фото-ЭДС измеряли с помощью осциллографа С8-12 и низкочастотного усилителя У4-28.
Импедансные измерения на поляризованных электродах проводили с использованием измерителя разности фаз Ф2-34, после поляризации – с помощью моста переменного тока Р-5021 по последовательной схеме.
Оже-спектры получены на электронном спектрометре фирмы «Riber» LAS-600. Для получения профилей распределения элементов оже-электронную спектроскопию использовали в сочетании с послойным распылением исследуемых образцов аргонным пучком.
Измерения времен релаксации, необходимых для определения состава сольватокомплексов и их распределения по формам, проводили на ЯМР-спектрометре Tesla BS 497.0.
Электропроводность растворов определяли с помощью измерителя CLR E7-13 на частоте 1 кГц. Для измерения вязкости растворов использовали вискозиметр с трехэлектродной схемой регистрации времени истечения раствора.
Локализующие свойства электролитов для анодной обработки оценивали по величине логарифмического индекса рассеяния (ЛИР) с помощью ячейки с протоком электролита по зависимости убыли массы анода от величины межэлектродного зазора (МЭЗ). Технологические эксперименты (определение точности копирования формы и размеров электрода-инструмента) проводили на электрохимических копировально-прошивочных станках Э-50 и СЭП-902А.
Определение рассеивающей способности электролитов для электроосаждения серебра проводили в щелевой ячейке Молера согласно ГОСТ 9.309–86. Изучение электрического поля в гальванической ванне проводили с помощью капилляров, соединенных с хлоридсеребряными электродами сравнения.
Оценку прочности сцепления металла покрытия с металлом основы проводили в соответствии с ГОСТ 9.302-88: перегибом образцов под углом 180º; методом нанесения на поверхность образцов сетки рисок во взаимно-перпендикулярных направлениях с прорезанием покрытия до металла основы; термообработкой при t=200оС.
Для измерения внутренних напряжений, использовали метод деформации гибкого катода. Коррозионную стойкость изделий с серебряным покрытием оценивали в ходе климатических испытаний в атмосфере соляного тумана на Государственном рязанском приборном заводе.
Шероховатость обработанной поверхности определяли с помощью профилографа-профилометра «Калибр» модели 252. Для исследования морфологии обработанной поверхности использовали оптический микроскоп МИИ-4 и электронный растровый микроскоп Tesla BS-300. Отражательную способность обработанной поверхности определяли с помощью фотоэлектрического блескомера ФБ-2.
Глава 3. Анодное поведение металлов при высоких анодных потенциалах
Приводятся результаты исследований анодного поведения вольфрама и сплавов на его основе, никеля, циркония, гафния, меди, серебра и сплава СрМ925 в водных и водно-органических электролитах в широком интервале концентраций растворов и температур.
Во всех случаях при достижении достаточно высокого анодного потенциала на поляризационных кривых наблюдаются участки предельных диффузионных токов. Величины предельных токов и значения потенциалов, при которых наблюдается переход в область диффузионного контроля, определяются как природой металла, так и составом электролита. Величины предельных токов возрастают при увеличении скорости вращения дискового электрода (рис. 1). Подобного рода зависимости имеют место как в растворах электрополирования, так и в системах, где имеет место химическое полирование при отсутствии внешнего тока.
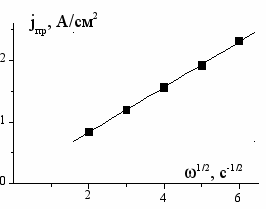 а а | 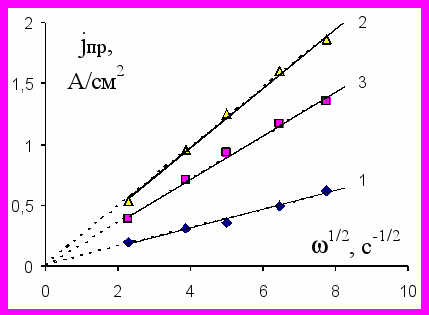 б б |
Рис. 1. Зависимость предельной анодной плотности тока для: а – циркония в водно-спиртовом растворе состава 1 М NaCl + 6 М ИПС; б – вольфрама в электролитах, содержащих 1 М NaCl и различное количество МЭА (моль/л):
1 – 1; 2 – 6; 3 – 8 от квадратного корня из скорости вращения электрода скорости вращения электрода. Т=298К.
Хроноамперометрические измерения при потенциостатическом анодном растворении никеля и циркония в водно-изопропанольных хлоридсодержащих растворах также свидетельствуют об ограничении скорости исследуемой реакции диффузионными процессами; это следует из линейного характера зависимостей jа – τ-1/2. Значения эффективной энергии активации анодного процесса, определенные температурно-кинетическим методом, имеют величины, характерные для замедленности стадии массопереноса (табл. 1).
Таблица 1.
Значение эффективной энергии активации анодного растворения металлов и сплавов в области предельных токов.
| Металл | Ni | W | Zr | Hf | Ti | Ag | CрМ925 | ВК8 |
| Аэф, кДж/моль | 16 | 14 | 13 | 14 | 17 | 16 | 14 | 12 |
Состав раствора оказывает значительное влияние на показатели анодного растворения металлов. Введение в состав водного электролита органических растворителей способствует повышению вязкости растворов (табл. 2) и уменьшению растворимости продуктов анодного окисления металла, поэтому в большинстве случаев приводит к уменьшению предельного анодного тока.
Таблица 2.
Кинематическая вязкость и электропроводность растворов
Н2О – 3 М органический растворитель – 1 М NaCl. Т=298 К.
| Органический растворитель | – | Изопропиловый спирт | Этиленгликоль | Глицерин |
| ν∙106, м2/с | 0,956 | 2,198 | 1,443 | 1,953 |
| , См/м | 7,24 | 4,58 | 5,59 | 5,87 |
При анодной поляризации вольфрама в растворах, содержащих моноэтаноламин (МЭА), наблюдается обратная картина – скорость растворения возрастает при увеличении содержания органического компонента до определенного предела (рис. 1.б). Это связано с тем, что для активации вольфрама необходима щелочная среда, а аминоспирты являются слабыми основаниями. В то же время, объемная концентрация гидроксид-ионов даже в растворе, содержащем 8 М МЭА, не превышает 0,015 моль/л, что недостаточно для обеспечения высокой скорости растворения вольфрама. Следовательно, МЭА принимает непосредственное участие в процессе анодного растворения вольфрама. Экстремальная зависимость предельного тока от концентрации МЭА обусловлена значительным повышением вязкости раствора.
При электрополировании серебра в растворах KCNS растворение протекает при наличии на его поверхности пассивирующей пленки, скорость растворения которой лимитируется подводом роданид-ионов. Уменьшение предельной плотности тока при введении в состав раствора глицерина обусловлено наложением процессов диффузии и гетерогенной химической реакции растворения солевого слоя. Экспериментальные зависимости 1/j - 1/
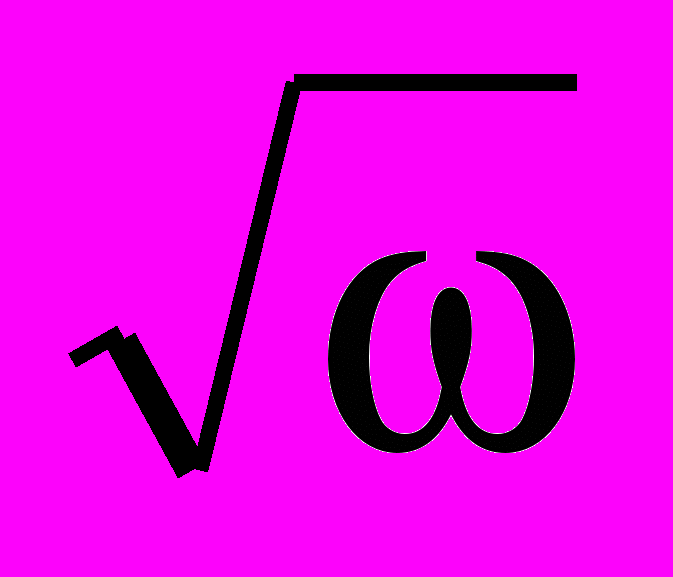 имеют линейный характер как в водном, так и в водно-органическом электролитах, однако не экстраполируются в ноль, что должно наблюдаться при чисто диффузионном контроле процесса. Следовательно, анодный процесс на серебряном электроде осложнен гетерогенной химической реакцией растворения солевого слоя AgSCN: AgSCN + SCN-→[Ag(SCN)2]-, для чего необходим избыток роданид-ионов. Рассчитанные значения реакционных токов составляют соответственно 45 и 17 А/см2 для водного и водно-глицеринового электролитов, что обусловлено, по-видимому, уменьшением растворимости AgSCN в водно-глицериновом электролите.
имеют линейный характер как в водном, так и в водно-органическом электролитах, однако не экстраполируются в ноль, что должно наблюдаться при чисто диффузионном контроле процесса. Следовательно, анодный процесс на серебряном электроде осложнен гетерогенной химической реакцией растворения солевого слоя AgSCN: AgSCN + SCN-→[Ag(SCN)2]-, для чего необходим избыток роданид-ионов. Рассчитанные значения реакционных токов составляют соответственно 45 и 17 А/см2 для водного и водно-глицеринового электролитов, что обусловлено, по-видимому, уменьшением растворимости AgSCN в водно-глицериновом электролите. Роль органического растворителя не всегда ограничивается только изменением вязкости электролита и растворимости продуктов анодного окисления. В ряде случаев возможно его непосредственное участие в анодном процессе в качестве комплексообразователя (по механизму «поверхностного комплексобразования», предложенному Я.М. Колотыркиным).
Нами с использованием метода ядерной магнитной релаксации доказано непосредственное участие молекул алифатического спирта в реакции анодного окисления никеля. Уменьшение величины коэффициента релаксационной эффективности с ростом концентрации органического компонента в растворе доказывает, что в первой координационной сфере катиона никеля (II) происходит процесс пересольватации.
Из величины константы равновесия были определены коэффициенты распределения сольватных форм никеля (II) для систем с различной концентрацией спирта. По значениям доли акваформы никеля (II) в водно-спиртовых системах были рассчитаны величины сольватационной составляющей энергии Гиббса (
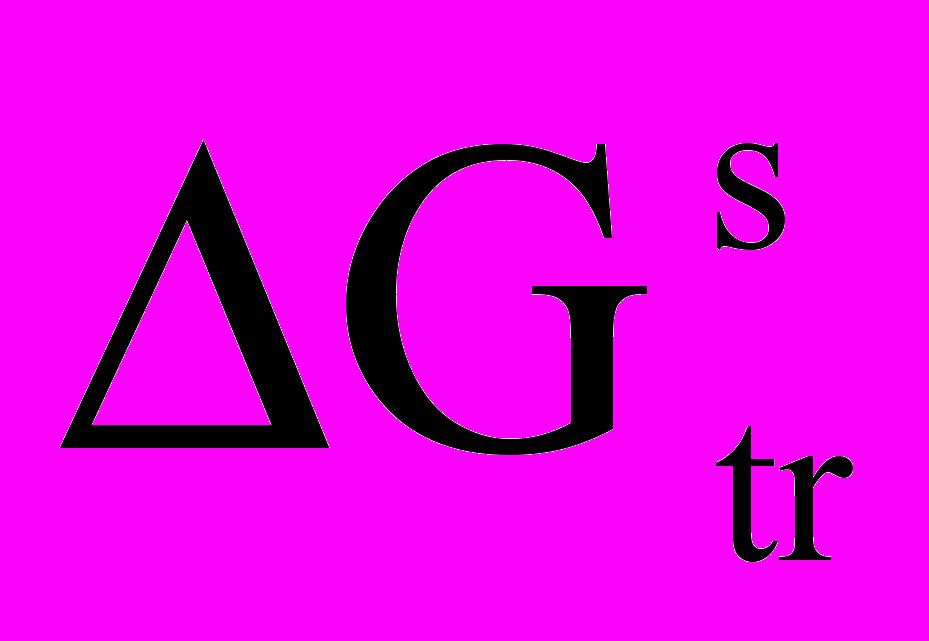 ), характеризующей энергетику процесса переноса ионов Ni (II) из воды в водно-спиртовой растворитель:
), характеризующей энергетику процесса переноса ионов Ni (II) из воды в водно-спиртовой растворитель: 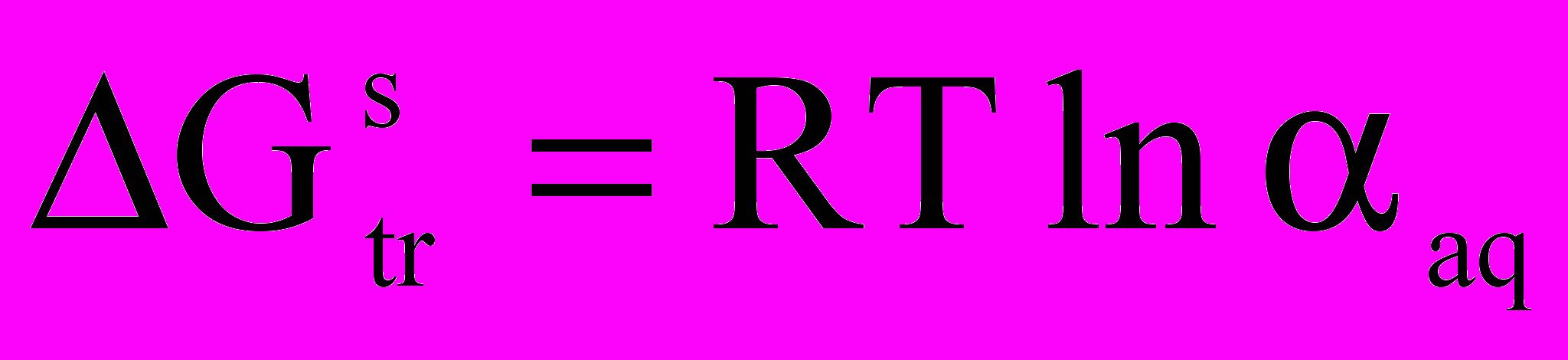 . Как видно из рис. 2, имеет место корреляция между зависимостями плотности тока и
. Как видно из рис. 2, имеет место корреляция между зависимостями плотности тока и 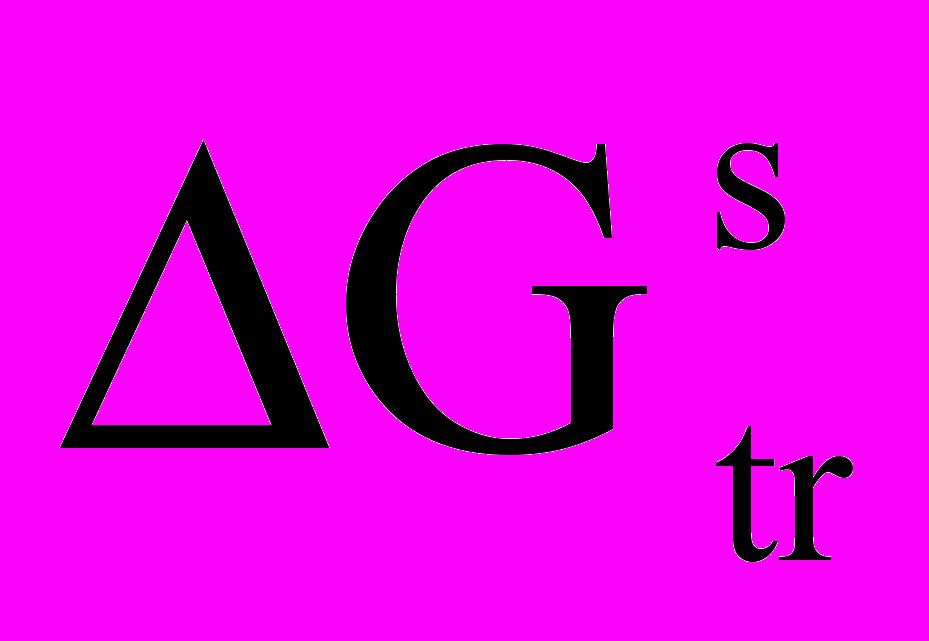 от содержания спирта, что подтверждает положение о непосредственном участии молекул спирта в процессе анодного растворения никеля.
от содержания спирта, что подтверждает положение о непосредственном участии молекул спирта в процессе анодного растворения никеля. 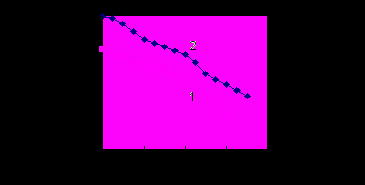 | Рис. 2. Зависимость скорости анодного растворения никеля (1) и величины сольватацион-ной составляющей энергии Гиббса переноса иона никеля (II) из воды в раствор: вода-спирт-хлорид натрия - хлорид никеля (2) от концентрации пропилового спирта. |
На примере анодного растворения меди установлена корреляция между донорным числом органического растворителя и шероховатостью поверхности после анодной обработки в водно-органических растворах. В качестве добавок были выбраны растворители с высокой основностью (гексиламин, триэтиламин), в водных растворах которых образуются аминные комплексы меди; диметилформамид, дающий смешанные гетеросольватные комплексы с ионами D- металлов, а также диоксан – растворитель с низкой основностью.
С усилением координирующей способности растворителя и соответственно ростом прочности связи Сu2+– растворитель полирующий эффект в смешанных водно-органических растворителях возрастает (рис. 3).
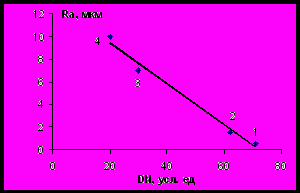 | Рис. 3. Зависимость качества обработанной поверхности меди (Ra, мкм) от донорного числа Гутмана (DN) для растворителей, используемых в качестве добавок: 1 – гексиламин, 2 – триэтиламин, 3 – диметилформамид, 4 – диоксан. ja = 0,8 А/см2, 294 К. |
Причина наблюдаемого эффекта электрополирования тесно связана с механизмом активирования анодного процесса путем нарушения оксидной пленки и образования смешанных гетеросольватных комплексов ионов меди с аминами.
Данные, полученные методом фотоэлектрополяризации, показали, что помимо массопереноса в растворе важную роль в эффекте выравнивания микропрофиля поверхности играют поверхностные оксидные или оксидно-солевые слои.
На вольфрамовом электроде величина отрицательной фото-ЭДС в водно-МЭА растворах на порядок меньше, чем в водном растворе хлорида натрия (рис. 4). Поэтому, в отличие от водного раствора NaCl, полная пассивация не наступает, а растворение протекает через слой поверхностного оксида.
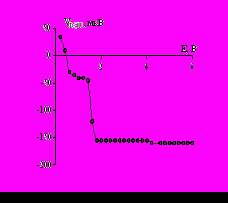 а а | 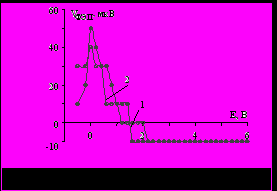 б б |
Рис. 4. Зависимость ЭДС фотоэлектрополяризации от потенциала для вольфрамового электрода: а – в растворе 1 М NaCl; б – в водно-органических растворах: 1 – 1 М NaCl + 1 М МЭА; 2 – 1 М NaCl + 6 М МЭА.
Наличие такого резистивного слоя, наряду с формированием вязкого приэлектродного слоя, насыщенного продуктами растворения, является необходимым условием, обеспечивающим эффект электрополирования, что подтверждается данными табл. 3.
Таблица 3.
Качество поверхности вольфрамового электрода (высота микронеровностей RZ) после обработки в растворах 1 М NaCl с различным содержанием МЭА при потенциале 4 В.
| СМЭА, моль/л | 0,1 | 0,5 | 1,0 | 2,0 | 4,0 | 6,0 | 8,0 |
| RZ, мкм | 2,72 | 0,43 | 0,38 | 0,37 | 0,29 | 0,18 | 0,34 |
Аналогичные результаты получены и при исследовании анодного растворения никеля, циркония и гафния.
Дополнительные сведения о влиянии свойств поверхностных слоев на показатели анодных процессов были получены методом импедансной спектроскопии. Линейный характер годографов для никеля и циркония после их анодной обработки в растворе хлорида натрия, содержащем ИПС доказывает, что диффузионный импеданс Варбурга является одним из основных элементов электрической эквивалентной схемы, описывающей процессы переноса металла в раствор. С ростом потенциала значения импеданса Варбурга возрастают, то есть увеличиваются диффузионные ограничения массопереносу через пленку. При переходе от водного к водно-спиртовому раствору значение импеданса Варбурга для никелевого электрода увеличивается в 2 раза. Это свидетельствует о зависимости полирующего эффекта от электрофизических свойств поверхностных пленок.
Состав этих пленок может меняться в зависимости от состава электролита. Методом оже-электронной спектроскопии при исследовании поверхностного слоя, сформировавшегося в ходе анодной обработки циркония в водно-спиртовом растворе хлорида натрия, установлено, что содержание металла в поверхностной пленке уменьшается, а содержание кислорода возрастает по мере приближения к границе раздела электрод-раствор (рис. 5).
 | Рис. 5. Распределение элементов по толщине поверхностной пленки, образованной на цирконии после анодной обработки в растворе состава: 1 М NaCl + 6 M ИПС + H2O. |
Присутствие в составе пленки углерода и хлора свидетельствует о непосредственном участии компонентов раствора в процессе формирования поверхностного слоя на цирконии при его анодной поляризации.
Для более полной характеристики состояния обработанной поверхности вольфрама, наряду с измерениями шероховатости и отражательной способности, был применен метод фрактальной геометрии. Анализ частотных зависимостей импеданса в координатах Найквиста и Боде показал, что исследуемая система вольфрам – раствор может моделироваться элементом постоянной фазы, и позволил рассчитать величины фрактальной размерности поверхности вольфрама, соответствующие различной концентрации моноэтаноламина в рабочем растворе (табл. 4). Приведенные данные свидетельствуют о том, что при увеличении содержания МЭА фрактальная размерность поверхности металла снижается вследствие уменьшения степени ее растравливания.
Таблица 4.
Фрактальная размерность поверхности вольфрама после анодной обработки в растворах электролитов.
| Раствор | Фрактальная размерность | Rz , мкм |
| 1 М NaCl + H2O | 2,548 | 2,80 |
| 1 М NaCl + 1 М МЭА + H2O | 2,227 | 0,38 |
| 1 М NaCl + 6 М МЭА + H2O | 2,156 | 0,18 |
При исследовании фрактальной геометрии поверхности серебра после анодного полирования использовали методику, основанную на компьютерном анализе микрофотографий обработанной поверхности. Полученные значения текстурной размерности свидетельствуют о более равномерном растворении серебра в водно-органическом электролите по сравнению с водным раствором KCNS (значения фрактальной размерности составили 1,43 и 1,65 соответственно). Это подтверждается результатами профилометрических измерений на образцах из серебра и сплава СрМ925 (табл. 5).
Таблица 5.
Влияние концентрации глицерина на среднее арифметическое отклонение микропрофиля Rа поверхности серебра и сплава СрМ 925 после обработки в растворе, содержащем 4М KSCN. jи=0,7 А/см2, tи=1 с, скважность 10.
| Металл | Rа, мкм при различной концентрации С3Н8О3, моль/л | |||||
| 0 | 0,08 | 0,20 | 0,40 | 0,55 | 0,70 | |
| Серебро | 0,142 | 0,075 | 0,063 | 0,062 | 0,116 | 0,125 |
| СрМ 925 | 0,353 | 0,351 | 0,345 | 0,302 | 0,291 | 0,350 |
