Магазины электрических величин
| Вид материала | Документы |
- Рабочей программы дисциплины Электроэнергетические системы и сети по направлению подготовки, 21.71kb.
- Отчет по лабораторной работе должен содержать: наименование работы и номер, схемы, 365.83kb.
- Экзаменационные вопросы по курсу «Электротехника и электроника», 23.91kb.
- Бизнес-план магазина товаров для детей Содержание, 138.19kb.
- 1. Основные понятия и обозначения электрических величин и элементов электрических цепей., 277.03kb.
- Цифровой вольтметр щ-304, 137.06kb.
- Телемеханики, 26.01kb.
- Отдел метрологического обеспечения измерений электрических величин, 42.58kb.
- Курсовая работа по курсу «основы физических измерений», 226.86kb.
- Теория электрических цепей (часть, 63kb.
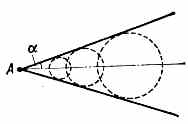
Конус Маха, возникающий от точечного источника возмущений в сверхзвуковом потоке.
В однородном сверхзвуковом потоке газа угол а между образующими М. к. и его осью наз. углом Маха; он связан с Маха числом М соотношением sin =1/M.
МАХА ЧИСЛО [по имени австр. учёного Э. Маха (Е. Mach)] (M-число), характеристика течения газа с большими скоростями, равная отношению скорости течения v к скорости звука а в той же точке потока; М= v/a. Когда тело движется в газе, М. ч. равно отношению скорости тела к скорости звука в этой среде. М. ч. служит одним из осн. подобия критериев в гидроаэромеханике и явл. мерой влияния сжимаемости газа на его движение. При М <<1 газы можно считать несжимаемыми. В воздухе сжимаемость необходимо учитывать при скоростях v>100 м/с, к-рым соответствует число М>0,3. При М<1 течение наз. дозвуковым, при М=1 — звуковым, а при М>1 — сверхзвуковым течением. В области течений с М>5 (т. н. гиперзвуковые течения) становятся существенными физико-хим.
398
превращения в газе, сжимаемом в ударной волне или тормозящемся в пограничном слое.
МАХЕ (единица Махе) (махе, ME), устаревшая внесистемная единица концентрации радиоактивных нуклидов. Была введена австр. физиком Г. Махе (Н. Mache). Иногда применяется в дозиметрии минеральных вод, лечебных грязей и т. п.; в М. указывают концентрацию в воде или в воздухе радона. 1 махе=3,64 эман=3,64•10-10кюри/л=13,47•103 Бк/м3.
МАЯТНИК, твёрдое тело, совершающее под действием приложенных сил колебания около неподвижной точки или вокруг оси. Обычно под М. понимают тело, совершающее колебания под действием силы тяжести; при этом ось М. не должна проходить через центр тяжести тела. Простейший М. состоит из небольшого массивного груза С, подвешенного на нити (или лёгком стержне) длиной l. Если считать нить нерастяжимой и пренебречь размерами груза по сравнению с длиной нити, а массой нити по сравнению
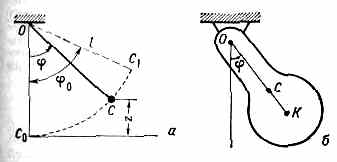
Рис. 1. Маятники: а — круговой математический; б — физический.
с массой груза, то груз на нити можно рассматривать как материальную точку, находящуюся на неизменном расстоянии l от точки подвеса О (рис. 1, а). Такой М. наз. м а т е м а т и ч е с к и м. Если же колеблющееся тело нельзя рассматривать как материальную точку, то М. наз. ф и з и ч е с к и м.
Математический маятник. Если М., отклонённый от равновесного положения c0, отпустить без нач. скорости или сообщить точке С скорость, направленную перпендикулярно ОС и лежащую в плоскости нач. отклонения, то М. будет совершать колебания в одной вертикальной плоскости и точка С будет двигаться по дуге окружности (плоский, или круговой математич. М.). В этом случае положение М. определяется одной координатой, напр, углом отклонения от положения равновесия. В общем случае колебания М. не являются гармоническими; их период Т зависит от амплитуды. Если же отклонения М. малы, он совершает колебания, близкие к гармоническим, с периодом:
Т=2(l/g),
где g — ускорение свободного падения; в этом случае период Т не зависит от амплитуды, т. е. колебания изохронны.
Если отклонённому М. сообщить нач. скорость, не лежащую в плоскости
начального отклонения, то точка С будет описывать на сфере радиуса l кривые, заключённые между двумя параллелями z=z1 и z=z2 (рис. 2, а), где значения z1 и z2 зависят от нач. условий (сферический М.). В частном случае, при z1=z2 (рис. 2, б) точка С будет описывать окружность в горизонтальной плоскости (конический М.). Интерес представляет ещё циклоидальный маятник, колебания к-рого изохронны при любой величине амплитуды.
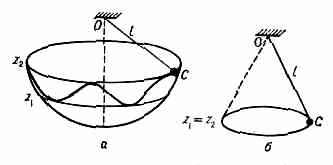
Рис. 2. Маятники: а — сферический; б — конический.
Физический маятник. М. представляет собой тв. тело, совершающее под действием силы тяжести колебания вокруг горизонтальной оси подвеса (рис. 1, б). Движение такого М. вполне аналогично движению кругового математич. М. При малых углах отклонения М. также совершает колебания, близкие к гармоническим, с периодом:
Т=2(I/Mgl),
где I — момент инерции М. относительно оси подвеса, l — расстояние от оси подвеса О до центра тяжести С, М — масса М. Следовательно, период колебаний физ. М. совпадает с периодом колебаний такого математич. М., к-рый имеет длину l0=I/Мl. Эта длина наз. приведённой длиной данного физ. М.
Точка К на продолжении прямой ОС, находящаяся на расстоянии l0 от оси подвеса, наз. центром качаний физ. М. При этом расстояние ОK=l0 всегда больше, чем ОС=l, Точка О оси подвеса М. и центр качания обладают св-вом взаимности; если ось подвеса сделать проходящей через центр качаний, то точка О прежней оси подвеса станет новым центром качаний и период колебаний М. не изменится. Это св-во взаимности используется в оборотном маятнике для определения приведённой длины l0; зная l0 и Т, можно найти значение g в данном месте.
Св-вами М. широко пользуются в разл. приборах: в часах, в приборах для определения ускорения силы тяжести, ускорений движущихся тел, колебаний земной коры, в гироскопич. устройствах, в приборах для эксперим. определения момента инерции тел и др. См. также Фуко маятник.
• Бухгольц Н. Н., Основной курс теоретической механики, 9 изд., ч. 1, 6 изд., ч. 2, М., 1972; Т а р г С. М., Краткий курс теоретической механики, 9 изд., М., 1974, гл. 28; X а й к и н С. Э., Физические основы механики, 2 изд., М., 1971, гл. 13.
С. М. Тарг.
МГД-ГЕНЕРАТОР, то же, что магнитогидродинамический генератор.
М — Д — П-СТРУКТУРА (структура металл — диэлектрик — полупроводник), конденсатор, состоящий из пластины полупроводника, слоя диэлектрика и металлич. электрода. При зарядке конденсатора электропроводность полупроводника изменяется вблизи границы раздела с диэлектриком вследствие изменения концентрации носителей заряда. На этом основана работа ряда приборов.

Рис. Схема МОП-транзистора.
Наиболее распространён кремниевый МОП-т р а н з и с т о р (металл — окисел металла — полупроводник). На подложке Si р-типа (рис.) окислением создаётся тонкий диэлектрич. слой двуокиси SiО2 (толщиной 1000 Å) и наносится металлич. электрод (з а т в о р). Под поверхностью диэлектрика в Si р-типа создаются на нек-ром: расстоянии друг от друга две области с электронной проводимостью, к к-рым подводятся металлич. контакты (исток и сток). Если к затвору приложить положит. потенциал, то все эл-ны под ним в Si (р) притянутся к тонкому слою диэлектрика, создав там проводящий инверсионный слой n-типа. В результате между стоком и истоком образуется канал, по к-рому течёт ток. Подобная система эквивалентна вакуумному триоду (исток — катод, сток — анод, затвор — сетка). Она может служить также элементом памяти. Для этого диэлектрик делается двухслойным — тонкий слой SiО2 и нитрида кремния. Электрич. заряд, введённый в Si, можно (с помощью нек-рых физ. процессов) перевести из Si в ловушки на границе окисел — нитрид. В этих ловушках заряд сохраняется длительно после снятия напряжения между затвором и подложкой (запоминание). Это состояние можно считывать по изменению свойств приповерхностной области подложки. М — Д — П-с.— один из базовых элементов твердотельной электроники. Они служат также для изучения поверхностных свойств полупроводников (вблизи его границы с диэлектриком).
• Мейндл Дж., Элементы микроэлектронных схем, «УФН», 1979, т. 127, в. 2; 3 и С. М., Физика полупроводниковых приборов, М., 1973.
399
МЕГА... (от греч. megas — большой), приставка к наименованию единицы физ. величины для образования наименования кратной единицы, равной 106 исходных единиц. Сокр. обозначение — М. Пример: 1 МВт (мегаватт) = 106 Вт.
МЕДЛЕННЫЕ НЕЙТРОНЫ, нейтроны с кинетич. энергией менее 100 кэВ. См. Нейтронная физика.
МЕЖАТОМНОЕ ВЗАИМОДЕЙСТВИЕ, взаимодействие между атомами как свободными, так и входящими в состав одной или разных молекул, кристаллов и т. д. М. в. может быть к о в а л е н т н ы м, и о н н ы м, м е т а л л и ч е с к и м, типа в о д о р о д н о й с в я з и и в а н-д е р - в а а л ь с о в ы м. Первые три типа М. в. явл. причиной образования химических связей в молекулах, атомных и ионных кристаллах, металлах и сплавах; водородные связи могут образовываться внутри молекул и между разными молекулами в случае, когда между двумя электроотрицат. атомами располагается злектроположит. атом Н; ван-дер-ваальсовы М. в. обусловливают межмолекулярное взаимодействие, а также ответственны за нек-рые св-ва молекул (напр., за существование разл. конформеров; см. Изомерия молекул). Энергия ковалентного, ионного и металлич. М. в. ~102 кДж/моль, энергия водородной связи ~10—50 кДж/молъ и энергия ван-дер-ваальсова М. в. ~0,1—1 кДж/моль.
Помимо указанной классификации, М. в. часто делят на валентные и невалентные. К валентным М. в. относят ковалентные, ионные и металлические, а к невалентным — ван-дер-ваальсовы М. в. Вз-ствие типа водородной связи считают либо слабым валентным, либо занимающим промежуточное положение между валентным и невалентным М. в. Невалентное М. в. может включать не только чисто ван-дер-ваальсово притяжение и отталкивание атомов, но также индукционное и поляризационное, электростатич. и др. М. в. Энергия невалентного М. в. по крайней мере на два порядка меньше энергии валентного М. в.
Ковалентное М. в. возникает в результате обобществления валентных эл-нов парой соседних атомов. Понижение энергии в этом случае выражается в обменных интегралах, поэтому Ковалентное межатомное взаимодействие часто называют обменным (см. Обменное взаимодействие). Ковалентное М. в. является причиной существования молекул простых газов (Н2, Сl2 и пр.), разл. соединений (Н2O, NH3 и пр.), многочисл. органич. молекул (СН4, Н3С—СН3 и пр.), а также атомных кристаллов (различных модификаций фосфора и серы, графита и пр.).
Ионное М. в. обусловлено переносом валентных эл-нов с одного атома на другой и электростатич. вз-ствием образовавшихся в результате этого переноса ионов. Оно характерно для соединений металлов с наиболее типичными металлоидами (напр., NaCl, СаСl2, Аl2O3), а также для ионных кристаллов (NaCl, CsCl и пр.). М. в. в ионных молекулах и кристаллах чаще всего носит частично ковалентный характер. Так, согласно квантовомеханич. расчётам, в молекуле Na+ Cl-заряды на атомах Na и Сl равны не заряду эл-на е, а составляют 0,8 е, и определённый вклад в стабилизацию этой молекулы вносит и обменное вз-ствие.
Металлическое М. в. характерно для чистых металлов и их соединений между собой и связано с наличием эл-нов проводимости, свободно движущихся в решётке металла. Эти эл-ны электростатически взаимодействуют с положительно заряженными атомами металлов, скрепляя их между собой. Металлич. М. в., в отличие от ковалентного и ионного М. в., явл. нелокализованными и ненаправленными.
Водородная связь возникает в том случае, когда между электроотрицат. атомами (атомами, обладающими большим сродством к эл-ну, напр. О, N, F) находится атом Н. Эл-н в атоме Н слабо связан с протоном, поэтому электронная плотность смещается на более электроотрицат. атом. В результате протон «оголяется» и не препятствует сближению атомов О...О, O...N и т. д., расстояние между к-рыми становится близким к тому, к-рое установилось бы в отсутствие атома Н.
Ван-дер-ваальсово М. в. складывается из отталкивания атомов, обусловленного перекрыванием их электронных оболочек, и дисперсионного притяжения. При сближении атомов эл-ны, имеющие противоположно направленные спины, отталкиваются. В результате межэлектронного отталкивания электронная плотность в пр-ве между ядрами двух взаимодействующих атомов уменьшается, что приводит к увеличению энергии межъядерного отталкивания. Т. о., ван-дер-ваальсово отталкивание атомов при их сближении складывается из отталкивания эл-нов и электростатич. отталкивания ядер, дезэкранированных вследствие вз-ствия эл-нов. Дисперсионное притяжение атомов возникает в результате корреляции в движении эл-нов и явл. чисто квант. эффектом. Ван-дер-ваальсово М. в. ответственно за отклонение св-в реальных газов от св-в идеальных газов, за относит. стабильность разл. конформеров, за структуру и св-ва мол. кристаллов и жидкостей и т. д.
М. в. определяется распределением электронной плотности в системе атомов и полностью описывается Шредингера уравнением. Для системы двух атомов решение ур-ния Шредингера, учитывающего кулоновское притяжение эл-нов к ядрам, межэлектронное и межъядерное отталкивание, а также кинетич. энергию эл-нов при разл. межъядерных расстояниях, даёт зависимость потенциальной энергии М. в. от расстояния между атомами. Точное решение получено только для мол. иона H+2. Для систем, состоящих из двух атомов, разработаны разл. приближённые методы решения ур-ния Шредингера. В случае же вз-ствия атомов в многоатомных молекулах или атомов, принадлежащих разным молекулам, применяются феноменологич. методы расчёта, базирующиеся на представлениях о точечных атомах. В основе этих методов лежит т. н. приближение Борна — Оппенгеймера, согласно к-рому энергию молекулы (и вообще любой многоатомной системы) можно рассматривать как непрерывную ф-цию координат ат. ядер.
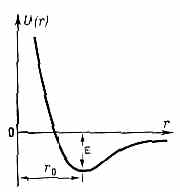
Зависимость потенциальной энергии межатомного вз-ствия U(r) от межъядерного расстояния r. — глубина потенциальной ямы, r0 — равновесное межатомное расстояние.
Для пары атомов такая ф-ция представлена на рис. Устойчивое состояние этой пары возникает при сближении атомов на определённое расстояние r0, отвечающее минимуму потенциальной энергии М. в. Р а в н о в е с н о е р а с с т о я н и е r0 и глубина потенциальной ямы различны для разных типов М. в. Определение потенциальной энергии U(r) эффективного вз-ствия атомов по существу и есть задача определения М. в. Феноменологич. методы расчёта М. в. основаны на использовании разл. полуэмпирич. ф-л для U(r), в к-рые r0, и нек-рые др. величины входят как параметры и подбираются на основании эксперим. данных.
Ковалентное М. в. наиболее часто описывают потенциальной ф-цией Морзе (трёхпараметровым потенциалом Морзе):
U(r)={1-ехр[-а(r-r0)]}2, (1)
где r0 примерно равно сумме ковалентных атомных радиусов, а величина а характеризует крутизну потенциальной ямы. Для двухатомной молекулы глубина потенциальной ямы равна энергии диссоциации, а r0 — межъядерное расстояние, к-рое наблюдалось бы в отсутствии внутримол. колебаний и отличалось бы от межъядерного расстояния, усреднённого за время колебаний, не более чем на 0,001 нм.
Потенциальную энергию ионного М. в. обычно записывают в виде:
400

где рA и рB — дипольные моменты ионов, а и B — их поляризуемости, — эмпирич. константа. Первый член (2) учитывает энергию кулоновского притяжения разноимённо заряженных ионов, второй — энергию обменного отталкивания электронных оболочек, третий и четвёртый члены характеризуют энергию вз-ствия свободных зарядов ионов с диполями pа pb, образовавшимися в результате поляризации каждого иона в электрич. поле др. иона, пятый — вз-ствие этих диполей друг с другом, шестой и седьмой — энергию деформации диполей квазиупругом приближении). Глупа потенциальной ямы равна:
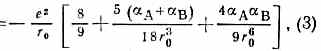
равновесное расстояние r0 определяли ур-нием:
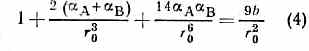
и равно сумме ионных радиусов атомов.
Ионное M. в. определяет структуру энергетику ионных кристаллов.
Для детального описания их структуры используют ф-лу (4), однако для оценки межатомных расстояний с умеренной точностью применяют аддитивную схему, основанную на системе ионных радиусов.
Металлич. М. в. иногда описывают модифициров. кулоновским потенциалом (наз. псевдопотенциалом), эффективно учитывающим вз-ствие эл-нов с оболочкой ионов, с обрезанием на малых расстояниях:
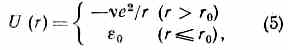
где v — заряд иона, равный числу эл-нов проводимости, приходящихся на один ион металла, 0 и r0 — параметры обрезания.
Для водородных связей вводят спец. потенциалы, гл. параметрами к-рых явл. r0 и , напр. используют ф-лу (1). Угловая же зависимость энергии водородной связи управляется ван-дер-ваальсовыми М. в., описываемыми атом-атомными потенциальными ф-циями (см. ниже). Так, угол О — Н...О, напр., не может быть острым, поскольку в этом случае энергия ван-дер-ваальсова М. в. была бы слишком высокой.
Ван-дер-ваальсово М. в. описывают ф-лой Леннард-Джонса (потенциалом 6—12 Леннард-Джонса):
U (x) = (x-12 -2x-6), (6)
где x=r/r0, или ф-лой Букингема (трёхпараметровым потенциалом Букингема 6-ехр):
U(x)=- Ax-6 + Bexp(-Cxr0), (7)
где А, В к С — эмпирич. параметры.
Расстояние r0 в случае ван-дер-ваальсова М. в. обычно на 0,2—0,3 нм больше, а глубина потенциальной ямы меньше на 3—4 порядка, чем при валентном М. в. Невалентное М. в. приближённо характеризуется ван-дер-ваальсовыми радиусами, к-рые примерно на 0,1 нм больше ковалентных радиусов. Сумма ван-дер-ваальсовых радиусов соответствует мин. расстоянию, на к-рое атомы могут сблизиться при нормальных условиях. Если r0 для ковалентного М. в. с хорошей точностью равно сумме ковалентных радиусов атомов, то значение r0 в ф-лах (6) и (7) больше суммы ван-дер-ваальсовых радиусов (превышение может достигать 0,1 нм).
Система ван-дер-ваальсовых радиусов, возникшая на основе многочисл. эксперим. данных, позволяет определять форму молекулы, если известны длины связей, валентные и двугранные углы (см. Молекула). Знание ван-дер-ваальсового «окаймления» молекул очень полезно при изучении структуры мол. кристаллов, а также жидкостей на основе принципа плотной упаковки молекул.
Более точное теор. изучение структуры мол. кристаллов и жидкостей проводят с помощью метода а т о м-а т о м н ы х п о т е н ц и а л ь н ы х ф-ц и й. В его основе лежит предположение о том, что энергия кристалла представляет собой сумму энергий вз-ствня пар молекул, а энергия вз-ствия каждой пары молекул складывается из ван-дер-ваальсовых М. в., описываемых потенциальными ф-циями (6) или (7). Такой метод оказывается эффективным для исследования органич. кристаллов, построенных из атомов трёх-четырёх сортов. Так, зная эмпирич. константы и r0 в выражении (6) или константы А, В, С в выражении (7), описывающих потенциальную энергию вз-ствия атомов С...С и Н...Н, можно рассчитать структуру и термодинамические свойства многочисл. кристаллов углеводородов.
Метод атом-атомных потенциальных ф-ций применяется и для расчётов конформаций (чаще всего в гибких органич. молекулах, в к-рых вращения вокруг хим. связей сравнительно свободны). Минимизируя энергию молекулы по внутр. геом. параметрам (в частности, по углам вращения), находят равновесную конформацию. Применение метода атом-атомных потенциальных ф-ций в сочетании с рентгеновским структурным анализом привело к увеличению точности и надёжности определения структурных параметров нек-рых белков, полисахаридов, ДНК и транспортных РНК.
Наряду с феноменологич. методами, играющими важную роль в разл. приложениях, в изучении М. в. применяются методы решения многоэлектронной задачи для многоатомной молекулы или для двух взаимодействующих молекул (см. Квантовая химия). Подавляющее большинство таких методов основано на приближении самосогласованного поля. Неэмпирич. расчёты, проводимые на ЭВМ, позволяют получать всё большую информацию о М. в.
• Torrens I. M., Interatomic potentials, N. Y.— L., 1972; Китайгородский А. И., Молекулярные кристаллы, М., 1971; П о л и н г Л., Общая химия, пер. с англ., М., 1974.
В. Г. Дашевский, А. И. Китайгородский.
