Конспект лекций для студентов по специальностям 190302 «Вагоны»
| Вид материала | Конспект |
СодержаниеОсновная цель курса Лекция 3. Аккумуляторы Достоинства кислотных аккумуляторов Недостатки кислотных аккумуляторов Достоинства щелочных аккумуляторов |
- Методические указания к выполнению контрольной работы для студентов заочной формы обучения, 193.46kb.
- Конспект лекций по курсу "Информатика и использование компьютерных технологий в образовании", 1797.24kb.
- Конспект лекций для студентов по специальности i-25 01 08 «Бухгалтерский учет, анализ, 2183.7kb.
- Учебно-методический комплекс по дисциплине «Конструирование и расчет вагонов» (название), 1231.1kb.
- Рабочая программа, методические указания, конспект лекций для студентов заочной формы, 375.73kb.
- Конспект лекций бурлачков в. К., д э. н., проф. Москва, 1213.67kb.
- Конспект лекций по курсу "Начертательная геометрия и инженерная графика" Кемерово 2002, 786.75kb.
- Конспект лекций для студентов специальности 080504 Государственное и муниципальное, 962.37kb.
- Краткий конспект лекций по дисциплине «Основы лесоводства и лесной таксации» Для студентов, 923.35kb.
- Конспект лекций по дисциплине «Маркетинг», 487.79kb.
Федеральное агентство железнодорожного транспорта
Челябинский институт путей сообщения
Филиал ГОУВПО «Уральского государственного университета путей сообщения»
(УрГУПС)
Кафедра естественнонаучных дисциплин
Общетехнический факультет
Е. А. Коновалова
С. М. Чигинцев
Химические источники тока и защита металлов от коррозии
Конспект лекций для студентов по специальностям
190302 «Вагоны»
190303 «Электрический транспорт железных дорог»
101800 «Электроснабжение железных дорог»
Челябинск
2009
Конспект лекций утвержден на заседании кафедры естественнонаучных дисциплин от 17 декабря 2008 г. (протокол № 3)
Тексты лекций по курсу «Химические источники тока и защита металлов от коррозии» предназначены для студентов дневного и заочного отделений специальностей «Электрический транспорт железных дорог», «Вагоны», «Электроснабжение железных дорог». Общетеоретическую базу лекций составляют лекции по основным химическим понятиям, необходимым для понимания вопросов прикладной химии на железнодорожном транспорте. В рамках этой проблемы рассматриваются химические источники тока (ХИТ), их применение на железнодорожном транспорте; дается целостное представление об электрохимических процессах; вопросы химической и электрохимической коррозии металлов, основные способы их защиты. Подробно рассмотрены теоретические основы коррозии, в том числе термодинамика и кинетика процессов.
Тексты лекций рекомендуются для самостоятельной работы студентов дневной и заочной форм обучения.
Рецензенты: А. Г. Тюрин, доктор химических наук, зав. кафедрой аналитической и физической химии ЧелГУ.
Н. В. Пыхова, кандидат технических наук, доцент кафедры коллоидной и когерентной химии ЧелГУ.
Оглавление
| Введение ……………………………………………………………………………. | 4 |
| Лекция 1. Электродные потенциалы и электродвижущие силы. Характеристика ХИТ …………………………………………………………………………………. | 5 |
| Лекция 2. Первичные гальванические элементы…………………………….. | 8 |
| Лекция 3. Аккумуляторы …………………………………………………………… | 11 |
| Лекция 4. Топливные элементы …………………………………………………….. | 16 |
| Лекция 5. Коррозия металлов. Теоретические вопросы в области коррозии ……….. | 19 |
| Лекция 6. Коррозия металлов в разных средах ……………………………………... | 24 |
| Лекция 7. Виды коррозии и техника борьбы с коррозией …………………………... | 28 |
| Лекция 8. Способы защиты металлов и сплавов от коррозии. Защитные покрытия... | 36 |
| Лекция 9. Электрохимическая защита металлов от коррозии …………………….. | 41 |
| Лекция 10. Ингибиторы коррозии металлов. Упаковочные материалы ……………. | 44 |
| Заключение …………………………………………………………………………. | 49 |
| Список литературы …………………………………………………………………. | 50 |
Введение
Конспект лекций по дисциплине «Химические источники тока и защита металлов от коррозии» составлен в соответствии с рабочей учебной программой «Уральского государственного университета путей сообщения» (УрГУПС).
Знание коррозионных процессов и способов защиты металлов - одно из основных направлений в деятельности инженера путей сообщения. Экономические потери от коррозии огромны. Они включают: потери металлов (до 10% от ежегодного выпуска); затраты на внеплановый ремонт и замену прокорродированного оборудования; ущерб от потерь при транспортировке тепла, нефте-, газо- и химпродуктов; затраты на экологические мероприятия. В ряде случаев недооценка коррозии делает небезопасным проведение технологических процессов.
В то же время, прямых специалистов по коррозии готовят ограниченное число вузов (обычно на химико-технологических или на факультетах в области стали и сплавов). Поэтому, инженеру путей сообщения приходится самому решать многие вопросы по защите от коррозии, как на стадии проектирования оборудования, так и при эксплуатации. В предлагаемом курсе, наряду с проблемами коррозии, рассматриваются и химические источники тока (ХИТ) для железнодорожного транспорта (их правильный выбор, электрохимические характеристики, особенности эксплуатации). Основная часть курса лекций посвящена не только теоретической части, но и обсуждению прикладных задач, которые необходимо решать в производственной сфере и на транспорте.
Изучение дисциплины опирается на курс "Химия", из которого студенты должны знать основы строения веществ, свойства растворов электролитов (воды, кислот, солей, щелочей), окислительно-восстановительные реакции, свойства металлов и полимеров. Основу курса составляет раздел химии – электрохимия.
^ Основная цель курса: формирование у студентов инженерно-химических знаний, позволяющих решать различные производственно-технические и научно-исследовательские задачи по избранной специальности.
В данном пособии рассмотрены и систематизированы на современном уровне все необходимые материалы для успешного освоения курса «Химические источники тока и защита металлов от коррозии».
Лекция 1. Электродные потенциалы и электродвижущие силы. Характеристика ХИТ
План
- Электродный потенциал металла
- Классификация химических источников тока.
- Электрохимическая характеристика источников тока
1. Электродный потенциал металла.
Электрод – это система, состоящая из двух контактирующих фаз: материала с электронной проводимостью (металла или полупроводника) и ионного проводника (расплава, раствора электролита или твердого электролита).
При погружении металла в твердый раствор его соли между металлической фазой и раствором будет происходить процесс обмена. Кристаллическая решетка металла состоит из положительно заряженных ионов (катионов) и свободных валентных электронов (электронный газ). В отсутствии водного раствора выход катионов металла из решетки металла маловероятен, так как этот процесс требует больших энергетических затрат. При погружении металла в водный раствор его соли полярные молекулы воды, взаимодействуя с катионами металлической решетки на её поверхности, облегчают переход катионов из металла в раствор. Катионы в металлической решетке существенно отличаются от гидратированных катионов этого же металла в растворе. Благодаря гидратации переход ионов раствор (процесс ионизации) становится энергетически выгодным: M + m H2O = M (H2O)mn+ + n e–.
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл – раствор возникает двойной электрический слой.

– +
– + +
Металл – + + + раствор
– + + +
– + + +
– + +
Рисунок 1.1. Двойной электрический слой на границе раздела фаз металл – раствор.
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом. По мере перехода ионов в раствор растёт отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует окислению металла. Наряду с этой реакцией протекает обратная реакция – восстановление ионов металла до атомов:
M (H2O)mn+ + n e– = M + m H2O.
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а скорость обратной реакции растет. При некотором значении электродного потенциала скорость прямого процесса равна скорости обратного – устанавливается равновесие:
M + m H2O ↔ M (H2O)mn+ + n e–.
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
Абсолютные значения электродных потенциалов экспериментально определить невозможно, но можно определить разность электродных потенциалов. Поэтому для характеристики электродных процессов пользуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измерительного электрода и электрода, потенциал которого условно принимается равным нулю.
Величина равновесного потенциала металла зависит от концентрации его ионов в растворе.
Равновесный обратимый потенциал металла в растворе его соли можно теоретически рассчитать по формуле Нернста:
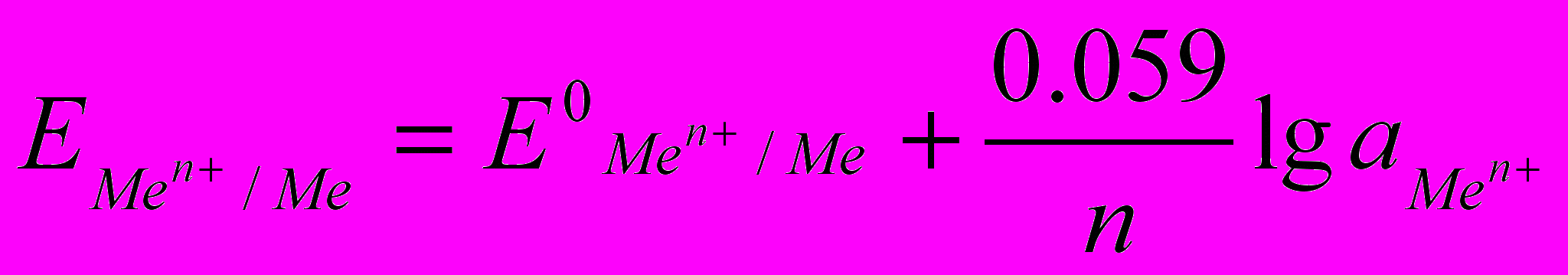 ,
, Где
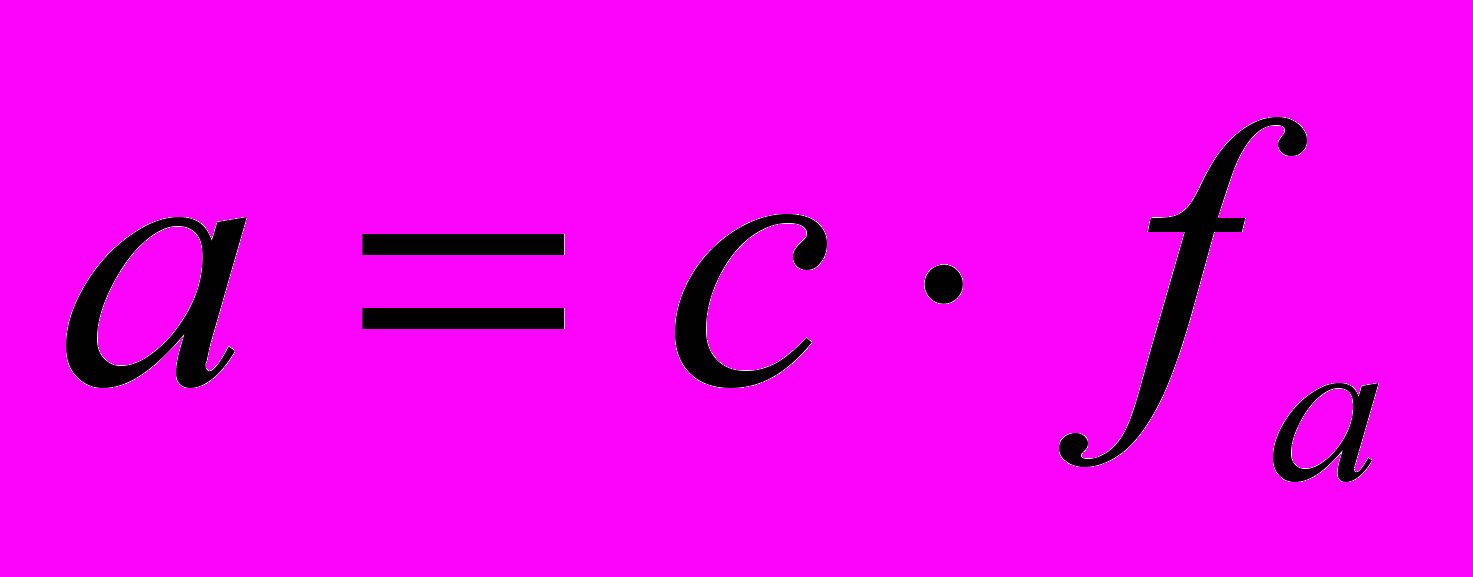 ,
, 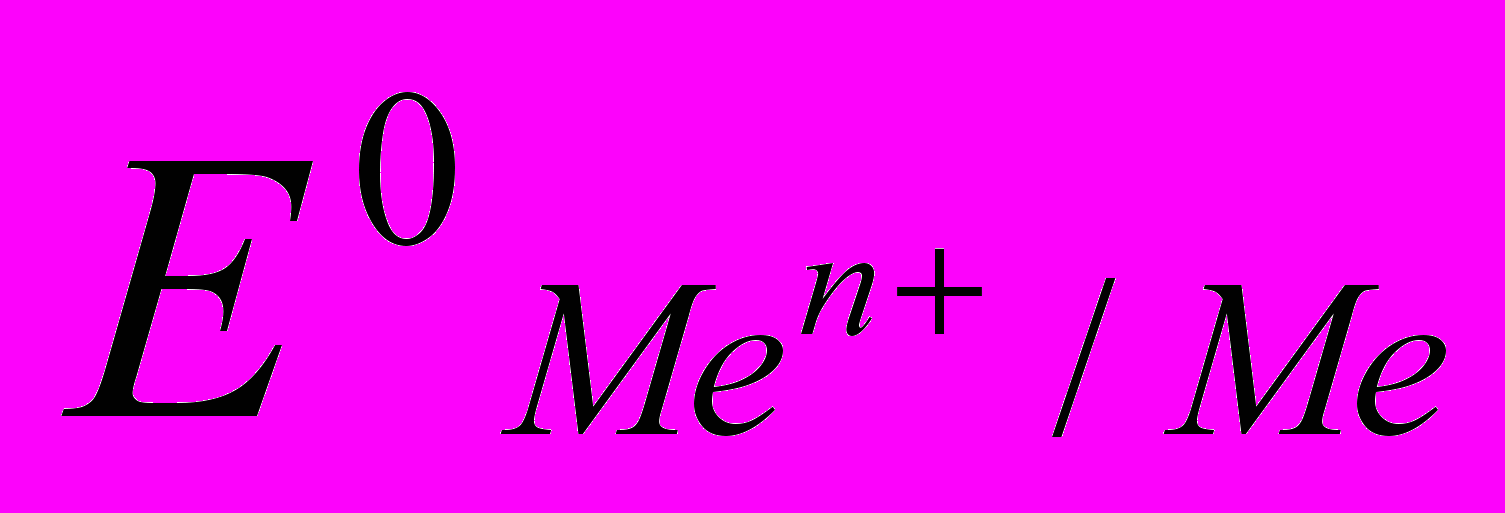 - стандартный электродный потенциал в равновесных условиях, n – валентность иона металла, а – активность, эффективная концентрация ионов металла в растворе, моль/л, С – концентрация ионов в растворе, моль/л, fa – коэффициент активности.
- стандартный электродный потенциал в равновесных условиях, n – валентность иона металла, а – активность, эффективная концентрация ионов металла в растворе, моль/л, С – концентрация ионов в растворе, моль/л, fa – коэффициент активности.Для разбавленных растворов, где активность мало отличается от концентрации (а ≈ С), в уравнение Нернста активность можно заменить концентрацией.
Стандартным потенциалом металлического электрода
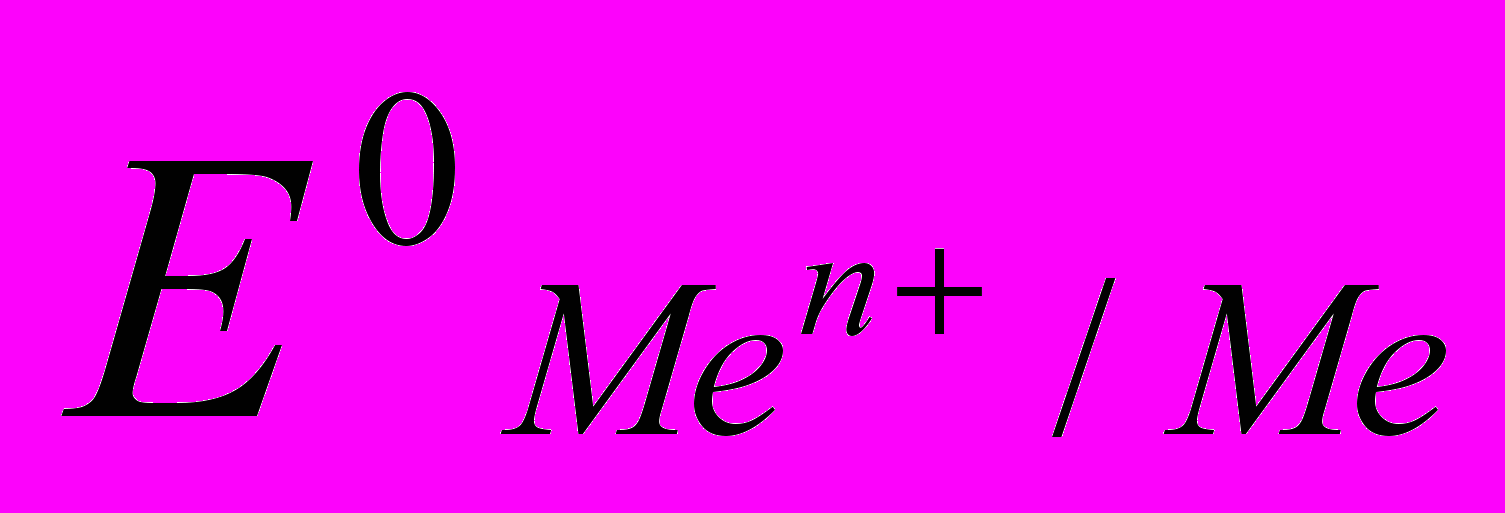 называется потенциал этого электрода в растворе собственных ионов с активностью, равной 1моль/л (а = 1 М) при Т = 298 К и давлении р=1 атм для всех компонентов, находящихся в газовой фазе.
называется потенциал этого электрода в растворе собственных ионов с активностью, равной 1моль/л (а = 1 М) при Т = 298 К и давлении р=1 атм для всех компонентов, находящихся в газовой фазе.Стандартные электродные потенциалы в водных растворах можно расположить в ряд по мере увеличения их значения слева направо. Такой ряд называется рядом стандартных электродных потенциалов. Стандартные электродные потенциалы металлов указывают на меру восстановительной способности атомов металлов и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильными восстановительными способностями обладает этот металл, то есть химическая активность металлов возрастает справа налево. И, наоборот, чем более положителен потенциал металлического электрода, тем более сильными окислительными способностями обладают его ионы.
2. Классификация химических источников тока (ХИТ).
По принципу работы химические источники тока делятся на три группы:
- первичные элементы одноразового действия, называемые гальваническими элементами, или просто элементами. После израсходования запаса реагентов они теряют работоспособность;
- аккумуляторы или аккумуляторные батареи (АКБ) - элементы многоразового действия, перезаряжаемые, вторичные или обратимые. Их работоспособность после разряда может быть восстановлена путём пропускания постоянного электрического тока через источник в направлении, противоположном току разряда, при этом продукты разложения превращаются в первоначальные активные вещества;
- топливные элементы (ТЭ) – это химические источники тока, в которые непрерывно подводятся новые порции реагентов и одновременно удаляются продукты реакции. Они могут непрерывно разряжаться в течение длительного времени.
3. Электрохимические характеристики источников тока
- ЭДС (электродвижущая сила) – максимальная разность потенциалов между положительным и отрицательным электродом.
ЭДС=φ(+) – φ(–),
где φ(+) и φ(–) – равновесные потенциалы положительного и отрицательного электродов соответственно, В. ЭДС зависит от природы и концентрации электролита, от состава и природы активных масс, температуры.
- Разрядное напряжение. При подключении к гальваническому элементу внешней цепи через него протекает гальванический ток. Зависимость между ЭДС и током, протекающим в цепи, выражается формулой:
Up = ЭДС – η(+) - η(–) - J·Rом,
где Up – разрядное напряжение, В; η(+) , η(–) – величина поляризации катода и анода, В; I·Rом – падение напряжения в гальваническом элементе, Rом – внутреннее сопротивление элемента.
- Ёмкость гальванического элемента Q – количество электричества, которое может отдать элемент при разряде. Q = I·t (А·ч), где I – сила тока, А; t – длительность разряда, час.
Номинальная ёмкость – ёмкость, которую должен отдать элемент в режиме разряда, указанном в технических условиях.
Остаточная ёмкость – ёмкость, которую отдаёт элемент после хранения. Ёмкость зависит от массы активных веществ, их природы, силы тока, температуры, продолжительности хранения, условий эксплуатации.
- Мощность – энергия, отдаваемая источником тока в единицу времени (Вт). N = Iср·Uср, где N – мощность, Вт; Iср – средняя сила тока, А; Uср – среднее напряжение при разряде, В.
- Удельная энергия: Am = A/m = Q·Uср/m, где Am – удельная энергия, Вт·час/кг; A – энергия источника тока, Вт·час; m – масса источника, кг; Uср - среднее напряжение, В.
- Удельная ёмкость Qm = Q/m, где Qm – удельная ёмкость, А·час/кг; Q – ёмкость, А·час; m – масса источника, кг.
Лекция 2. Первичные гальванические элементы
План
- Гальванический элемент Вольта и Якоби-Даниэля.
- «Сухой» элемент Лекланше. «Сухие» элементы новой конструкции.
- Щелочные (алкалические) марганцовокислые и медноокислые элементы.
- Ртутно-цинковые и серебряно-цинковые щелочные элементы.
1. Гальванический элемент Вольта и Якоби-Даниэля.
Гальванические элементы как источники электрического тока нашли широкое применение в технике.
Первый гальванический элемент получен в 1799 г физиком А. Вольта. Этот элемент состоит из двух пластин – цинковой и медной, погруженных в разбавленный раствор серной кислоты. Работает он непродолжительное время, так как на медной пластине выделялся газообразный водород, затрудняющий переход электронов к окислителю, а это приводит к быстрому уменьшению разности потенциалов гальванического элемента.
Изменение потенциалов электродов при работе гальванических элементов называется гальванической поляризацией. Для уменьшения гальванической поляризации применяются вещества, увеличивающие скорость катодных процессов. Эти вещества называются деполяризаторами. К ним относятся окислители MnO2, O2, K2Cr2O7 и ионы Cu2+. В медно-цинковом элементе деполяризатором служит раствор СuSO4. Уменьшение поляризации гальванического элемента называют деполяризацией.
Примером простейшей электрохимической системы, в которой электрический ток получают за счёт окислительно-восстановительных реакций, служит медно-цинковый элемент Якоби – Даниэля. Он состоит из медной пластины, погружённой в раствор CuSO4, и цинковой пластины, погруженной в раствор ZnSO4. Электроды отделены друг от друга пористой перегородкой. На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие: Zn ↔ Zn2+ + 2e–. В результате этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие: Cu ↔ Cu2+ + 2e–. Возникает электродный потенциал меди. Цинковый электрод заряжается отрицательно, а медный – положительно.
При соединении меди с цинком металлическим проводником электроны будут переходить от цинка к меди. Схема элемента Якоби – Даниэля записывается так:
Анод (-) Zn / ZnSO4 // CuSO4 / Cu (+) Катод
Токообразующая реакция – то есть суммарная химическая реакция в гальваническом элементе – выглядит следующим образом: Zn + Cu2+ = Cu + Zn2+.
Таким образом, на цинковой пластине идёт процесс окисления: Zn – 2e- = Zn2+, а на медной – восстановление: Cu2+ + 2e- = Cu.
Таким образом гальванические элементы служат для превращения химической энергии в электрическую.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называются анодами. Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называются катодами. Движение ионов в растворе – анионов SO42- к аноду, а катионов Zn2+, Cu2+ к катоду – замыкает электрическую цепь первичного элемента.
2. «Сухой» элемент Лекланше. «Сухие» элементы новой конструкции.
Первичные источники тока – это источники одноразового действия. примером таких элементов может служить марганцово-цинковый элемент с солевым электролитом, известным под названием «сухой» элемент. Он был предложен французским химиком Лекланше в конце XIX века и почти без изменений дошел до наших дней. В марганцево-цинковом элементе активными материалами, обеспечивающими токообразующую окислительно - восстановительную реакцию, являются диоксид марганца MnO2 и цинк. Катодом в этом элементе является МnO2 с токоотводом из угля, так как двуоксид марганца недостаточно хорошо проводит ток. МnO2 находится в контакте с электролитом, основным компонентом которого является влажный хлорид аммония NH4Cl. Этот электролит достаточно вязкий, практически не текуч, поэтому элемент называют «сухим», хотя в нём конечно есть и молекулы воды, принимающие непосредственное участие в электродных процессах.
Схематически элемент можно изобразить так:
Анод Zn / NH4Cl / MnO2 Катод
На катоде происходит восстановление диоксида марганца:
MnO2 + H2O + e- = MnOOH + OH-
На аноде окисляется цинк: Zn – 2e- = Zn2+.
Перешедшие в электролит катионы цинка образуют гидроксид:
Zn2+ + 2 OH- = Zn(OH)2.
2Zn(OH)2 + 4 NH4Cl = [Zn(NH3)4 ]Cl2 + ZnCl2 + 4H2O.
Суммарный анодный процесс можно описать уравнением:
2Zn + 4 NH4Cl + 4 OH- = 4e- + [Zn(NH3)4 ]Cl2 + ZnCl2.
Суммируя катодный и анодный процесс, получим уравнение токообразующей реакции:
2Zn + 4 NH4Cl + 4 MnO2 = 4MnOOH + [Zn(NH3)4 ]Cl2 + ZnCl2.
ЭДС элемента составляет 1,5 – 1,65 В. Это обусловлено некоторым колебанием потенциалов электродов в зависимости от рН загущенного раствора хлорида аммония.
К числу достоинств «сухого» элемента Лекланше относится его способность работать в любом положении и невосприимчивость к сотрясениям и другим не очень сильным механическим воздействиям.
В «сухих» цилиндрических элементах новой конструкции, например, «Марс» (373) в цинковый стакан вставлена свёрнутая в цилиндр картонная диафрагма, покрытая с наружной стороны электролитной пастой. Внутрь цилиндра вставлен не обёрнутый агломерат (диоксид марганца, сажа, 18% хлорид аммония), который плотно прижимает диафрагму к цинковому стаканчику. Электролит имеет следующий состав (в %): NH4Cl (15), ZnCl2 (4,5), CaCl2 (4,5), HgCl2 (0,3), MgCl2 (3), мука (15), вода (57,5). Хлориды цинка и кальция вводят для уменьшения высыхания электролита; хлориды магния и ртути – для уменьшения скорости коррозии цинка.
«Сухие» элементы используются для питания различной бытовой и радиолюбительской аппаратуры. Они могут эксплуатироваться при температуре от -5 до +550С. Однако они плохо работают при низких температурах и больших токах.
3. Щелочные (алкалические) марганцово-цинковые и медноокисные
элементы.
В настоящее время большое внимание уделяется производству алкалических марганцево-цинковых элементов. Электрохимическую схему такого элемента можно изобразить следующим образом:
А (-) Zn / KOH, K2Zn(OH)4 / MnO2 (+)
Е0 MnO2/Mn2+ = 0,17 В; Е0 Zn/Zn2+ = - 1,22 В. ЭДС = 0,17 – ( -1,22) = 1,39 В.
По сравнению с солевыми марганцево-цинковыми элементами они имеют лучшую работоспособность при больших токах разряда, кроме того, алкалические элементы могут быть использованы при температурах от 25 до 55оС, имеют хорошую герметичность и малый саморазряд.
Они применяются для питания при повышенных токах разряда в переносных радиоприемниках, магнитофонах, портативных телевизорах и т.д.
Схема щелочных медноокисных элементов следующая:
А(-) Zn / KOH / CuO, Cu (+) К
Анодный процесс: Zn – 2e- + 2 KOH = K2ZnO2 + 2H+;
Катодный процесс: CuO + 2e- + 2H+ = Cu + H2O.
Суммарный процесс: Zn + CuO + 2 KOH = K2ZnO2 + Cu + H2O.
В качестве положительного электрода используют CuO или (CuO+Cu) с добавкой жидкого стекла. Отрицательным электродом служит сплав цинка с ртутью, которая способствует уменьшению саморазряда. Эти элементы используются стационарно для сигнализации и связи на железнодорожном транспорте.
4. Ртутно-цинковые и серебряно-цинковые щелочные элементы
Ртутно-цинковые элементы выпускаются малой емкости – от 0,05 до 15 А·ч. Материал анода – цинк, катода – оксид ртути. На катоде идет следующий процесс: HgO + H2O + 2e- = Hg + 2 OH-.
Эти элементы предназначены для разряда малыми и средними токами и могут работать при температурах от 0 до 80оС. Основной их недостаток - высокая стоимость, дефицитность и токсичность ртутного сырья. Применяются в карманных калькуляторах, ручных часах и т.п.
Более перспективными являются щелочные серебряно-цинковые элементы. Их электрохимическая схема:
Zn / NaOH или KOH / Ag2O
Эти элементы обладают малыми токами саморазряда и работают при температурах от 0 до 50оС. Используются в измерительной технике. Однако имеют ограниченное применение из-за их дороговизны.
