Курс лекций 1999-2000 гг
| Вид материала | Курс лекций |
- Курс лекций 1999-2000, 14768.78kb.
- Курс лекций для студентов заочного обучения Бурмистрова Л. А., Финансы предприятий:, 1991.45kb.
- Курс лекций. Спб, 1118.16kb.
- Курс лекций. Спб, 172.51kb.
- Курс лекций. Спб, 639.95kb.
- Цнж курс «Управление газетой», 1997 г.; «Триз-шанс» (Москва) курс «Приемы рекламы, 21.89kb.
- В. Б. Аксенов Краткий курс лекций, 1098.72kb.
- Курс лекций Барнаул 2001 удк 621. 385 Хмелев В. Н., Обложкина А. Д. Материаловедение, 1417.04kb.
- Основы политологии: Курс лекций. 2-е изд., доп. Ростов на/Дону.: Феникс, 1999. 573, 14.9kb.
- Г. И. Невельского Н. Н. Жеретинцева Курс лекции, 1964.49kb.
Лекция 16
Ранее мы рассматривали стабильность фиксированных, "твердых" белковых структур. Но — при определенных внешних условиях — самой стабильной может оказаться не твердая, а расплавленная или даже развернутая форма белковой молекулы. Тогда белок "денатурирует", теряет свою нативную, "рабочую" структуру.
Обычно денатурация белка наблюдается in vitro, при воздействии на него аномальной температуры или денатуранта [мочевины, H+ или OH— ионов (т.е. аномального рН) и т.д.]. Однако распад "твердой" структуры белка и затем ее повторная самоорганизация происходит и в живой клетке — что играет важную роль, например, в процессе транспорта белков через мембраны.
Денатурация и ренатурация глобулярных белков in vitro — объект интенсивных исследований, интерес к которым поддерживается их связью с проблемой самоорганизации белка, т.е. с вопросом о том, как белковая цепь находит свою уникальную структуру среди гигантского числа возможных альтернатив. Сегодня я практически не буду касаться кинетических аспектов денатурации и самоорганизации белков и сосредоточусь на термодинамических и структурных аспектах этих явлений.
Больше всего изучены водорастворимые глобулярные белки, и именно о них я буду рассказывать.
Что показывает эксперимент?
Твердо установлено, что денатурация малых белков является кооперативным переходом с одновременным и резким, "S-образным" изменением многих (хотя порой и не всех) характеристик молекулы (Рис.16-1). S-образность экспериментальных кривых показывает, что соответствующие характеристики молекулы меняются от тех, что характерны для нативного белка, до тех, что характерны для белка денатурированного; а узость этих S-образных кривых свидетельствует о кооперативности перехода, т.е. о том, что он охватывает сразу много аминокислотных остатков.
-
а
б
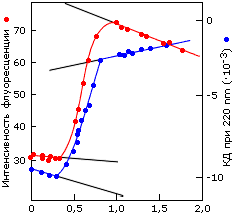
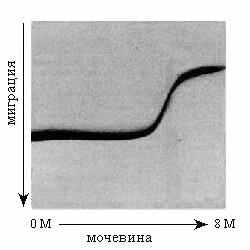
Рис.16-1. Денатурация белка сопровождается резким, "S-образным" изменением многих характеристик молекулы. (а) Синхронное изменение КД (
 ) [длина волны — 220 нм] и флуоресценции (
) [длина волны — 220 нм] и флуоресценции ( ) при денатурации фосфоглицераткиназы в растворе гуанидингидрохлорида. (б) Электрофорез цитохрома с при разных концентрациях мочевины: замедление миграции вызвано разбуханием молекулы при денатурации. Картинки взяты из [6].
) при денатурации фосфоглицераткиназы в растворе гуанидингидрохлорида. (б) Электрофорез цитохрома с при разных концентрациях мочевины: замедление миграции вызвано разбуханием молекулы при денатурации. Картинки взяты из [6]. Более того: денатурация белка происходит как переход типа "все-или-ничего" (Рис.16-2).
-
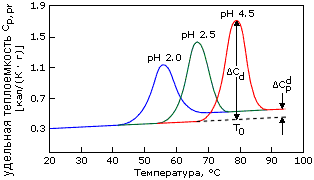
Рис.16-2. Калориметрическое исследование тепловой денатурации лизоцима при разных рН. Положение пика удельной теплоемкости (Ср) определяет температуру T0, его ширина — ширину перехода T, площадь под пиком — поглощенное при плавлении тепло Н в расчете на грамм белка. То, что они удовлетворяют условиям (16.4), (16.5), свидетельствует, что денатурация происходит как переход типа "все или ничего". Увеличенная теплоемкость денатурированного белка — следствие увеличения поверхности контакта его гидрофобных боковых групп с водой при (частичном или полном) разворачивании белка. Картинка взята из P.L.Privalov & N.N.Khechinashvili, J. Mol. Biol. (1974) 86:665-684.
Последнее (вы должны это помнить) означает, что при таком переходе только начальное (нативное) и конечное (денатурированное) состояние наблюдаются в заметных количествах (Рис.16-3), а "полуденатурированных" молекул практически нет. [Хотя, конечно, они тоже должны быть, пусть в мизерном количестве, — ведь не переходит же одно состояние в другое при помощи нуль-транспортировки; но наличие "полусвернутых" структур отражается только на кинетике перехода, разговор о которой еще впереди.] Иначе говоря, переход "все-или-ничего" является микроскопическим аналогом фазового перехода первого рода в макроскопических системах (например — плавления кристалла). Однако — в отличие от истинного фазового перехода — S-образность перехода "все-или-ничего" имеет не нулевую, а конечную ширину, так как этот переход охватывает не макроскопическую, а микроскопическую, очень небольшую систему.
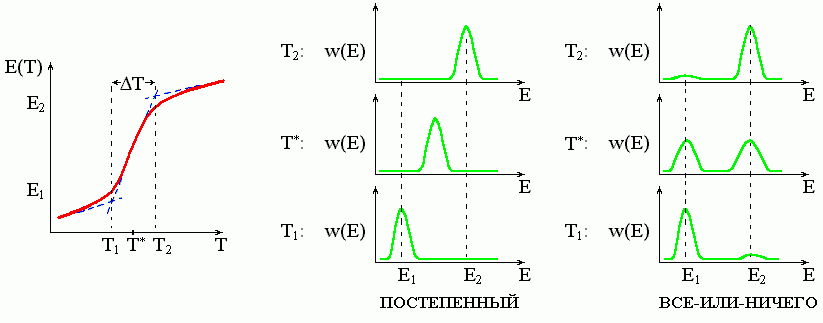
Рис.16-3. При одном и том же виде зависимости энергии Е (или другого наблюдаемого параметра) от температуры, кооперативный ("S-образный") переход может быть и переходом типа "все-или-ничего" (пример: денатурация белка), и постепенным, "безродным" (пример: переход спираль-клубок в полипептидах). Различия проявляются не в виде кривой Е(Т), а в функции распределения W(E) молекул по энергии (или по другому наблюдаемому параметру). Пунктирные линии на левом рисунке поясняют графическое определение T, температурной ширины перехода.
Как было экспериментально показано, что денатурация небольших белков подчиняется принципу "все-или-ничего" — об этом чуть позже, а пока уместно уточнить, что денатурация типа "все-или-ничего" относится к небольшим глобулярным белкам и отдельным доменам крупных белков, а денатурация больших глобулярных белков, как показывают многочисленные опыты, слагается из плавления входящих в них доменов.
Может ли денатурированный белок ренатурировать и обрести свою нативную структуру? То есть — обратима ли его денатурация?
