Курс лекций 1999-2000 гг
| Вид материала | Курс лекций |
- Курс лекций 1999-2000, 14768.78kb.
- Курс лекций для студентов заочного обучения Бурмистрова Л. А., Финансы предприятий:, 1991.45kb.
- Курс лекций. Спб, 1118.16kb.
- Курс лекций. Спб, 172.51kb.
- Курс лекций. Спб, 639.95kb.
- Цнж курс «Управление газетой», 1997 г.; «Триз-шанс» (Москва) курс «Приемы рекламы, 21.89kb.
- В. Б. Аксенов Краткий курс лекций, 1098.72kb.
- Курс лекций Барнаул 2001 удк 621. 385 Хмелев В. Н., Обложкина А. Д. Материаловедение, 1417.04kb.
- Основы политологии: Курс лекций. 2-е изд., доп. Ростов на/Дону.: Феникс, 1999. 573, 14.9kb.
- Г. И. Невельского Н. Н. Жеретинцева Курс лекции, 1964.49kb.
Лекция 13
Теперь в фокусе нашего внимания будут находиться глобулярные, а точнее — водорастворимые глобулярные белки. Именно они наиболее исследованы: для сотен — изучена спонтанная самоорганизация, для тысяч — расшифрована атомная трехмерная структура. Поэтому именно их обычно имеют в виду, говоря о "типичных белковых структурах", о "закономерностях, наблюдаемых в строении и самоорганизации белков" и т.д. После этой необходимой оговорки — обратимся к структурам глобулярных белков.
Рентгенструктурные исследования (а позже, — двух- и многомерный ЯМР) позволили установить — за 40 лет интенсивной работы многих десятков лабораторий — атомную структуру порядка 2000 белков (а если считать и мутантные формы, и различные функциональные состояния — то раз в пять больше).
Что можно увидеть в структурах белков — водорастворимых глобулярных белков — с птичьего полета?
Мы видим, что небольшие (из 50 — 150, реже из 200 — 250 остатков) цепи укладываются в компактную глобулу диаметром 25-40
 (Рис.13-1); и что более крупные белки состоят из нескольких таких субглобул — "доменов" (Рис.13-2). Белковая цепь упаковывается в глобулу так же плотно, как органические молекулы — в кристалл. Это видно и при взгляде на поверхность белка (Рис.13-1а), и на "срезе" белковой глобулы, показанном на Рис.13-1б. Однако, рассматривая белок, нам предстоит рассматривать не плотноупакованные электронные облака (или Вандерваальсовы поверхности) атомов — иначе ничего не будет видно внутри белка — а только очищенные от "мяса" атомов (Рис.13-1в) и даже от боковых групп вообще (Рис.13-1г) скелеты белковых молекул. Поэтому не поддавайтесь часто создаваемому рисунками ощущению "рыхлости" белковых глобул!
(Рис.13-1); и что более крупные белки состоят из нескольких таких субглобул — "доменов" (Рис.13-2). Белковая цепь упаковывается в глобулу так же плотно, как органические молекулы — в кристалл. Это видно и при взгляде на поверхность белка (Рис.13-1а), и на "срезе" белковой глобулы, показанном на Рис.13-1б. Однако, рассматривая белок, нам предстоит рассматривать не плотноупакованные электронные облака (или Вандерваальсовы поверхности) атомов — иначе ничего не будет видно внутри белка — а только очищенные от "мяса" атомов (Рис.13-1в) и даже от боковых групп вообще (Рис.13-1г) скелеты белковых молекул. Поэтому не поддавайтесь часто создаваемому рисунками ощущению "рыхлости" белковых глобул! 
Рис.13-1. Картинки, изображающие строение небольшого белка — -субъединицы интерлейкина 8 — при разной степени схематизации. (а) Атомная модель (изображены только "тяжелые", не-водородные атомы: синие — азоты, красные — кислороды, серые — углероды); в силу того, что цепь в глобуле упакована плотно, мы видим лишь поверхность белка. (б) Срез атомной модели подчеркивает плотность упаковки. (в) Скелетная модель главной цепи (темная линия) и боковых групп (более светлые отростки). (г) Ход главной цепи. (д) Схема строения белка, на которой выделены вторичные структуры (две -спирали и один -лист из трех -тяжей) в главной цепи белка. (е) Структурный каркас белка, сложенный из вторичных структур. Все рисунки даны в одной и той же проекции и в одинаковом масштабе.

Рис.13-2. Глобулярные домены в -кристаллине. Цветная кодировка трассирует ход цепи (от синего на N-конце цепи к зеленому в середине и к желтому и красному на С-конце).
Каркас пространственной структуры подавляющего большинства глобул (доменов) сложен из уже изученных нами регулярных вторичных структур — -спиралей и -листов (Рис.13-1д), которые стабилизованы регулярными водородными связями в регулярной главной цепи. Кстати, эти вторичные структуры были теоретически предсказаны Полингом, Кори и Брэнсоном еще до расшифровки атомного строения белковых молекул. "Штабель", сложенный из этих структур (Рис.13-1е), определяет основные особенности строения белка.
Каркас из - и -структур как бы окружает гидрофобное ядро (или ядра) белка, а нерегулярные петли лежат дальше, на периферии глобулы. Петли практически никогда не входят внутрь белковой глобулы — и неудивительно: их не вовлеченные во вторичную структуру пептидные группы не должны порывать своих водородных связей с водой, это вело бы к нестабильности глобулы.
В зависимости от строения каркаса, глобулярные белки подразделяются на: "чистые" белки; "чистые" белки; и "смешанные" /, & и + белки. Строго говоря, эта классификация типов белковых структур относится к малым белкам, а также к отдельным доменам (т.е. к компактным субглобулам, из которых сложены большие белки), так как большие белки могут содержать, например, и -, и -домены одновременно.
Нас будет прежде всего интересовать: 1) архитектура упаковки - и - структурных сегментов в компактную глобулу (Рис.13-1е); и 2) ход цепи через глобулу (Рис.13-1д), — или, как часто говорят, "топология белковой глобулы".
При этом мы часто будем использовать упрощенные схемы строения белков (Рис.13-3). Такое упрощение достигается не только обращением основного внимания на вторичные структуры (при пренебрежении к детальному строению петель), но и пренебрежением различий в размерах этих структур и к деталям их взаимной ориентации [при этом мы переходим от "укладок" ("folds", Рис.13-3а) к "мотивам укладок" ("folding patterns", Рис.13-3б) белковых цепей].

Рис.13-3. Упрощенные представления белковых структур. (а) Детальная укладка ("fold"), описывающая размещение вторичных структур в цепи белка и в пространстве (см. также Рис.13-1д). (б) Мотив укладки белковой цепи ("folding pattern"): опущены детали хода петель, размера и точной ориентации -спиралей (изображенных в виде параллельных цилиндров) и -тяжей (изображенных в виде стрелок). (в) Упаковка: штабель ("stack") структурных сегментов: петли удалены, опущены размер, ориентация и направление -спиралей и -тяжей (изображенных поэтому в виде лент).
Упрощение это оправдывается тем, что детали строения петель и точные размеры и ориентации структурных сегментов (и даже некоторые маленькие структурные сегменты) не сохраняются, когда мы переходим от рассматриваемого белка к его довольно близкому (имеющему сходную аминокислотную последовательность, т.е. явно общее происхождение) родственнику — например, от гемоглобина к гемоглобину (Рис.13-4).

Рис.13-4. Два близко родственных белка: гемоглобин и гемоглобин лошади (оба — с гемом). Найдите сходства и различия! (Подсказка: при общем высоком сходстве — различия в деталях конформации петель, в деталях ориентации некоторых спиралей, и в одном дополнительном спиральном витке в глобине, справа).
На следующем, более высоком уровне упрощения, необходимом для классификации структур белковых глобул, мы иногда вообще будем рассматривать лишь упаковку структурных сегментов в глобулу — т.е. сложенные из вторичных структур упаковки, или "штабели" ("stacks"), — временно забыв о петлях, соединяющих эти вторичные структуры в единую молекулу (Рис.13-3в).
Я буду специально пользоваться такими упрощенными схемами мотивов укладки и упаковки белковой цепи, — вырисовывая в то же время, для сравнения, и "истинные" структуры белков так, как их дает компьютер. Казалось бы, зачем нужны упрощенные схемы, если компьютер может нарисовать "все как есть". Дело в том, однако, что "все как есть" содержит очень много деталей, а схемы берут из них главные, повторяющиеся в разных сходных белках. Поэтому они удобны и для классификации белковых структур, и для выделения их главных, типических черт. Рассматривая подробные картинки белков, вы все равно в уме выделяете такие типические черты, — а схемы просто позволяют вам систематизировать ваше интуитивное выделение. Кроме того, они дают возможность составить "словесный портрет" белка. На практике такие схемы и такие словесные портреты вам понадобятся сразу же, как только вы захотите выяснить, на кого похож интересующий вас белок: они подчеркивают главное, убирая детали. Конечно, эти "детали" могут быть самыми важными для функционирования белка, и мы с этим встретимся, — но это обстоятельство только подчеркивает относительную независимость функции белка от мотива укладки цепи в нем.
И "упаковки", и "мотивы укладки" цепи в белковую глобулу сосредотачивают наше внимание не просто на всевозможных (рыхлых, ажурных и т.п.) комплексах из структурных сегментов, а лишь на тех, где они, эти структурные сегменты, уложены плотно. Так мы очерчиваем те области конфигурационного пространства, что соответствуют плотной (но без стерического перекрывания) упаковке белковой цепи в глобулу — т.е. окрестности достаточно глубоких минимумов энергии невалентных взаимодействий. Они дают возможность не только классифицировать уже известные белковые структуры, но и предвидеть новые, еще не найденные в природе.
Здесь уместно сделать пояснение. Когда я буду говорить о классификации белковых структур, об их сходстве и т.д. — я буду иметь в виду не тривиальные вещи типа того, что все глобины похожи друг на друга, независимо от того, работают ли они в человеке или в морском червяке. Это, конечно, так, и белки можно классифицировать по филогенетическим семействам, внутри которых функции и, главное, аминокислотные последовательности белков варьируют не слишком сильно. Однако часто сходными пространственными структурами обладают белки, эволюционно никак, по всем тестам, не связанные между собой. И вот это, чисто структурное сходство я буду подчеркивать.
Начнем с изучения строения -белков. -структурные домены устроены, пожалуй, проще других: вытянутые участки цепи собраны обычно в два, реже — в несколько -листов, уложенных друг на друга. Иными словами, "штабеля" вторичной структуры в -белках выглядят довольно просто.
В -белках преобладает антипараллельная -структура.
Так как белки собраны из асимметричных (L) аминокислот, то вытянутые участки слегка скручены сами по себе. Причем, так как минимум энергии вытянутой конформации лежит, как вы помните, на карте Рамачандрана выше диагонали, — вытянутые участки имеют левовинтовую скрученность. В итоге объединения, при помощи водородных связей, скрученных -участков в листы, — определенным образом скручены и эти -листы (Рис.13-5). Их поверхность напоминает пропеллер. Угол между смежными вытянутыми участками -листа составляет около 250. Значит, этот пропеллер выглядит как левовинтовой, если смотреть на него поперек хода -участков (см. Рис.13-5а). И то же скручивание является правовинтовым, если смотреть вдоль хода -участков (см. Рис.13-5б). Так обычно и делают, — смотрят вдоль хода -тяжей и говорят, что у -листа правопропеллерная скрученность.

Рис.13-5. Лист -структуры, вид поперек (а) и вдоль (б) -тяжей. Лист имеет складчатую поверхность (она подчеркивается выступающими С-атомами, окрашенными в зеленый цвет), и — обычно — правопропеллерную (если смотреть вдоль тяжей) скрученность. Водородные связи между -тяжами изображены пунктиром.
Существует два основных типа упаковки -листов: продольная и ортогональная (Рис.13-6а и 13-6б). В обоих случаях -листы упакованы "лицом к лицу", и гидрофобное ядро домена заключено между ними, но в первом случае листы повернуты друг относительно друга слабо — на угол около 300 (плюс-минус 10150), а во втором — сильно, на 900 (плюс-минус 10150); углы, лежащие вне этих двух диапазонов (в частности, углы около +300), наблюдаются редко.

Рис.13-6. Ортогональная (а) и продольная (б) упаковка -листов. Вид сверху и с торца. На виде сверху — приближение -тяжа к читателю показано его (тяжа) расширением. Штрихпунктир — ось ортогонального -бочонка. На оси находятся оба "открытых" угла этой упаковки. Здесь -листы наиболее раздвинуты. В двух других, "закрытых" углах листы наиболее сближены; здесь цепь изгибается и переходит из слоя в слой. При ортогональной упаковке гидрофобное ядро имеет приблизительно цилиндрическую форму. В продольной упаковке, наоборот, ядро плоское, расстояние между скрученными листами меняется мало, а поворот одного листа относительно другого позволяет гидрофобным поверхностям лежащих друг над другом скрученных -тяжей соприкасаться на большой длине. Картинка, с небольшими изменениями, взята из C.Chothia & A.V.Finkelstein, Annu. Rev. Biochem. (1990) 59:1007-1039.
При ортогональной упаковке (Рис.13-6а) -участки скручены и обычно несколько изогнуты, так что общая форма "штабеля" начинает напоминать цилиндр с сильным наклоном -участков к оси. Такую упаковку часто так и называют, — -цилиндром или -бочонком, хотя в -цилиндрах, сложенных из антипараллельной -структуры (в отличие от -цилиндров, сложенных из параллельной -структуры, о которых речь впереди), — в данном случае сеть водородных связей часто разорвана (или надорвана) на противоположных боках бочонка, что позволяет довольно четко выделить два -листа. В "закрытом" углу такой упаковки -участки обоих листов близко сходятся, так что цепь перетекает из листа в лист ценой изгиба и поворота на 900: можно сказать, что единый -лист согнут и уложен сам на себя. В противоположных — "открытых" — углах -листы расходятся, а образующаяся щель обычно заполняется или -спиралью, или нерегулярными петлями, — или активным центром, как в ретинол-связывающем белке (Рис.13-7).

Рис.13-7. Ретинол-связывающий белок: пример ортогонально упакованного -листа. Ход цепи напоминает узор "меандр" (см. топологическую схему — плоскую развертку -цилиндра — сбоку). На этой схеме -тяжи изображены стрелками. "Меандр" получается потому, что соседние по цепи -тяжи являются соседями на поверхности цилиндра; они связаны водородными связями (связь, существующая между крайними -тяжами, изображена на плоской развертке маленькими черточками). Ретинол-связывающий центр находится у оси цилиндра. Сам ретинол окрашен в фиолетовый цвет. Цветная кодировка прослеживает ход цепи по -цилиндру. Цифры на топологической схеме указывают порядок структурных сегментов в цепи.
Продольная упаковка (Рис.13-6б) характерна для листов, которые лишь скручены, как пропеллер, но не изогнуты дугой. Такую упаковку обычно называют -сэндвичем. Торцы -сэндвича прикрыты нерегулярными петлями (вы это видите на Рис.13-8). В некоторых -сэндвичах крайние тяжи -листов столь сближены (иногда они даже соединены несколькими водородными связями), что эта упаковка принимает форму цилиндра с малым наклоном -участков к оси.

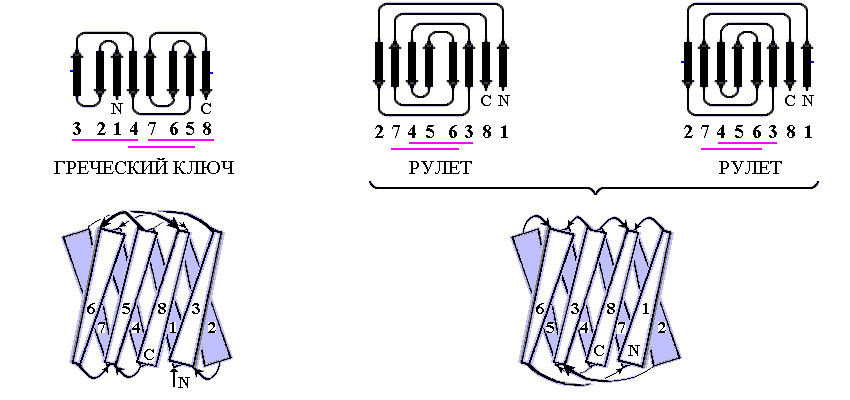
Рис.13-8. Примеры продольной упаковки -листов. Мотивы укладки цепи в домене кристаллина (а) (см. также Рис.13-2), в -домене белка — катаболитического активатора (б) и в белке оболочки сателлитного вируса некроза табака (в). Внизу показаны топологические схемы этих белков. Все эти белки включают характерную топологию "греческого ключа" (или "согнутой пополам -шпильки"), в которой четыре соседних по цепи -тяжа антипараллельны, причем первый и четвертый связаны водородными связями. На топологических схемах двухслойный -сэндвич развернут (как разрезанный сбоку цилиндр) и представлен в одной плоскости. Место разреза выбрано так, чтобы подчеркнуть симметрию укладки цепи. Так, в кристаллине он приходится на стык -тяжей 3 и 8 — с тем, чтобы подчеркнуть сходство структур первой (тяжи 1 — 4) и второй (тяжи 5 — 8) половинок домена. На топологической схеме сближением -тяжей показаны Н-связи между ними; дополнительно, Н-связи между краями развертки (если они есть) показаны маленькими черточками на краях. Увеличенное расстояние между -тяжами отделяет один -лист сэндвича от другого (если там нет водородных связей -тяжей). Домен кристаллина содержит повтор, два греческих ключа: из тяжей 1 — 4 и 5 — 8; и еще один греческий ключ образован -тяжами 4 — 7. Изображенные на рисунках (б,в) белки содержат "ключи" из тяжей 3 — 6 и 4 — 7. Более того, они имеют топологию многократно согнутой -шпильки (она обычно называется "рулет"): здесь Н-связи соединяют также -тяжи 1 и 8, 2 и 7, — в дополнение к связям тяжей 3 и 6, 4 и 5, типичным для "греческих ключей". Обратите внимание, что топология "греческого ключа" позволяет белковой цепи окружить ядро глобулы лучше, чем позволяет "меандр" (Рис.13-7): не только -структурой с боков, но и петлями сверху и снизу. Обычно продольные упаковки -листов представляют собой -сэндвич (а,б), но некоторые из них (например — белка оболочки сателлитного вируса некроза табака и белков оболочки ряда других вирусов) можно представить также в форме -цилиндров с колинеарными -тяжами (в).
Необходимо подчеркнуть, что мотивов укладки белковой цепи имеется гораздо меньше, чем архитектур белковых глобул, а типов "штабелей" — гораздо меньше, чем мотивов укладки белковой цепи.
Так, одному и тому же "штабелю", т.е. одной и той же упаковке структурных сегментов могут соответствовать разные мотивы укладки цепи в глобулу, т.е. эти сегменты могут быть по-разному связаны единой полипептидной цепью. Рис.13-8 показывает, как один и тот же -сэндвич (при различной топологии, т.е. при различном ходе цепи через этот сэндвич) служит основой структуры трех разных белковых доменов — домена кристаллина (а), -домена белка — катаболитического активатора (б), а также белка вирусной оболочки (в). Причем два последних белка имеют даже одинаковый мотив укладки цепи - то есть в них цепь одинаково проходит через одинаковый -структурный штабель (это подчеркивается фигурной скобкой на рисунке 13-8)!
Здесь я не могу удержаться от искушения показать вам еще один белок, в основе которого лежит -сэндвич. Это — иммуноглобулин, точнее — так (или примерно так) устроен каждый домен этого большого белка (Рис.13-9).

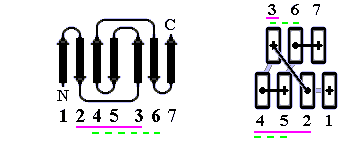
Рис.13-9. Продольная упаковка -листов в константном домене легкой цепи иммуноглобулина
 . Слева представлена подробная картина белка; радужная расцветка (от синего до красного) трассирует ход цепи, от N- к С-концу. На топологической схеме (в центре рисунка) подчеркнуты "греческие ключи". На рисунке справа дан вид на белок "снизу" (с торцов структурных сегментов). Прямоугольники - торцы -тяжей. Крестик соответствует N-концу сегмента (т.е. он "идет от нас"), точка — его С-концу (т.е. он "идет к нам"). Ход петель, соединяющих структурные сегменты, показан черной линией, если петля обращена к нам, и светлой, если она находится на противоположной стороне укладки. Обратите внимание, что такая схема позволяет представить колинеарную упаковку этих сегментов (-тяжей) наиболее просто. Кроме того, она дает возмохность увидеть пространственное строение "греческих ключей" и заметить, что два имеющихся "ключа" в пространстве организованы по-разному.
. Слева представлена подробная картина белка; радужная расцветка (от синего до красного) трассирует ход цепи, от N- к С-концу. На топологической схеме (в центре рисунка) подчеркнуты "греческие ключи". На рисунке справа дан вид на белок "снизу" (с торцов структурных сегментов). Прямоугольники - торцы -тяжей. Крестик соответствует N-концу сегмента (т.е. он "идет от нас"), точка — его С-концу (т.е. он "идет к нам"). Ход петель, соединяющих структурные сегменты, показан черной линией, если петля обращена к нам, и светлой, если она находится на противоположной стороне укладки. Обратите внимание, что такая схема позволяет представить колинеарную упаковку этих сегментов (-тяжей) наиболее просто. Кроме того, она дает возмохность увидеть пространственное строение "греческих ключей" и заметить, что два имеющихся "ключа" в пространстве организованы по-разному. Подобным же образом уложены цепи белков примерно пятидесяти (!) других суперсемейств, — белков, не похожих на иммуноглобулин по аминокислотной последовательности (хотя часть из них и отвечает, как иммуноглобулин, за специфическое связывание каких-то объектов — например, при межклеточном узнавании). Помимо удовольствия показать вам столь популярный мотив укладки цепи, я преследую еще одну цель: показать, что мотив строения белка с более или менее колинеарной упаковкой структурных сегментов проще всего отражается схемой, представляющей вид с торца на такой белок.
Перейдем к ортогональной упаковке -листов. Рисунок 13-10 показывает, как один и тот же -цилиндр (при различной топологии, при различном ходе цепи через ортогональную укладку -листов) служит основой и сериновой протеазы типа трипсина (а), и протеазы кислой, типа пепсина (б).
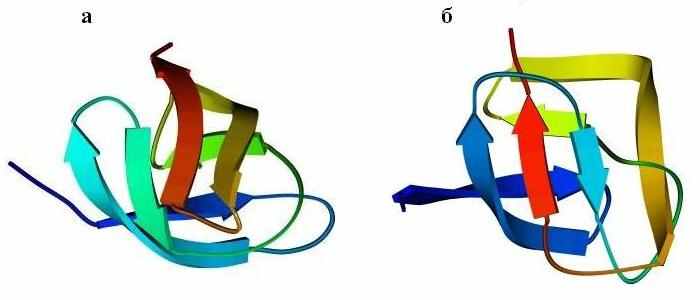
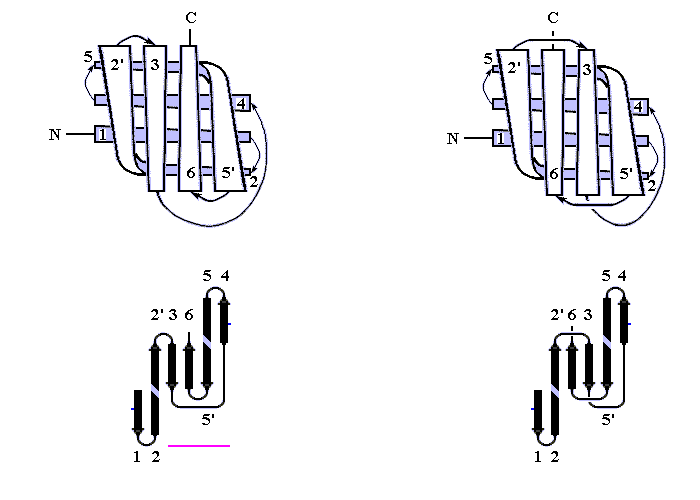
Рис.13-10. Мотив укладки цепи в сериновой протеазе (а) и в кислой протеазе (б). В последнем белке петли укорочены и изображены довольно схематично. Показана схема ортогональной упаковки -листов в этих белках, а также топологические схемы -листов. Эти листы согнуты (при изгибе края листов уходят от читателя и смыкаются; возникающая при этом водородная связь краев -листа изображена черточками); места перегибов -тяжей соответствуют их более светлым частям. "Греческий ключ" в трипсине подчеркнут.
При этом -домен белка — катаболитического активатора имеет точно такой же мотив укладки цепи (т.е. ту же топологию хода цепи через такого же вида -структурный штабель), что и совершенно не связанный с ним (ни генетически, ни функционально) белок оболочки сателлитного вируса некроза табака.
Примеры такого сходства структур при отсутствии какой-либо другой видимой связи между белками очень многочисленны.
Выше мы рассмотрели "базовые" конструкции -белков. Есть и более сложные — например, "многозаходный пропеллер".
В "пропеллере" нейраминидазы (Рис.13-11) — шесть наклонно уложенных -листов образуют розетку (в других белках бывает до восьми -листов). Если рассматривать эти листы попарно — они образуют -сэндвичи, так что "пропеллер" часто описывают как суперцилиндр, сложенный из -сэндвичей.
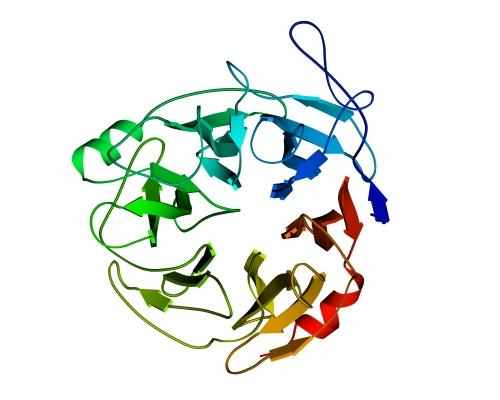
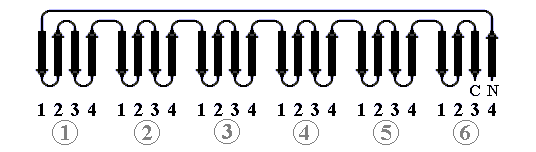
Рис.13-11. -Структура в форме "шестилопастного пропеллера" в нейраминидазе. Внизу — схема топологии этого белка, состоящего из шести антипараллельных -листов.
Во "вмятине" на оси этого суперцилиндра — вы видите, что она не прикрыта петлями — находится активный центр. В ретинол-связывающем белке мы уже встречались с таким расположением активного центра — во вмятине в центре цилиндра, и мы встретимся с ним еще.
Интересна также — прежде всего своей регулярностью — конструкция типа "-призмы" или (другое название) "-спирали" (Рис.13-12). Три грани такой призмы образованы тремя -листами — причем параллельными! — а цепь проходит сквозь них по спирали, непрерывно переходя из одного листа в другой. При этом она как бы навивается на ось призмы, образуя либо обычную при соединении параллельных -тяжей правую спираль, либо (в других призмах) спираль левую, исключительно редкую при соединении -тяжей.
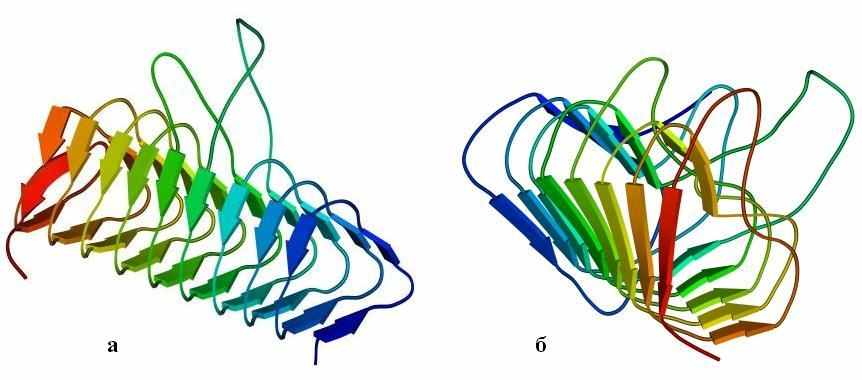
Рис.13-12. -Призма в ацилтрансферазе (а) и в пиктатлиазе С (б). Обратите внимание на разную закрученность цепи вокруг длинной оси призмы: необычную, левую на рисунке (а) и обычную, правую — на рисунке (б), а также на то, что при левой закрученности цепи отсутствует обычная (правопропеллерная, если смотреть вдоль -тяжей, см. Рис.13-12б и Рис.13-5 — 13-11) скрученность -листа.
Теперь уместно поговорить о топологии -белков. Прежде всего обращает на себя внимание то, что -белки сложены преимущественно из антипараллельной -структуры. Большинство рассмотренных нами до сих пор -белков состояло из чистой антипараллельной -структуры. Порой к ним примешивается небольшое количество параллельной (см. Рис.13-10б). Очень редко, но бывают белки, сложенные из чисто параллельной -структуры (см. Рис.13-12).
То, что "примесь" параллельной к антипараллельной -структуре довольно мала — в общем, не удивительно, так как они имеют несколько разные конформации, так что их стык должен быть энергетически невыгодным. В какой мере энергетическая невыгодность структуры сочетается с относительной редкостью ее встречаемости — об этом мы поговорим на одной из ближайших лекций; однако в целом ясно, что стабильная система — а белок стабилен — должна состоять в основном из стабильных же элементов и избегать внутренне нестабильных.
Преимущественно же антипараллельный характер -листов в -белках тесно связан с тем, что их архитектура обычно основана на -шпильках (Рис.13-13). Такие шпильки часто бывают согнуты пополам, а иногда — согнуты дважды или даже трижды (как на Рис.13-8б,в).

Рис.13-13. Антипараллельные -шпильки.
Петли, соединяющие -участки, обычно имеют вход и выход на одном и том же краю укладки (т.е. они не пересекают "штабель", а прикрывают его торец). Это видно почти на всех рисунках. При этом петли, даже если они длинны, чаще всего соединяют близкие между собой в пространстве концы -участков. Поэтому соседние по цепи участки, как правило, не параллельны — и часто образуют анитипараллельные -шпильки.
Отметим также, что "наложение" петли на петлю (или, как говорят, "пересечение петель") встречается редко (такое исключение из правил показано на Рис.13-10б, снизу), — видимо, потому что при этом петли должны дополнительно изгибаться (чтобы избежать столкновения или дегидратации), что опять-таки энергетически невыгодно. Избегание наложения петель — общее структурное правило, наблюдающееся в белках.
В результате, из многих изображенных на Рис.13-14 возможных конфигураций -листа, сложенного из единого куска цепи, — по-настоящему часто встречаются лишь три мотива: "меандр" и два "греческих ключа" (они подчеркнуты на рисунке) — именно эти мотивы свободны от всех отмеченных выше недостатков.
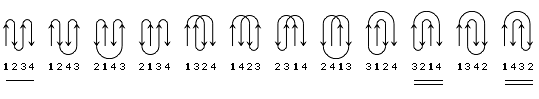
Рис.13-14. Возможные топологии листов из четырех -участков. Показаны только листы, где каждые два подряд (в цепи) идущих -участка направлены в противоположные стороны. Из этих топологий часто встречаются только "меандр" (подчеркнут одной чертой) и два (подчеркнуты двойной чертой) "греческих ключа" (они различаются только направлением поворота цепи от шпильки из тяжей 1,4 к шпильке из тяжей 3,4). Пример белка с меандром — ретинол-связывающий белок (см. Рис.13-7); примеры белков с "греческим ключом" — -кристаллин и другие белки, изображенные на Рис.13-8), или трипсин (Рис.13-10).
"Меандр" — это, кстати, имя очень извилистой реки в Греции — характерен тем, что соседние по цепи -тяжи являются также ближайшими соседями в пространстве (Рис.13-8); обычно (но не всегда) они связаны водородными связями. "Греческий ключ" (такой орнамент можно увидеть на старых вазах и садовых решетках) характерен тем, что четыре соседних по цепи -тяжа антипараллельны, причем первый и четвертый связаны водородными связями. При этом на самом деле второй и/или третий -тяжи "ключа" часто лежат не в том же (как может показаться из Рис.13-14), а в другом -листе. При этом в пространстве образуются различные структуры — так называемые "abcd" структуры Ефимова — с одной и той же топологией греческого ключа (Рис.13-15). Найдите их на рисунках 13-8, 13-10.
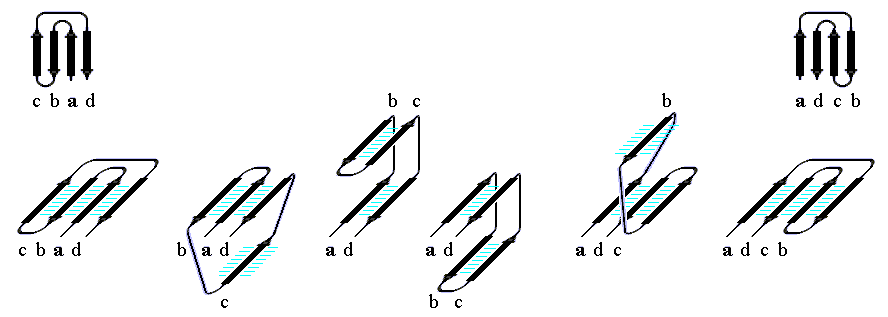
Рис.13-15. Различные пространственные "abcd" структуры Ефимова с топологией греческого ключа. Обратите внимание на правый ход суперспирали, состоящей из двух параллельных -тяжей одного -листа и лежащего между ними в цепи -тяжа другого листа (т.е. на суперспираль из -тяжей b-c-d на втором слева внизу и на суперспираль из тяжей a-b-c на второй справа внизу схемах). Именно такое — "правовинтовое" — соединение параллельных -тяжей одного -листа типично для белков; обратное, "левовинтовое" встречается очень редко.
Все такие характерные, часто встречающиеся в белках структуры (шпильки, меандр, греческий ключ, abcd структуры и т.д.), сложенные из соседних по цепи элементов (и/или ) структуры, часто называют "супервторичными" структурами.
