«Российская медицинская академия последипломного образования Росздрава»
| Вид материала | Диплом |
- «Российская медицинская академия последипломного образования Росздрава», 245.06kb.
- Лимфогенные методы в комплексном лечении рожистого воспаления 14. 01. 17 хирургия, 1146.26kb.
- На правах рукописи, 311.59kb.
- «Российская медицинская академия последипломного образования Росздрава», 742.4kb.
- Фотодинамическая терапия псориаза препаратами тетрасульфофталоцианинового ряда 14., 335.98kb.
- Оценка метаболитов микрофлоры при воспалительных заболеваниях пародонта. 14. 01., 347.36kb.
- Факторы риска и особенности течения рахита у детей раннего возраста в современных условиях, 757.52kb.
- Неспецифические урогенитальные инфекции женщин (этиология, клиника, диагностика, терапия), 359.63kb.
- На правах рукописи енгай Вадим Анатольевич ретроспективный анализ эффективности адьювантной, 278.8kb.
- Клинические Особенности ранних форм эндокринной офтальмопатии 14. 00. 08 глазные болезни, 324.04kb.
На правах рукописи
Давыдова
Любовь Алексеевна
Синдром острого повреждения легких в интенсивной терапии больных с внутричерепной гипертензией
14.01.20-анестезиология и реаниматология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва - 2011
Работа выполнена в Государственном образовательном учреждении дополнительного профессионального образования «Российская медицинская академия последипломного образования Росздрава»
^ Научный руководитель:
| доктор медицинских наук, профессор | Евдокимов Евгений Александрович |
Официальные оппоненты:
| доктор медицинских наук, профессор | ^ Шестопалов Александр Ефимович |
| доктор медицинских наук, профессор | Овечкин Алексей Михайлович |
Ведущее учреждение:
«Федеральное государственное военное образовательное учреждение ВПО Военно-медицинская академия имени С. М. Кирова МО РФ »
Защита состоится «23» мая 2011 года в14.00 часов на заседании диссертационного совета Д 208.072.11 при ГОУ ВПО РГМУ Росздрава по адресу: 117997, г. Москва, ул. Островитянова, д.1.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО РГМУ Росздрава по адресу: 117997, г. Москва, ул. Островитянова, д.1.
Автореферат разослан «1» апреля 2011 года
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Г.Д.Лазишвили
^ Список использованных сокращений
АД артериальное давление
ВАП вентилятор-ассоциированная пневмония
ВЧД внутричерепное давление
ВЧГ внутричерепная гипертензия
ВЧК внутричерепное кровоизлияние
ДО дыхательный объем
ИВЛ искусственная вентиляция легких
ИВСВЛ индекс внесосудистой воды легких
ИПСЛ индекс проницаемости сосудов легких
ЧМТ черепно-мозговая травма
ОПЛ острое повреждение легких
ОРИТ отделение реанимации и интенсивной терапии
ПДКВ положительное давление в конце выдоха
ПОН полиорганная недостаточность
ЦПД церебральное перфузионное давление
ЧСС частота сердечных сокращений
ШКГ шкала комы Глазго
FiO2 фракция кислорода в дыхательной смеси
РаО2 парциальное давление кислорода в артериальной крови
РаСО2 парциальное углекислого газа в артериальной крови
^ ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
В структуре заболеваемости населения России травматические и нетравматические поражения головного мозга занимают одно из первых мест [Пирадов М.А., 2008]. Актуальными остаются проблемы коррекции внечерепных осложнений у больных с повреждениями головного мозга, в том числе проблемы дыхательной недостаточности.
Частота развития острого повреждения легких (ОПЛ) у больных с нарушениями сознания составляет от 50 до 80% [Stubbe Н., 2008]. При патологоанатомическом исследовании лёгких при черепно-мозговой травме и острых нарушениях мозгового кровообращения, всегда выявляются резко выраженные гемодинамические расстройства [Bratton et al, 1997, Demling et al., 1990]. Легочных осложнения оказывают существенное влияние на структуру исходов при черепно-мозговой травме и нарушениях мозгового кровообращения [Mascia and Andrews, 1998; Holland et al., 2003; Щеголев А.И., 2007].
Современные подходы к лечению больных с ОПЛ основаны на использовании респираторной терапии и профилактике развития полиорганной недостаточности (ПОН), которая является основной причиной смерти больных с ОПЛ [Bellingan G.J., 2002, Кассиль В.Л., 2001, Гельфанд Б.Р., 2001].
Профилактика ишемии мозга при его поражении заключается в стабилизации гемодинамики, лечении гипоксии и своевременной коррекции внутричерепной гипертензии [R. Chesnut, 1995, Крылов В.В., 2010]. Для этого необходимо использовать достаточный объем инфузионной поддержки, коллоидные, кристаллоидные и гиперосмоляльные препараты [Щеголев А.В., 2003, Царенко С.В., 2009]. Неограниченная инфузионно-трансфузионная терапия может усугублять течение ОПЛ [Wheeler A., 2000], однако ограничение объема жидкости не приводит к улучшению исходов у больных с ОПЛ [Neil R. MacIntyre, 2006]. Применение только кристаллоидных растворов может отрицательно влиять на течение ОПЛ [Hudson LD, 1992], но с другой стороны, применение коллоидов и препаратов крови также небезопасно [Галстян Г.М., 2006]. Поэтому вопрос об оптимальной тактике инфузионной терапии у больных с сочетанием ОПЛ и внутричерепной гипертензии в настоящее время является предметом дискуссий.
Наиболее эффективным и безопасным методом респираторной терапии ОПЛ является «протективная» вентиляция легких с использованием дыхательного объема 5-7 мл/кг [The Acute Respiratory Distress Syndrome Network, 2000; Гельфанд Б.Р., 2000, Кассиль В.Л., 2001]. Этот метод ИВЛ не всегда допустим у пациентов с поражением головного мозга, т.к. часто сопровождается гиперкапнией и сопутствующим повышением внутричерепного давления (ВЧД). К росту ВЧД и ухудшению мозгового кровотока могут приводить и другие методы респираторной терапии ОПЛ – вентиляция с повышенным положительным давлением в конце выдоха (ПДКВ), положение больного в прон-позиции [Bein T., 2002; Davis R.L., 1997]. Таким образом, проблема выбора тактики респираторной терапии у больных с сочетанием внутричерепной гипертензии и острого повреждения легких остается актуальной в настоящее время.
^ Цель исследования
Повысить эффективность и безопасность инфузионной терапии и респираторной поддержки при остром повреждении легких у пациентов с поражением головного мозга.
^ Задачи исследования
- Оценить частоту развития и тяжесть течения острого повреждения легких, а также факторы риска у нейрохирургических и неврологических больных в остром периоде заболевания.
- Изучить частоту развития и динамику острого повреждения легких при использовании различных схем инфузионно-трансфузионной терапии.
- Оценить значимость индекса внесосудистой воды легких (ИВСВЛ) для выбора тактики инфузионно-трансфузионной терапии у больных с острым повреждением легких.
- Изучить возможность применения вентиляции с высоким уровнем ПДКВ у больных с внутричерепной гипертензией и острым повреждением легких.
- Сравнить исходы заболевания у пациентов с внутричерепной гипертензией и острым повреждением легких в зависимости от используемых схем инфузионной терапии.
^ Научная новизна
- Впервые в клинической практике определена частота и факторы риска развития острого повреждения легких у пациентов с нарушениями сознания в остром периоде травматического и нетравматического поражения головного мозга.
- Впервые с применением метода транспульмональной термодилюции и общепринятыми принципами диагностики острого повреждения легких исследовано развитие острого повреждения легких у пациентов с нарушениями сознания вследствие органического поражения головного мозга. Проведена оценка влияния различных схем инфузионно-трансфузионной терапии на частоту развития и динамику ОПЛ.
- Проведена оценка безопасности проведения ИВЛ с высокими значениями ПДКВ у больных с внутричерепной гипертензией. Доказана взаимосвязь значений ПДКВ и ВЧД в зависимости от особенностей течения заболевания. Выявлено, что максимальная величина ПДКВ, не вызывающая нарушений церебральной гемодинамики у больных с внутричерепной гипертензией составляет 15 см вод. ст.
^ Практическая значимость
Установлены сроки и частота развития острого повреждения легких у больных с нарушениями сознания, находящихся на ИВЛ.
Выявлено отсутствие статистически значимой корреляции вводимых объемов жидкости и сроков развития и тяжести течения ОПЛ у этой категории больных.
Произведена оценка влияния различных инфузионных сред на показатель ИВСВЛ и клиническое течение ОПЛ. Выявлена взаимосвязь между динамикой показателя ИВСВЛ и тяжестью ОПЛ. Установлена взаимосвязь между уровнем ПДКВ и значением ВЧД у пациентов с внутричерепной гипертензией.
Определены показания и противопоказания к проведению инфузионно-трансфузионной терапии и подбору параметров ИВЛ у пациентов с сочетанием внутричерепной гипертензии и острого повреждения легких.
^ Основные положения, выносимые на защиту
- Ограничение объема инфузионной поддержки менее 35 мл/кг/сут не исключает высокой частоты развития ОПЛ у больных с нарушениями сознания в остром периоде заболевания.
- При использовании гиперосмоляльных растворов у больных с нарушенной оксигенацией следует осуществлять мониторинг газового состава крови для своевременной коррекции параметров респираторной поддержки.
- Проведение ИВЛ с ПДКВ более 15 см вод. ст. с целью мобилизации альвеол при остром повреждении легких у пациентов с внутричерепной гипертензией должно сопровождаться инвазивным мониторингом АД и ВЧД.
^ Внедрение результатов исследования в практику
Разработанные рекомендации по формированию схем инфузионной терапии и респираторной поддержки внедрены в ОРИТ для неврологических больных ФГУ «Лечебно-реабилитационный центр» Росздрава и ОРИТ №24 ГКБ №1 им. Пирогова.
^ Апробация работы
Основные положения работы доложены на 6-ой, 7-ой и 8-ой научно-практической конференциях «Безопасность больного в анестезиологии-реаниматологии», Москва, 2008-2010 год, конференции «Актуальные вопросы респираторной медицины», Москва, 2009 г., апробация работы состоялась на расширенном заседании кафедр анестезиологии и неотложной медицины ГОУ ДПО РМАПО, нейрохирургии ГОУ ДПО РМАПО, детской анестезиологии и реаниматологии ГОУ ДПО РМАПО, отделения реанимации и интенсивной терапии № 24 ГКБ №1 им. Н.И.Пирогова, отделения анестезиологии ГКБ им. С.П. Боткина 29.10.2010 г.
Публикации: по теме диссертации опубликовано 12 печатных работ, из них 3 в журналах, рекомендованных ВАК.
^ Объем и структура работы:
Диссертация изложена на 111 страницах машинописного текста и состоит из введения, обзора литературы, материалов и методов, 3 глав собственных результатов, заключения, выводов, практических рекомендаций и библиографического указателя, который содержит 21 отечественный и 97 иностранных источников. Материалы иллюстрированы 21 таблицей и 12 рисунками.
^ СОДЕРЖАНИЕ РАБОТЫ
Характеристика клинических наблюдений
С 2007 по 2010 год в отделении реанимации для неврологических и нейрохирургических больных ФГУ «Лечебно-реабилитационный центр» Росздрава для оценки влияния объемов инфузионной терапии на частоту развития и тяжесть течение ОПЛ у больных с нарушениями сознания, был обследован 61 пациент (таблица 1).
Таблица 1
^ Нозологическая характеристика обследованных больных.
| Характер патологии | Число пациентов | |
| n | % | |
| ЧМТ | 10 | 16 |
| ВЧК нетравматического генеза | 29 | 28 |
| Объемное образование головного мозга | 17 | 49 |
| Инфаркт головного мозга | 5 | 8 |
| Итого | 61 | 100 |
Средний возраст пациентов составил 52,7 ± 14,1 лет. Обследован 31 мужчина и 30 женщин. Все больные находились в тяжелом и крайне тяжелом состоянии, средняя оценка тяжести состояния на момент поступления в ОРИТ, по шкале APACHE II составила 17,5 ± 4,8 баллов. Среди всех пациентов 32 (52%) были подвергнуты плановому оперативному вмешательству, 17 человек (28%) были оперированы по экстренным показаниям, 12 больным (20%) оперативное нейрохирургическое вмешательство не проводилось. 27 больным (44%) была выполнена установка датчика внутричерепного давления (ВЧД), 7 пациентам (11 %) дополнительно установлена система метаболического мониторинга головного мозга – церебральный микродиализ.
Отбор больных осуществляли согласно критериям включения:
- Острый период травматического или нетравматического поражения головного мозга и/или ранний послеоперационный период оперативного нейрохирургического интракраниального вмешательства
- Угнетение сознания от 4 до 10 баллов включительно по шкале комы Глазго (ШКГ)
- Возраст от 16 до 75 лет включительно
- Необходимость проведения респираторной поддержки по внелегочным показаниям, предполагаемая продолжительность искусственной вентиляции легких не менее 2 суток
- Отсутствие признаков острого повреждения легких и/или пневмонии на момент поступления
- Отсутствие тяжелой сопутствующей патологии и/или хронических заболеваний
Пострадавшие, соответствующие критериям включения, были разделены на две группы.
- Основная группа – с ограничением инфузионной поддержки до 35 мл/кг/сут в течение первых 7 суток с момента поступления в отделение.
- Контрольная группа – без ограничения объема вводимых инфузионных растворов в течение первых 7 суток интенсивной терапии
Всем больным проводили стандартную интенсивную терапию. Инфузионную терапию осуществляли комбинацией коллоидных и кристаллоидных препаратов в соотношении 1/2. По показаниям в состав инфузионной терапии включались гиперосмоляльные растворы. По показаниям использовались симпатомиметики, гипотензивные средства и диуретические препараты. Всем пациентам контролировали суточный баланс жидкости. Энтеральное питание начинали с первых суток нахождения больного в отделении реанимации. При необходимости добавляли парентеральное питание. Всем больным проводили ИВЛ аппаратами Puritan-Bennet 760 (Mallinckrodt, США), Vela (Viasys, США), SERVO-i (Maquet, Германия) с дыхательным объемом 8-10 мл/кг. Напряжение углекислоты в артериальной крови поддерживали в пределах 30 – 40 мм рт. ст. При появлении признаков острого повреждения легких или острого респираторного дистресс-синдрома уменьшали дыхательный объем до 6-7 мл/кг идеальной массы тела. 50 пациентам была выполнена операция пункционно-дилятационной трахеостомии по методу Григгса. Анальгетические и седативные препараты использовали в режиме управляемой седации при необходимости проведения инвазивных процедур (трахеостомия, катетеризация сосудов) и для коррекции психомоторного возбуждения больных.
У 9 больных проводили управляемую внутривенную гипотермию аппаратом COOLGARD 3000 (Alsius, USA) которую начинали в первые сутки с момента поступления больного в ОРИТ.
^ 2.2 Методы исследования
Клинико-неврологический осмотр проводили всем пациентам при поступлении в отделение реанимации и в дальнейшем каждые 4 часа (при необходимости чаще). При осмотре больного оценивали уровень бодрствования, наличие очаговых и дислокационных симптомов.
Для количественной оценки уровня бодрствования использовали шкалу комы Глазго. Непосредственно при поступлении больного в отделение реанимации тяжесть состояния оценивали по шкале APACHE II (1985). При выписке пациента из клиники или переводе в другое лечебное учреждение исход заболевания оценивали по шкале исходов Глазго, положительными неврологическими исходами считали исходы 1 и 2 типа.
Всем больным в 1-2 сутки выполняли компьютерную томографию головного мозга. При поступлении и в дальнейшем каждые 4-5 сутки или чаще всем пациентам проводили рентгенографию грудной клетки в прямой проекции.
При поступлении в отделение реанимации и в дальнейшем каждые сутки (при необходимости чаще) всем пациентам определяли концентрацию гемоглобина, количество эритроцитов и лейкоцитов, лейкоцитарную формулу, уровень гематокрита, глюкозы, мочевины, креатинина, билирубина плазмы крови, кислотно-основное состояние венозной и артериальной крови, концентрацию натрия и калия в плазме крови. Проводили общеклиническое исследование мочи.
Внутричерепное давление определяли 27 больным. 18 пациентам проводили вентрикулярное измерение ВЧД, интрапаренхиматозно внутричерепное давление измеряли 9 больным. Проксимальный конец датчика подсоединяли к монитору ВЧД «Codman ICP Express».
Всем пациентам постоянно мониторировали частоту и ритм сердечных сокращений, частоту дыхательных движений, температуру тела и насыщение гемоглобина кислородом по данным пальцевой пульсоксиметрии с помощью прикроватного монитора «Philips IntelliVue MP70» с соответствующими интегрированными модулями.
Инвазивное измерение АД проведено 47 пациентам. Для этого 14 пациентам катетеризировали лучевую артерию, а у 33 больных оценку системной гемодинамики проводили методом транспульмональной термодилюции.
Всем пациентам ежедневно проводили оценку степени острого повреждения легких по шкале Murray (1988) – Lung Injury Score (LIS).
^ 2.4 Оценка влияния состава инфузионой терапии на гидратацию легочной ткани и развитие ОПЛ
У 29 больных с установленной системой волюметрического мониторинга Pulsion Picco Plus проводили оценку влияния состава инфузионных растворов на показатели ИВСВЛ, индекса проницаемости сосудов легких (ИПСЛ), параметры системной гемодинамики и развитие ОПЛ. Применялся 20% раствор альбумина ("Baxter", Австрия), введение альбумина осуществляли планово в составе инфузионно-трансфузионной терапии в дозе 5мл/кг/сут.
Введение альбумина проводили у 17 пациентов, всего было выполнено 49 наблюдений. Продолжительность применения альбумина составила от 1 до 6 суток. Средний возраст больных в этой группе составил 47±13 лет, обследовано 10 мужчин и 7 женщин. Непосредственно перед инфузией альбумина, по окончании инфузии, а также каждые 12 часов проводили термодилюционные измерения, оценивались показатели пред- и постнагрузки, статические и динамические параметры системной гемодинамики. Проводили оценку ИВСВЛ и ИПСЛ и анализ газового состава артериальной крови и содержание альбумина в плазме крови. Тяжесть повреждения легких на момент проведения исследований оценивали по шкале LIS. Изучали взаимосвязь динамики ИВСВЛ и ИПСЛ до и после трансфузии альбумина с тяжестью ОПЛ и исходными значениями параметров.
Помимо оценки кратковременного влияния раствора альбумина на показатели ИВСВЛ проводили также сравнение ИВСВЛ у пациентов, которым вводили альбумин с контрольной группой больных, где альбумин не применялся. Контрольную группу составили 12 человек, средний возраст больных составил 42±17 лет, в группу вошли 6 мужчин и 6 женщин. В группах оценивалась посуточная динамика показателей системной гемодинамики и ИВСВЛ, а также показателей биохимии крови. Дополнительно в каждой группе оценивалась частота развития и тяжесть течения ОПЛ, чтобы оценить возможный эффект альбумина на развитие легочных осложнений.
^ 2.5 Оценка влияния гиперосмоляльных растворов на показатели волюметрического статуса и оксигенацию артериальной крови у пациентов с внутричерепной гипертензией
Исследовался 15 % раствор маннитола – 400 мл («Маннит», ОАО «Биохимик», Саранск и «Маннитол», ОАО Биосинтез, Пенза) и 7,2% р-ра хлорида натрия в 6% ГЭК 200/0,5 – 250 мл («ГиперХАЕС», Фрезениус Каби Дойчланд ГмбХ, Германия).
Всего было проведено 56 наблюдений у 21 человека. Средний возраст больных составил 45 ± 12 лет. Обследовано 15 мужчин и 6 женщин. У 13 пациентов на момент исследования отмечались признаки острого повреждения легких. Исследуемые гиперосмоляльные растворы применяли при повышении ВЧД более 20 мм рт.ст. До начала исследования, по окончании введения препарата и через 60 мин после введения определяли ВЧД, церебральное перфузионное давление (ЦПД), ИВСВЛ, напряжение кислорода и углекислого газа в артериальной крови, отношение РaO2/FiO2.
До начала исследования, сразу после окончания инфузии и через 60 минут после окончания введения гиперосмоляльных растворов оценивали концентрацию натрия и осмоляльность в плазме артериальной крови. Полученные величины сравнивали с исходными значениями.
^ 2.6 Оценка влияния параметров ИВЛ на динамику ВЧД и ЦПД у пациентов с ОПЛ.
В исследование вошло 12 пациентов с признаками острого повреждения легких в остром периоде поражения головного мозга. Обязательным условием для включения в исследование являлось проведение инвазивного мониторинга ВЧД и АД. Обследовано 7 мужчин и 5 женщин. Средний возраст больных составил 49,8 ± 15,4 года. Всем больным проводилась ИВЛ аппаратом Vela (Viasys, США) или SERVO-i (Maquet, Германия) в режиме с контролем давления в дыхательных путях с исходными параметрами: давление вдоха 30 см вод ст, ПДКВ 10 см вод ст, ЧД 14-16 в мин, FiO2 – 0.4-0.5. При этом дыхательный объем составлял 500-700 мл, что соответствует 7-8 мл/кг, а минутный объем вентиляции составил 8-9 л/мин. Перед началом исследования фиксировались следующие показатели: ДО, динамическая податливость легких, АД, ЧСС, ИВСВЛ, ВЧД, ЦПД, РаО2, РаСО2, показатели предыдущей точки анализа микродиализной жидкости. Сразу после фиксации параметров увеличивали ПДКВ с шагом в 5 см Н2О по 15 мин или около 200 дыхательных циклов, на каждом этапе фиксируя показатели системной гемодинамики, ВЧД, ЦПД, дыхательного объема и динамической податливости легких. При повышении ВЧД выше 30 мм рт. ст. и/или падении ЦПД ниже 70 мм рт. ст. более чем на 30 секунд, исследование прекращали и оставляли предыдущее значение ПДКВ. Максимальный уровень ПДКВ составил 25 см вод. ст.
Полученные на этапах исследования значения параметров сравнивали с исходными величинами. Дополнительно по результатам исследования были выделены две группы больных с разным типом реакции на увеличение ПДКВ и эти группы сравнивались между собой.
^ 2.7. Статистическая обработка
Статистическую обработку полученных данных осуществляли при помощи пакета программ STATISTICA 6.0 (StatSoft, США). Различия внутри групп оценивали при помощи критерия Стьюдента для повторных измерений и критерия Уилкоксона. Для оценки различий между группами использовали критерий Манна-Уитни и точный критерий Фишера, дисперсионный анализ. Для оценки зависимостей переменных оценивали коэффициент корреляции Пирсона и коэффициент ранговой корреляции Спирмена (r). Различия считали достоверными при уровне критерия значимости (р) менее 0,05. Данные в работе представлены в формате M ± σ, M – среднее значение, σ – стандартное отклонение при «нормальном» и в формате Медиана (25 и 75 перцентили) при «ненормальном» распределении.
Результаты собственных исследований
^ 1. Частота развития и особенности течения ОПЛ у больных с поражением головного мозга в остром периоде заболевания.
Общая частота развития ОПЛ за весь период пребывания в ОРИТ у обследованных пациентов составила 47,5% - 29 человек. Выявлено, что возникновение ОПЛ ухудшает прогноз основного заболевания, увеличивает длительность проведения ИВЛ, приводит к значимому увеличению летальности и снижает вероятность благоприятного неврологического исхода на 20% (табл. 2).
Таблица 2
^ Сравнение групп пациентов с ОПЛ и без ОПЛ по основным признакам
| Параметр | Больные с ОПЛ (n=29) | Больные без ОПЛ (n=32) |
| Средний возраст, лет | 50,2 ± 15,6 | 52,4 ± 15.2 |
| Гендерный состав, n (%) | мужчины – 13 (45%) женщины – 16 (55%) | мужчины – 18 (56%) женщины – 14 (44%) |
| Длительность ИВЛ, сут | 17,9 ± 10,1* | 11,0 ± 7,8* |
| Длительность пребывания в ОРИТ, сут | 24,3 ± 13,5 | 25,7 ± 21,3 |
| Частота благоприятных неврологических исходов, % | 13,8 %* | 34,3 %* |
| Летальность, % | 62 %* | 37,5%* |
| Летальность на 30 сутки с момента начала исследования, % | 59 %* | 22 %* |
Примечание: n – число наблюдений, * - p<0,05
Основными факторами риска развития ОПЛ являются отсутствие положительной неврологической динамики в первые 7 суток заболевания и связанная с этим длительная ИВЛ. Также в ходе исследования выявлено негативное влияние проведения внутривенной гипотермии на частоту развития и тяжесть течения ОПЛ. В группе пациентов, которым проводилась управляемая внутривенная гипотермия, ОПЛ развилось у 6 больных (67%), а вентилятор-ассоциированная пневмония (ВАП) была диагностирована у 7 больных (78%) на 4-5 сутки с момента поступления в отделение.
Проведен анализ данных волюметрического мониторинга и оценка значимости показателя ИВСВЛ в диагностике и лечении ОПЛ у исследованной когорты пациентов. Обращает на себя внимание исходно высокий уровень показателя ИВСВЛ у всех пациентов уже в первые сутки мониторинга, который составил 8,4±2,5 мл/кг, что выше нормальных значений. На этом фоне после развития ОПЛ у всех больных отмечалось дальнейшее увеличение показателя ИВСВЛ, напрямую связанное с тяжестью ОПЛ по шкале LIS, критерий ранговой корреляции Спирмена (r) составил 0,44 (p<0.05).
При оценке влияния объема инфузионной терапии на сроки развития и тяжесть течения ОПЛ при сравнении средних значений показателя гидратации легочной ткани у пациентов статистически значимых отличий не обнаружено, в основной группе ИВСВЛ составил 9,03 ± 3,25 мл/кг, а в контрольной 9,23 ± 3,7 мл/кг. Обращает на себя внимание то, что у пациентов обеих групп средний показатель ИВСВЛ за весь период наблюдения оказался выше нормы. Частота развития и тяжесть течения ОПЛ в группах с ограничением инфузионной поддержки и без ограничения объемов инфузии оказалась одинаковой и составила 45% и 47% соответственно. Отмечено отсутствие различий в показателях ИВСВЛ в первые 7 суток интенсивной терапии в группах с разным объемом инфузионной поддержки. Результаты исследования демонстрируют отсутствие прямого влияния ограничения объема инфузионной терапии на частоту развития ОПЛ у больных неврологического и нейрохирургического профиля. При развитии ОПЛ в группе больных с большим объемом инфузии отмечается быстрый рост ИВСВЛ до 10,6 ± 2,9 мл/кг (рис. 1), и при состоявшемся ОПЛ объем вводимой жидкости рекомендуется ограничить.
Рис. 1 Различия в показателях ИВСВЛ в подгруппах больных с ОПЛ в группах больных с разным объемом инфузии
Ч
 астота благоприятных неврологических исходов по ШИГ не отличалась в группах пациентов с разным объемом инфузионной терапии и составила 24% и 25% в основной и контрольной группе соответственно. Средняя продолжительность ИВЛ в основной и контрольной группе не отличалась и составила 14,2 ± 9 дней и 14,6 ± 9 дней соответственно.
астота благоприятных неврологических исходов по ШИГ не отличалась в группах пациентов с разным объемом инфузионной терапии и составила 24% и 25% в основной и контрольной группе соответственно. Средняя продолжительность ИВЛ в основной и контрольной группе не отличалась и составила 14,2 ± 9 дней и 14,6 ± 9 дней соответственно.Средняя продолжительность пребывания больного в ОРИТ составила 24,4 ± 17,4 суток в основной группе и 25,6 ± 18,4 суток в контрольной группе. Частота развития ПОН в основной и контрольной группе составила 13 случаев (45%) и 15 случаев (47%) соответственно.
При изучении эффектов состава инфузионных сред установлено, что переливание альбумина у больных с интактными легкими не приводит к увеличению гидратации легочной ткани. В первые пять суток интенсивной терапии при переливании растворов альбумина не получено статистически значимой разницы в значениях ИВСВЛ до и после трансфузии. Но при исходно высокой проницаемости легочных сосудов, которая имеет сильную корреляцию с тяжестью ОПЛ по шкале LIS (r=0,71), прирост ИВСВЛ после трансфузии альбумина составил до 10 мл/кг. Кроме этого, средние значения показателя ИВСВЛ в группе с альбумином были статистически значимо выше, чем в группе, где препарат не использовался: 9,2±1,45 мл/кг и 10,9 ± 2,7 мл/кг соответственно (p < 0,05). При оценке посуточной динамики показателя ИВСВЛ, статистически значимые отличия между группами обнаружены на 3 и 5 сутки исследования (рис.2).
Таким образом, переливание альбумина у больных с интактными легкими безопасно, а при появлении признаков ОПЛ сопровождается гипергидратацией легких.
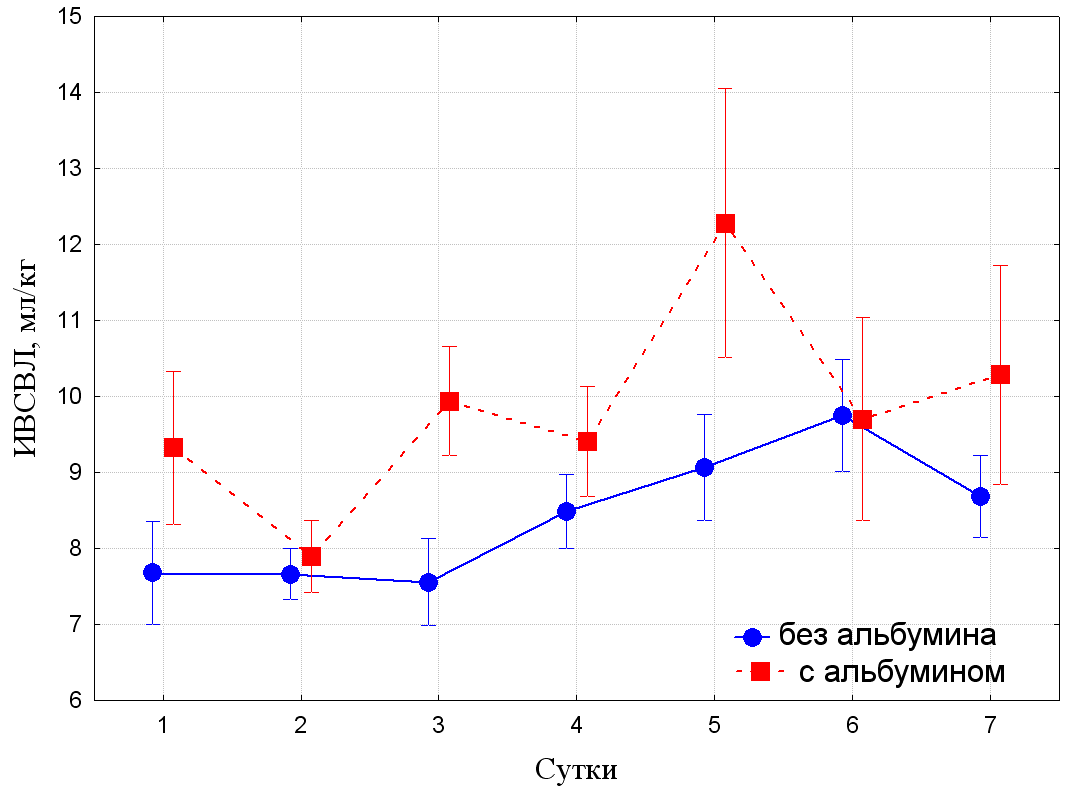
Рис. 2 Динамика показателя ИВСВЛ в исследовании с 20% раствором альбумина (вертикальные границы отражают 95% доверительный интервал)
При изучении гиперосмоляльных растворов наблюдались ожидаемые системные гемодинамические эффекты: статистически значимое увеличение артериального давления, сердечного выброса, снижение ВЧД и повышение ЦПД, улучшение церебральной гемодинамики было достигнуто у всех обследованных пациентов. Но переливание 250 мл 7,2% р-ра хлорида натрия в 6% ГЭК 200/0,5 приводит к статистически значимому снижению РаО2 в артериальной крови за счет снижения растворимости кислорода на фоне повышения осмоляльности плазмы. Следует отметить, что несмотря на значимую разницу, даже после переливания гиперосмоляльного раствор у больных уровень РаО2 все же оставался в пределах нормальных значений (табл. 3). Это связано с исходно высокими значениями РаО2, которые можно объяснить тем, что большинство больных во время исследования находились на ИВЛ с высоким FiO2. Похожие результаты получены и при исследовании 15% раствора маннитола, однако в этом случае статистической значимой разницы в до и после инфузии не выявлено, но различия по отношению РаО2/FiO2 обнаружены.
Таблица 3
^ Показатели газообмена и ИВСВЛ до введения 250 мл раствора ГиперХАЕС через 5 мин и 1 час после окончания инфузии
| Показатель | n | До | 5 мин | 1 час |
| ИВСВЛ, мл/кг | 26 | 8,1±2,7 | 7,3 ± 1,8 * | 7,6 ± 2 |
| РаО2, мм рт. ст. | 34 | 165,1 ± 70,4 * | 141,0 ± 68,4 * | 118,2 ± 71,2 * |
| РаСО2, мм рт. ст. | 34 | 37,2 ± 5,7 | 37,3 ± 6,3 | 36,7 ± 6,1 |
| SaO2, % | 34 | 95,5 ± 3,6 | 92,5 ± 4,2 | 94,8 ± 3,2 |
| Qs/Qt, % | 22 | 5±1 | 5±3 | 5±3 |
| РаO2/FiO2 | 34 | 346 ± 116 * | 316 ± 125 * | 307 ± 147 * |
Примечание: * - p<0.05 при сравнении с исходными значениями, n – число измерений
При исходных значениях РаО2 на нижней границе нормы в 60 мм рт. ст. переливание гиперосмоляльного раствора может привести к развитию гипоксии и должно сопровождаться мониторингом РаО2, чтобы своевременно скорректировать параметры респираторной поддержки.
Провели анализ безопасности повышения уровня ПДКВ с целью раскрытия альвеол у 12 пациентов с внутричерепной гипертензией. Получены данные, свидетельствующие о недостаточной безопасности данного маневра и необходимости расширенного нейромониторинга в случае его проведения по строгим показаниям. При увеличении ПДКВ до 15 см вод ст. падение ЦПД ниже 70 мм рт. ст. отмечалось в 5 наблюдениях из 28 (18 %), при уровне ПДКВ в 20 см вод. ст. – в 12 случаях из 21 (57%) и при уровне ПДКВ 25 см вод. ст. в 6 наблюдениях из 8 (75%). Отмечались статистически значимые отличия по показателям АДср, ВЧД и ЦПД для точек 20 и 25 см вод. ст. Выявили, что увеличение ПДКВ более 15 см вод. ст. приводит к росту ВЧД, падению АД и снижению ЦПД (табл.4).
Таблица 4
^ Динамика показателей АДср, ВЧД и ЦПД при различных уровнях ПДКВ
| Уровень ПДКВ, см вод. ст. | 10 (n=28) | 15 (n = 28) | 20 (n = 21) | 25 (n = 8) |
| АДср, мм рт .ст. | 99,6 ± 6,4 | 95,35 ± 7,0 | 89,0 ± 6,2* | 78,1 ± 6,2* |
| ЧСС, уд/мин | 86,2 ± 5,3 | 87,1± 7,5 | 95,2 ± 8,4* | 98,3± 3,2* |
| ВЧД, мм рт. ст. | 14,3 ± 5,3 | 15,6 ± 5,44 | 20,4 ± 5,8* | 22,6 ± 4,1* |
| ЦПД, мм рт. ст. | 85,4 ± 7,6 | 79,8 ± 9,5 | 68,6 ± 6,8* | 55,5 ± 9* |
Примечание: n – число наблюдений, * - p<0.05
Эти наблюдения подтверждают данные о том, что вентиляции с высоким ПДКВ у больных с внутричерепной гипертензией опасна. У больных с более низкими комплайнсом дыхательной системы и значениями РаO2/FiO2 маневр открытия альвеол при помощи ПДКВ оказался более эффективным и безопасным (табл.5).
Таким образом, у пациентов с ВЧГ маневр открытия альвеол может быть эффективным и безопасным, но должен обязательно сопровождаться мониторингом церебрального перфузионного давления.
Таблица 5
^ Значения исходных параметров оксигенации, вентиляции и податливости (С) в группах больных с разной эффективностью маневра открытия альвеол
| | Группа с положительным ответом, n = 11 | Группа с отрицательным ответом n = 17 |
| РаO2/FiO2, мм рт. ст. | 215 (183-233)* | 250 (216-260)* |
| РаСО2 арт, мм рт. ст. | 38,5 ± 1,4 | 36,9 ± 0,8 |
| ДО, мл/кг | 539 ± 62* | 634 ± 69* |
| С, мл/см Н2О | 37,5 ± 5,1* | 47,2± 7,4* |
Примечание: n – количество исследований, * - p<0,05 при сравнении между группами
Заключение
Острое повреждение легких у больных с поражением головного мозга в остром периоде заболевания развивается в 50 % случаев. Развитие ОПЛ требует корректировки тактики инфузионно-трансфузионной и респираторной терапии.
Подбор оптимальной тактики инфузионной и респираторной терапии у данной категории больных должен сопровождаться проведением расширенного респираторного, гемодинамического и нейромониторинга.
Выводы
- У пациентов с органическим поражением головного мозга в остром периоде заболевания частота развития ОПЛ составляет до 50%. Развитие ОПЛ увеличивает длительность проведения ИВЛ, приводит к увеличению летальности на 25% и снижает вероятность благоприятного неврологического исхода на 20%.
- Ограничение объемов инфузионной терапии менее 35 мл/кг/сут в первые 7 суток заболевания не приводит к уменьшению частоты развития и тяжести течения ОПЛ и не влияет на исход заболевания. При состоявшемся ОПЛ объем инфузионной терапии рекомендуется ограничить при условии поддержания стабильного уровня церебрального перфузионного давления.
- Внутривенное введение 20% раствора альбумина в дозе 5 мл/кг/сут, приводит к увеличению индекса внесосудистой воды легких у больных с признаками ОПЛ до 10,9 ± 2,7 мл/кг, но не приводит к увеличению частоты развития и тяжести течения ОПЛ.
- Введение 7,2% р-ра хлорида натрия в 6% ГЭК 200/0,5 с целью коррекции ВЧД у пациентов с нарушенной оксигенацией артериальной крови может приводить к снижению PaО2 ниже 60 мм рт. ст. и требует контроля газового состава артериальной крови и оптимизации параметров респираторной поддержки.
- У пациентов с внутричерепной гипертензией повышение уровня ПДКВ более 15 см вод. ст. с целью мобилизации альвеол при ОПЛ приводит к падению ЦПД ниже 70 мм рт. ст. и может быть выполнено только при условии проведения мониторинга артериального и внутричерепного давления в реальном времени.
^ Практические рекомендации.
1. Ограничение объемов инфузионной терапии менее 35 мл/кг/сут в остром периоде поражения головного мозга у больных с интактными легкими не приводит к снижению частоты развития острого повреждения легких. Основным критерием достижения гемодинамической стабильности у пациента с повреждением мозга в остром периоде должен быть уровень церебрального перфузионного давления не ниже 70 мм рт ст. Для достижения этой цели можно применять любой объем инфузионных растворов при условии контроля суточного гидробаланса. Ограничивать объем инфузионной терапии с целью профилактики гипергидратации легочной ткани не нужно.
Применение объемов инфузионной поддержки более 35 мл/кг сут при состоявшемся ОПЛ приводит к значимому увеличению ИВСВЛ. Поэтому при развитии ОПЛ объем инфузионной терапии рекомендуется снизить, если это не приводит к нарушению системной гемодинамики и артериальной гипотензии, сопровождающейся снижением ЦПД.
2. Применение растворов 20% альбумина в дозе 5 мл/кг/сут у больных с признаками ОПЛ сопровождается повышением ИВСВЛ и использование этого раствора у пациентов с ОПЛ рекомендуется ограничить.
3. Внутривенное введение 250 мл 7,2% р-ра хлорида натрия в 6% ГЭК 200/0,5 и 400 мл 15% раствора маннитола может сопровождаться снижением РаО2, что требует мониторинга газового состава артериальной крови. Для профилактики гипоксии у больных с исходно низким уровнем РаО2 необходимо изменить параметры респираторной поддержки перед инфузией гиперосмоляльного препарата.
4. Проведение ИВЛ с ПДКВ выше 15 см вод. ст. и маневра открытия альвеол у пациентов с внутричерепной гипертензией приводит к критическому снижению ЦПД и должно осуществляться только в условиях инвазивного контроля ВЧД и АД. Уровень ПДКВ до 15 см вод. ст. у пациентов с внутричерепной гипертензией не приводит к падению ЦПД ниже 70 мм рт. ст. 5. Использование управляемой внутривенной гипотермии как метода нейропротекции в комплексе интенсивной терапии острого периода поражения головного мозга существенно увеличивает риск возникновения ОПЛ и ВАП и должно сопровождаться ежедневным мониторингом состояния легких.
По теме диссертации опубликованы следующие работы
- Ловцевич Н.В., Давыдова Л.А. Микродиализ и нейромониторинг. // Анестезиология и реаниматология. М.: Медицина – №2. - 2008. с.85-88
- Евдокимов Е.А., Гутников А.И., Давыдова Л.А., Адамовский Н.Г., Карпенко В.В. Внутривенная гипотермия у пациентов с поражением головного мозга: преимущества и риск повреждения легких. // Тезисы докладов XI съезда анестезиологов и реаниматологов ЦФО. Актуальные вопросы интенсивной терапии. – СПб., 2008. – С. 520-521
- Царенко С.В., Вахницкая В.В., Белова Н.В., Давыдова Л.А. Капнометрия и капнография реанимационного мониторинга. // Клиническая анестезиология и реаниматология : научно-практический журнал. - М. : ФИОТ. – № 1 - 2007. Том 4 - с. 2-6
- Гутников А.И., Давыдова Л.А., Ловцевич Н.В., Мещеряков Г.Н. Гемодинамические эффекты инфузионной терапии больных в остром периоде внутричерепного кровоизлияния // Сборник тезисов шестой научно-практической конференции «Безопасность больного в анестезиологии-реаниматологии», Москва, 2008 г. – с. 29 .
- Гутников А.И., Давыдова Л.А., Ловцевич Н.В. Гипотермия как метод нейропротекции у пациентов с повреждениями структур задней черепной ямки /Сборник тезисов шестой научно-практической конференции «Безопасность больного в анестезиологии-реаниматологии», Москва, 2008 г. – с. 25
- Гутников А.И., Давыдова Л.А., Евдокимов Е.А. Применение альбумина в составе инфузионно-трансфузионной терапии острого периода поражения головного мозга. //Анестезиология и реаниматология М.: Медицина – №3. - 2009. с 41-44
- Давыдова Л.А., Гутников А.И. , Евдокимов Е.А., Карпенко В.В., Ловцевич Н.В., Назаров Ю.Н. Первый опыт применения режима нейронального контроля дыхания у пациентов с поражением головного мозга. // Сборник тезисов научно-практической конференции «Актуальные вопросы респираторной медицины», Москва, 2009 г. – с. 54
- Евдокимов Е.А., Давыдова Л.А., Гутников А.И., Карпенко В.В. Системные эффекты инфузионной терапии: осмоляльность и газообмен. /// Седьмая научно-практическая конференция «Безопасность больного в анестезиологии-реаниматологии», Москва, 2009 г. – с. 21
- Давыдова Л.А., Гутников А.И., Ловцевич Н.В., Евдокимов Е.А. Режим нейронального контроля дыхания у пациентов с поражением головного мозга/ // Сборник тезисов седьмой научно-практической конференции «Безопасность больного в анестезиологии-реаниматологии», Москва, 2009 г. – с. 20-21
- Давыдова Л.А., Гутников А.И., Евдокимов Е.А., Клочков О.Е., Карпенко В.В. Влияние гиперосмоляльных растворов на парциальное давление кислорода в артериальной крови. // Анестезиология и реаниматология, М. : Медицина– №3. - 2010. с. 50-53
- Давыдова Л.А., Гутников А.И., Евдокимов Е.А., Вильчинский К.Э.Возможности новых режимов ИВЛ при ОПЛ и ОРДС. // Сборник научных трудов восьмой научно-практической конференции «Безопасность больного в анестезиологии-реаниматологии», Москва, 2010 г. – с. 24
- Вильчинский К.Э., Гутников А.И., Давыдова Л.А., Царенко С.В., Евдокимов Е.А. Маркеры применения инотропной и вазопрессорной поддержки при неотложных состояниях. Неотложная медицина - № 4 – 2010 с. 23-26
