Томского Научного Центра со рамн автореферат диссертации
| Вид материала | Автореферат диссертации |
- Томского Научного Центра со рамн автореферат, 725.4kb.
- Трухачёва Наталия Геннадьевна офтальмосонография в комплексной диагностике опухолей, 456.47kb.
- Автореферат на соискание ученой степени, 643.39kb.
- Вопросы маркетинга современные технологии психотерапевтического сервиса Семке, 723.44kb.
- Особенности рака и гиперпластических процессов эндометрия в сочетании с миомой матки, 408.19kb.
- Солонский Анатолий Владимирович морфологические закон, 583.42kb.
- Антиметастатическая активность препаратов природного происхождения 14. 00. 25 фармакология,, 1023.15kb.
- Уманский сергей Викторович динамика пограничных психических расстройств, 571kb.
- Н. А. Корнетов нии психического здоровья Томского научного центра со рамн, 481.16kb.
- Совершенствование методов диагностики и лечения рака тела матки 14. 00. 14 онкология, 520.93kb.
На правах рукописи
Герасимов
Алексей Владимирович
ФЕРМЕНТЫ Метаболизма эстрогенов
у больных раком тела матки.
молекулярно-эпидемиологическое
исследование
14.00.14 – онкология
14.00.16 – патологическая физиология
А В Т О Р Е Ф Е Р А Т
диссертации на соискание ученой степени
кандидата медицинских наук
Новосибирск 2006
Работа выполнена в ГУ НИИ молекулярной биологии и биофизики СО РАМН (г.Новосибирск) и ОГУЗ Новосибирском областном онкологическом диспансере.
Научные руководители:
доктор медицинских наук Красильников Сергей Эдуардович
доктор биологических наук,
профессор Гуляева Людмила Федоровна
Официальные оппоненты:
доктор медицинских наук,
профессор Сидоров Сергей Васильевич
доктор медицинских наук,
профессор Куликов Вячеслав Юрьевич
Ведущая организация:
ГУ РОНЦ им. Н.Н. Блохина РАМН (г. Москва)
Защита диссертации состоится «___»_________2006 г. в ____ часов на заседании диссертационного совета Д. 001.032.01 в ГУ НИИ онкологии ТНЦ СО РАМН (634009, г.Томск, пер.Кооперативный, 5).
С диссертацией можно ознакомиться в библиотеке Научно-исследовательского института онкологии Томского Научного Центра СО РАМН.
Автореферат диссертации разослан «___» _________2006 г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук И.Г.Фролова
^
Общая характеристика работы
Актуальность темы. Рак тела матки (эндометрия) является наиболее распространенным злокачественным новообразованием женской половой сферы. На протяжении последних 20 лет во многих экономически развитых странах Европы и Северной Америки отмечается неуклонное повышение заболеваемости гормонозависимыми опухолями органов репродуктивной системы у женщин: раком молочной железы, эндометрия и яичников. Эти тенденции не могут быть объяснены только увеличением средней продолжительности жизни, а связаны с нарастанием в популяции таких «болезней цивилизации» как ановуляция, хроническая гиперэстрогения, бесплодие, миома матки и генитальный эндометриоз (Максимов, 1994). Они сочетаются с метаболическими нарушениями (ожирение, гиперлипидемия, гиперинсулинемия, сахарный диабет), образуя по существу хорошо очерченный синдром системных нарушений в трех гомеостазах: репродуктивном, энергетическом и адаптационном (Дильман, 1983, 1987). За последние 30 лет заболеваемость раком эндометрия возросла в 3 раза (Чиссов, 2002; Новикова и Чулкова, 2005). Такая же ситуация отмечается в США, Швеции, Италии, Франции, Англии (Barber, 1981; Di Saia and Creasman, 1992; Herbst, 1992; Максимов, 1994).
Показатель заболеваемости раком эндометрия в Западной Европе составляет 10, в США и Канаде – 25 на 100 000 женского населения (Emons et al., 2000). В России рак тела матки занимает второе место среди злокачественных новообразований у женщин, уступая лишь раку молочной железы. В 2000 г число заболевших этими новообразованиями во всех возрастных группах, в пересчете на 100 000 женского населения России, равнялось 25, а среднегодовой прирост заболеваемости в интервале 1991–2000 гг. находился на уровне 3,13 % (Берштейн, 2004). На долю РТМ приходится 6,5% всех случаев злокачественных новообразований, выявленных среди женского населения России (Давыдов и Аксель, 2002; Давыдов, 2006) и 5,9 % среди женского населения Сибири и Дальнего Востока (Чойнзонов и др., 2004). Доля женщин, заболевших РЭ в репродуктивном и в перименопаузальном возрасте, составляет почти 40 % от общего числа больных (Новикова, 1995, 2005; Tabata et al., 2001).
Миома матки является одной из наиболее распространенных доброкачественных опухолей репродуктивной системы и встречается у 25 – 30% женщин репродуктивного возраста (Andersen, 1998). Биологическое своеобразие эндометрия состоит в том, что это гормоночувствительная ткань, очень динамичная по своей природе. Она обладает способностью не только циклически обновлять почти весь свой клеточный состав, но и чутко реагировать на все изменения гормональных влияний на уровне целого организма (Бохман и Максимов, 1992). По данным Сидоренко Ю.С. (1996), у женщин молодого возраста злокачественный процесс в матке развивается на фоне снижения секреции половых стероидов всех классов - эстрогенов, прогестинов, андрогенов, а у пожилых отмечается четко выраженное повышение уровня эстрогенных гормонов. И, тем не менее, как молодым, так и пожилым больным раком тела матки присуще нарушение равновесия между отдельными представителями половых стероидов, которое у пожилых выражено в виде сочетанной гиперэстрогенизации организма, проявляющейся повышением абсолютного уровня эстрадиола и относительного преобладания его над прогестинами. У молодых – явление относительной эстрогенизации проявляется благодаря наиболее выраженному, в сравнении со всеми стероидами, снижением уровня андрогенных гормонов, сдвигу андрогенно-эстрогенного равновесия в сторону эстрадиола, а также в нарушении эстрогенно-прогестинового баланса. Не вызывает сомнения тот факт, что содержание в аденокарциноме эндометрия рецепторов прогестерона и эстрадиола является важным прогностическим фактором, определяющим чувствительность к гормонотерапии (Кузнецов, Баринов, Кушлинский, 1999).
Многочисленные исследования показали, что злокачественные опухоли женской репродуктивной сферы, в том числе рак эндометрия, также в большинстве случаев являются гормонозависимыми (Emons et al., 2000). Особое место в этом процессе занимают эстрогены, играющие важную роль в стимуляции клеточной пролиферации в органах-мишенях (Henderson and Canellos, 1990). И хотя о молекулярных механизмах действия стероидов накоплен большой экспериментальный материал, вопрос о том, как эти гормоны стимулируют пролиферацию в раковых клетках, пока остается открытым. Показана роль эстрогенов в активации рецепторов, принимающих участие в регуляции транскрипции многих генов, участвующих в клеточной пролиферации (Enmark and Gustafsson, 1999). Все эти исследования объединяет тот факт, что необходимым условием запуска процессов трансформации в клетках-мишенях является увеличение содержания стероидов, в частности эстрогенов. В последнее время появилась концепция локального синтеза эстрогенов в отдельных клетках, приводящего к изменению содержания эстрогенов и, как следствие этого, к усилению процессов пролиферации (Sasano and Harada, 1998; Simpson, 2003). Метаболизм эстрогенов in situ, включая их синтез и элиминацию, играет важную роль в росте и развитии многих гормонозависимых опухолей человека, включая рак тела матки (Miller and Sharpe, 1998). Известно, что метаболизм эстрогенов осуществляется двумя основными ферментативными системами: 1. Система синтеза гормонов. Эстрогены образуются путем конверсии андрогенов в результате сложной цепи биохимических преобразований. Ключевую роль в конечной цепи превращений играет фермент ароматаза (цитохром Р450 19-го семейства, CYP19) (Simpson, 2000; Коломиец и др., 2003). 2. Система деградации эстрогенов, осуществляемая цитохромом Р450. В последние годы в этом процессе доказана роль таких форм цитохрома Р450, как CYP1A1, CYP1A2, CYP1B1, которые окисляют эстрогены с образованием субстратов для 2-й фазы метаболизма (Lee et al., 2003). Дальнейшая деградация метаболитов гормонов осуществляется с помощью сульфотрансфераз (SULT). Стероидные сульфотрансферазы сульфонируют эстрогены до их сульфонатов, биологически неактивных форм эстрогенов (Hobkirk, 1993). Сульфаты эстрогенов имеют большой период полураспада, и это позволяет предположить, что сульфаты эстрогенов могут служить резервуаром для образования биологически активных эстрогенов посредством действия стероидной сульфатазы (STS) (Sugawara and Fujimoto, 2004). Соотношение между уровнями стероидной сульфатазы и эстрогеновой сульфотрансферазы в опухоли, может также играть важную роль в регуляции уровней эстрогенов in situ. Любое нарушение в одной из этих систем вызывает изменение в содержании эстрогенов, что может быть одной из причин возникновения злокачественных опухолей.
В Новосибирской области исследований по выявлению факторов риска, в том числе и нарушению метаболизма эстрогенов, у больных раком тела матки и миомой матки не проводилось. Проведение эпидемиологических исследований в таких случаях помогает не только выявить основные факторы риска заболевания, но и также охарактеризовать женщин по таким показателям, как возраст менархе, менопауза, количество абортов. Одним из факторов усиления продукции эстрогенов является нарушение их метаболизма. Этому могут способствовать генетически детерминированные нарушения в активности ферментов. Тогда целесообразным представляется проведение комплексного молекулярно-эпидемиологического исследования больных раком тела матки женщин.
^ Цель работы: исследовать ферменты метаболизма эстрогенов у больных раком тела матки и миомой матки.
Задачи исследования:
1. На основе клинико-эпидемиологического анализа оценить факторы риска у женщин Новосибирской области с диагнозом рак тела матки и миома матки.
2. Оценить частоты аллельных вариантов генов, кодирующих ферменты метаболизма эстрогенов: CYP1A1, CYP1A2, CYP19 и SULT1A1 у больных с раком тела матки и миомой матки.
3. Оценить экспрессию генов hSULT1E1 и hSTS и активность стероидной сульфатазы в нормальных тканях эндометрия и в доброкачественных и злокачественных тканях матки.
^ Научная новизна работы
Впервые у женщин Новосибирской области с миомой и раком тела матки проведен клинико-эпидемиологический анализ факторов риска развития этих заболеваний. Показано, что факторами риска являются средний возраст, возраст наступления менархе и менопаузы, отсутствие родов и бесплодие, наличие в анамнезе ожирения и сахарного диабета, применение заместительной гормонотерапии и наличие сопутствующих заболеваний половой сферы.
Впервые у здоровых женщин и больных раком тела матки и миомой матки проведено исследование генетического полиморфизма ферментов метаболизма эстрогенов цитохромов Р450 (CYP1A1, CYP1A2, CYP19), сульфотрансферазы (SULT1A1). Показано, что женщины с С аллелем гена CYP1A2 и/или G аллелем гена SULT1A1 в Новосибирской области имеют повышенный риск развития этих заболеваний.
Впервые у женщин оценена активность и экспрессия гена стероидной сульфатазы в нормальных тканях эндометрия и в доброкачественных и злокачественных тканях матки. Показано, что экспрессия гена и активность в опухолевой ткани повышена в сравнении с нетрансформированной тканью.
^ Практическая значимость
На основании полученных данных показано, что целесообразно выделение групп риска по развитию доброкачественных и злокачественных опухолей матки у женского населения различных возрастных групп.
Анализ частот аллельных вариантов генов CYP1A2 и SULT1A1 у больных с миомой и раком тела матки целесообразно использовать для проведения дальнейших исследований по выявлению дополнительного диагностического маркера.
Увеличение уровня экспрессии гена hSTS и повышение активности фермента в тканях эндометрия рассматривать как предикторный фактор риска развития рака тела матки.
^ Положения, выносимые на защиту:
- Факторами риска развития рака тела матки являются: возраст (от 40 до 60 лет), позднее наступление менархе, поздняя менопауза, отсутствие родов, бесплодие, ожирение, сахарный диабет, заболевания сердечно-сосудистой системы (ишемическая болезнь сердца, атеросклеротический кардиосклероз), заместительная гормонотерапия. Большинство из этих факторов может свидетельствовать о существенной роли гормональных факторов в формировании опухолей.
- У женщин больных миомой и раком тела матки, в отличие от здоровых, выявлено достоверное снижение частоты встречаемости мутантного аллеля гена цитохрома Р450 CYP1A2 и сульфотрансферазы SULT1A1.
- Уровень экспрессии гена стероидной сульфатазы hSTS в опухолевых тканях эндометрия в 1,5 – 3 раза выше относительно нормальной ткани, тогда как экспрессия эстрогеновой сульфотрансферазы SULT1E не меняется.
- Ферментативная активность стероидной сульфатазы hSTS зависит от типа опухоли. В опухолевых тканях эндометрия она в 2 – 5 раз выше, тогда как в миоматозных узлах матки активность распределена неравномерно: у 50 % больных не изменяется, повышается у 14 % больных и понижается у 36 %.
Апробация работы
Основные результаты работы были представленны и обсуждены на Российской научно-практической конференции, посвященной 25-летию НИИ онкологии ТНЦ СО РАМН (Томск, 2004); на научно-практической конференции «Актуальные проблемы онкогинекологии» (Кемерово, 2004); на межрегиональной юбилейной научно-практической конференции (Новокузнецк, 2006); на региональной конференции молодых ученых-онкологов «Актуальные вопросы экспериментальной и клинической онкологии» (Томск, 2006); на I съезде лимфологов с международным участием «Проблемы экспериментальной, клинической и профилактической лимфологии» (Новосибирск, 2006).
Публикации
По материалам диссертации имеется 13 печатных работ.
^ Объем и структура диссертации
Диссертационная работа изложена на 122 страницах машинописного текста и состоит из введения, трех глав, заключения, выводов, практических рекомендаций, а также списка использованной литературы. Работа иллюстрирована 5 таблицами, 47 рисунками и 9 фотографиями. Библиографический указатель содержит 187 источников, из которых 64 отечественных и 123 иностранных.
Автор искренне благодарен научным руководителям д.м.н. С.Э. Красильникову, д.б.н., профессору Л.Ф. Гуляевой, коллективу лаборатории молекулярных механизмов канцерогенеза НИИ МББ СО РАМН за помощь в проведении экспериментальных исследований и обсуждении полученных результатов, а также всему коллективу Новосибирского областного онкологического диспансера.
^ МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Для ретроспективного анализа историй болезни использовались данные о 1200 больных раком тела матки и 2100 больных миомой тела матки, которые находились на лечении в гинекологическом отделении Новосибирского областного онкологического диспансера (г. Новосибирск) с 1990 по 2004 г. В качестве контрольной группы были выбраны 200 женщин, не имеющих гинекологической патологии, которые проходили плановый осмотр в гинекологическом отделении центральной районной больницы г. Искитима (Новосибирская область). Средний возраст в контрольной группе (I группа) составил 60,4 ± 1,4 лет (возрастные границы – от 39 до 84 лет); в группе больных миомой тела матки (II группа) – 46,1 ± 1,8 лет (от 28 до 69 лет); в группе больных раком тела матки (III группа) – 57,6 ± 2,6 лет (от 27 до 79 лет); в группе больных раком тела матки в сочетании с миомой (IV группа) – 55,3 ± 2,2 лет (от 27 до 74 лет).
Диагноз устанавливали на основании общепринятых методов. Больные проходили клиническое и гинекологическое обследование, ультразвуковое сканирование и компьютерную томографию органов малого таза. Для определения стадии заболевания РТМ использовали две международные классификации FIGO и TNM. Стадию заболевания окончательно уточняли во время хирургического вмешательства. По гистологической структуре опухоли в 90 % случаев имела место аденокарцинома эндометрия. У всех больных проведено изучение анамнестических данных с акцентированием внимания на факторах риска развития миомы и РТМ. Полученные данные фиксировали в специально разработанных индивидуальных анкетах с анализом причин и условий возникновения патологического процесса, возраста, проф. вредности, менструальной и репродуктивной функций, конституционных особенностей, сопутствующих патологий. Для оценки избыточного веса и ожирения мы использовали индекс массы тела (ИМТ) - вес/рост2 [кг/м2]. Нормальным ИМТ для женщины считается индекс, не превышающий 25 кг/м2, ИМТ в пределах от 25,1 до 29,9 кг/м2 – избыточный вес, ИМТ ≥30 кг/м2 – ожирение.
Для исследования генетического полиморфизма ферментов метаболизма эстрогенов суспензия клеток буккального эпителия была получена у пациенток Областного онкологического диспансера. Группа исследования составила 168 женщин раком тела матки, 172 женщины с миомой тела матки и 172 образца, взятых от здоровых женщин, было использовано в качестве контрольной группы. Контролем служили женщины, не имеющие злокачественных патологий женских половых органов.
Для определения уровня экспрессии генов hSULT1E1 и hSTS, а также для определения уровня ферментативной активности стероидной сульфатазы использовали опухолевую ткань эндометрия женщин, удаленную в ходе хирургического вмешательства (15 пациенток с диагнозом миома тела матки и 12 пациенток с раком тела матки). В качестве контроля служила прилегающая к опухоли нетрансформированная ткань эндометрия.
Забор материала проводился с согласия больных и протоколировался по стандартам этического комитета Российской Федерации.
Геномную ДНК из буккального эпителия выделяли методом высоко-солевого осаждения белков (Salting-out protein method). Концентрацию выделенной ДНК измеряли спектрофотометрически. Амплификацию специфических участков исследуемых генов проводили методом ПЦР. Для этого использовались специфические праймеры к последовательностям генов CYP1A1, CYP1A2, CYP19 и SULT1A1. Праймеры к генам CYP1A1 (F: 5'-TAGGAGTCTTGTCTCATGCC-3', R: 5'-GCACTTAAGCAGTCTGTTTGAG-3') и CYP1A2 (F: 5'-TGAGGCTCCTTTCCAGCTCTCA-3', R: 5'-GAAGCT CTGTGGCCGAGAAGG-3') были подобраны с использованием программы VectorNTI. Структура праймеров к гену CYP19 была взята из работы Sasano H. и соавт. (1997), для SULT1A1 из работы Raftogianis R.B. и соавт. (1997). Реакция ПЦР проводилась в буфере, содержащем 10 мМ Tris-HCl (pH 8,3), 1,5 мМ MgCl2, 50 мМ KCl с использованием амплификатора «Терцик» ("ДНК Технологии", Россия). Объем реакционной смеси составлял 20 мкл с содержанием 100 нг геномной ДНК, 2 мкл 10x ПЦР-буфера, 20 пмоль каждого праймера, 0,2 мМ dNTP и 2 ед. акт. Taq-ДНК-полимеразы. Реакцию амплификации для генов CYP1A1, CYP1A2 и SULT1A1 проводили в следующих температурных режимах: 95°С – 3 мин, далее 35 циклов: денатурация 95oC – 15 сек, отжиг праймеров 62oC - 20 сек и элонгация 72oC - 20 сек; для гена CYP19: 95°С – 3 мин, далее 35 циклов: денатурация 95oC –15 сек, отжиг праймеров 59oC - 20 сек и элонгация 72oC - 20 сек. Продукты полимеразной цепной реакции разделяли методом горизонтального электрофореза в 1,5 % агарозном геле. Генотипирование проводили методом ПДРФ-анализа (полиморфизм длины рестрикционых фрагментов) продуктов ПЦР специфических участков генома с использованием соответствующих ферментов рестрикции: CYP1A1 - эндонуклеаза рестрикции MspI; CYP1A2 - эндонуклеаза рестрикции ApaI; CYP19 - эндонуклеаза рестрикции SfaNI; SULT1A1 - эндонуклеаза рестрикции HhaI. Объем реакционной смеси составил 17 мкл с добавлением ~1 мкг ПЦР-продукта и 1,5 ед. акт. соответствующей эндонуклеазы рестрикции. Смесь инкубировали в течение 3 – 5 ч при 37°С в зависимости от активности ферментов. Анализ продуктов рестрикции проводили методом вертикального гель-электрофореза в
8 % полиакриламидном геле.
Выделение РНК проводили гуанидин-фенольным методом (Chomczynski and Sacchi, 1987). Очистку РНК от примеси ДНК проводили с помощью ДНКазы (Promega) согласно инструкции производителя. Концентрацию выделенной РНК измеряли спектрофотометрически. Для синтеза кДНК in vitro брали по 1 мкг РНК на пробу. Относительное содержание мРНК hSULT1E1 и hSTS определяли методом мультиплексной ОТ-ПЦР (Wong et al., 1994). В качестве эндогенного внутреннего контроля, относительно которого проводилось выравнивание продуктов амплификации исследуемых генов, был выбран ген «домашнего хозяйства» 18S rRNA. ПЦР предварительно оптимизировали по числу циклов, концентрации Mg2+, количеству праймеров. Каждая проба ПЦР содержала 2 мкл кДНК, 1х буфер для ПЦР, 0,2 мМ dNTP, 20 пкмоль праймеров для hSULT1E1 или hSTS и 2 ед. ак. Taq ДНК-полимеразы. Праймеры для амплификации гена «домашнего хозяйства» 18S rRNA (20 пкМ) были добавлены через несколько циклов. В наших условиях наиболее подходящее число циклов для hSTS - 46, hSULT1E1 – 39, 18S rRNA – 18. Продукты ПЦР анализировали электрофорезом в 2% агарозном геле. Гель окрашивали бромистым этидием, сканировали с помощью видеосистемы «DNA Analyzer» (Москва) и денситометрировали с помощью программы ”Total Lab”. Относительное содержание мРНК hSULT1E1 или hSTS оценивали в относительных единицах как отношение интенсивности окрашивания специфической полосы генов к интенсивности полосы гена «домашнего хозяйства».
Выделение S9-фракции проводили при 4˚С. Кусочек ткани растирали в ступке с жидким азотом. К ткани прибавляли 1 мл раствора, содержащего 100 мМ KCl, 10 мМ KH2PO4, 10 мМ Na2HPO4 и 1 мМ ЭДТА (pH 7,5). Гомогенат тщательно перемешивали и центрифугировали 15 мин, на центрифуге Eppendorf 5415D при 1000g. Определение белка проводили методом Брэдфорда M.M. (Bradford, 1976). Активность hSTS измеряли по реакции десульфатирования сульфата эстрона (Е1S) методом ВЭЖХ-анализа (Ohsaki et al., 1993). Разделение продуктов ферментативной реакции проводили на колонке Nucleosil C18 100, 5 мкм в изотоническом режиме. В качестве подвижной фазы использовалась система ацетонитрил : 0.1 М ацетат аммония (41 : 59). Скорость потока составляла 0,15 мл/мин. Измерение проводилось при помощи УФ-детектора при длине волны 280 нм. В работе использовался автоматизированный комплекс для ВЭЖХ Altex, а также компьютером, оснащенным программой GME712 для количественной оценки хроматографических пиков.
Статистическая обработка результатов проводилась с помощью программ Epi6 и SISA (a.net/sisa/). В качестве критерия, определяющего, является ли исследуемый признак фактором риска заболевания, было использовано отношение шансов (odds ratio или ОШ). Для оценки достоверности различий между выборками использовался критерий Фишера. Наблюдаемое распределение генотипов проверяли на отклонение от равновесия Харди-Вайнберга. Статистическую обработку результатов исследования экспрессии генов и измерения ферментативных активностей проводили с помощью программ STATISTICA 6.0 и ORIGIN 6.0. Результаты представлены в виде M ± m, где М - среднее, m – ошибка среднего. Для оценки достоверности различий между выборками использовался t -критерий Стьюдента.
^ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Клиническая характеристика больных
и показатели отношения шансов, основных факторов риска
развития миомы и рака тела матки в Новосибирской области
В результате исследования влияния различных факторов риска на развитие рака тела матки и миомы матки у жительниц Новосибирской области нами были получены интересные результаты. Так, исследование позволило выявить, что риск развития этих заболеваний достоверно выше в возрасте от 40 до 60 лет (Рис. 1), что возможно связано с затуханием детородной функции и нарушением регуляции секреции гормонов.
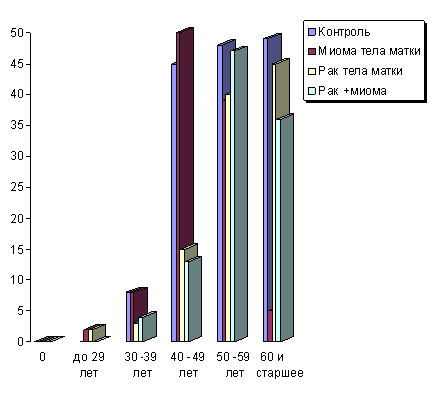
Рис. 1. Возрастное распределение женщин четырех групп в Новосибирской области.
Среди обследованных женщин Новосибирской области наибольший риск развития миомы матки был у женщин занимающихся физическим трудом (ОШ=0,92; 95% ДИ: 0,52-1,61), в тоже время в группе женщин, больных раком эндометрия, наблюдается обратная тенденция: наибольший риск развития рака эндометрия был у женщин, занимающихся умственным трудом (ОШ=1,43; 95 % ДИ: 0,82-2,50). Этот факт можно объяснить малоподвижным образом жизни, поскольку физическая нагрузка оказывает протекционный эффект на риск развития рака эндометрия, что скорее всего в этом случае связано с уменьшением уровня эстрогенов в крови (Purdie and Green, 2001). Кроме того, люди, занятые в интеллектуальной сфере деятельности, больше подвержены действию стрессирующих факторов, в отличие от людей, занятых физическим трудом.
Наряду с этим, как показало наше исследование при анализе возраста менархе, среди больных Новосибирской области с миомой матки раннее менархе (раньше 11 лет) отмечено у 2,4 % женщин (ОШ=0,96, 95% ДИ: 0,15-5,76), тогда как среди больных раком тела матки – у 5,2 % (ОШ=2,02, 95 % ДИ: 0,43-9,32), а при их сочетании – 8,2 % (ОШ=3,43, 95 % ДИ: 0,81-14,52). Позднее наступление менархе (старше 13 лет) отмечено у 61,3 % женщин с миомой тела матки (ОШ=1,68, 95% ДИ: 0,95-2,95) и 71,8 % женщин, больных раком эндометрия (ОШ=2,70, 95% ДИ: 1,50-4,85), а при сочетанной патологии эндометрия и миометрия – 58,7% (ОШ=1,50, 95% ДИ: 0,86-2,63). Стоит отметить, что средний возраст наступления менархе отмечен старше 13 лет во всех исследуемых группах.
При сравнительном анализе возраста менопаузы также наблюдаются отличия от контрольной группы (26,5%). Позднее наступление менопаузы отмечено при миоме – у 42,5% женщин (ОШ=2,05, 95% ДИ: 1,13-3,71), при раке тела матки – у 56,8% (ОШ=3,64, 95% ДИ: 2,01-6,61) и при их сочетании – у 44,9 % пациенток (ОШ=2,26, 95% ДИ: 1,24-4,10), что указывает на негативные изменения регуляции функций яичников. Помимо этого, высокий риск возникновения не только рака тела матки, но и миомы, хотя и в меньшей степени, имеют женщины Новосибирской области, имеющие нарушения в репродуктивных функциях. Отсутствие родов в анамнезе закономерно выше у пациенток, больных раком тела матки – 12,8 % (ОШ=2,78, 95%
ДИ: 0,95-8,16), чем с миомой матки – 6,9 % (ОШ=1,40, 95% ДИ: 0,43-4,61). Основываясь на этом факте можно предположить, что рождение детей может снижать у женщины вероятность возникновения рака эндометрия и миомы матки в последующем. Это предположение подтверждается фактом наличия бесплодия у больных женщин. Бесплодие, отсутствующее в группе контроля, в 4,5 раза выше при раке тела матки, по сравнению с миомой матки (16,4 % и 3,7 % соответственно).
Очень важными, на наш взгляд, представляются результаты анализа избыточного веса и ожирения в сравниваемых группах женщин Новосибирской области. Для этого мы использовали индекс массы тела (ИМТ). В исследуемых группах пациенток с ожирением (ИМТ ≥30 кг/м2) в группе больных миомой матки было 37,8 % (ОШ=1,45, 95% ДИ: 0,80-2,62), в группе больных раком тела матки – 54,1 % (ОШ=2,81, 95% ДИ: 1,51-5,04), при их сочетании – 51,8% (ОШ=2,56, 95% ДИ: 1,43-4,59). Таким образом, наши данные позволяют утверждать, что ожирение для женщин среднего и пожилого возраста, проживающих в Новосибирской области, является фактором риска в большей степени рака тела матки, чем миомы. С другой стороны, наше исследование показало, что избыточная масса тела не является фактором риска развития этих заболеваний.
Следующая часть наших исследований была посвящена анализу сопутствующих и предшествующих диагнозам рак тела матки и миома соматических заболеваний. Из них, в первую очередь, мы выделили заболевания эндокринной системы (сахарный диабет) и сердечно-сосудистые заболевания (гипертоническая болезнь, ишемическая болезнь сердца и атеросклеротический кардиосклероз). В группе с диагнозом миома матки сопутствующим заболеванием эндокринной системы страдали 1,9 % женщин (ОШ=0,53, 95% ДИ: 0,08-3,19), при раке тела матки процент женщин с сахарным диабетом значительно выше – 9,6 % (ОШ=2,92, 95% ДИ: 0,83-10,23), при сочетании патологий – 9,7 % (ОШ=2,96, 95% ДИ: 0,84-10,23). Таким образом, для женщин Новосибирской области сахарный диабет является фактором риска рака эндометрия, но не миомы.
Пациенток с гипертонической болезнью в группах с диагнозом рак тела матки и рак в сочетании с миомой также закономерно выше (35,5 %, ОШ=2,13, 95% ДИ: 1,13-4,02 и 39,8 %, ОШ=2,56, 95% ДИ: 1,36-4,81 соответственно), чем в контрольной группе (20,5 %) и группе пациенток с миомой матки – 34,1 %, ОШ=2,00, 95% ДИ: 1,06-3,79. Пациенток с ишемической болезнью сердца и атеросклеротическим кардиосклерозом в исследуемых группах значительно выше в группе больных раком тела матки (17,6%, ОШ=8,33, 95% ДИ: 2,14-32,35 и 16,1%, ОШ=5,30, 95% ДИ: 1,60-17,43 соответственно) и раком в сочетании с миомой (22,6%, ОШ=11,38, 95% ДИ: 2,98-43,49 и 14,8%, ОШ=4,78, 95% ДИ: 1,44-15,91 соответственно), чем в группе больных с миомой матки (6,9%, ОШ=2,89, 95% ДИ: 0,66-12,62 и 4,1%, ОШ=1,17, 95% ДИ: 0,27-5,04 соответственно).
Таким образом, наличие в анамнезе ожирения, сахарного диабета, гипертонической болезни, ишемической болезни сердца и атеросклеротического кардиосклероза несомненно должно рассматриваться в качестве факторов риска развития миомы и рака тела матки у женщин Новосибирской области. Полученные нами данные подтверждают данные литературы о высоком удельном весе обменно-эндокринных нарушений таких, как сахарный диабет, ожирение, гипертоническая болезнь в развитии миомы матки и рака эндометрия (Гилязутдинова и Михайлов, 2000; Берштейн, 2000; Weiss et al., 2006).
Помимо этого, высокий риск возникновения миомы и рака тела матки имеют женщины, у которых в анамнезе имеются сопутствующие гинекологические заболевания: воспалительные заболевания гениталий, гормонопродуцирующие опухоли яичников, внутренний эндометриоз и гиперпластические процессы эндометрия. Эти результаты наглядно демонстрируют роль дисрегуляции функции яичников и нарушение местных защитных факторов мио- и эндометрия воспалительными процессами (гинекологические заболевания) в возникновении миомы и рака тела матки.
Использование заместительной гормонотерапии в постменопаузе также значительно увеличивает риск возникновения опухолей. В группе с диагнозом миома матки заместительная гормонотерапия имела место в 8,4 % случаев, ОШ=9,07, 95% ДИ: 1,11-73,60, в группе с диагнозом рак тела матки в 9,7 % случаев, ОШ=11,95, 95% ДИ: 1,49-95,67, а в группе с сочетанной патологией эндометрия и миометрия в 6,4 % случаев, ОШ=6,76, 95% ДИ: 0,80-56,75.
Таким образом, большинство выявленных нами факторов риска развития миомы и рака тела матки, такие как средний возраст возникновения заболеваний, возраст наступления менархе и менопаузы, отсутствие родов и бесплодие, ожирение и сахарный диабет, заместительная гормонотерапия могут свидетельствовать о существенной роли гормональных факторов в формировании опухолей. Первостепенное значение в этом процессе имеют половые гормоны – эстрогены. Многочисленные исследования показали, что эстрогены в большинстве случаев необходимы для развития миомы матки, гиперпластических процессов эндометрия, а также для инициации и поддержания роста злокачественных опухолей эндометрия (Берштейн, 2000; Савицкий и Савицкий, 2000; Emons et al., 2000). Такие изменения пролиферативной активности эндометрия и миометрия могут быть обусловлены как гиперэстрогенемией в кровотоке (эндо- и экзогенные эстрогены), так и особенностями метаболизма эстрогенов в самом эндометрии и миомах матки in situ.
^ Анализ аллельных вариантов генов цитохромов P450 CYP1A1, CYP1A2, CYP19 и сульфотрансферазы SULT1A1
у больных с раком и миомой тела матки
Одной из причин нарушения гормонального статуса являются генетические факторы, в частности, связанные с нарушением метаболизма эстрогенов. Генетический полиморфизм делится на три типа: точечные мутации (SNP), делеции или инсерции и увеличение числа копий генов (Seymour et al., 2003). Наибольший интерес у исследователей связан с точечными мутациями, так как показано, что, наличие SNP даже вне кодирующей области, может быть связан с ослаблением или усилением функции гена. Определение таких вариантов ДНК в группах риска позволит своевременно выявить начало заболевания или проводить профилактическую терапию. В связи с этим нами было проведено исследование аллельных вариантов генов, кодирующих ферменты метаболизма эстрогенов (CYP1A1, CYP1A2, CYP19 и SULT1A1) у больных с диагнозами рак тела матки и миома матки. Анализ аллельных вариантов генов с использованием ПДРФ-анализа является на сегодняшний день общепринятым методом исследования генетического полиморфизма как фактора риска.
При исследовании генетического полиморфизма ферментов метаболизма эстрогенов у больных миомой матки было выявлено, что у больных женщин отмечено незначительно (недостоверное) снижение частоты мутантного аллеля C гена CYP1A1 и гетерозиготного генотипа Т/С по сравнению с контролем (Табл. 1).
При этом у женщин, больных миомой матки, наблюдалось также недостоверное уменьшение частоты встречаемости мутантного аллеля А гена CYP1A2, но увеличение гетерозиготного генотипа С/А. У женщин со злокачественной трансформацией тканей эндометрия частота мутантного аллеля С гена CYP1A1 была практически одинакова с контролем. При анализе полиморфных вариантов гена CYP1A2 у женщин, больных раком тела матки, было выявлено достоверное уменьшение частоты встречаемости как мутантного аллеля А (Р=0,0003), так и мутантного гомозиготного генотипа А/А (Р=0,005) по сравнению с группой контроля.
Таблица 1
Частоты аллелей и генотипов диких и полиморфных вариантов генов CYP1A1, CYP1A2, CYP19 и SULT1A1
| | Рак тела матки | Миома тела матки | Контрольная группа, n (%) | ||||
| n (%) | ОШ (95% ДИ) | P | n (%) | ОШ (95% ДИ) | P | ||
| CYP1A1 Частоты аллелей T C Частоты генотипов T/T T/C C/C всего | 300 (89,3) 36 (10,7) 132 (78,6) 36 (21,4) 0 (0,0) 168 | 0,88(0,55-1,43) 0,87(0,52-1,45) | 0,715 0,696 1,000 | 312 (91,8) 28 (8,2) 142 (83,5) 28 (16,5) 0 (0,0) 170 | 0,66(0,39-1,10) 0,63(0,36-1,08) | 0,125 0,104 1,000 | 296 (88,1) 40 (11,9) 128 (76,2) 40 (23,8) 0 (0,0) 168 |
| CYP1A2 Частоты аллелей C A Частоты Генотипов C/C C/A A/A всего | 94 (28,3) 238 (71,7) 6 (3,6) 82 (49,4) 78 (47,0) 166 | 0,49(0,34-0,72) | 0,0003 0,081 0,005 | 74 (21,8) 266 (78,2) 4 (2,4) 66 (38,8) 100 (58,8) 170 | 0,70(0,48-1,04) | 0,097 0,128 0,050 | 56 (16,5) 284 (83,5) 0 (0,0) 56 (32,9) 114 (67,1) 170 |
| CYP19 Частоты аллелей C T Частоты генотипов C/C C/T T/T всего | 310 (93,4) 22 (6,6) 146(88,0) 18 (10,8) 2 (1,2) 166 | 1,28(0,67-2,44) 1,94(0,87-4,35) 0,54(0,09-2,99) | 0,515 0,114 0,686 | 326 (94,8) 18 (5,2) 154 (89,5) 18 (10,5) 0 (0,0) 172 | 1,00(0,49-2,05) 1,84(0,82-4,12) | 1,000 0,166 0,122 | 326 (94,8) 18 (5,2) 158 (91,9) 10 (5,8) 4 (2,3) 172 |
| SULT1A1 Частоты аллелей G A Частоты генотипов G/G A/G A/A всего | 206 (62,0) 126 (38,0) 68 (41,0) 70 (42,2) 28 (16,9) 166 | 0,68(0,50-0,93) 1,03(0,63-1,67) 0,49(0,27-0,88) | 0,019 0,999 0,021 | 222 (65,3) 118 (34,7) 68 (40,0) 86 (50,6) 16 (9,4) 170 | 0,59(0,43-0,81) 1,26(0,78-2,04) 0,28(0,13-0,54) | 0,0014 0,393 0,0001 | 180 (52,9) 160 (47,1) 60 (35,3) 60 (35,3) 50 (29,4) 170 |
Примечание: n – количество женщин, ОШ – отношение шансов, ДИ – доверительный интервал.
Учитывая данные Badawi A.F. и соавт. (2001) о том, что фермент цитохром Р450 1A2 определяет, в основном 2-эстрогенгидрокси-лазную активность, участвуя в деградации 40-50 % циркулирующих эстрогенов, можно утверждать, что снижение числа мутантного аллеля определяет более низкую активность этого фермента, так как эта мутация приводит к значительному увеличению активности соответствующего белка (Sachse et al., 1999). Это может приводить к увеличению фонового уровня эстрогенов вследствие медленной скорости их окисления до неактивных продуктов метаболизма и вызывать состояние гиперэстрогенемии. Возможно, в данном случае канцерогенез развивается по ER-опосредованному механизму (промоторный тип), так как увеличение концентрации эстрогенов, особенно с увеличением уровня рецепторов ERα и ERβ, является фактором риска гормонозависимых новообразований. Полученные результаты, в свете существующих представлений о метаболизме эстрогенов, демонстрируют связь между активностью определенных ферментов семейства цитохромов Р450 (в основном, CYP1A2) с гормонассоциированными новообразованиями (Бочкарева и др., 2004). Таким образом, наши результаты позволяют предположить, что женщины с диким аллелем С гена CYP1A2 имеют более высокий риск развития рака эндометрия.
В тоже время для гена ароматазы (CYP19) различий по частоте встречаемости мутантного аллеля Т у женщин с миомой матки и раком эндометрия по сравнению с контролем не было обнаружено. Исследуемый Arg264Cys полиморфизм представляет собой нуклеотидную замену C→T в 264 кодоне гена ароматазы. Эта мутация влияет на стабильность фермента (Kagawa et al., 2004), однако данных о влиянии этого полиморфизма на активность белка на сегодняшний день нет. В литературе описаны случаи, когда наличие полиморфизма Arg264Cys ассоциировано с риском заболевания раком молочной железы (Kawajiri and Nakachi, 1990; Modugno and Weissfeld, 2001). Таким образом, можно предположить, что в механизме развития гиперэстрогенемии при миоме и раке тела матки ведущую роль играет низкий уровень деградации эстрогенов. Для окончательного ответа о роли CYP19 в патогенезе миомы матки и рака эндометрия необходимо исследование других мутаций, влияющих на функциональную активность фермента. Кроме того, возможно, что генетическая составляющая в активности ароматазы не является решающим фактором для развития опухоли.
При исследовании частоты встречаемости мутантного аллеля А гена сульфотрансферазы (SULT1A1), осуществляющего инактивацию окисленных продуктов эстрогенов, было выявлено, что у пациенток с доброкачественными и злокачественными заболеваниями матки наблюдается достоверное снижение частоты встречаемости мутантного аллеля (Р=0,0014 и Р=0,019 соответственно) и гомозигот мутантного типа (Р=0,0001 и Р=0,021) по сравнению с контролем. Таким образом, женщины Новосибирской области с диагнозами миома и рак тела матки имеют более высокую частоту дикого аллеля G гена SULT1A1 относительно контрольной группы. Этот факт говорит о том, что у этих женщин повышенный уровень активности фермента, так как нуклеотидная замена G638→A приводит к 85 %-ному снижению активности SULT1A1. Кроме того, активация сульфотрансферазы может быть обусловлена внешними факторами окружающей среды. Поступление в организм ксенобиотиков вызывает активацию сульфотрансферазы, которая участвуют не только в детоксикации эстрогенов и ксенобиотиков, но и в биоактивации потенциальных канцерогенов, таких как ароматические и гетероциклические амины (Coughtrie and Johnston, 2001). Полученные нами результаты позволяют сделать предположение, что у больных женщин повышена активность SULT1A1, что, скорее всего, сопровождается повышенным содержанием активных метаболитов канцерогенов, поступивших из окружающей среды. Это может говорить о вовлечении химически индуцированного канцерогенеза в процесс возникновения исследуемых патологий. Таким образом, результаты нашего исследования генетического полиморфизма ферментов метаболизма эстрогенов показали, что женщины с С аллелем гена CYP1A2 и/или G аллелем гена SULT1A1 имеют повышенный риск развития рака эндометрия.
^
Определение экспрессии генов hSULT1E1 и hSTS в эндометрии при миоме и раке тела матки
Для дальнейшего исследования роли сульфонирования эстрогенов в гормональном канцерогенезе нами было определено относительное содержание мРНК гена hSULT1E1, кодирующего фермент эстрогеновая сульфотрансфераза в образцах опухолевых и нетрансформированных тканей у 9-ти больных с диагнозом аденокарцинома тела матки (Рис. 2). Полученные результаты показали, что уровень экспрессии гена hSULT1E1 в большинстве случаев не меняется (у 7-ми пациенток из 9-ти), хотя у 2-ух пациенток наблюдается значительное снижение экспрессии в опухолевой ткани (в 4 раза). Можно предположить, что в ткани, в которой понижена экспрессия гена, будет снижена активность соответствующего фермента. Это может привести к повышению концентрации эстрогенов и катехолэстрогенов, и, следовательно, может увеличивать риск новообразований, что показано для рака молочной железы (Le Bail et al., 1998).
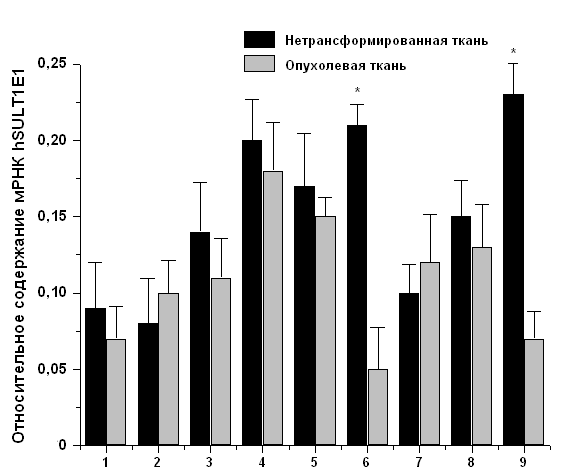
Рис. 2. Относительное содержание мРНК hSULT1E1 в нетрансформированной и опухолевой тканях эндометрия больных с диагнозом аденокарцинома тела матки. Представлено среднее значение ± SD. Каждый эксперимент проводился трижды. Отличия значений с достоверностью:* - р < 0,001.
Предполагается, что баланс между сульфонированием и десульфатированием в тканях, может играть важную роль в регуляции уровней эстрогенов in situ. Сульфаты эстрогенов могут служить резервуаром для образования биологически активных эстрогенов посредством действия STS (Sugawara and Fujimoto, 2004). Следовательно, определение уровня экспрессии гена hSTS и активности соответственного фермента является важным шагом в изучении механизма развития рака эндометрия. По нашим данным, уровень экспрессии гена hSTS в опухолевых тканях эндометрия в 1,5 – 3 раза выше относительно нетрансформированной ткани у 11-ти пациенток из 12-ти с диагнозом аденокарцинома тела матки (Рис. 3), и у 11-ти пациенток из 15-ти с диагнозом миома тела матки (Рис. 4). Для измерения ферментативной активности hSTS нами предложен модифицированный метод ВЭЖХ анализа для определения конечного продукта ферментативной реакции. Наши результаты продемонстрировали, что ферментативная активность hSTS в опухолевых тканях эндометрия также значительно выше относительно нетрансформированной ткани у всех пациенток с диагнозом аденокарцинома тела матки (Рис. 5).
В случае миомы тела матки ферментативная активность hSTS ведет себя по-разному: повышается у 2-ух больных, понижается у 4-ех и у 8-ми больных не изменяется (Рис. 6).
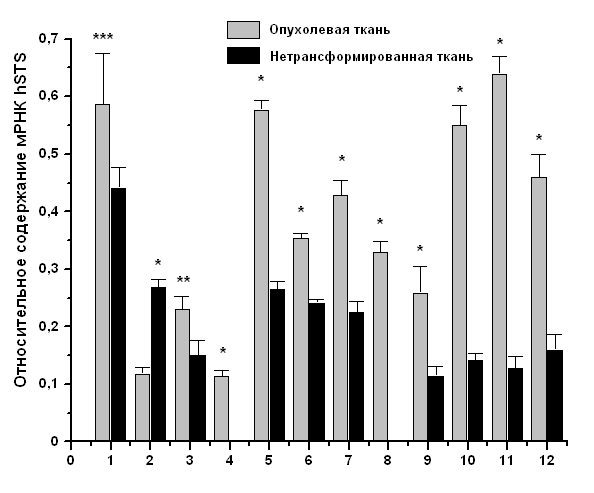
Рис. 3. Относительное содержание мРНК hSTS в нетрансформированной и опухолевой тканях эндометрия больных с диагнозом аденокарцинома тела матки. Представлено среднее значение ± SD. Каждый эксперимент проводился трижды. Отличия значений с достоверностью: * - р < 0,001, ** - р < 0,01, *** - р < 0,05.
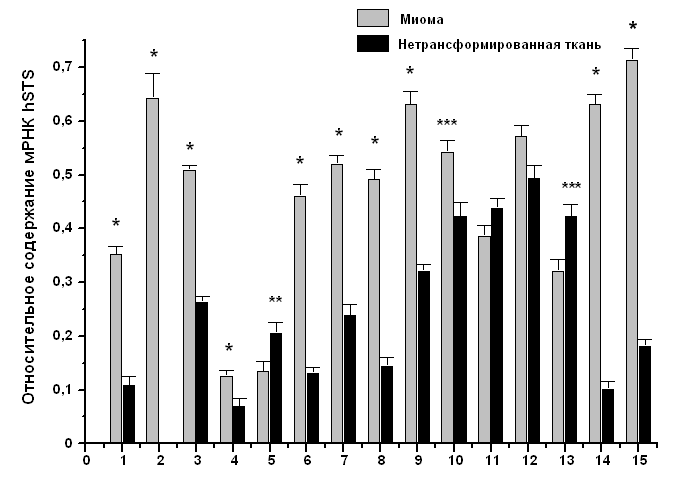
Рис. 4. Относительное содержание мРНК hSTS в нетрансформированной и опухолевой тканях эндометрия больных с диагнозом миома тела матки. Представлено среднее значение ± SD. Каждый эксперимент проводился трижды. Отличия значений с достоверностью: * - р < 0,001, ** - р < 0,01, *** - р < 0,05.
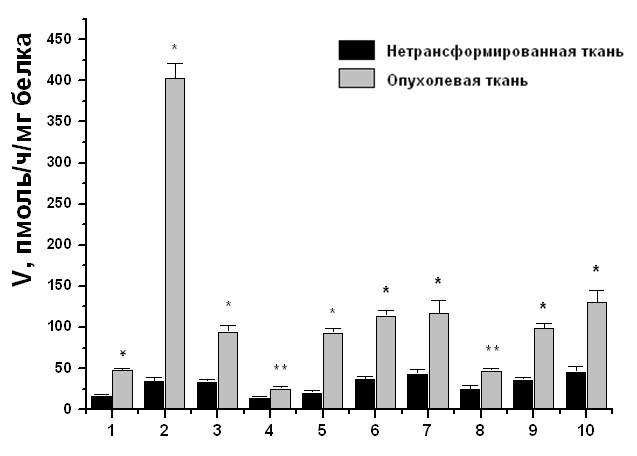
Рис. 5. Ферментативная активность hSTS в нетрансформированной и опухолевой тканях эндометрия больных с диагнозом аденокарцинома тела матки. Представлено среднее значение ± SD. Каждый эксперимент проводился трижды. Отличия значений с достоверностью: * - р < 0,01, ** - р < 0,05.
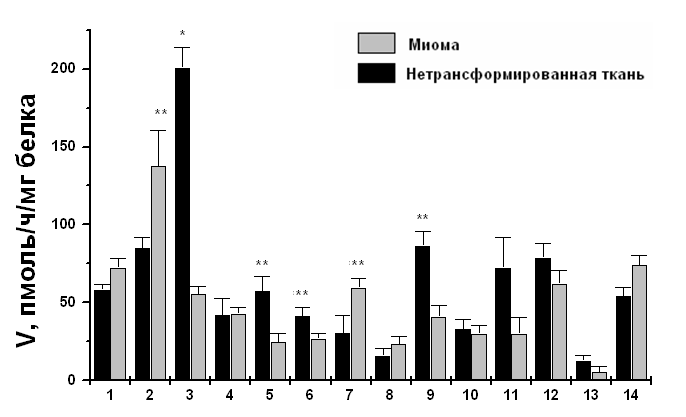
Рис. 6. Ферментативная активность hSTS в нетрансформированной и опухолевой тканях эндометрия больных с диагнозом миома тела матки. Представлено среднее значение ± SD. Каждый эксперимент проводился трижды. Отличия значений с достоверностью: * - р < 0,01, ** - р < 0,05.
Анализируя полученные данные, можно сделать заключение, что в опухолевых тканях эндометрия регистрируется повышение экспрессии гена hSTS, а экспрессия гена hSULT1E1 имеет тенденцию к снижению. Эти результаты свидетельствуют о вовлечении ферментов сульфонирования/ десульфонирования эстрогенов в механизм возникновения и поддержания гормонозависимых опухолей эндометрия человека. Стероидная сульфатаза осуществляет реакцию гидролиза сульфатов эстрона, из которого могут быть синтезированы стероиды с эстрогенными свойствами (например, эстрадиол), стимулирующие рост опухоли. В этом случае индукция hSULT1E1 и/или ингибирование hSTS могут иметь потенциальный лечебный эффект в терапии рака эндометрия.
В целом, анализируя результаты, полученные при исследовании рака эндометрия и миомы матки, можно заключить, что данные опухоли являются в большинстве случаев гормонозависимыми. Это подтверждается как эпидемиологическими, так и молекулярно-генетическими исследованиями. Различия выявлены лишь при исследовании опухолевых тканей. Так, экспрессия гена hSTS и активность фермента неравномерно распределена в тканях миомы, тогда как практически во всех исследованных злокачественных опухолях эти показатели значительно выше относительно нетрансформированных тканей. Это говорит о том, что, действительно в большинстве случаев рак эндометрия является гормонозависимым. По-видимому, повышенная активность hSTS обеспечивает рост и поддержание опухоли. Возможно, что доброкачественные опухоли с повышенной активностью этого фермента имеют больший онкогенный потенциал.
Заключение
Проведенное исследование при анализе анамнестических данных у больных миомой и раком эндометрия позволило выявить факторы риска развития этих заболеваний у женщин в Новосибирской области. К факторам риска в первую очередь относятся средний возраст, возраст наступления менархе и менопаузы, отсутствие родов и бесплодие, наличие в анамнезе ожирения и сахарного диабета, применение заместительной гормонотерапии и наличие сопутствующих заболеваний половой сферы. Большинство из этих факторов может свидетельствовать о существенной роли гормональных факторов в формировании опухолей. Исследование генетического полиморфизма ферментов метаболизма эстрогенов у больных показало, что женщины с С аллелем гена CYP1A2 и/или G аллелем гена SULT1A1 в Новосибирской области имеют повышенный риск развития рака эндометрия. С другой стороны, повышенным риском развития миомы матки обладают женщины только с G аллелем гена SULT1A1. Это может свидетельствовать о том, что в патогенез рака эндометрия вовлечено большее количество генов, чем в патогенез миомы матки. Кроме того, предполагая, что баланс между сульфонированием и десульфатированием в тканях, может играть важную роль в регуляции уровней эстрогенов in situ, был определен уровень экспрессии генов hSULT1E1 и hSTS и измерена ферментативная активность hSTS в образцах опухолевых и нетрансформированных тканей. Полученные данные показали, что ферменты сульфонирования/ десульфонирования эстрогенов вовлечены в механизм возникновения и поддержания гормонозависимых опухолей эндометрия человека, так как в опухолевых тканях эндометрия регистрируется увеличение относительного уровня мРНК hSTS и ферментативной активности, а экспрессия гена hSULT1E1 имеет тенденцию к снижению.
ВЫВОДЫ
- При анализе анамнестических данных у больных миомой и раком тела матки и клинического течения заболеваний выявлены факторы риска, связанные с возрастом менархе и менопаузы, отсутствием родов и бесплодием, наличием в анамнезе ожирения и сахарного диабета, применение заместительной гормонотерапии и наличием сопутствующих заболеваний.
- У больных миомой матки, в отличие от здоровых женщин, выявлено достоверное снижение частоты встречаемости мутантного аллеля гена сульфотрансферазы (SULT1A1), тогда как у больных раком тела матки, выявлено достоверное снижение частоты встречаемости мутантных аллелей генов цитохрома Р450 1А2 (CYP1A2) и сульфотрансферазы.
- Уровень экспрессии гена стероидной сульфотрансферазы hSULT1E1 в опухолевых тканях эндометрия практически не меняется, тогда как уровень экспрессии гена стероидной сульфатазы hSTS в 1,5 – 3 раза выше относительно нетрансформированной ткани.
- Ферментативная активность hSTS во всех опухолевых тканях эндометрия в 2 – 5 раз выше относительно нетрансформированной ткани у пациенток с диагнозом рак тела матки, а у пациенток с миомой тела матки активность повышается у 14 % больных, понижается у 36 % и у 50 % больных не изменяется.
^ ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Анамнестические и клинические данные пациенток целесообразно использовать для формирования групп риска по развитию рака тела матки и миомы.
- Анализ аллельных вариантов генов CYP1A2 и SULT1A1 у больных миомой и раком тела матки целесообразно использовать для проведения дальнейших исследований по выявлению дополнительного диагностического маркера.
- Увеличение уровня экспрессии гена hSTS и повышение активности фермента в тканях эндометрия рассматривать как предикторный фактор развития рака тела матки.
^ Список работ, опубликованных
по теме диссертации:
1. Исследование полиморфизма генов ферментов метаболизма ксенобиотиков у женщин Новосибирской области, больных раком яичников и раком эндометрия //Материалы Российской научно-практической конференции, посвященной 25-летию НИИ онкологии ТНЦ СО РАМН «Современное состояние и перспективы развития экспериментальной и клинической онкологии». – Томск: НТЛ, 2004. – С. 138-139. (соавт. Михайлова О.Н., Прудников А.В., Красильников С.Э., Гуляева Л.Ф., Ляхович В.В.).
2. Использование методов молекулярной биологии в диагностике и лечении онкогинекологических заболеваний //Материалы научно-практической конференции «Актуальные проблемы онкогинекологии». – Кемерово, 2004. – С. 15-22. (соавт. Гуляева Л.Ф., Захарова Л.Ю., Михайлова О.Н., Прудников А.В., Барков Е.С., Тархов А.В., Красильников С.Э.).
3. Экспрессия генов апоптоза ВСL-2 и ангиогенеза IL-8 в злокачественных новообразованиях шейки матки в зависимости от проведения курса химиотерапии //Материалы юбилейной межрегиональной научно-практической конференции «Современные медицинские технологии в акушерстве, перинатологии и гинекологии». – Новокузнецк, 2006. – С. 79-81. (соавт. Гуляева Л.Ф., Захарова Л.Ю., Пустыльняк В.О., Красильников С.Э.).
4. Исследование экспрессии генов сульфотрансферазы и сульфатазы в злокачественных опухолях тела матки //Материалы юбилейной межрегиональной научно-практической конференции «Современные медицинские технологии в акушерстве, перинатологии и гинекологии». – Новокузнецк, 2006. – С. 142-143. (соавт. Шульга Ю.В., Красильников С.Э., Гуляева Л.Ф.).
5. Рак эндометрия у женщин Новосибирской области: особенности заболеваемости //Материалы региональной конференции молодых ученых-онкологов «Актуальные вопросы экспериментальной и клинической онкологии». – Томск, 2006. – С. 6-7. (соавт. Барков Е.С., Красильников С.Э., Войцицкий В.Е.).
6. Сравнительный анализ результатов эпидемиологических исследований при миоме и раке тела матки у женщин Новосибирской области за период 1990-2004 год //Материалы региональной конференции молодых ученых-онкологов «Актуальные вопросы экспериментальной и клинической онкологии». – Томск, 2006. – С. 13-14. (соавт. Красильников С.Э., Войцицкий В.Е., Барков Е.С.).
7. Гормонотерапия при раке эндометрия у женщин Новосибирской области //Материалы Российской научно-практической конференции с международным участием «Современные методы лечения онкологических больных: достижения и неудачи». – Барнаул, 2006. – С. 75 (соавт. Барков Е.С., Красильников С.Э., Войцицкий В.Е.).
8. Органосохраняющее лечение при атипической гиперплазии эндометрия у женщин репродуктивного возраста Новосибирской области //Материалы Российской научно-практической конференции с международным участием «Современные методы лечения онкологических больных: достижения и неудачи». – Барнаул, 2006. – С. 75-76 (соавт. Войцицкий В.Е., Барков Е.С., Красильников С.Э.).
9. К вопросу о выявлении факторов риска для развития саркомы матки //Материалы Российской научно-практической конференции с международным участием «Современные методы лечения онкологических больных: достижения и неудачи». – Барнаул, 2006. – С. 159-160 (соавт. Барков Е.С., Кайгародов А.А., Красильников С.Э.).
10. Особенности регионарного метастазирования при саркоме матки у больных I и II клинических стадий //Материалы I съезда лимфологов с международным участием «Проблемы экспериментальной, клинической и профилактической лимфологии». – Новосибирск, 2006. – С. 35-37 (соавт. Барков Е.С., Кайгародов А.А., Красильников С.Э.).
11. Эпидемиологический анализ 167 случаев саркомы матки в Новосибирской области //Вестник НГУ. Серия: Биология, клиническая медицина. – 2006. – Т.4, выпуск 2. – С.3-8 (соавт. Осташевский В.А., Барков Е.С., Красильников С.Э., Гуляева Л.Ф.).
12. Estrogen-metabolizing gene polymorphisms in the assessment of female hormone-dependent cancer risk //The Pharmacogenomics J. – 2006. – Р. 1-5 (cоавт. Mikhailova O.N., Gulyaeva L.F., Prudnikov A.V., Krasilnikov S.E.).
13. Анализ заболеваемости и некоторых факторов риска рака тела матки в Новосибирской области //Сибирский онкологический журнал. – 2006. - №2. – С. 27-31 (соавт. Осташевский В.А., Барков Е.С., Красильников С.Э., Гуляева Л.Ф.).
^ СПИСОК СОКРАЩЕНИЙ
ДИ – доверительный интервал (confidence interval)
CYP – цитохром Р450
CYP19 – цитохром P450 19-го семейства
CYP1А1 – цитохром P450 1А1
CYP1А2 – цитохром P450 1А2
E1S – сульфат эстрона
ER – эстрогеновый рецептор
SNP – единичная нуклеотидная замена (Single Nucleotide Polymorphism)
STS – стероидная сульфатаза
SULT – сульфотрансфераза
ИМТ – индекс массы тела
ДНК – дезоксирибонуклеиновая кислота
ОШ – отношение шансов (odds ratio)
ПДРФ-анализ – полиморфизм длины рестрикционных фрагментов
ПЦР – полимеразная цепная реакция
РТМ – рак тела матки
Подписано в печать 11.2006. Формат 60х84/16. Бумага офсетная.
Тираж 60 экз. Печ.л. 2. Уч.-изд.л. 1,86. Заказ № .
Типография Сибирского университета потребительской кооперации.
630087, Новосибирск, пр.К.Маркса,26.
